我国心脑血管病患病率、致残率及死亡率仍处于上升阶段, 其中大约50%的心脑血管疾病是由血栓形成事件引发而来。血管、血液以及血流环境是血栓形成的关键介质。当前抗血小板药物的局限性包括高出血风险、药物起效时间延迟以及个体对抗血小板药物的反应性差异较大。血小板的重要功能是参与止血与血栓形成。止血是为了维持血管壁的完整性, 而血栓形成是血管壁功能障碍所导致的。血小板及凝血因子在止血与血栓形成过程中的功能有所重叠, 这种重叠可能会导致抗血栓治疗的出血风险。但是血栓与止血之间也存在重要的差异, 如局部的血流力学环境差异、两种血栓的孔隙度、活性蛋白扩散渗透速度差异等。因此止血过程中形成的栓子具有自限性, 而动脉血栓往往会导致血管闭塞。血管壁破裂导致血管内外形成巨大的压力差, 血管内腔失去压力, 血管迅速收缩有助于减少失血。当血小板和凝血因子形成栓子以止血时, 栓子具有多孔隙特征, 形成管壁内外压力梯度, 以驱动血浆成分穿过血凝块到达血管外腔, 并促使止血凝块固定在适当的位置。相反, 动脉血栓形成处的血管壁是不可渗透的, 动脉粥样斑块在高壁剪应力和高壁剪切率的条件下可触发血小板血栓形成。高剪应力驱动血管性血友病因子(von Willebrand factor, vWF)构型变化并在裸露的胶原蛋白表面上形成附着, 在动脉血流高剪应力条件下捕获血小板, 形成血栓。如果利用血流力学环境的差异, 对血栓形成部位特定靶向给药, 则可能会降低药物引发出血的不良反应。流动剪应力是血管维持动态平衡的主要因素之一。当前常规的靶向治疗方法依赖于因人而异的化学和生物学条件。生物力学动态平衡所导致的病理生理机制具有一定的普遍性, 从而为治疗和诊断方法提供了新的思路。因此本文对近年来有关剪切诱导血小板活化聚集可能的机制及治疗方法进行综述, 并总结了目前传统中药抗剪切诱导血小板聚集的研究进展。
1 血液流动中的剪应力血液作为一种循环的液体, 具有流动性变形的特性。根据牛顿黏性定律, 剪应力(τ)是黏度(η)与剪切率(γ)的乘积(τ = η×γ)。血液在血管内的流动对血管壁产生了平行于血流方向的剪应力, 以及垂直于血流方向的壁面压力[1]。当血液在血管中分层流动时, 血流剪应力是对抗血液流动的各层血液之间的内阻力, 通常特指血流对血管壁的摩擦力。剪切率是描述层流流体速度变化梯度的物理量。一般的血液流动呈现轴流(层流), 即位于血管轴心处的血细胞流速快, 靠近血管壁的血细胞的流速慢。红细胞和白细胞沿着轴心流动, 血小板靠近管壁流动[2], 这种血液分布特点有助于血小板迅速集结至受损血管部位而发挥止血功能。研究表明, 在正常脉管系统中, 静脉中血管壁的剪切率约10~200 s-1, 大动脉中约为300~800 s-1, 小动脉管壁剪切率则约为450~1 600 s-1 [3]。而在血栓性疾病状态下, 轻度至重度的动脉狭窄处可达2 000~8 000 s-1, 严重的动脉粥样硬化动脉的最大壁剪切率高达40 000 s-1 [4, 5]。本文所涉及的多为动脉系统的高剪应力。
2 剪切诱导血小板聚集机制 2.1 剪切诱导血小板聚集与vWF目前, 公认的剪切诱导血小板聚集机制多与vWF相关[6]。vWF是一种大分子的可溶性多聚糖蛋白, 在止血和血栓形成过程中至关重要。该蛋白储存在血管内皮细胞的Weibel-Palade体、巨核细胞以及血小板α颗粒中[7]。vWF在正常生理反应以及血栓形成或受炎症刺激条件下分泌至血液[8]。血浆vWF主要包含3个vWF-A结构域: A1主要识别血小板膜糖蛋白受体GPIbα (glycoprotein-Ibα), A2调节vWF蛋白质大小, A3则是其与内皮下胶原蛋白的结合位点[9]。vWF的主要作用是在高剪应力条件下, 充当血小板-内皮下相互作用、血小板活化和细胞聚集的介质。vWF还是凝血因子VIII的载体, 通过保护它免受蛋白水解降解, 最终将其传递到血管损伤部位, 有助于延长其循环半衰期。而vWF与血小板的相互作用是依赖于血小板膜糖蛋白受体复合物GPIb-IX-V中的GPIbα以及整合素蛋白αIIbβ3。
2.1.1 剪切诱导的vWF A1结构域暴露并与血小板膜受体 GPIbα结合GPIb-IX-V受体复合物在血小板上大量表达, 该复合物由GPIbα、GPIbβ、GPIX和GPV亚基组成, 其中GPIbα与vWF结合。GPIbα由1个富含N末端亮氨酸的重复结构域、1个大糖肽区域、1个长柄、1个C末端跨膜螺旋结构和1个短细胞质结构域组成[10]。在止血和血栓形成初始阶段时, 血小板被黏附或转移固定在受损血管部位的vWF基底上。循环血小板与vWF之间的初始接触是通过vWF的A1结构域与GPIbα的N末端结构域之间的结合相互作用实现的, 且两者之间的相互作用对于初始血小板黏附至关重要[11]。
vWF与GPIbα的结合需要动态的血液流动条件。在低剪应力下, vWF以螺旋样或球状体存在, 无法暴露其A1结构域。随着剪应力的增大, vWF构象发生变化, 由紧密的球状展开为长条链状结构, 暴露A1结构域, 并与血小板膜表面糖蛋白GPIbα受体结合, 从而使高速流动状态下的血小板停滞[12, 13]。GPIbα-A1相互作用导致后续其他细胞内信号事件, 包括整联蛋白αIIbβ3激活, 二磷酸腺苷、凝血酶和血栓素A2产生以及丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)、磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, PI3K)、蛋白激酶B (protein kinase B, PKB)等胞内蛋白信号传导激活[14, 15]。
除了vWF构象改变暴露A1域与GPIbα结合外, vWF和GPIbα之间的相互作用也通过GPIbα的变化来调节[16, 17]。GPIbα在富含鞘磷脂和胆固醇的膜结构域中的重新分配, 这种膜结构域被称为脂质筏。脂质筏被认为是可以物理浓缩受体以及衔接蛋白和效应酶的平台, 从而导致信号传导事件的放大。研究发现剪切触发GPIbα易位到脂质筏并激活应激激酶P38MAPK (p38 mitogen activated protein kinases), 随后该应激激酶激活胞质磷脂酶A2 (cytosolic phospholipase A2, cPLA2), 其从膜磷脂中释放花生四烯酸(arachidonic acid, AA)。AA介导的信号分子14-3-3ζ[18]与GPIbα胞质尾部结合后聚集, 从而导致GPIbα与vWF的相互作用增强[19]。
2.1.2 GPIbα传导应力并激活整合素蛋白αIIbβ3血小板整合素蛋白αIIbβ3存在于血小板膜表面, 是含有2个亚基(α胞外部分组成的杂二聚体IIb和β3)通过非共价键、单跨膜结构域和小胞质结构域连接[20]。研究表明, 血小板活化的最终步骤是促进整合素αIIbβ3的亲和力增高, 使αIIbβ3与纤维蛋白原和vWF不可逆的结合, 形成稳定的血小板聚集体[21, 22]。GPIbα传导机械力信号导致血小板内瞬时Ca2+浓度增大, 将大部分整合素推向中间激活状态。该中间状态随后促进αIIbβ3蛋白由外而内的信号传导, 以进一步转化为活性状态。αIIbβ3的高亲和力状态使其能够与血纤蛋白原和vWF结合, 从而增强血小板之间的黏附力及稳定聚集。众多血小板内的蛋白质都可以参与并影响αIIbβ3构象变化。踝蛋白talin作为一种机械敏感信号枢纽的细胞质蛋白[23, 24], 被认为是αIIbβ3激活最重要的一种[25]。整合素相互作用蛋白kindlins被发现是talin-αIIbβ3相互作用的调节剂和刺激剂[26]。Rap1 (repressor-activator protein 1)作为一种小的GTP酶(guanosine triphosphatase), 可以调节talin与Rap1-GTP之间的相互作用并激活αIIbβ3“由内而外”的信号[27]。
2.1.3 剪切敏感的vWF A2结构域与血管性血友病因子裂解蛋白酶ADAMTS-13 (a disintegrin and metalloproteinase with a thrombospondin type 1 motif, member 13)超大vWF串联体在高剪应力条件下呈现伸长展开状态, 其A2结构域完全暴露。位于折叠中心的A2结构域会被ADAMTS-13识别, 该蛋白酶会对A2结构域特定肽键进行切割而将大vWF多聚体裂解为较小的vWF。由于vWF多聚体的长度与止血能力密切相关, ADAMTS-13酶的切割具有重要的调控作用。缺乏ADAMTS-13会导致vWF促血栓形成潜力增加, 并导致血栓性血小板减少性紫癜[28]; 另一方面, 可能使A2结构域不稳定的突变会引起vWF被ADAMTS-13过度切割为较小的无活性片段, 导致出血性疾病, 临床上称为血管性血友病[29]。
2.2 机械力离子通道蛋白piezo12010年, Coste等[30]在小鼠神经瘤上发现一种机械力离子通道蛋白piezo, 该蛋白可以直接感受力学刺激。随后研究发现该蛋白广泛存在于牙周、血管、肾脏、膀胱、骨骼、结肠和神经节等多种组织中, 可以非选择性地通过Ca2+、Mg2+、K+和Na+等影响生物各项活动[31-33], 其包括piezo1和piezo2两个亚基, piezo1蛋白在细胞对力学刺激的感应方面具有重要作用, piezo2蛋白则主要存在于神经元中。人血小板膜表面存在piezo1蛋白, 在血流剪应力刺激情况下变化, 该通道打开并使得钙离子内流, 进一步激发血小板内其他蛋白的活化, 从而影响血栓形成与发展[34]。研究表明, piezo1蛋白呈现为一种三聚体复合物, 总体为螺旋桨形状, 3个弯曲的“叶片”围绕着中心孔, 顶部被称为C末端胞外域(C-terminal extracellular domain, CED)的顶盖所覆盖[35]。而目前关于piezo1离子通道打开并进行离子渗透的途径主要为:局部剪切流可能会置换CED域并暴露出离子渗透途径; 剪切流导致血小板膜张力的增加, 曲率减小, 可能导致piezo1结构中“叶片”的疏水错配以及“束”和“锚”结构域的构象变化, 从而打开孔; 内膜拉伸引起的质膜厚度变化, 也可能发生疏水性不匹配, 从而导致孔螺旋中的倾斜而可能导致孔打开; 环状脂质、激动剂和抑制剂可直接插入通道结构内以引发通道构象的变化; 脂质和化学改性剂也可能直接插入膜中, 从而引起膜硬度、张力或曲率变化, 从而导致通道活化[36]。狼蛛毒肽(Grammastola spatulate mechanotoxin-4, GsMTx-4)是从动物狼蛛唾液腺内提取出来的一种多肽(含34个氨基酸残基), 是一种机械力通道阻断剂, 可以特异性地阻断piezo1蛋白通道[37]。GsMTx-4能够以张力依赖性方式进入piezo1蛋白内, 使得通道附近的张力分布发生扭曲, 从而使通道力传递效率降低[38]。GsMTx-4可以抑制剪切诱导的血小板聚集。而小分子合成化合物Yoda1, 由于其含有2个氯和硫醚基团, 可以充当piezo1通道的分子楔形物, 促进了力诱导的构象变化, 可有效降低通道的激活机械阈值, 从而特异性激活piezo1离子通道[39, 40]。
2.3 血小板内皮黏附分子1 (platelet endothelial cell adhesion molecule-1, PECAM-1)血小板与内皮细胞都可响应血流剪应力条件。PECAM-1作为细胞黏附分子中的免疫球蛋白超家族成员, 其分子质量为130 kDa, 主要存在于粒细胞、单核细胞、血小板及血管内皮细胞表面上。早期研究发现, PECAM-1被认为是一种机械敏感分子, 可响应血流剪应力, 对生物体的生长及发展起关键作用[41, 42]。内皮细胞上的PECAM-1在受到剪应力刺激后其张力发生改变[43]。PECAM-1的胞质结构在感受机械力刺激下展开并发生磷酸化, 这也被认为是其机械传导的第一步[44]。进一步研究发现, PECAM-1与血管内皮细胞钙黏着蛋白(vascular endothelial-cadherin, VE-cadherin)以及激活磷脂酰肌醇-3-OH激酶VEGFR2 (vascular endothelial growth factor receptor 2)可以形成机械敏感复合物, 在流动条件下激活整联蛋白从而影响血管重塑、心脏发育以及动脉粥样硬化的发展[45]。有研究表明, PECAM-1介导血小板与内皮细胞间的相互作用从而影响剪应力下的血小板活化[46]。
2.4 导向受体神经丛蛋白plexin D1导向受体神经丛蛋白plexins是在轴突引导、肿瘤进展和免疫细胞调节中具有一系列重要功能的一类细胞受体[47-49]。已知plexins主要通过与相应配体结合, 以结合细胞或游离状态与其他共受体一起发挥作用, 从而激发细胞内信号传递, 导致细胞骨架和细胞黏附一系列变化[50]。2020年, Mehta等[51]在牛主动脉内皮细胞上发现plexin D1蛋白在机械感应和机械诱导相关疾病发病机制中具有重要作用。研究发现, 敲减或敲除plexin D1会使得剪应力关键信号介导Akt、细胞外调节蛋白激酶1/2 (extracellular signal-regulated kinase 1/2, ERK1/2)和内皮型一氧化氮合酶(endothelial nitric oxide synthase, eNOS)的激活受抑制以及下游重要蛋白转录因子KLF2 (kruppel-like factor 2)及KLF4、促炎因子CCL2 (C-C motif ligand 2)、血管细胞黏附分子1 (vascuolar cell adhesion molecule 1, VCAM-1)的表达受阻。该蛋白是内皮细胞在体内外应答剪应力不可或缺的, 并可调节动脉粥样硬化病变斑块的特异性分布。
3 抗剪切诱导血小板聚集的化合物及单克隆抗体目前已经上市或者正在进行研发的靶向剪切抗血小板聚集的疗法主要是通过靶向剪切依赖的vWF-GPIbα相互作用的血栓形成机制, 或者是狭窄动脉管腔处高剪应力引起的药物释放。该靶向疗法主要针对动脉系统的剪切依赖的血小板聚集或药物释放, 该系统中的剪应力远高于静脉系统[52]。
3.1 卡帕珠单抗卡帕珠单抗(caplacizumab)是目前唯一获得美国食品及药品管理局(Food and Drug Administration, FDA)批准的药物, 主要用于治疗成人获得性血栓性血小板减少性紫癜(thrombotic thrombocytopenic purpura, TTP)。该药是一种人源化纳米抗体, 可以与vWF A1域上的GPIbα结合位点特异性结合。卡帕珠单抗以剂量依赖方式抑制高剪应力下血小板与vWF之间的黏附, 而在低剪应力条件下对血小板黏附无影响[53]。在狒狒TTP模型中, 发现该抗体结合vWF的同时可以导致血小板数量的降低以及乳酸脱氢酶(lactic dehydrogenase, LDH)水平正常化(该酶与vWF活性相关), 但是未观察到过度出血风险[54]。
3.2 AJvW-2和AJW200AJvW-2是一种针对人vWF A1结构域的鼠类单克隆IgG1抗体, 可以抑制高剪应力下的血小板聚集。应用锥板黏度计测量患者在剪切诱导下的血小板聚集情况, 发现该抗体在10 μg·mL-1给药浓度下对高剪切诱导的血小板聚集具有抑制作用, 而在低剪应力下不会影响聚集[55]。AJW200是针对vWF A1域的IgG4人源化单克隆抗体, 旨在克服AJvW-2在人体内的免疫原性和在体内快速清除。AJW200可以抑制在高剪切条件下的血小板黏附和聚集[56]。
3.3 ARC1779和ARC15105ARC1779是vWF A1结构域的适配体, 已在一项临床试验中评估了对TTP疾病的效应[57]。ARC1779可以抑制高剪应力下血小板聚集, 且具有与阿昔单抗相当的抗血栓形成作用, 并且出血时间延长更短[58]。但也有文献报道了ARC1779体内给药后出血和导致贫血的不良反应[59]。ARC15105是第二代经过化学修饰的抗vWF适配体, 可以抑制心肌梗塞的临床环境中靶向剪切依赖性的血小板聚集。研究发现, 在高剪应力条件下, ARC15105完全抑制了瑞斯托霉素诱导的血小板凝集, 并导致裸露的猪主动脉节段中血小板黏附的抑制作用超过90%[60]。
3.4 剪切活化的纳米粒聚集体血栓形成的病理部位的血流剪应力往往异常高, 设计在特定剪应力范围作用下才会释放药物的剂型, 既可达到靶向给药的目的, 也可大幅度降低药物用量。Korin等[61]设计了一种只有在病理性高剪切率下才能分解的纳米粒聚集体(shear activated nanoparticles, SA-NPs)。实验表明, 在氯化铁诱导肠系膜损伤模型中, SA-NPs可以保证狭窄部位药物的局部高浓度, 而游离全身其他部位的药物浓度很低, 从而使得出血并发症的发生率降低。
3.5 剪切敏感性脂质体或囊泡脂质体是被磷脂双层包围的水核心组成的球形囊泡(直径100~250 nm)。脂质体纳米胶囊(nanocapsules, NCs)凭借其独特的负载和稳定大量亲水和疏水药物的能力, 为靶向药物的输送提供了可能。最近的研究发现, Molloy等[62]研制出了对剪切敏感的卵磷脂酰胆碱(phosphatidylcholine, PC)脂质体, 将临床抗血小板药物依替巴肽进行靶向局部血栓部位给药。在模拟狭窄剪切条件的狭窄微通道中进行了体外血液灌注测定, 与游离的依替巴肽相比, 剪切敏感的加载有依替巴肽的脂质体显著降低了血栓负荷而没有任何出血时间的延长。
4 中药对抗剪切诱导血小板聚集的治疗传统中医基础理论中“血”的含义是运行于脉管中富有营养的红色液态物质, 而瘀血是指体内血液停滞而形成的病理产物[63], 血瘀与多种病因导致的血行不畅有关。可见, 中医的“血”与现代医学的“血”含义大体相通, 而血瘀则与现代临床的血栓性疾病联系密切。中医针对这一病症, 常用活血化瘀中药进行治疗。现代药理学研究表明大多数的活血化瘀中药可以改善微循环、改善血液流变学、改善血流动力学、抑制血小板功能以及抑制炎症反应。目前已发现具有抑制血小板聚集功能的中药成分有:三七皂苷、川芎嗪、丹参酮、丹参多酚酸、莪术挥发油、槲皮素、水蛭素以及延胡索乙素等[64]。
4.1 三七总皂苷(Panax notoginseng saponins, PNS)PNS为中药三七的有效活性成分之一, 其质量分数约为12%[65]。PNS含有多种单体成分, 如人参皂苷(ginsenoside) Rg1、Rb1、Rb2、Rb3、Rd、Re、Rc以及三七皂苷(notoginsenoside) R1、R2、R3、R6等[66]。上世纪90年代筛选发现PNS具有抗剪切诱导血小板聚集的体外效应[67]。Han等[68]发现PNS以剂量依赖和剪应力依赖方式抑制血小板黏附和聚集, 且其作用机制可能与剪切流动条件下的VCAM-1、VE-cadherin和缝隙连接蛋白43 (connexin43, Cx43)与炎症以及介导的血小板募集和白细胞在炎症内皮上的黏附有关。近期研究表明, PNS可以改善血栓模型血流状态、改善血流力学环境、抑制血小板聚集并与机械力离子通道蛋白piezo1相关[69]。
4.2 川芎嗪中药川芎具有祛风止痛、活血行气药效, 川芎嗪及阿魏酸是川芎中的2种主要有效成分, 具有抗血小板聚集、扩血管、抗血栓、钙拮抗等多种作用[70]。早期研究发现, 川芎嗪对剪切诱导血小板聚集具有明显抑制效应[71]。随后发现, 单独使用川芎嗪以及川芎嗪联合大蒜素使用可以抑制剪切诱导血管内皮细胞分泌vWF, 这可能是川芎嗪抗剪切诱导血小板聚集的机制[72, 73]。
4.3 丹参丹参是临床常用的活血化瘀中药, 其主要的化学成分为脂溶性的丹参酮类以及水溶性的酚酸类。现代药理学研究表明, 丹参在心脑血管保护方面具有抗血小板聚集、抗动脉粥样硬化、改善脑损伤等作用[74]。研究发现, 丹酚酸B联合层流剪应力可以抑制肿瘤坏死因子α (TNF-α)刺激的VCAM-1、细胞间黏附分子1 (intercellular cell adhesion molecule-1, ICAM-1)和E-选择素(E-selectin)的表达[75]; 丹参酚酸B联合川芎嗪可抗剪切诱导血小板聚集, 其机制可能与抑制血小板CD42d (血小板膜表面GPIb-IX-V中的GPV)、血小板微颗粒、血小板膜糖蛋白CD61以及CD62p (P-选择素)相关[76]; 参莲提取物(丹参总酚酸、丹参酮IIa以及穿心莲内酯混合物)联合剪应力可以预防动脉粥样硬化(atherosclerosis, AS)的效应, 其机制可能与抑制核转录因子NF-κB信号通路活化从而抑制黏附蛋白E-selectin的表达相关[77]; 模拟体内低剪应力状态家兔给予参莲提取物可通过改善血流灌注量明显减少AS的发生[78]; 剪应力联合丹参山楂提取物可能通过调节纤溶系统和抑制纤溶酶原激活物抑制剂-1的稳定性来抑制血栓形成[79]; 丹参酮IIa血管外膜给药对低血流剪应力诱导的内膜损伤及血栓形成有改善作用, 其机制可能与抑制内皮vWF分泌相关[80]。
4.4 银杏内酯B银杏内酯B是从银杏叶中提取的, 被认为是一种天然血小板活化因子(platelet-activating factor, PAF)的拮抗剂[81], 其对血小板聚集以及血栓的形成具有明显抑制作用[82]。有研究发现银杏内酯B在层流剪应力条件下可以抑制TNF-α诱导的血小板和单核细胞黏附于内皮细胞, 其作用机制可能与减弱VCAM-1、VE-cadherin和Cx43的表达相关[83]。
4.5 原儿茶酸(protocatechuic acid, PCA)PCA是一种从忍冬(金银花)花中提取出的具有生物活性的植物化学物质。有研究发现, 在大鼠动脉血栓形成模型中, PCA具有抗血栓形成作用, 并显著延迟了FeCl3诱导的动脉闭塞。PCA可以降低高剪切率(> 10 000 s-1)诱导的血小板聚集并减弱血小板的激活、减弱细胞内的钙动员、颗粒分泌和黏附受体表达, 其效应机制可能是通过阻止vWF因子与GPIb的结合而发挥药效[84]。
5 结语与展望血栓形成是由血管、血液及血流三者相互作用的复杂过程。血管结构的改变是血栓形成的前提, 血管内皮结构受损及其功能紊乱使得血管内壁的抗凝能力减弱。局部血液流变或其他物理和化学等因素可以激活血液中的血小板和白细胞。活化后的血小板在内皮损伤部位首先发生黏附、变形和聚集, 并招募凝血蛋白及多种血细胞促进血栓进一步稳定形成, 而白细胞对血管内皮的黏附、浸润及游走则会加剧血管内皮的炎症反应, 从而使血小板以及白细胞更多地黏附和聚集在血管病变处。内皮细胞以及被激活的血小板和白细胞会持续释放多种活性物质, 进一步加重血管病变和募集更多的细胞, 最后导致血栓形成和组织损伤。
静脉血栓形成的血流力学环境与动脉血栓形成完全不同:静脉瓣膜功能不全会造成血流淤滞, 导致瓣膜血栓形成; 在血栓形成的瓣膜上游, 静脉压增高导致血管扩张并引起内皮功能障碍。在低流量或无流量条件下形成的静脉血栓体积通常较大(长度通常 > 10 cm)且富含红细胞, 但也会存在富含血小板的区域。在静脉壁剪切率和壁剪应力分别为约100 s-1和1~2 dyn·cm-2时, 血小板糖蛋白αIIbβ3-纤维蛋白原的相互作用可维持静脉剪切率下的血小板聚集, 而vWF蛋白并未参与静脉血栓的形成[85]。静脉血管处的剪切率为10~200 s-1, 正常静脉的剪应力范围为0.8~8 dyn·cm-2; 狭窄静脉由于血流速度减慢, 局部剪应力往往小于0.8 dyn·cm-2 [86], 静脉系统剪应力水平远远低于动脉系统。作者既往研究显示[66], 三七总皂苷在低流动剪应力条件下, 对于抑制血小板黏附具有明显效应, 并优于阿司匹林。剪应力会影响抗血小板聚集药物的效应的发挥。在动脉中, 当剪切率超过600 s-1时, 血小板黏附和聚集逐渐变得越来越依赖vWF。在严重的血管狭窄部位(可能发生在动脉粥样硬化血栓形成部位), 血小板所经历的剪切速率会增加1~2个数量级, 特别是在剪切率 > 5 000 s-1的力学条件下, 血小板聚集可通过vWF-GPIbα键形成动脉血栓[86]。
基于剪切诱导血小板聚集研究手段的不断进步, 本课题组通过对椎板式剪切仪、流动小室、原子力显微镜以及微流通道系统的使用, 发现剪切诱导血小板聚集与常规激光浊度法测定血小板聚集有明显差异, 因此针对当前剪切诱导血小板聚集及相关治疗方法进行综述, 并对剪切诱导血小板聚集作用机制进行总结(图 1)。目前有关剪切诱导血小板聚集机制的研究多是与血浆vWF和血小板膜表面受体GPIb及GPIIb/IIIa的相互作用相关, 而力学刺激血小板膜表面机械力离子通道piezo1、血小板内皮黏附分子1 (PECAM-1)和导向受体神经丛蛋白plexin D1则是近几年发现的与剪应力相关的蛋白靶点, 其可感受剪应力的刺激并传导下游蛋白激活, 进而影响血小板的活化聚集。
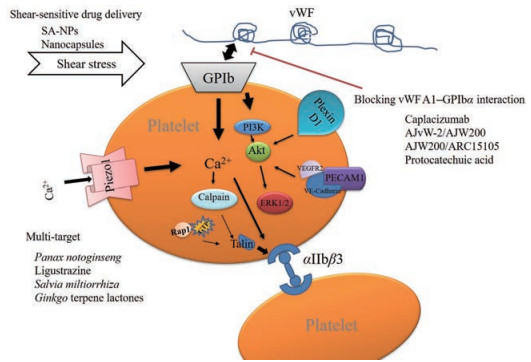
|
Figure 1 Possible mechanism of shear-induced platelet aggregation and therapies. ① Shear-induced vWF combined with GPIb, GPIbα-A1 interactions lead to other intracellular signaling events, including integrin αIIbβ3 activation, PI3K activation, and so on; ② Shear-induced platelet aggregation via activating piezo1, PECAM-1, or plexin D1 mechanically sensitive signals and downstream signal pathways. The therapies included blocking vWF A1-GPIbα interaction, shear-sensitive drug delivery, or multi-target protein action. SA-NPs: Shear activated nanoparticles; vWF: Von Willebrand factor; GPIb: Glycoprotein-Ib; PI3K: Phosphatidylinositol 3 kinase; VEGFR2: Vascular endothelial growth factor receptor 2; PECAM-1: Platelet endothelial cell adhesion molecule-1; VE-cadherin: Vascular endothelial-cadherin; ERK1/2: Extracellular signal-regulated kinase 1/2; Rap1: Repressor-activator protein 1; GTP: Guanosine triphosphatase |
当前, 对剪应力敏感的药物和载体的研究仍处于起步阶段, 将该技术推向临床仍面临许多挑战。迄今为止, 尚无已被批准的常规测定法来表征此类药物和载体的剪切活化。另外, 由于高剪应力可能是各种病理状况的结果, 因此在治疗多个狭窄部位所导致的临床症状中, 需要定义排除标准[87]。而传统中药在治疗心脑血管疾病方面有其特色, 中药抗剪切诱导血小板聚集往往具有多靶点效应, 通过其多种调控作用发挥防治心脑血管疾病效应: ①改善血流力学环境, 常通过改善血液流变性(包括改变红细胞变形、黏附能力和血浆分子成分变化)、改善血流动力学(扩张外周血管、增加冠脉血流量、降低外周阻力和增加组织器官的血流量)、改善微循环(加速血液循环、缓解微血管痉挛、降低毛细血管通透性以及建立侧支循环)实现; ②改善血小板功能, 降低聚集性; ③保护血管内皮功能及其结构的完整性; ④调节炎症、免疫等其他生理功能等。随着深入研究, 人们将揭示出更多活血化瘀中药抗剪切诱导血小板聚集的药效与机制, 从而精准防治心脑血管疾病。
作者贡献:刘蕾负责文献调研; 刘蕾和游云负责撰写文章; 游云和廖福龙负责对文章进行指导及修改。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Weiss HJ, Turitto VT, Baumgartner HR. Effect of shear rate on platelet interaction with subendothelium in citrated and native blood. I. Shear rate-dependent decrease of adhesion in von Willebrand's disease and the Bernard-Soulier syndrome[J]. J Lab Clin Med, 1978, 92: 750-764. |
| [2] |
Aarts PA, van den Broek SA, Prins GW, et al. Blood platelets are concentrated near the wall and red blood cells in the center in flowing blood[J]. Arteriosclerosis, 1988, 8: 819-824. DOI:10.1161/01.ATV.8.6.819 |
| [3] |
Gogia S, Neelamegham S. Role of fluid shear stress in regulating VWF structure, function and related blood disorders[J]. Biorheology, 2015, 52: 319-335. |
| [4] |
Strony J, Beaudin A, Brands D, et al. Analysis of shear stress and hemodynamic factors in a model of coronary artery stenosis and thrombosis[J]. Am J Physiol, 1993, 265: H1787-H1796. |
| [5] |
Sakariassen KS, Orning L, Turitto VT. The impact of blood shear rate on arterial thrombus formation[J]. Future Sci OA, 2015, 1: FSO30. |
| [6] |
Rana A, Westein E, Niego B, et al. Shear-dependent platelet aggregation: mechanisms and therapeutic opportunities[J]. Front Cardiovasc Med, 2019, 6: 141. DOI:10.3389/fcvm.2019.00141 |
| [7] |
Sadler JE. Biochemistry and genetics of von Willebrand factor[J]. Annu Rev Biochem, 1998, 67: 395-424. DOI:10.1146/annurev.biochem.67.1.395 |
| [8] |
Nightingale T, Cutler D. The secretion of von Willebrand factor from endothelial cells; an increasingly complicated story[J]. J Thromb Haemost, 2013, 11: 192-201. |
| [9] |
Zhou YF, Eng ET, Zhu J, et al. Sequence and structure relationships within von Willebrand factor[J]. Blood, 2012, 120: 449-458. |
| [10] |
Nakamura F, Pudas R, Heikkinen O, et al. The structure of the GPIb-filamin A complex[J]. Blood, 2006, 107: 1925-1932. DOI:10.1182/blood-2005-10-3964 |
| [11] |
Savage B, Saldívar E, Ruggeri ZM. Initiation of platelet adhesion by arrest onto fibrinogen or translocation on von Willebrand factor[J]. Cell, 1996, 84: 289-297. DOI:10.1016/S0092-8674(00)80983-6 |
| [12] |
Ruggeri ZM, Orje JN, Habermann R, et al. Activation-independent platelet adhesion and aggregation under elevated shear stress[J]. Blood, 2006, 108: 1903-1910. |
| [13] |
Schneider SW, Nuschele S, Wixforth A, et al. Shear-induced unfolding triggers adhesion of von Willebrand factor fibers[J]. Proc Natl Acad Sci U S A, 2007, 104: 7899-7903. DOI:10.1073/pnas.0608422104 |
| [14] |
Sumpio BE, Yun S, Cordova AC, et al. MAPKs (ERK1/2, p38) and AKT can be phosphorylated by shear stress independently of platelet endothelial cell adhesion molecule-1 (CD31) in vascular endothelial cells[J]. J Biol Chem, 2005, 280: 11185-11191. DOI:10.1074/jbc.M414631200 |
| [15] |
Chen Z, Li T, Kareem K, et al. The role of PI3K/Akt signaling pathway in non-physiological shear stress-induced platelet activation[J]. Artif Organs, 2019, 43: 897-908. DOI:10.1111/aor.13465 |
| [16] |
Shrimpton CN, Borthakur G, Larrucea S, et al. Localization of the adhesion receptor glycoprotein Ib-IX-V complex to lipid rafts is required for platelet adhesion and activation[J]. J Exp Med, 2002, 196: 1057-1066. DOI:10.1084/jem.20020143 |
| [17] |
Geng H, Xu G, Ran Y, et al. Platelet glycoprotein Ib beta/IX mediates glycoprotein Ib alpha localization to membrane lipid domain critical for von Willebrand factor interaction at high shear[J]. J Biol Chem, 2011, 286: 21315-21323. DOI:10.1074/jbc.M110.202549 |
| [18] |
Dai K, Bodnar R, Berndt MC, et al. A critical role for 14-3-3zeta protein in regulating the VWF binding function of platelet glycoprotein Ib-IX and its therapeutic implications[J]. Blood, 2005, 106: 1975-1981. |
| [19] |
Gitz E, Koopman CD, Giannas A, et al. Platelet interaction with von Willebrand factor is enhanced by shear-induced clustering of glycoprotein Ibα[J]. Haematologica, 2013, 98: 1810-1818. DOI:10.3324/haematol.2013.087221 |
| [20] |
Shattil SJ, Kashiwagi H, Pampori N. Integrin signaling: the platelet paradigm[J]. Blood, 1998, 91: 2645-2657. DOI:10.1182/blood.V91.8.2645.2645_2645_2657 |
| [21] |
Coller BS, Shattil SJ. The GPⅡb/Ⅲa (integrin αⅡbβ3) odyssey: a technology-driven saga of a receptor with twists, turns, and even a bend[J]. Blood, 2008, 112: 3011-3025. |
| [22] |
Shattil SJ, Kim C, Ginsberg MH. The final steps of integrin activation: the end game[J]. Nat Rev Mol Cell Biol, 2010, 11: 288-300. DOI:10.1038/nrm2871 |
| [23] |
Goult BT, Yan J, Schwartz MA. Talin as a mechanosensitive signaling hub[J]. J Cell Biol, 2018, 217: 3776-3784. DOI:10.1083/jcb.201808061 |
| [24] |
Fujitani K, Kambayashi J, Ariyoshi H, et al. Calpain activation in shear-induced platelet aggregation[J]. J Cell Biochem, 1997, 66: 54-64. DOI:10.1002/(SICI)1097-4644(19970701)66:1<54::AID-JCB7>3.0.CO;2-X |
| [25] |
Watanabe N, Bodin L, Pandey M, et al. Mechanisms and consequences of agonist-induced talin recruitment to platelet integrin alphaⅡbbeta3[J]. J Cell Biol, 2008, 181: 1211-1222. DOI:10.1083/jcb.200803094 |
| [26] |
Ma YQ, Qin J, Wu C, et al. Kindlin-2 (Mig-2): a co-activator of β3 integrins[J]. J Cell Biol, 2008, 181: 439-446. DOI:10.1083/jcb.200710196 |
| [27] |
Chrzanowska-Wodnicka M, Smyth SS, Schoenwaelder SM, et al. Rap1b is required for normal platelet function and hemostasis in mice[J]. J Clin Invest, 2005, 115: 680-687. DOI:10.1172/JCI22973 |
| [28] |
Tsai HM. Shear stress and von Willebrand factor in health and disease[J]. Semin Thromb Hemost, 2003, 29: 479-488. DOI:10.1055/s-2003-44556 |
| [29] |
Sadler JE. New concepts in von Willebrand disease[J]. Annu Rev Med, 2005, 56: 173-191. DOI:10.1146/annurev.med.56.082103.104713 |
| [30] |
Coste B, Mathur J, Schmidt M, et al. Piezo1 and piezo2 are essential components of distinct mechanically activated cation channels[J]. Science, 2010, 330: 55-60. DOI:10.1126/science.1193270 |
| [31] |
Cahalan SM, Lukacs V, Ranade SS, et al. Piezo1 links mechanical forces to red blood cell volume[J]. Elife, 2015, 4: e07370. DOI:10.7554/eLife.07370 |
| [32] |
Hyman AJ, Tumova S, Beech DJ. Piezo1 channels in vascular development and the sensing of shear stress[J]. Curr Top Membr, 2017, 79: 37-57. DOI:10.1016/bs.ctm.2016.11.001 |
| [33] |
Wu J, Lewis AH, Grandl J. Touch, tension, and transduction-the function and regulation of piezo ion channels[J]. Trends Biochem Sci, 2017, 42: 57-71. DOI:10.1016/j.tibs.2016.09.004 |
| [34] |
Ilkan Z, Wright JR, Goodall AH, et al. Evidence for shear-mediated Ca2+ entry through mechanosensitive cation channels in human platelets and a megakaryocytic cell line[J]. J Biol Chem, 2017, 292: 9204-9217. DOI:10.1074/jbc.M116.766196 |
| [35] |
Saotome K, Murthy SE, Kefauver JM, et al. Structure of the mechanically activated ion channel piezo1[J]. Nature, 2018, 554: 481-486. DOI:10.1038/nature25453 |
| [36] |
Ge J, Li W, Zhao Q, et al. Architecture of the mammalian mechanosensitive piezo1 channel[J]. Nature, 2015, 527: 64-69. DOI:10.1038/nature15247 |
| [37] |
Bae C, Sachs F, Gottlieb PA. The mechanosensitive ion channel piezo1 is inhibited by the peptide GsMTx4[J]. Biochemistry, 2011, 50: 6295-6300. DOI:10.1021/bi200770q |
| [38] |
Gnanasambandam R, Ghatak C, Yasmann A, et al. GsMTx4: mechanism of inhibiting mechanosensitive ion channels[J]. Biophys J, 2017, 112: 31-45. DOI:10.1016/j.bpj.2016.11.013 |
| [39] |
Lacroix JJ, Botello-Smith WM, Luo Y. Probing the gating mechanism of the mechanosensitive channel piezo1 with the small molecule yoda1[J]. Nat Commun, 2018, 9: 2029. DOI:10.1038/s41467-018-04405-3 |
| [40] |
Botello-Smith WM, Jiang W, Zhang H, et al. A mechanism for the activation of the mechanosensitive piezo1 channel by the small molecule yoda1[J]. Nat Commun, 2019, 10: 4503. DOI:10.1038/s41467-019-12501-1 |
| [41] |
Fujiwara K, Masuda M, Osawa M, et al. Is PECAM-1 a mechanoresponsive molecule?[J]. Cell Struct Funct, 2001, 26: 11-17. DOI:10.1247/csf.26.11 |
| [42] |
Chen Z, Tzima E. PECAM-1 is necessary for flow-induced vascular remodeling[J]. Arterioscler Thromb Vasc Biol, 2009, 29: 1067-1073. DOI:10.1161/ATVBAHA.109.186692 |
| [43] |
Conway DE, Breckenridge MT, Hinde E, et al. Fluid shear stress on endothelial cells modulates mechanical tension across VE-cadherin and PECAM-1[J]. Curr Biol, 2013, 23: 1024-1030. DOI:10.1016/j.cub.2013.04.049 |
| [44] |
Snyder JL, Mcbeath E, Thomas TN, et al. Mechanotransduction properties of the cytoplasmic tail of PECAM-1[J]. Biol Cell, 2017, 109: 312-321. DOI:10.1111/boc.201600079 |
| [45] |
Tzima E, Irani-Tehrani M, Kiosses WB, et al. A mechanosensory complex that mediates the endothelial cell response to fluid shear stress[J]. Nature, 2005, 437: 426-431. DOI:10.1038/nature03952 |
| [46] |
Meza D, Shanmugavelayudam SK, Mendoza A, et al. Platelets modulate endothelial cell response to dynamic shear stress through PECAM-1[J]. Thromb Res, 2017, 150: 44-50. DOI:10.1016/j.thromres.2016.12.003 |
| [47] |
Oh WJ, Gu C. The role and mechanism-of-action of sema3E and plexin-D1 in vascular and neural development[J]. Semin Cell Dev Biol, 2013, 24: 156-162. DOI:10.1016/j.semcdb.2012.12.001 |
| [48] |
Vivekanadhan S, Mukhopadhyay D. Divergent roles of plexin D1 in cancer[J]. Biochim Biophys Acta Rev Cancer, 2019, 1872: 103-110. DOI:10.1016/j.bbcan.2019.05.004 |
| [49] |
Ueda Y, Kondo N, Ozawa M, et al. Sema3e/plexin D1 modulates immunological synapse and migration of thymocytes by Rap1 inhibition[J]. J Immunol, 2016, 196: 3019-3031. DOI:10.4049/jimmunol.1502121 |
| [50] |
Sakurai A, Gavard J, Annas-Linhares Y, et al. Semaphorin 3E initiates antiangiogenic signaling through plexin D1 by regulating Arf6 and R-Ras[J]. Mol Cell Biol, 2010, 30: 3086-3098. DOI:10.1128/MCB.01652-09 |
| [51] |
Mehta V, Pang KL, Rozbesky D, et al. The guidance receptor plexin D1 is a mechanosensor in endothelial cells[J]. Nature, 2020, 578: 290-295. DOI:10.1038/s41586-020-1979-4 |
| [52] |
Westein E, Hoefer T, Calkin AC. Thrombosis in diabetes: a shear flow effect?[J]. Clin Sci (Lond), 2017, 131: 1245-1260. DOI:10.1042/CS20160391 |
| [53] |
van Loon JE, de Jaegere PP, Ulrichts H, et al. The in vitro effect of the new antithrombotic drug candidate ALX-0081 on blood samples of patients undergoing percutaneous coronary intervention[J]. Thromb Haemost, 2011, 106: 165-171. DOI:10.1160/TH10-12-0804 |
| [54] |
Callewaert F, Roodt J, Ulrichts H, et al. Evaluation of efficacy and safety of the anti-VWF nanobody ALX-0681 in a preclinical baboon model of acquired thrombotic thrombocytopenic purpura[J]. Blood, 2012, 120: 3603-3610. |
| [55] |
Gresele P, Momi S. Inhibitors of the interaction between von Willebrand factor and platelet GPIb/IX/V[J]. Handb Exp Pharmacol, 2012, 210: 287-309. |
| [56] |
Kageyama S, Yamamoto H, Nakazawa H, et al. Pharmacokinetics and pharmacodynamics of AJW200, a humanized monoclonal antibody to von Willebrand factor, in monkeys[J]. Arterioscler Thromb Vasc Biol, 2002, 22: 187-192. DOI:10.1161/hq0102.101520 |
| [57] |
Bae ON. Targeting von Willebrand factor as a novel anti-platelet therapy; application of ARC1779, an anti-vWF aptamer, against thrombotic risk[J]. Arch Pharm Res, 2012, 35: 1693-1699. DOI:10.1007/s12272-012-1000-3 |
| [58] |
Jilma-Stohlawetz P, Gilbert JC, Gorczyca ME, et al. A dose ranging phase Ⅰ/Ⅱ trial of the von Willebrand factor inhibiting aptamer ARC1779 in patients with congenital thrombotic thrombo-cytopenic purpura[J]. Thromb Haemost, 2011, 106: 539-547. |
| [59] |
Markus HS, Mccollum C, Imray C, et al. The von Willebrand inhibitor ARC1779 reduces cerebral embolization after carotid endarterectomy: a randomized trial[J]. Stroke, 2011, 42: 2149-2153. DOI:10.1161/STROKEAHA.111.616649 |
| [60] |
Siller-Matula JM, Merhi Y, Tanguay JF, et al. ARC15105 is a potent antagonist of von Willebrand factor mediated platelet activation and adhesion[J]. Arterioscler Thromb Vasc Biol, 2012, 32: 902-909. DOI:10.1161/ATVBAHA.111.237529 |
| [61] |
Korin N, Gounis MJ, Wakhloo AK, et al. Targeted drug delivery to flow-obstructed blood vessels using mechanically activated nanotherapeutics[J]. JAMA Neurol, 2015, 72: 119-122. DOI:10.1001/jamaneurol.2014.2886 |
| [62] |
Molloy CP, Yao Y, Kammoun H, et al. Shear-sensitive nanocapsule drug release for site-specific inhibition of occlusive thrombus formation[J]. J Thromb Haemost, 2017, 15: 972-982. DOI:10.1111/jth.13666 |
| [63] |
Cao HX. Basic Theory of Traditional Chinese Medicine (中医基础理论)[M]. Beijing: China Traditional Chinese Medicine Press, 2004: 97.
|
| [64] |
Peng C. Chinese Medicine Pharmacology (中药药理学)[M]. Beijing: China Traditional Chinese Medicine Press, 2012: 248.
|
| [65] |
Sha MC, Zhou YF, Zhang HZ, et al. Study on differences of chemical components in different parts of Panax notoginseng[J]. Mod Chin Med (中国现代中药), 2018, 20: 832-836. |
| [66] |
Shi SM, Liu YZ, Tai W, et al. Smashing tissue extraction and HPLC determination of active saponins from different parts of Panax notoginseng[J]. Chin Herb Med, 2012, 4: 340-344. |
| [67] |
Liao FL. Experimental study on anti-shear stress induced platelet aggregation of three activating blood and removing stasis components[C] // Word Integrated Medicine Congress Abstracts (世界中西医结合大会论文摘要集). Beijing: China Association of Integrative Medicine, 1997: 76-77.
|
| [68] |
Han S, Chen Y, Wang J, et al. Anti-thrombosis effects and mechanisms by Xueshuantong capsule under different flow conditions[J]. Front Pharmacol, 2019, 10: 35. DOI:10.3389/fphar.2019.00035 |
| [69] |
Liu L, Ding SL, Chen Y, et al. Effects of Xueshuantong injection on thrombosis formation and blood flow in rats[J]. Chin J Chin Mater Med (中国中药杂志), 2020, 45: 2446-2453. |
| [70] |
Yin L, Peng Y, Chen HP, et al. Comparison of the content of phenolic acids in ligusticum chuanxiong from new and traditional producing areas and the connotation of division grades[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2013, 19: 91-94. |
| [71] |
Liao FL, Li B, Peng J, et al. Experimental study on inhibition of shear induced platelet aggregation by ligustrazini[J]. Chin Pharm Bull (中国药理学通报), 1997, 13: 47-50. |
| [72] |
You Y. Influence of Ligustrazine on Shear Induced Secretion of vWF from Endothelial Cells and Shear Induced Platelet Aggregation (川芎嗪抑制剪切应力诱导血小板聚集的机制研究-对血管内皮细胞分泌vWF的影响) [D]. Beijing: China Academy of Chinese Medical Sciences, 2000.
|
| [73] |
Liao FL, You Y, Han D. Effects of ligustrazine and allicin on shear induced secretion of von Willebrand factor from endothelial cell and shear induced platelet aggregation[J]. Natl Med J China (中华医学杂志), 2001, 81: 508-509. |
| [74] |
Wan XH, Wang YL, Zhou CZ, et al. Research progress on chemical constituents and pharmacological effects of Salvia miltiorrhiza[J]. Chin Tradit Herb Drugs (中草药), 2020, 51: 788-798. |
| [75] |
Xie LX, Durairajan SS, Lu JH, et al. The effect of salvianolic acid B combined with laminar shear stress on TNF-α-stimulated adhesion molecule expression in human aortic endothelial cells[J]. Clin Hemorheol Microcirc, 2010, 44: 245-258. DOI:10.3233/CH-2010-1269 |
| [76] |
Zhang HX. Joint Effect of Tetramethylpyrazine and Salvianolic acid B on Shear Stress Induced Thrombosis (川芎嗪与丹参酚酸B联合干预剪应力诱导血栓形成的研究)[D]. Beijing: Beijing University of Chinese Medicine, 2006.
|
| [77] |
You Y, Gong M, Li YJ, et al. Shear stress combined with Shenlian extracts regulates E-selectin expression via NF-κB pathway in endothelial cells[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2012, 18: 261-265. |
| [78] |
Zhou SY, Wang YH, Li YJ, et al. Effect of Shenlian extracts on blood flow and vessel pathological changes in rabbits carotid atherosclerosis model induced by low shear stress[J]. China J Chin Mater Med (中国中药杂志), 2013, 38: 1595-1600. |
| [79] |
Wang W, Gong LL, Li L, et al. Study on the antithrombotic mechanism of joint of shear stress with the fruit of Crataegus Pinnatifida Bge. Var. majar N.E. Br. and the root of Salviae Miltiorrhizae Bge[J]. Chin J Pharmacovigilance (中国药物警戒), 2018, 15: 462-466, 475. |
| [80] |
You Y, Zhang Y, Liao FL, et al. Tanshinone Ⅱa adventitia administration improves vascular intimal injury induced on low shear stress[J]. Chin J Microcirc (微循环学杂志), 2012, 22: 84. |
| [81] |
Tian QY, Gong LL. Research progress in ginkgo terpene lactones[J]. Cent South Pharm (中南药学), 2016, 14: 838-841. |
| [82] |
Liu X, Yan Y, Bao L, et al. Ginkgolide B inhibits platelet release by blocking Syk and p38 MAPK phosphorylation in thrombin-stimulated platelets[J]. Thromb Res, 2014, 134: 1066-1073. DOI:10.1016/j.thromres.2014.08.025 |
| [83] |
Zhang M, Sun J, Chen B, et al. Ginkgolide B inhibits platelet and monocyte adhesion in TNFα-treated HUVECs under laminar shear stress[J]. BMC Complement Altern Med, 2018, 18: 220. DOI:10.1186/s12906-018-2284-8 |
| [84] |
Kim K, Bae ON, Lim KM, et al. Novel antiplatelet activity of protocatechuic acid through the inhibition of high shear stress-induced platelet aggregation[J]. J Pharmacol Exp Ther, 2012, 343: 704-711. DOI:10.1124/jpet.112.198242 |
| [85] |
Brass LF, Diamond SL. Transport physics and biorheology in the setting of hemostasis and thrombosis[J]. J Thromb Haemost, 2016, 14: 906-917. DOI:10.1111/jth.13280 |
| [86] |
Kroll MH, Hellums JD, McIntire LV, et al. Platelets and shear stress[J]. Blood, 1996, 88: 1525-1541. DOI:10.1182/blood.V88.5.1525.1525 |
| [87] |
Epshtein M, Korin N. Shear targeted drug delivery to stenotic blood vessels[J]. J Biomech, 2017, 50: 217-221. DOI:10.1016/j.jbiomech.2016.11.015 |
 2020, Vol. 55
2020, Vol. 55


