药物是人类在长期的生产、生活及与疾病作斗争的过程中逐步发现和发展起来的。在人类发现药物的漫长历史中, 大自然提供了许多结构多样和活性新颖的天然产物。这些天然产物多是动植物或微生物体内的内源性化学成分或其代谢产物, 主要包括多糖类、氨基酸类、抗生素类、生物碱类、黄酮类和萜类等化学成分。在早期人类为维持生存与伤痛疾病作斗争的过程中, 意外发现这些天然产物有减轻伤病或解除疾病的功效, 便逐步有意识地应用它们来治疗疾病。随着时代的发展与科技的进步, 药物的发现也逐步由随机筛选转向了合理设计, 而天然产物仍然是药物或先导化合物发现与开发的重要来源。据统计, 在1981~2010年间, 美国食品与药品管理监督局(Food and Drug Administration, FDA)批准上市的药物中, 34%来源于天然产物或其衍生物[1]。
肿瘤作为威胁人类健康的重大疾病, 其发病率与死亡率均位于各类疾病前列。随着肿瘤生物学与分子药理学的不断发展, 人们对于肿瘤的本质认识也愈发清楚。肿瘤发生和发展过程中细胞内的信号转导、细胞周期的调控、细胞凋亡的诱导、血管新生以及细胞与细胞外基质的相互作用等各种细胞内分子事件也正在被逐步阐明。以肿瘤细胞中特有或高度活化信号转导通路的重要节点分子作为药物靶标发现选择性作用于特定靶标的分子靶向抗肿瘤药物已成为最近30余年抗肿瘤药物研发的重要方向[2], 其相比于传统的细胞毒类药物具有高效、低毒和特异性强的优点[3]。然而, 现有分子靶向药物结构类型有限, 而且随着其在临床上的应用, 耐药和毒副作用成为分子靶向药物研究与开发的瓶颈[4]。
天然产物作为分子靶向药物的一个重要来源, 拥有结构新颖多样和生物活性独特的特点, 借助药物化学等手段, 通过对其进行结构改造、修饰与优化, 从而得到抗耐药、毒副作用小的新型化学实体, 可为突破分子靶向药物的开发瓶颈提供新的思路[5]。同时, 对天然产物结构的修饰与优化也为新型先导化合物的设计节省了巨大的资金投入, 在一定程度上缩短了新药的研发周期。目前在临床使用的分子靶向抗肿瘤药物已有70余种, 其中不乏来源于天然产物或其衍生物的代表, 罗米地辛和雷帕霉素等均为来源于天然产物的分子靶向抗肿瘤药物。此外, 以具有一定生物活性的天然产物作为苗头化合物, 对其进行结构修饰和优化, 得到一系列具有潜在开发价值的衍生物也是分子靶向抗肿瘤药物发现与开发的重要途经。本文将概述来源于天然产物或其衍生物的分子靶向抗肿瘤药物的研究进展和展望。
1 组蛋白去乙酰化酶抑制剂近年来的研究表明表观遗传修饰在肿瘤的发生和发展中具有非常重要的作用。一系列调控表观遗传修饰的蛋白被相继发现和确证为肿瘤治疗靶标。组蛋白乙酰化酶(histone acetylase, HAT)和组蛋白去乙酰化酶(histone deacetylase, HDAC)是表观遗传中的2种重要修饰酶, 二者互相制约, 共同调节人体正常的生理功能, 一旦表达或功能失调可能导致肿瘤的发生和发展。HDAC抑制剂(HDAC inhibitor, HDACi)通过抑制HDAC的活性, 增强组蛋白的乙酰化, 促进转录因子与DNA链结合, 启动抑癌基因等特异性基因表达, 从而发挥抑制肿瘤细胞增殖、促使肿瘤细胞凋亡等效应[6]。
罗米地辛(romidepsin)是一个新的具有抗肿瘤活性的组蛋白去乙酰化酶抑制剂(图 1), 最早从革兰阴性菌C. violaceum的培养基中分离出来, 具有笼形双环缩酚酸肽结构和稀有的二硫键[7]。体外研究显示其具有较弱的抗菌活性, 并能使H-ras转化的细胞逆转为正常的细胞形态, 因此它最初被美国国家癌症研究所作为一种靶向ras的化合物进行后续开发[8]。随后对其深入的研究发现, 它能够有效地抑制HDAC活性, 对HDAC1和HDAC2的半数抑制浓度(half maximal inhibitory concentration, IC50)分别为36和47 nmol·L-1, 于2009年和2011年被美国FDA批准用于治疗皮肤T细胞淋巴瘤(cutaneous T cell lymphoma, CTCL)和外周T细胞淋巴瘤(peripheral T cell lymphoma, PTCL)[9]。

|
Figure 1 The structure of romidepsin |
罗米地辛的抗肿瘤活性主要是通过抑制HDAC影响细胞核内的RNA转录来完成的。它是一个含有二巯基的前体药物, 比其还原形式(reduced romidepsin)更稳定, 且该二硫键有助于其更有效地扩散穿过细胞膜, 一旦进入细胞内则被谷胱甘肽还原活化, 而后可逆性地与HDAC活性中心的锌离子相互作用从而抑制其功能[9] (图 2)。

|
Figure 2 The transformation of romidepsin in vivo |
泛素-蛋白酶体系统(ubiquitin-proteasome system, UPS)是细胞内蛋白质修饰和降解的主要系统。UPS对于蛋白质的结构与功能具有重要的调节作用, 它由至少6个不可分割的部分组成, 包括泛素、泛素激活酶E1、泛素结合酶E2、泛素连接酶E3、26S蛋白酶体和去泛素酶(de-ubiquitinating enzymes, DUB)等。研究表明, UPS在肿瘤的发生和发展中起着重要的作用, 以UPS重要组成部分为治疗靶标的抗肿瘤新药研发也成为近年来研究的热点。
2.1 E2泛素结合酶抑制剂—leucettamol ALeucettamol A是从海生海绵(Leucetta aff.microrhaphis)中提取的环肽化合物[10], 它是第1个能够抑制泛素结合酶UBC13 (ubiquitin-conjugating enzyme 13)与UEV1A (ubiquitin-conjugating enzyme variant 1A)结合的化合物, 其抑制UBC13与UEV1A蛋白相互作用的IC50为110 nmol·L-1 [11]。
2.2 蛋白酶体抑制剂—marizomib (NPI-0052)Marizomib是一种海洋放线菌Salinispora tropica的提取物[12], 它能够非可逆性地抑制蛋白酶体β1 (具有类半胱氨酸蛋白酶活性, cysteine protease-like, C-L)、β2 (具有类胰蛋白酶活性, tryptase-like, T-L)和β5 (具有类糜蛋白酶活性, chymotrypsin-like, CT-L)亚基的活性, 其对美国国家癌症研究所60种肿瘤细胞系生长抑制的半数生长抑制浓度(half maximal growth inhibitory concentration, GI50)均低于10 nmol·L-1 [13]。相比于硼替佐米(首个被美国FDA批准用于治疗多发性骨髓瘤的蛋白酶体抑制剂), marizomib的作用迅速而持久, 暴露于marizomib 15 min就可诱导肿瘤细胞发生凋亡, 而相同浓度的硼替佐米需要处理8 h以上才能达到相同的药效作用。不同于硼替佐米, marizomib对C-L、T-L和CT-L这3种酶均能够产生非可逆性抑制作用, 而硼替佐米则主要对CT-L酶产生可逆性抑制作用, 因此marizomib对硼替佐米耐药的多发性骨髓瘤细胞也具有杀伤作用, 且其还能减轻硼替佐米诱导的神经病变[14]。目前marizomib已经进入治疗多发性骨髓瘤(multiple myeloma, MM)的Ⅱ期临床试验, 初步结果表明marizomib的耐受性好, 毒副作用较低, 有望用于治疗难治复发的多发性骨髓瘤(图 3)。

|
Figure 3 The structures of leucettamol A and marizomib |
细胞周期是细胞生命活动的基本过程, 它控制着细胞从静止期转向生长增殖期, 细胞周期蛋白依赖性激酶(cyclin dependent kinases, CDKs)和细胞周期蛋白(cyclins)是细胞周期调控机制中的核心分子。细胞周期调控失调与细胞癌变有着密切关系, 因此靶向干预细胞周期的关键蛋白和通路已成为抑制肿瘤的重要治疗策略。细胞周期蛋白依赖性激酶抑制剂是以细胞周期蛋白依赖性激酶为靶点, 通过阻断细胞周期控制细胞增殖, 从而达到抗肿瘤的目的。
3.1 FlavopiridolFlavopiridol是一种由rohitukine半合成的黄酮类衍生物(rohitukine是从印度本土植物Dysoxylum binectariferum中分离得到的生物碱, 图 4)[15], 对多种肿瘤细胞具有较强的抑制作用, 其通过与激酶上腺嘌呤核苷三磷酸(adenosine-triphosphate, ATP)结合口袋的相互作用, 可显著抑制CDK1、CDK2、CDK4、CDK6及CDK7活性, 从而引起细胞的G1或G2/M期阻滞, 是一种经典的非选择性CDKs抑制剂[16]。

|
Figure 4 The structure of flavopiridol |
Flavopiridol是第一个进入临床研究的CDKs抑制剂[17], 目前已有一些关于其用于治疗实体肿瘤和恶性血液肿瘤的Ⅰ期和Ⅱ期临床试验报道。在flavopiridol作用于难治性慢性淋巴细胞性白血病的Ⅰ期临床试验研究中, 42例患者静脉注射flavopiridol 6周后, 有19例患者出现部分缓解, 且这些患者的反应期中位数超过12个月[18]。此外, 在flavopiridol与紫杉醇联用于晚期实体瘤患者的Ⅰ期临床试验研究中, 二者联用对晚期食管癌、肺癌和前列腺癌患者具有一定临床疗效[19]。在一项Ⅱ期临床试验中, flavopiridol联合阿糖胞苷和米托蒽醌应用于62例急性粒细胞白血病成年患者, 表现出了良好的治疗效果, 53%的患者出现自限性的肿瘤细胞溶解, 75%的患者表现出完全缓解[20]。目前, 该化合物正处于针对急性骨髓性白血病(acute myeloid leukemia, AML)患者的Ⅱ期临床试验研究阶段。
3.2 Staurosporine及其衍生物Staurosporine是1977年由日本科学家Omura等[21]从Streptomyces sp.培养液中分离出来的一种生物碱。Staurosporine起初被作为抗真菌化合物进行开发, 直至1986年日本科学家Tamaoki等[22]发现其可有效抑制蛋白激酶C (protein kinase C, PKC), IC50为2.7 nmol·L-1, 并对肿瘤细胞具有明显的杀伤作用。后续的激酶谱筛选实验显示, staurosporine是一种广谱的蛋白激酶抑制剂, 对丝/苏氨酸激酶和酪氨酸激酶均有良好的抑制活性, 包括PKC、cAMP依赖的蛋白激酶(protein kinase A, PKA)和CDKs等[23]。由于该化合物对激酶抑制的选择性差, 限制了其成药可能性, 但其新颖的结构以及具有多种生物活性的特点, 吸引着国内外诸多学者以staurosporine为先导化合物进行进一步结构修饰及生物活性的研究[24]。
UCN-01是staurosporine的一种衍生物, 其在staurosporine内酰胺环的7位引入了1个羟基, 故又称7-hydroxystaurosporine。作为ATP竞争性蛋白激酶抑制剂, UCN-01可显著抑制PKC、CDKs及细胞周期检查点激酶1 (checkpoint kinase 1, Chk1)活性, 较之staurosporine对激酶的选择性更高[25]。在对UCN-01进一步开发的过程中, 发现其与血浆中α-1酸性糖蛋白的结合率较高, 在一定程度上降低了其在体内的生物利用度[26]。一项UCN-01用于难治性肿瘤患者的I期临床试验研究显示其静脉输注安全性良好, 确定推荐剂量为42.5 mg·m-2·d-1, 连续输注3天[27]。目前该化合物处于治疗淋巴瘤的Ⅱ期临床研究。
Novartis公司通过对staurosporine的结构改造, 得到了具有多靶点激酶抑制活性的衍生物midostaurin (PKC412/CGP41251), 其可有效抑制PKC、CDKs、PDGFR、VEGFR和src等激酶活性, 对多种肿瘤细胞及异体移植瘤具有良好的抑制作用[28]。在对midostaurin的深入研究中发现, 其对含有FLT-3 (fms related receptor tyrosine kinase 3)突变的骨髓瘤细胞具有很好的生长抑制作用, 后续的临床试验也进一步证实其对包含FLT-3突变的急性髓细胞白血病患者疗效显著[28, 29]。2017年, midostaurin经美国FDA批准上市, 主要用于含有FLT-3突变的急性骨髓性白血病患者[30] (图 5)。
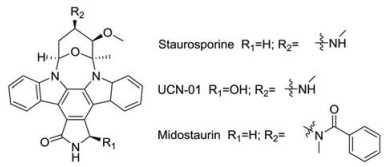
|
Figure 5 The structures of staurosporine and its derivatives |
Olomucine最初发现于块根类蔬菜中, 是白萝卜子叶中的化学成分, 是第一个2, 6, 9-三取代嘌呤衍生物。通过对35种不同的激酶活性实验研究发现, olomucine只抑制CDK1和CDK2 (IC50为7 μmol·L-1)、CDK5 (IC50为7 μmol·L-1)以及细胞外调节蛋白激酶1和丝裂原活化蛋白(extracellular signal-regulated kinase 1/mitogen-activated protein, ERKl/MAP)激酶(IC50为30 μmol·L-1), 对CDK6的抑制活性很弱(IC50 > 150 μmol·L-1), 对CDK4则无活性(IC50 > l mmol·L-1)[31]。
为了提高其对CDKs的抑制活性, 基于olomucine的构效关系, 化学家通过结构改造得到了roscovitine, 其可有效抑制CDK2 (IC50为0.1 μmol·L-1)、CDK7 (IC50为0.5 μmol·L-1)和CDK9 (IC50为0.8 μmol·L-1), 但其对CDK4的抑制活性较弱(IC50为14.2 μmol·L-1)[32]。由于roscovitine结构中存在1个手性中心, 通过对其2个光学异构体的CDKs抑制活性测定发现: R构型比S构型表现出更强的CDK抑制活性[31]。后续对R-roscovitine (seliciclib, CYC202)的进一步研究发现, 其可通过抑制CDK7与CDK9的活性来阻止RNA聚合酶II的磷酸化, 进而降低Mcl-l (MCL1 apoptosis regulator, BCL2 family member)抗凋亡蛋白的表达水平, 诱导多发性骨髓瘤细胞发生凋亡[33]。Seliciclib与卡培他滨联用于晚期实体瘤患者的I期临床试验研究表明, 二者联用安全性良好, 且对携带BRCA (breast cancer)突变的患者具有初步的抗肿瘤活性, 提示BRCA突变可作为潜在的生物敏感标志物[34]。目前, seliciclib已作为候选药物进入了I或II期临床试验研究(图 6)。

|
Figure 6 The structures of olomucine and seliciclib |
热休克蛋白是机体细胞在应激状态(高温环境、缺氧、感染、饥饿和创伤)下高效表达的一组蛋白质, 它广泛存在于原核生物和真核生物细胞中, 具有高度保守性。HSPs可与多种蛋白形成复合体, 陪伴蛋白分子在细胞内转运、跨膜以及帮助新生多肽的正确折叠和有效组装, 同时降低细胞内高浓度蛋白环境下蛋白聚集变性的危险, 从而调节靶蛋白的作用, 故热休克蛋白又被称为“分子伴侣”。根据分子量和等电点的不同, HSPs可分为HSP110、HSP90、HSP70、HSP60和小分子量HSPs家族。研究发现肿瘤细胞通过高表达HSP90蛋白来避免一系列变异和过表达的肿瘤蛋白的错误折叠和降解, 因此HSP90被认为是服务于癌基因依赖现象和肿瘤细胞生存的关键因子, 靶向HSP90热激蛋白的抑制剂也成为当前抗肿瘤药物研发的热点之一。
4.1 格尔德霉素(geldanamycin)1970年, 格尔德霉素发现于吸水链霉菌的发酵液中, 其属于苯安沙类抗生素, 初步研究发现其具有抗寄生虫和抗肿瘤的活性, 直到20世纪90年代才确证格尔德霉素的作用靶点为热激蛋白HSP90[35]。格尔德霉素通过特异性结合HSP90蛋白N端结构域上的ATP或ADP (adenosine-diphosphate)结合位点, 特异性抑制HSP90所必需的ATP酶活性, 干扰HSP90的正常功能, 阻止HSP90底物蛋白活化, 最终导致癌蛋白通过泛素蛋白酶体途径被降解, 从而起到抑制肿瘤细胞生长的作用[36]。虽然格尔德霉素在50多种肿瘤细胞系中均具有良好的增殖抑制活性, 但其稳定性差以及高肝脏毒性的特点限制了其进一步的开发与应用[37]。
4.2 Tanespimycin (17-AAG)17-AAG是格尔德霉素的一种衍生物, 其结构与格尔德霉素基本相似, 其肝脏毒性小, 水溶性好, 是第一个进入临床试验的格尔德霉素衍生物[38]。在Ⅰ期临床试验研究中, 17-AAG与紫杉醇、多西他赛、顺铂、吉西他滨、伊立替康、阿糖胞苷或索拉非尼联合使用, 显示其具有可接受的耐受性, 但治疗效果有限[39]。后续研究发现17-AAG和曲妥珠单抗的联合治疗具有较好的治疗效果, 在一项临床Ⅱ期试验研究中进一步确证了二者联用的抗肿瘤活性, 该研究纳入了31名HER2 (human epidermal growth factor receptor-2)扩增(HER2+)的晚期乳腺癌患者, 在接受曲妥珠单抗和17-AAG联合治疗后的总缓解率为22%, 中位生存期为17个月[40]。同时17-AAG与硼替佐米联用在多发性骨髓瘤中也具有良好的协同效应[41]。由于该化合物专利即将到期和生产成本高昂, 施贵宝公司停止了对其的进一步开发。
4.3 Alvespimycin (17-DAMG)17-DAMG是另一种格尔德霉素类似物, 具有更好的水溶性和口服生物利用度, 在临床前研究中显示出比17-AAG更强的抗肿瘤活性[42]。Ⅰ期临床试验评估了其静脉和口服给药的毒性反应, 除了常见的毒性反应(如疲劳、恶心和腹泻)外, 还报告了肝脏、肺、心脏、肾脏和眼部的毒性反应。在急性髓细胞白血病和黑色素瘤患者中, 单用17-DAMG可观察到肿瘤的消退。在顽固性卵巢癌和HER2扩增的乳腺癌患者中, 联合应用17-DAMG和曲妥珠单抗也可观察到肿瘤消退[43]。然而, 由于其安全性较差, 17-DAMG于2008年被Kosan公司停止了开发。
4.4 Retaspimycin (IPI-504)IPI-504是17-AAG的水溶性盐酸对苯二酚盐衍生物[42]。IPI-504较17-AAG对HSP90的抑制活性更强, 肝脏毒性较小。在多发性骨髓瘤、非小细胞肺癌和胃肠道间质瘤患者中进行的Ⅰ期临床试验研究显示其具有可接受的药物耐受性, 并确定了推荐剂量为225 mg·m-2, 每周2次不间断治疗或400 mg·m-2, 每周2次, 2周后休息1周[44]。在随后针对非小细胞肺癌患者的Ⅱ期临床试验研究中, IPI-504显示出良好的治疗效果。目前该化合物处于Ⅱ期临床试验研究阶段[45] (图 7)。
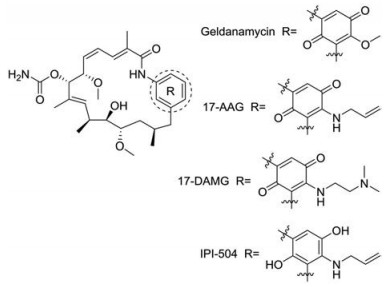
|
Figure 7 The structures of geldanamycin and its derivatives |
PI3K-蛋白激酶B (protein kinase B, PKB, 又称Akt)-mTOR信号通路是传递来自于受体酪氨酸激酶和G蛋白偶联受体信号的主要通路之一, 在多种细胞功能中扮演着重要的角色, 包括细胞周期、增殖、生长、存活、运动、蛋白合成和糖代谢的调控。
根据蛋白结构和底物偏好可将PI3K分为Ⅰ、Ⅱ和Ⅲ类。Ⅰ类能够在磷脂酰肌醇4, 5二磷酸[phosphatidylinositol (4, 5)-bisphosphate, PIP2]、磷脂酰肌醇4磷酸(phosphatidylinositol 4-phosphate, PIP)或磷脂酰肌醇(phosphatidylinositol, PI)的3-OH上进行磷酸化。I类PI3K进一步可分为IA类和IB类, 它们是由1个催化亚基p110α、p110β、p110δ或p110γ和1个调节亚基p85组成的异二聚体。Ⅱ类PI3K能够磷酸化PI和PIP, 分为PIK3C2α、PIK3C2β或PIK3C2γ 3个亚型, 主要参与细胞内物质的运输、细胞存活和膜受体蛋白的内化过程。Ⅲ类则能够磷酸化PI, 只有1种亚型即Vps34 (vacuole protein-sorting defective 34), 参与了高尔基体的囊泡运输过程, 在细胞自噬过程扮演了重要角色; mTOR是丝/苏氨酸蛋白激酶, 由2 549个氨基酸组成, 其在细胞内通过和不同的蛋白结合, 形成mTORC1和mTORC2两种功能不同的复合体, 它们由不同的上游信号激活并调节下游不同的信号通路。
近年来, 靶向PI3K/mTOR通路的抗肿瘤药物研发进展迅速, 其中不乏来源于天然产物或其衍生物的代表。
5.1 PI3K泛抑制剂—wortmannin和LY294002Wortmannin是在1957年从真菌Penicillium Wortmanni中分离得到的天然产物, 起初被发现具有很强的细胞增殖抑制和抗炎活性, 直到1993年才发现它能够抑制PI3K活性。Wortmannin为PI3K泛抑制剂, 对人Ⅰ类PI3K、Ⅱ类PIK3C2β和Ⅲ类Vps34的IC50低于10 nmol·L-1, 更高浓度下也可以抑制mTOR。Wortmannin通过共价结合到PI3K的ATP口袋的Lys (p110α的802位或p110γ的833位)而抑制激酶活性, 其与PI3Kα/γ的晶体结构表明, 除了这个共价结合位点外, wortmannin还通过若干个氢键和疏水相互作用与PI3K结合[46]。
槲皮素(quercetin)是广泛存在于各类植物中的黄酮类化合物, 研究显示, 它是天然的抗氧化剂和广谱的蛋白激酶抑制剂, 具有广泛的药理作用和生理活性, 如抗肿瘤、抗氧化、抗炎和抗过敏等。由于槲皮素自身的溶解性差, 生物利用率低, 限制了其后续的开发和利用, 因此通过对槲皮素进行结构修饰合成其衍生物以提高溶解度和生物利用度的研究受到越来越多的关注。LY294002是礼来公司在1994年通过改造天然产物槲皮素得到的人工合成的ATP竞争性的PI3K抑制剂, 对Ⅰ类PI3K、mTOR抑制的IC50约为10 μmol·L-1, 但相对于前体槲皮素而言对PI3K的选择性有了很大提高(图 8)。

|
Figure 8 The structures of wortmannin, quercetin, and LY294002 |
Wortmannin与LY294002作为第一代广谱PI3K抑制剂, 对PI3K分子均具有较强的抑制活性, 虽然由于选择性差和不良反应限制了它们在药物治疗领域的应用潜力, 但二者对于后续新型PI3K抑制剂的研究与开发具有深远的影响和意义。
5.2 mTOR抑制剂—rapamycin及其衍生物Rapamycin是最早发现的mTOR抑制剂, 是20世纪70年代从细菌Streptomyces hygroscopicus中分离出来的大环内酯类抗生素, 初步研究显示其具有良好的抗真菌活性, 最初也是针对白色念珠菌、新生隐球菌和烟曲霉对其进行开发[47]。后续对其深入的研究发现, rapamycin通过结合FK506结合蛋白12 (FK506-binding protein 12, FKBP-12)可特异性地与mTOR的FRB (FK506-rapamycin binding)结构域结合, 从而抑制mTOR的活性, 具有良好的免疫抑制活性[48]。1997年美国FDA批准rapamycin作为免疫抑制剂应用于肾移植。由于rapamycin的溶解度和稳定性较差, 以及专利即将到期, 各制药公司于20世纪90年代后期相继研发出多个rapamycin的衍生物。
Temsirolimus是由美国惠氏公司开发的rapamycin衍生物, 其可通过口服或静脉给药。2007年在美国和欧洲被批准上市作为治疗转移性肾细胞癌的一线药物。Temsirolimus也被批准用于治疗复发性套细胞淋巴瘤。
Everolimus是由诺华制药公司开发的口服rapamycin衍生物, 于2009年3月经美国FDA批准上市, 主要用于舒尼替尼或索拉菲尼治疗无效的晚期肾癌患者。此后, 美国FDA又陆续批准其增加多项临床应用症:包括用于绝经后女性患者晚期激素受体阳性HER2阴性乳腺癌的治疗; 用于成人晚期胰腺神经内分泌肿瘤(pancreatic neuroendocrine tumor, PNET); 用于成人无需立即手术的肾血管平滑肌脂肪瘤和结节性硬化症(图 9)。

|
Figure 9 The structures of rapamycin and its derivatives |
蛋白激酶是一类从高能供体分子(如ATP)转移磷酸基团到特定靶分子(底物)的蛋白, 在细胞的信号转导及其复杂的生命活动中起到了广泛的作用。酪氨酸蛋白激酶(protein tyrosine kinase, PTK)是一类催化ATP γ位磷酸基团转移到蛋白酪氨酸残基酚羟基的激酶, 能催化多种底物蛋白质酪氨酸残基磷酸化, 在细胞生长、增殖和分化中具有重要的作用。多数蛋白酪氨酸激酶属于致癌RNA病毒的癌基因产物, 也可由脊椎动物的原癌基因产生, 其基因扩增或激活性突变是促进肿瘤发生和发展的重要因素之一。因此靶向酪氨酸激酶的抑制剂研发是分子靶向抗肿瘤药物的热点之一。实际上, 目前上市的分子靶向抗肿瘤药物大多数为酪氨酸激酶抑制剂。
6.1 GenisteinGenistein是豆科植物中广泛存在的雌激素类异黄酮化合物, 研究发现其具有抑制蛋白酪氨酸激酶的活性, 对于前列腺癌具有潜在的治疗作用[49]。Genistein能够促使慢性髓系白血病细胞K562的分化, 并抑制K562细胞中癌蛋白Bcr-Abl (BCR activator of Rho GEF and GTPase-Abl tyrosine kinase)的合成, 从而促进细胞的凋亡[50]。在一项针对前列腺癌患者的Ⅰ期临床试验研究中评估了其口服给药的药代动力学参数与安全性, 发现其安全性良好, 患者未发现明显的毒性反应[51]。在另一项针对前列腺癌患者的Ⅱ期临床试验中, 研究人员发现genistein虽然具有良好的安全性, 但其并不能有效降低患者血浆中性激素结合球蛋白、总雌二醇以及睾丸素的含量[52], 因此, 对于genistein的开发还有待进一步的临床试验去证实。
6.2 PhenoxodiolPhenoxodiol是genistein的结构类似物, 其具有广谱的抗肿瘤活性, 可有效抑制由DMBA (dimethylbenzanthracene)诱发的小鼠乳腺癌的发生和发展[53]。在晚期实体瘤患者中进行的临床Ⅰ期试验研究显示, 其静脉注射具有良好的药物耐受性, 患者未见明显的毒副反应, 药物安全性良好[54]。此外, 一项phenoxodiol与常用化疗药联用的Ⅱ期临床试验研究证实其能够有效提高患者对化疗药物的敏感性, 逆转患者对顺铂或紫杉醇的耐药性[55]。目前该化合物已被美国FDA批准为快速通道药物, 正处于Ⅱ或Ⅲ期临床试验研究阶段(图 10)。

|
Figure 10 The structures of genistein and phenoxodiol |
基于天然产物的药物开发一直是抗肿瘤药物发现与研究的重要方向。据不完全统计, 目前已有5个来源于天然产物或其衍生物的分子靶向抗肿瘤药物用于肿瘤的临床治疗, 还有约10个化合物处于临床试验阶段(表 1)。天然产物作为药物来源的重大宝库, 与其本身的诸多优势密不可分:植物或其他生物代谢所产生的活性物质本身就是为了自我防卫, 这些化合物往往具有抵抗微生物或其他的生理功能; 天然产物的化学结构往往十分复杂, 以至于难以用人工合成的方法去获得, 因而天然产物可作为先导化合物及候选药物的重要来源; 许多天然产物具有天然生成的手性, 比起没有手性的大部分合成化合物更具有类药性。这些自然形成的优势为天然产物向药物的转化提供了更多的选择, 也是天然产物在药物开发与研究中发挥着重要作用的原因。当然, 在天然产物的药物开发过程中, 由于其本身存在的一些不足, 在一定程度上限制了其向药物的转化和开发。这些不足包括:提取的天然产物往往含量较低, 难以保障市场需求; 由于其结构的复杂性, 为后续的全合成或半合成增加了难度; 一些天然产物本身虽具有治疗活性, 但毒副作用大, 限制了其使用。因此, 如何通过合理的生物合成方法来弥补天然产物的不足之处, 充分发挥天然产物本身具有的独特优势, 成为了天然产物向药物转化与开发的重要一环。
| Table 1 Molecularly targeted anti-tumor drugs derived from natural products or their derivatives that are approved or in clinical trials. HDAC: Histonedeacetylases; CTCL: Cutaneous T cell lymphoma; PTCL: Peripheral T cell lymphoma; MM: Multiple myeloma; CDK: Cyclin dependent kinase; AML: Acute myeloid leukemia; PKC: Protein kinase C; Chk1: Checkpoint kinase 1; PDGFR: Platelet-derived growth factor receptor; VEGFR: Vascular endothelial growth factor receptor; Src: Src protein; HSP: Heat shock protein; mTOR: Mammalian target of rapamycin; PNET: Pancreatic neuroendocrine tumor; PTK: Protein tyrosine kinase |
随着化学生物学和合成生物学等学科的快速发展, 天然产物自身存在的缺陷与不足可望得到解决。针对天然产物得率低的缺点, 可以采用合理的生物学方法, 如植物组织培养、微生物发酵等技术来直接获取目标化合物或其中间体, 再通过适当的合成化学方法对中间体进行化学修饰, 从而获取足量的目标化合物; 对于天然产物难以合成的问题, 可以基于对其构效关系的分析, 进行适当的结构简化, 通过减少立体结构中心、骨架跃迁等方式降低合成难度; 对于天然产物毒副作用大、生物利用度低的问题, 可以运用结构化学的手段, 对化合物进行合理的化学结构修饰与优化, 提高其生物利用度并降低其毒副作用。这些新科学和新技术的发展将继续促使天然产物在抗肿瘤药物研发的过程中发挥更大的作用。在未来天然产物向药物转化的开发与研究中, 除了对天然产物进行分离纯化及结构鉴定外, 更为重要的是对天然产物构效关系的研究, 在此基础上通过合理的结构化学的方法对其结构进行修饰与优化, 以得到合适的药物先导或药物候选化合物, 这将是挖掘天然产物资源作为抗肿瘤药物研究与开发的有效策略。
作者贡献:张旭负责综述的文献调研与撰写; 蒙凌华负责论文的指导与审阅。
利益冲突:所有作者均声明不存在利益冲突。
| [1] |
Harvey AL, Edrada-Ebel R, Quinn RJ. The re-emergence of natural products for drug discovery in the genomics era[J]. Nat Rev Drug Discov, 2015, 14: 111-129. DOI:10.1038/nrd4510 |
| [2] |
Hu HX, Wang XQ, Zhang H, et al. Mechanism and clinical progress of molecular tergeted cancer therapy[J]. Acta Pharm Sin (药学学报), 2015, 50: 1232-1239. |
| [3] |
Hoelder S, Clarke PA, Workman P. Discovery of small molecule cancer drugs: successes, challenges and opportunities[J]. Mol Oncol, 2012, 6: 155-176. DOI:10.1016/j.molonc.2012.02.004 |
| [4] |
Holohan C, Van Schaeybroeck S, Longley DB, et al. Cancer drug resistance: an evolving paradigm[J]. Nat Rev Cancer, 2013, 13: 714-726. DOI:10.1038/nrc3599 |
| [5] |
Newman DJ, Cragg GM. Natural products as sources of new drugs over the last 25 years[J]. J Nat Prod, 2007, 70: 461-477. DOI:10.1021/np068054v |
| [6] |
Dong ZJ, Han C, Liu JJ, et al. Histone deacetylase inhibitors: research advances[J]. J Int Pharm Res (国际药学研究杂志), 2017, 44: 1098-1106, 1124. |
| [7] |
VanderMolen KM, McCulloch W, Pearce CJ, et al. Romidepsin (Istodax, NSC 630176, FR901228, FK228, depsipeptide): a natural product recently approved for cutaneous T-cell lymphoma[J]. J Antibiot (Tokyo), 2011, 64: 525-531. DOI:10.1038/ja.2011.35 |
| [8] |
Nakajima H, Kim YB, Terano H, et al. FR901228, a potent antitumor antibiotic, is a novel histone deacetylase inhibitor[J]. Exp Cell Res, 1998, 241: 126-133. DOI:10.1006/excr.1998.4027 |
| [9] |
Grant C, Rahman F, Piekarz R, et al. Romidepsin: a new therapy for cutaneous T-cell lymphoma and a potential therapy for solid tumors[J]. Expert Rev Anticancer Ther, 2010, 10: 997-1008. DOI:10.1586/era.10.88 |
| [10] |
Kong F, Faulkner DJ. Leucettamol-A and leucettamol-B, 2 antimicrobial lipids from the calcareous sponge leucetta-microraphis[J]. J Org Chem, 1993, 58: 970-971. DOI:10.1021/jo00056a037 |
| [11] |
Tsukamoto S, Takeuchi T, Rotinsulu H, et al. Leucettamol A: a new inhibitor of Ubc13-Uev1A interaction isolated from a marine sponge, Leucetta aff. microrhaphis[J]. Bioorg Med Chem Lett, 2008, 18: 6319-6320. DOI:10.1016/j.bmcl.2008.10.110 |
| [12] |
Macherla VR, Mitchell SS, Manam RR, et al. Structure-activity relationship studies of salinosporamide a (NPI-0052), a novel marine derived proteasome inhibitor[J]. J Med Chem, 2005, 48: 3684-3687. DOI:10.1021/jm048995+ |
| [13] |
Feling RH, Buchanan GO, Mincer TJ, et al. Salinosporamide A: a highly cytotoxic proteasome inhibitor from a novel microbial source, a marine bacterium of the new genus Salinospora[J]. Angew Chem Int Ed Engl, 2003, 42: 355-357. DOI:10.1002/anie.200390115 |
| [14] |
Chauhan D, Hideshima T, Anderson KC. A novel proteasome inhibitor NPI-0052 as an anticancer therapy[J]. Br J Cancer, 2006, 95: 961-965. DOI:10.1038/sj.bjc.6603406 |
| [15] |
Cragg GM, Newman DJ. Plants as a source of anti-cancer agents[J]. J Ethnopharmacol, 2005, 100: 72-79. DOI:10.1016/j.jep.2005.05.011 |
| [16] |
Sedlacek HH. Mechanisms of action of flavopiridol[J]. Crit Rev Oncol Hemat, 2001, 38: 139-170. DOI:10.1016/S1040-8428(00)00124-4 |
| [17] |
Senderowicz AM. Flavopiridol: the first cyclin-dependent kinase inhibitor in human clinical trials[J]. Invest New Drugs, 1999, 17: 313-320. DOI:10.1023/A:1006353008903 |
| [18] |
Byrd JC, Lin TS, Dalton JT, et al. Flavopiridol administered using a pharmacologically derived schedule is associated with marked clinical efficacy in refractory, genetically high-risk chronic lymphocytic leukemia[J]. Blood, 2007, 109: 399-404. DOI:10.1182/blood-2006-05-020735 |
| [19] |
Schwartz GK, O'Reilly E, Ilson D, et al. Phase I study of the cyclin-dependent kinase inhibitor flavopiridol in combination with paclitaxel in patients with advanced solid tumors[J]. J Clin Oncol, 2002, 20: 2157-2170. DOI:10.1200/JCO.2002.08.080 |
| [20] |
Karp JE, Smith BD, Levis MJ, et al. Sequential flavopiridol, cytosine arabinoside, and mitoxantrone: a phase Ⅱ trial in adults with poor-risk acute myelogenous leukemia[J]. Clin Cancer Res, 2007, 13: 4467-4473. DOI:10.1158/1078-0432.CCR-07-0381 |
| [21] |
Omura S, Iwai Y, Hirano A, et al. A new alkaloid AM-2282 of Streptomyces origin. Taxonomy, fermentation, isolation and preliminary characterization[J]. J Antibiot (Tokyo), 1977, 30: 275-282. DOI:10.7164/antibiotics.30.275 |
| [22] |
Tamaoki T, Nomoto H, Takahashi I, et al. Staurosporine, a potent inhibitor of phospholipid/Ca2+ dependent protein-kinase[J]. Biochem Biophys Res Commun, 1986, 135: 397-402. DOI:10.1016/0006-291X(86)90008-2 |
| [23] |
Gani OA, Engh RA. Protein kinase inhibition of clinically important staurosporine analogues[J]. Nat Prod Rep, 2010, 27: 489-498. DOI:10.1039/b923848b |
| [24] |
Liu M, Jia H, Sha Y. Research progress in derivatization and structure-activity relationships of staurosporine[J]. J Shenyang Pharm Univ (沈阳药科大学学报), 2014, 31: 224-240. |
| [25] |
Eastman A. Cell cycle checkpoints and their impact on anticancer therapeutic strategies[J]. J Cell Biochem, 2004, 91: 223-231. DOI:10.1002/jcb.10699 |
| [26] |
Fuse E, Kuwabara T, Sparreboom A, et al. Review of UCN-01 development: a lesson in the importance of clinical pharmacology[J]. J Clin Pharmacol, 2005, 45: 394-403. DOI:10.1177/0091270005274549 |
| [27] |
Sausville EA, Arbuck SG, Messmann R, et al. Phase I trial of 72-hour continuous infusion UCN-01 in patients with refractory neoplasms[J]. J Clin Oncol, 2001, 19: 2319-2333. DOI:10.1200/JCO.2001.19.8.2319 |
| [28] |
Gallogly MM, Lazarus HM. Midostaurin: an emerging treatment for acute myeloid leukemia patients[J]. J Blood Med, 2016, 7: 73-83. |
| [29] |
Kindler T, Lipka DB, Fischer T. FLT3 as a therapeutic target in AML: still challenging after all these years[J]. Blood, 2010, 116: 5089-5102. |
| [30] |
Levis M. Midostaurin approved for FLT3-mutated AML[J]. Blood, 2017, 129: 3403-3406. DOI:10.1182/blood-2017-05-782292 |
| [31] |
Zhang J, Wang Q, Hou X, et al. Recent advances in cyclin-dependent kinase inhibitors with purine scaffold[J]. Chin J Org Chem (有机化学), 2015, 35: 1022-1032. DOI:10.6023/cjoc201410039 |
| [32] |
Benson C, Kaye S, Workman P, et al. Clinical anticancer drug development: targeting the cyclin-dependent kinases[J]. Br J Cancer, 2005, 92: 7-12. DOI:10.1038/sj.bjc.6602229 |
| [33] |
MacCallum DE, Melville J, Frame S, et al. Seliciclib (CYC202, R-roscovitine) induces cell death in multiple myeloma cells by inhibition of RNA polymerase Ⅱ-dependent transcription and down-regulation of Mcl-1[J]. Cancer Res, 2005, 65: 5399-5407. DOI:10.1158/0008-5472.CAN-05-0233 |
| [34] |
Tolaney SM, Hilton JF, Cleary JM, et al. 2016 Annual Meeting of the American Society of Clinical Oncology (2016年美国肿瘤临床学会年会)[C]. Alexandria: AMER SOC CLINICAL ONCOLOGY Press, 2016: 2503.
|
| [35] |
Whitesell L, Mimnaugh EG, De Costa B, et al. Inhibition of heat shock protein HSP90-pp60v-src heteroprotein complex formation by benzoquinone ansamycins: essential role for stress proteins in oncogenic transformation[J]. Proc Natl Acad Sci U S A, 1994, 91: 8324-8328. DOI:10.1073/pnas.91.18.8324 |
| [36] |
Liao ZY, Zhen YS. Advances in antitumor activity of the HSP90 inhibitor geldanamycin[J]. Acta Pharm Sin (药学学报), 2001, 36: 716-720. |
| [37] |
Hostein I, Robertson D, DiStefano F, et al. Inhibition of signal transduction by the Hsp90 inhibitor 17-allylamino-17-demethoxygeldanamycin results in cytostasis and apoptosis[J]. Cancer Res, 2001, 61: 4003-4009. |
| [38] |
Iyer G, Morris MJ, Rathkopf D, et al. A phase I trial of docetaxel and pulse-dose 17-allylamino-17-demethoxygeldanamycin in adult patients with solid tumors[J]. Cancer Chemother Pharmacol, 2012, 69: 1089-1097. DOI:10.1007/s00280-011-1789-3 |
| [39] |
Jhaveri K, Taldone T, Modi S, et al. Advances in the clinical development of heat shock protein 90 (Hsp90) inhibitors in cancers[J]. Biochim Biophys Acta, 2012, 1823: 742-755. DOI:10.1016/j.bbamcr.2011.10.008 |
| [40] |
Modi S, Stopeck A, Linden H, et al. HSP90 inhibition is effective in breast cancer: a phase Ⅱ trial of tanespimycin (17-AAG) plus trastuzumab in patients with HER2-positive metastatic breast cancer progressing on trastuzumab[J]. Clin Cancer Res, 2011, 17: 5132-5139. DOI:10.1158/1078-0432.CCR-11-0072 |
| [41] |
Richardson PG, Chanan-Khan AA, Lonial S, et al. Tanespimycin and bortezomib combination treatment in patients with relapsed or relapsed and refractory multiple myeloma: results of a phase 1/2 study[J]. Br J Haematol, 2011, 153: 729-740. DOI:10.1111/j.1365-2141.2011.08664.x |
| [42] |
Garcia-Carbonero R, Carnero A, Paz-Ares L. Inhibition of HSP90 molecular chaperones: moving into the clinic[J]. Lancet Oncol, 2013, 14: e358-e369. DOI:10.1016/S1470-2045(13)70169-4 |
| [43] |
Pacey S, Wilson RH, Walton M, et al. A phase I study of the heat shock protein 90 inhibitor alvespimycin (17-DMAG) given intravenously to patients with advanced solid tumors[J]. Clin Cancer Res, 2011, 17: 1561-1570. DOI:10.1158/1078-0432.CCR-10-1927 |
| [44] |
Siegel D, Jagannath S, Vesole DH, et al. A phase 1 study of IPI-504 (retaspimycin hydrochloride) in patients with relapsed or relapsed and refractory multiple myeloma[J]. Leuk Lymphoma, 2011, 52: 2308-2315. DOI:10.3109/10428194.2011.600481 |
| [45] |
Riely GJ, Gettinger SN, Stoller RG, et al. 2011 Annual Meeting of the American Society of Clinical Oncology (2011年美国肿瘤临床学会年会)[C]. Alexandria: AMER SOC CLINICAL ONCOLOGY Press, 2011: 7516.
|
| [46] |
Powis G, Bonjouklian R, Berggren MM, et al. Wortmannin, a potent and selective inhibitor of phosphatidylinositol-3-kinase[J]. Cancer Res, 1994, 54: 2419-2423. |
| [47] |
Sehgal SN. Sirolimus: its discovery, biological properties, and mechanism of action[J]. Transplant Proc, 2003, 35: 7S-14S. DOI:10.1016/S0041-1345(03)00211-2 |
| [48] |
Vignot S, Faivre S, Aguirre D, et al. mTOR-targeted therapy of cancer with rapamycin derivatives[J]. Ann Oncol, 2005, 16: 525-537. DOI:10.1093/annonc/mdi113 |
| [49] |
Wang TT, Sathyamoorthy N, Phang JM. Molecular effects of genistein on estrogen receptor mediated pathways[J]. Carcinogenesis, 1996, 17: 271-275. DOI:10.1093/carcin/17.2.271 |
| [50] |
Papazisis KT, Zambouli D, Kimoundri OT, et al. Protein tyrosine kinase inhibitor, genistein, enhances apoptosis and cell cycle arrest in K562 cells treated with gamma-irradiation[J]. Cancer Lett, 2000, 160: 107-113. DOI:10.1016/S0304-3835(00)00569-3 |
| [51] |
Miltyk W, Craciunescu CN, Fischer L, et al. Lack of significant genotoxicity of purified soy isoflavones (genistein, daidzein, and glycitein) in 20 patients with prostate cancer[J]. Am J Clin Nutr, 2003, 77: 875-882. DOI:10.1093/ajcn/77.4.875 |
| [52] |
Kumar NB, Krischer JP, Allen K, et al. A phase Ⅱ randomized, placebo-controlled clinical trial of purified isoflavones in modulating steroid hormones in men diagnosed with localized prostate cancer[J]. Nutr Cancer, 2007, 59: 163-168. DOI:10.1080/01635580701432678 |
| [53] |
Constantinou AI, Mehta R, Husband A. Phenoxodiol, a novel isoflavone derivative, inhibits dimethylbenz[a]anthracene (DMBA)-induced mammary carcinogenesis in female Sprague-Dawley rats[J]. Eur J Cancer, 2003, 39: 1012-1018. DOI:10.1016/S0959-8049(03)00124-2 |
| [54] |
Choueiri TK, Mekhail T, Hutson TE, et al. Phase I trial of phenoxodiol delivered by continuous intravenous infusion in patients with solid cancer[J]. Ann Oncol, 2006, 17: 860-865. DOI:10.1093/annonc/mdl010 |
| [55] |
Goss G, Quinn M, Rutherford T, et al. A randomised phase Ⅱ study of phenoxodiol with platinum or taxane chemotherapy in chemoresistant epithelial ovarian cancer, fallopian tube cancer and primary peritoneal cancer[J]. EJC Suppl, 2005, 3: 261. |
 2020, Vol. 55
2020, Vol. 55


