近年来, 由于肿瘤放化疗技术的普遍实施、器官移植的逐步开展及糖皮质激素等药物的广泛使用, 院内免疫抑制患者的数量正在逐年增加。而细菌性感染是免疫抑制患者最常见的感染性疾病, 是导致患者死亡的常见病因。铜绿假单胞菌(Pseudomonas aeruginosa, PA)是临床最常见的细菌性感染相关病原菌之一, 是导致住院患者高死亡率和高发病率的主要感染菌, 其引起的肺部感染通常具有病程长、治愈率低等特点, 在医院获得性肺炎(HAP)中占第二位[1-3]。目前, 对由铜绿假单胞菌引起的肺部感染采取的主要治疗措施是抗菌治疗, 但由于铜绿假单胞菌具有多种耐药机制及多重耐药的特点, 很难进行彻底根治[4, 5], 而传统的抗生素由于生物利用率低, 在胃肠道被部分降解或无法穿过肺部黏液屏障而浓度不足以在肺组织达到并维持最低抑菌浓度以上, 往往需要大剂量给药、长周期治疗, 这导致明显的毒副作用, 如肝肾损伤等[6], 同时其对生物膜内细菌的杀伤效果和对胞内感染治疗效果差, 易产生耐药性, 使治疗难以奏效[7]。因此, 免疫抑制患者的肺部铜绿假单胞菌感染已成为我国肺部感染临床诊治的一大难题。
临床上常采用莫西沙星(MXF)治疗肺部细菌性感染。MXF为氟喹诺酮类抗菌药, 抗菌谱广, 对革兰阳性菌及革兰阴性菌都具有一定的抗菌活性, 但其水溶性高, 给药后难以长时间停留于感染部位, 易被机体清除, 且长期大量应用后具有一定的肝毒性, 因此其在临床上的应用受到一定的限制。
为解决抗菌药物治疗效果不佳、毒副作用强的问题, 研究者利用一些具有抗菌活性的纳米材料, 或以一些纳米材料为基础, 构建能有效提高抗菌药物活性和安全性的纳米给药系统[8]。目前已有抗菌药物纳米制剂进入临床研究。纳米给药系统的主要优势有: ①增强了药物与细菌作用或者改变药物作用方式, 达到杀灭细菌的作用; ②提高药物的作用效率, 达到降低药物毒性的目的[9]; ③提高抗菌药物穿透组织屏障和细菌生物膜的能力; ④提高药物在血液循环中的稳定性, 延长其半衰期, 减小给药量, 减少给药次数[10-12]。
本研究以苯硼酸修饰的α-环糊精(αCD)作为药物载体, 外层再包裹卵磷脂和二硬脂酰基磷脂酰乙醇胺-聚乙二醇(DSPE-PEG), 负载MXF制备了纳米药物递送系统并用于肺部分离耐药铜绿假单胞菌的抗菌治疗。本研究通过对载药纳米药物进行理化性质表征及体外药效学考察, 评价其抗耐药铜绿假单胞菌疗效, 为肺部细菌性感染的药物治疗提供参考依据。
材料与方法材料与试剂 卵磷脂(Alfa Aesar公司); 二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000 (DSPE-PEG2000, 西安瑞禧生物科技有限公司); MXF (大连美仑生物科技有限公司); oxidizing-αCD (Oxi-αCD)由本课题组前期合成; 普朗尼克F127 (德国BASF公司); Cy5 (西安瑞禧生物科技有限公司); SYTO 9 (美国Molecular Probes公司); RPMI-1640培养基、胎牛血清、0.25%胰酶溶液(美国Hyclone公司); LB及MHB培养基(北京陆桥生物技术有限公司); 哥伦比亚血琼脂平板(重庆庞通医疗器械有限公司); CCK-8试剂盒(上海碧云天生物科技有限公司)。
仪器 高效液相色谱仪(HPLC, 日本岛津公司); 激光共聚焦显微镜(德国Zeiss公司); 多功能酶标仪(美国Thermo scientific公司); 激光粒度仪(Zetasizer Nano ZS, 英国Malvern公司); 透射电镜(TEM, JEM-1400, 日本电子株式会社)。
细胞培养 人支气管上皮细胞(HBE)购自中国科学院上海细胞生物研究所, 用含10%胎牛血清的RPMI-1640培养基于37 ℃、5% CO2及饱和湿度条件下连续培养。
细菌培养与菌液制备 铜绿假单胞菌P727由本实验室保存, 来源于陆军军医大学第一附属医院肺部感染患者痰液样本。将P727菌株接种至哥伦比亚血琼脂平板, 于微生物培养箱中37 ℃倒置培养24 h。随后挑取平板上单菌落, 置于10 mL LB液体培养基中, 于恒温振荡摇床中180 r·min-1、37 ℃振荡过夜, 收集P727菌液, 4 ℃、3 500 r·min-1离心5 min。弃去上清液, 用无菌生理盐水调节菌液浓度为1.0×108 CFU·mL-1 (麦氏比浊法)。
载莫西沙星纳米药物的制备和表征 将卵磷脂6.0 mg与DSPE-PEG2000 18.0 mg溶于600 μL无水乙醇, 超声分散, 加入超纯水15 mL, 超声分散后于油浴中65 ℃缓慢加热0.5 h, 另将Oxi-αCD 30 mg与MXF 3 mg溶于1.5 mL乙腈与1.5 mL甲醇的混合溶剂中, 将载体与药物溶液缓慢滴加入卵磷脂和DSPE-PEG2000混合溶液中(混合溶液预先冷却至室温), 快速搅拌3 min, 于室温条件下缓慢搅拌2 h使自组装形成纳米粒。收集反应溶液, 于10 000 r·min-1离心10 min, 弃去上清液, 保留沉淀, 加入5% F127溶液200 μL重悬分散, 再加入超纯水10 mL, 按前述离心条件重复洗涤2次, 最后加入超纯水200 μL重悬分散, 得到所制备纳米药物。通过激光粒度仪测定该纳米药物的粒径分布与大小, 并进行电位测定。取纳米溶液20 μL, 加入甲醇破乳后通过HPLC测定MXF含量, 另取纳米溶液20 μL冻干后称重, 得到纳米药物含量, 按如下公式计算纳米药物的载药量(drug loading, DL)及包封率(entrapment efficiency, EE), 重复测定3次。
| $ {{\rm{DL}} = {W_{\rm{e}}}/{W_{\rm{d}}} \times 100\% } $ | (1) |
| $ {{\rm{EE}} = {W_{\rm{e}}}/{W_{\rm{t}}} \times 100\% } $ | (2) |
其中, We为包裹于纳米粒内的药物量, Wd为载药纳米粒总量, Wt为纳米粒中药物总量。
体外释放实验 取载药纳米粒200 μL加入透析袋(3 500 kDa)中, 将透析袋置于40 mL 0.01 mol·L-1磷酸盐缓冲液(PBS)中, 于恒温振荡摇床中100 r·min-1、37 ℃进行体外释药研究, 分别于0.5、1、2、4、6、8、12、24、48、72、96和120 h等时间点取PBS介质溶液4 mL, 并同时补充新鲜释放介质溶液4 mL。将所取样品经过0.22 μm滤膜过滤, 通过HPLC测定MXF浓度, 并计算药物累计释放量, 绘制释放曲线。其HPLC检测色谱条件:色谱柱: Kromasil-C18柱, 250 mm×4.6 mm, 5 μm, 流动相:甲醇-四正丁基溴化铵磷酸盐缓冲液(28:72), 检测波长296 nm, 柱温40 ℃, 流速1.0 mL·min-1, 进样量5 μL。
CCK-8细胞毒性实验 将正常支气管上皮细胞HBE细胞接种于96孔板中, 待细胞长满至80%, 用不含血清和双抗的1640培养基将空白纳米粒(不含MXF)与载MXF纳米粒按两倍稀释法进行稀释, 得到一系列浓度的药物溶液。将各药物溶液加入96孔板中, 与HBE细胞共同孵育24 h。待培养完成后, 于各孔中加入CCK-8溶液10 μL继续培养1 h, 之后用酶标仪于450 nm处进行吸光度检测。
最低抑菌浓度(minimum inhibitory concentration, MIC)测定 将MXF与载药纳米粒用MHB培养基分别依次进行等比稀释, 得到质量浓度依次为64、32、16、8、4、2、1、0.5、0.25、0.125和0.062 5 μg·mL-1的药物溶液。将P727菌液浓度用MHB培养基调整为1.0×106 CFU·mL-1。在96孔板中各加入菌液100 μL后继续加入不同浓度的MXF和载药纳米粒溶液各100 μL, 对照组仅加入MHB培养基, 使药物溶液与菌液混合均匀后放置于37 ℃培养箱中进行培养, 24 h后观察抑菌效果, 测定MIC值。
生物膜形成抑制实验 将P727细菌与MXF、载药纳米粒按照1/4 MIC MXF于96孔板中共同培养24 h, 之后用1%结晶紫进行染色, 待PBS洗涤风干后加入30%冰醋酸溶液。通过酶标仪于590 nm处测定各孔吸光度值, 进行生物膜抑制能力评价。
透射电镜(transmission electron microscope, TEM)观察 根据MIC值测定结果, 将MXF、空白纳米粒与载药纳米粒按照1/4 MIC值MXF加入P727菌液中(菌液浓度为1.0×106 CFU·mL-1), 共同培养4 h, 之后收集菌液, 3 500 r·min-1离心5 min, 用预冷PBS进行洗涤, 收集细菌沉淀加入2.5%戊二醛4 ℃固定过夜, 制样后进行TEM观察。
细菌与纳米粒结合实验 取1×106 CFU·mL-1 P727菌液1 mL, 加入1.5 μL SYTO 9荧光探针, 避光孵育15 min。之后将荧光标记的P727细菌与1 mL Cy5溶液、Cy5标记的荧光纳米药物于37 ℃培养箱中共同培养2 h, 对照组则加入PBS溶液1 mL。待培养完成后于共聚焦显微镜下进行观察。
数据分析 采用Prism 5.0软件进行统计学分析。计量数据用x ± s表示。组间均数差异采用Student's t-test进行检验, P < 0.05表示具有显著性差异。
结果与讨论 1 载药纳米粒的理化性质表征粒径测定结果表明(图 1A), 该载药纳米粒的粒径为332.5 ± 2.7 nm, 多分散指数(PDI)为0.125 ± 0.053, 电位为-24.3 ± 1.7 mV, 粒径大小分布均匀。TEM结果显示, 该纳米粒具有类球形结构, 且粒径大小和分布与粒径仪测定结果一致(图 1B)。该载药纳米粒的载药量为(6.02 ± 1.27) %, 包封率为(16.69 ± 1.17) %。
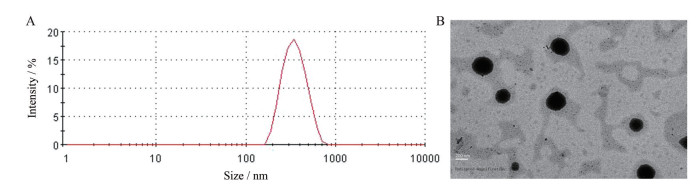
|
Figure 1 The size distribution (A) and morphology (B) of moxifloxacin loaded nanoparticles (MXF/NPs). Scale bar represents 200 nm |
载药纳米药物在PBS中能较快释放, 24 h内释放约70%, 72 h内释放量可达到87%, 而在120 h几乎可完全释放药物(图 2)。结果表明, 本研究中所制备的载药纳米粒具有良好的释药性能, 能在一定时间内实现快速释药, 这为纳米药物发挥体内治疗作用提供了良好的基础。
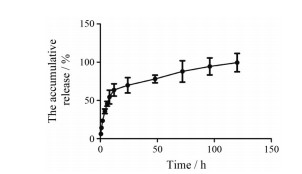
|
Figure 2 The drug release profiles of MXF/NPs in phosphate buffer saline (PBS). n = 3, x ± s |
空白纳米粒和载药纳米粒在给药浓度范围内(0~16 μg·mL-1)均对HBE细胞不产生毒性, 细胞存活率均在80%以上(图 3)。结果表明, 本研究中所制备纳米粒及载体材料具有良好的生物安全性, 可用于体内递药。
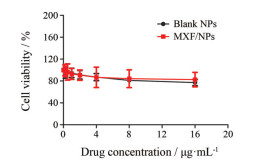
|
Figure 3 The effect of blank nanoparticles (blank NPs) and MXF/NPs on human bronchial epithelial (HBE) cell viability. n = 3, x ± s |
微孔法测得MXF溶液对铜绿假单胞菌P727的MIC值为16 μg·mL-1, 说明该菌株对MXF耐药, 且临床检验报告显示该菌株对环丙沙星及左氧氟沙星均耐药, 为多药耐药菌, 而载MXF纳米药物对铜绿假单胞菌P727的MIC值为8 μg·mL-1, 是MXF溶液的1/2。结果表明, 载药纳米粒与游离药物MXF相比, MIC值降低, 能更有效地抑制耐药铜绿假单胞菌P727的生长, 具有更强的抑菌活性。
5 生物膜形成抑制实验铜绿假单胞菌生物膜的形成是其耐药及引起难治性肺部感染的重要原因, 因此在本研究中对比考察了MXF及载药纳米粒抑制铜绿假单胞菌生物膜形成的能力。结果表明, 相比于对照组, MXF及载药纳米粒均能显著抑制细菌生物膜的形成, 而相比于MXF游离药物, 载药纳米粒抑制细菌生物膜形成的能力更强(图 4)。
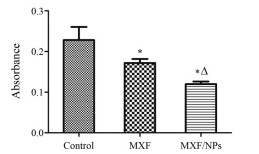
|
Figure 4 The effects on biofilm formation of P727 isolate treated with control (cells were treated with culture medium), MXF, MXF/NPs at 1/4 MIC of MXF (4 μg·mL-1). The absorbance value was measured at 590 nm. MIC: Minimum inhibitory concentration. n = 3, x ± s. *P < 0.05 vs control group; △P < 0.05 vs MXF group |
与对照组和空白纳米粒组相比, MXF溶液组与载药纳米粒组均能够显著抑制细菌生长, 但相对于MXF溶液组, 载药纳米粒组对耐药P727细菌的抑制能力更强, 可明显观察到细菌细胞在纳米药物作用后结构破坏, 胞内遗传物质等内容物外漏, 继而死亡。而MXF溶液组作用后, 细菌细胞则未观察到明显的形态变化与死亡(图 5)。
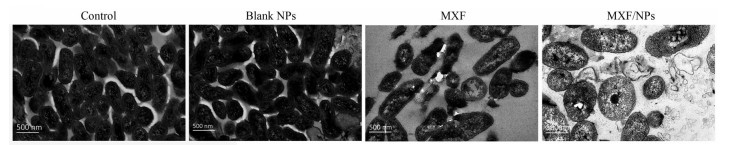
|
Figure 5 The effect of different drug solution on the morphology of P727 bacteria. The P727 isolate cells were separately incubated with control, blank NPs, MXF, MXF/ NPs at 1/4 MIC of MXF (4 μg·mL-1) for 4 h, then were fixed with 2.5% glutaraldehyde overnight. Scale bar represents 500 nm |
从图 6中可以看出, 游离Cy5与P727细菌细胞几乎不发生结合, 而相对于游离Cy5, Cy5标记纳米粒与细菌细胞具有较强的结合作用, 间接验证了MIC的测定结果, 证明纳米药物可以靶向到细菌细胞表面, 从而持续释放药物, 发挥抗菌效果, 因此抗菌作用较游离药物更强。关于纳米药物与细菌细胞之间的靶向结合作用, 推测是由于纳米载体表面含有苯硼酸结构基团, 该基团与细菌表面存在较强的特异性相互作用, 而对正常细胞则几乎不产生影响。该基团可以与细菌细胞壁上的糖蛋白相结合[13], 形成硼酸酯复合物, 从而使纳米药物靶向到细菌表面, 有效地防止抗菌药物在非细菌感染部位进行非特异性释放, 这大大提高了抗菌药物的局部组织浓度。另外, 细菌感染部位活性氧(ROS)浓度较高[14], 当纳米药物靶向至细菌表面时, 在ROS催化下, 硼酸基被氧化断键[15], 纳米粒结构破坏, 从而释放出负载的抗菌药物, 杀死细菌。此外, 细菌细胞表面糖基与纳米药物苯硼酸基团形成的硼酸酯复合物也可以通过硼酯键交换使纳米粒结构破坏释放药物, 发挥抗菌效果, 其具体机制仍需进一步的探索与验证。

|
Figure 6 The interaction capability of P727 bacteria with Cy5 solution and Cy5 labeled nanoparticles. In the control group, only the phosphate buffer saline (PBS) solution was added. Green is SYTO 9 labeled P727, and red is Cy5 and Cy5 labeled nanoparticles. The red arrow shows the nanoparticles are targeted to the surface of the bacteria. Scale bar represents 20 μm |
粒径结果和TEM结果表明, 本研究中已成功制备了载MXF纳米药物, 该纳米药物呈类球状结构, 粒径大小均一, 能够在PBS中快速释放并发挥药效, 且对HBE细胞无毒性, 生物安全性良好。同时, 由于纳米药物可以靶向至铜绿假单胞菌细胞表面, 释放药物, 发挥药效, 显著抑制细菌生物膜的形成, 因此具有良好的抑菌活性。此外, 本研究内容主要是体外研究, 应建立相应的肺部细菌感染动物模型进行载药纳米药物的体内药效学评价, 对实现临床细菌感染特别是肺部感染的控制和治疗、开发和研究抗生素新型给药制剂, 尤其是缓释、靶向等新型给药系统具有重大的临床意义。但目前应用于临床的抗菌药物纳米制剂还很少, 因此, 加大抗菌药物新型给药系统如脂质体和纳米粒等的开发研究, 制备低毒、高效、长效和缓释的新型抗菌药物制剂将为细菌感染的临床抗生素治疗带来新方向。
作者贡献: 王瑜负责载药纳米药物的制备与表征, 王前梅主要进行HPLC药物浓度分析, 冯伟、袁慊参与了部分体外抗菌实验, 姚璞参与了数据分析及文献整理, 夏培元对文章研究思路进行了指导, 孙凤军是文章整体研究方案的构思者与负责人。
利益冲突: 所有作者均不存在利益冲突。
| [1] |
Zhao K, Li W, Li J, et al. TesG is a type Ⅰ secretion effector of Pseudomonas aeruginosa that suppresses the host immune response during chronic infection[J]. Nat Microbiol, 2019, 4: 459-469. DOI:10.1038/s41564-018-0322-4 |
| [2] |
Carevic M, Öz H, Fuchs K, et al. CXCR1 regulates pulmonary anti-pseudomonas host defense[J]. J Innate Immun, 2016, 8: 362-373. DOI:10.1159/000444125 |
| [3] |
Merchant Z, Buckton G, Taylor KM, et al. A new era of pulmonary delivery of nano-antimicrobial therapeutics to treat chronic pulmonary infections[J]. Curr Pharm Des, 2016, 22: 2577-2598. DOI:10.2174/1381612822666160317142139 |
| [4] |
Brown ED, Wright GD. Antibacterial drug discovery in the resistance era[J]. Nature, 2016, 529: 336-343. DOI:10.1038/nature17042 |
| [5] |
Harms A, Maisonneuve E, Gerdes K. Mechanisms of bacterial persistence during stress and antibiotic exposure[J]. Science, 2016, 354: aaf4268. DOI:10.1126/science.aaf4268 |
| [6] |
Soto S, López-Rosés L, Avila S, et al. Moxifloxacin-induced acute liver injury[J]. Am J Gastroenterol, 2002, 97: 1853-1854. |
| [7] |
Chen XN, Shen YN, Li PY, et al. Bacterial biofilms:characteristics and combat strategies[J]. Acta Pharm Sin (药学学报), 2018, 53: 2040-2049. |
| [8] |
Hadinoto K, Cheow WS. Nano-antibiotics in chronic lung infection therapy against Pseudomonas aeruginosa[J]. Colloids Surf B Biointerfaces, 2014, 116: 772-785. DOI:10.1016/j.colsurfb.2014.02.032 |
| [9] |
Sun XR, Zang LC, Shi QW, et al. Advance in research on cell-derived nanomedicine delivery system[J]. Acta Pharm Sin (药学学报), 2017, 52: 1110-1116. |
| [10] |
Dou MJ, Wang JP, Huang GH. Application of microparticle drug delivery system in preparation of antibacterial drug dosage forms[J]. Shandong Med J (山东医药), 2012, 52: 96-99. |
| [11] |
Zhang H. Targeted antibiotic delivery with liposomes and nanoparticles[J]. Foreign Med Sci Sec Pharm (国外医学•药学分册), 2000, 06: 357-359. |
| [12] |
Zhou WK, Hou XC, Li GL. Application of new drug delivery system to prevent and treat infections caused by biofilms[J]. Chin Med Biotechnol (中国医药生物技术), 2016, 11: 532-538. |
| [13] |
Chen Y, Tong J, Dong J, et al. A temperature-responsive boronate core cross-linked star (CCS) polymer for fast and highly efficient enrichment of glycoproteins[J]. Small, 2019, 15: e1900099. DOI:10.1002/smll.201900099 |
| [14] |
Van Acker H, Coenye T. The role of reactive oxygen species in antibiotic-mediated killing of bacteria[J]. Trends Microbiol, 2017, 25: 456-466. DOI:10.1016/j.tim.2016.12.008 |
| [15] |
Zhang QX, Zhang FZ, Chen Y, et al. Structure-property correlations of reactive oxygen species-responsive and hydrogen peroxide-eliminating materials with anti-oxidant and anti-inflammatory activities[J]. Chem Mater, 2017, 29: 8221-8238. DOI:10.1021/acs.chemmater.7b02412 |
 2020, Vol. 55
2020, Vol. 55


