PD-1/PD-L1 (programmed death-1/programmed death-ligand 1)信号通路抑制剂是目前肿瘤免疫治疗领域研究的热点, 在多种恶性肿瘤的治疗过程中取得了显著的临床效果。PD-1全称程序性死亡受体-1, 其基因名为CD279, 由PDCD1基因编码, 属于CD28超家族成员。常表达在活化T细胞表面, 是重要的免疫检查点。PD-L1全称程序性死亡受体-配体1, 基因名为B7-H1/CD274, 是PD-1蛋白配体, 属于Ⅰ型跨膜蛋白。目前已有多个PD-1/PD-L1抗体药物经美国FDA与中国药监局批准上市。然而抗体药物价格昂贵, 且半衰期较长, 在临床应用中出现了多种免疫相关的不良反应[1]。由于小分子抑制剂具有生物利用度高, 修饰技术较为成熟以及免疫不良反应低等优势, 针对PD-1/PD-L1免疫信号通路的小分子抑制剂的研究开发受到了广泛关注, 现有研究表明一些小分子肽和肽类衍生物、磺胺类及联芳类小分子等表现出对于PD-1/PD-L1信号通路较好的抑制活性[2, 3]。但目前尚无PD-1/PD-L1信号通路小分子抑制剂成药上市, 而通过化学合成的研究方式筛选此类小分子存在效率低、结构类型有限等限制。天然产物中含有丰富的结构新颖、作用独特的小分子, 为寻找有效PD-1/PD-L1信号通路小分子抑制剂提供了巨大化合物宝库。但目前关于从天然产物中筛选该类抑制剂的研究尚处于起步阶段, 且无完善高效的筛选方法。五加科植物人参Panax ginseng C.A.Mey.的干燥根和根茎为我国历史悠久的传统名贵中药材, 到目前已有两千多年的药用历史, 近年来其在免疫调节与抗肿瘤中体现的效用正被研究者越来越多的关注[4, 5]。在目前的研究报道中, 人参抗肿瘤活性的作用机制主要为肿瘤细胞增殖抑制、肿瘤细胞诱导凋亡、肿瘤细胞诱导分化、周围免疫增强、炎症反应抑制等方式, 主要作用通路包括JAK1/STAT3通路、PI3K/Akt通路、COX-2通路、β-catenin通路等[6-8]。而人参通过PD-1/PD-L1信号通路发挥的抗肿瘤作用未见报道。为此, 本研究以中药材人参为研究对象, 通过液质联用的方法从中鉴定了9个皂苷类成分, 并使用表面等离子共振(SPR)技术从中筛选出了3个具有PD-1结合活性的人参皂苷类化合物。同时以其中的代表性化合物人参皂苷Rg1进行了细胞药理学验证, 为PD-1/PD-L1信号通路小分子抑制剂的研究开发提供了全新思路。
材料与方法表达菌株 hPD-1蛋白: E. coli BL21 (DE3), 含有pET-28a-exhPD-1质粒; hPD-L1蛋白: E. coli BL21(DE3), 含有pET-30a (+)-hPD-L1质粒。
细胞株 A549 cell line与Jurkat Tcell line均购自American Tissue Culture Collection (ATCC, Rockville, MD, USA)。
仪器 岛津HPLC-IT-TOF-MS液质联用系统(CBM-20A系统控制器、LC-20ADXR高压泵、LC-20AD高压泵、DGU-20A5自动脱气机、SIL-20ACXR自动进样器、CTO-20AC柱温箱、SPD-M20A光电二极管阵列检测器、SPD-20A紫外检测器、IT-TOF-MS质谱仪、LCMS Solution工作站); Biacore 8k表面等离子共振仪(GE Healthcare); AUW120D分析天平(日本岛津公司SHIMAZU); Milli-Q®超纯水系统(Millipore); Zeiss LSM激光共聚焦显微镜(德国蔡司公司); Berthold LB941微孔板式多功能酶标仪(Berthold公司); FACSCanto Ⅱ流式细胞仪(BD公司)。
材料 蛋白纯化预装柱(天演生物); Series S CM5芯片, PBS 1×, 偶联缓冲液, 氨基偶联试剂盒, 再生试剂(50 mmol·L-1 NaOH), 以上均购自GE Healthcare; hPD-1蛋白、hPD-L1蛋白(实验室纯化); 人参皂苷Rg1、人参皂苷Rb1与人参皂苷Re均购自成都格莱特生物科技有限公司; 纳武利尤单抗(欧狄沃(Opdivo))购自Bristol-Myers Squibb Company; 人参药材购自北京同仁堂; 乙腈(质谱级)购自Duksan Pure Chemical Co., Ltd; 其余试剂均为从商业公司购得的分析纯试剂。
人参中化学成分的分离与鉴定 取人参样品粉末1.0 g, 精密称定, 用10 mL甲醇提取两次, 合并提取液, 蒸干; 残渣用10 mL去离子水溶解后使用10 mL乙醚萃取, 弃去乙醚部分, 取水部分使用10 mL水饱和正丁醇萃取, 收集正丁醇部分, 反复3次; 将所收集正丁醇部分蒸干, 取适量甲醇溶解, 转移至10 mL容量瓶中, 用甲醇定容, 摇匀, 滤过, 取续滤液即得。
经过对实验条件的探索, 最终确定本实验采用的HPLC条件为: HPLC梯度洗脱程序见表 1, 柱温30 ℃, 流速1 mL·min-1, 检测波长203 nm。
| Table 1 Gradient condition of HPLC analysis of Panax Ginseng |
人参中化学成分与PD-1结合活性的SPR筛选 为进行人参中化学成分与PD-1结合活性的SPR筛选, 本研究通过液相制备与冻干方法取得了9种皂苷类成分的单一固体, 并采用SPR技术考察其与PD-1蛋白相互作用[9]。本研究使用的是运用较为广泛的CM5传感芯片, 采用的固定方式为氨基偶联。
在PD-1与小分子的分子相互作用实验中, PD-1被固定于CM5芯片表面, PD-1的最终偶联量为16 000 RU。最终分析物浓度梯度为200 μmol·L-1等倍稀释至0.78 μmol·L-1。
在小分子竞争抑制PD-1/PD-L1的分子相互作用实验中, PD-L1被固定于CM5芯片表面, PD-L1的最终偶联量为3 000 RU, PD-1蛋白浓度10.38 nmol·L-1, 分析物浓度从250 μmol·L-1等倍稀释至0.488 μmol·L-1。
人参皂苷Rg1对PD-1/PD-L1抑制活性的细胞学验证 为进一步考察人参皂苷Rg1在细胞学层面上是否能够通过阻断PD-1/PD-L1结合而抑制肿瘤细胞对T细胞的屏蔽从而提高T细胞对肿瘤细胞杀伤力, 本研究进行了细胞学验证。首先进行免疫荧光实验, 设立空白对照组、阳性对照组与实验组考察人参皂苷Rg1分别在3、6、9 μmol·L-1浓度下对于PD-1/PD-L1结合的阻断作用。
进而考察人参皂苷Rg1对于是否能够促进T细胞对于肿瘤细胞的杀伤, 本实验设计以不同浓度的人参皂苷Rg1加入人PBMCs细胞与肺癌A549细胞的共培养培养基中, 观察肺癌A549细胞的凋亡率是否随人参皂苷Rg1浓度变化而变化。首先通过CCK8实验确定人参皂苷Rg1在12.5、25、50与100 μmol·L-1浓度下对A549细胞的细胞毒性, 再通过细胞凋亡检测考察人参皂苷Rg1分别在3、6、9 μmol·L-1浓度下对PBMCs细胞杀伤肺癌A549细胞的影响。细胞实验中所用阳性对照药为欧狄沃(Opdivo)。
结果与讨论 1 人参中化学成分分离与鉴定结果通过对照品比对与液质联用的方法, 得到了人参药材的液相色谱图(图 1)与负离子模式下的质谱总离子流图(图 2), 并从人参指纹图谱中指认了9个化合物[10-12] (表 2), 其结构见图 3, 其中乙酰人参皂苷Rg1因质谱结果无法确定其乙酰基位置, 因此未给出其具体结构。
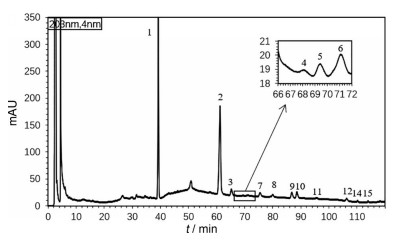
|
Figure 1 HPLC chromatograph of Panax ginseng |

|
Figure 2 Total ion chromatograph (TIC) of Panax ginseng |
| Table 2 Identification of 9 compounds in Panax ginseng under negative ion mode of LC-MSn. tR: Retention time; Glc: Glucose; Rha: Rhamnose; Ara: Arabinose. *Compounds confirmed by comparison with reference standards |
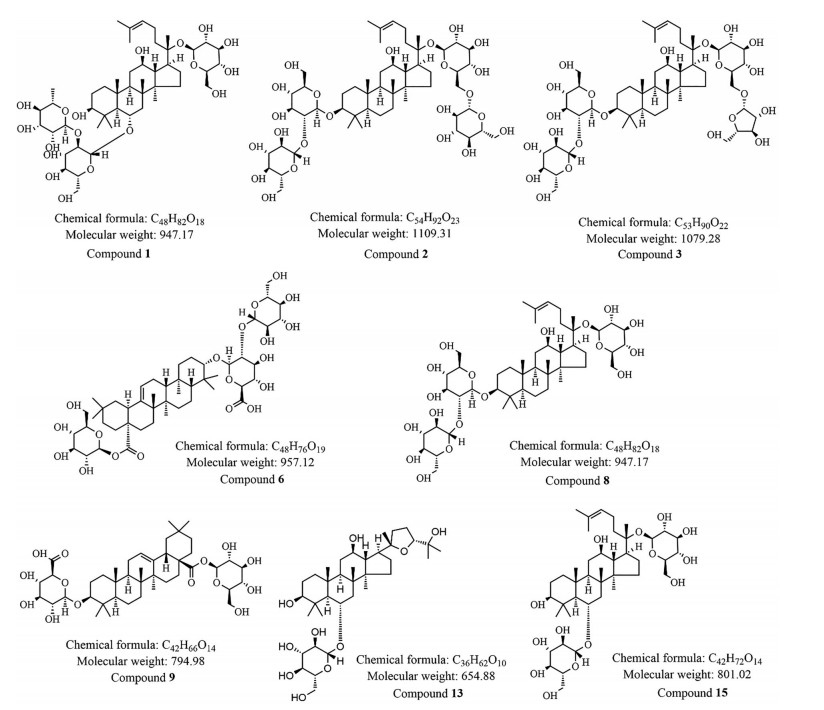
|
Figure 3 Compound structures of identified components in Panax ginseng (acetyl-Rg1 or isomer excluded) |
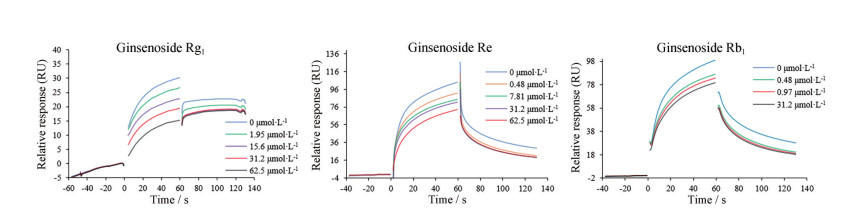
SPR实验结果如图 4所示。用Biacore 8k Evaluation Software分析软件对图 4中的PD-1/PD-L1数据进行动力学模型拟合, 得到PD-1蛋白与PD-L1蛋白相互作用KD (mol·L-1)值为5.98×10-8, 该数值接近文献报道[13], 表明所纯化的PD-1与PD-L1保留了较强的生物活性。同时使用亲和力模型对小分子与PD-1数据进行拟合, 人参皂苷Rg1、人参皂苷Rb1与人参皂苷Re表现出了较强的结合活性, 结果如表 3所示。其他化合物则未表现出具有浓度依赖的PD-1结合活性。

|
Figure 4 SPR signals of PD-1/PD-L1, ginsenoside Rg1/PD-1, ginsenoside Rb1/PD-1 and ginsenoside Re/PD-1 interaction |
| Table 3 SPR results of active compounds interacting with PD-1 |
进一步的小分子与PD-1/PD-L1的竞争抑制SPR实验结果如图 5所示。竞争抑制实验中的最大抑制率如表 4所示, 结果显示, 人参皂苷Rg1抑制PD-1/PD-L1结合的信号值呈现明显剂量依赖性(dose-dependent manner)地低于空白对照, 随着小分子浓度的增加, 信号值不断降低, 最大抑制率达到52.56%。可以认为人参皂苷Rg1能够特异性地抑制PD-1与PD-L1的蛋白相互作用。人参皂苷Rb1与人参皂苷Re表现出了剂量依赖性地低于空白对照, 但最大抑制率不足50%, 抑制效率低于人参皂苷Rg1。
|
Figure 5 SPR signal of competition experiment of ginsenoside Rg1, ginsenoside Rb1 and ginsenoside Re between PD-1/PD-L1 |
| Table 4 SPR results of ginsenoside Rg1, ginsenoside Rb1 and ginsenoside Re in PD-1/PD-L1 competition experiment |
免疫荧光实验结果及统计结果如图 6所示。结果显示, 人参皂苷Rg1在9 μmol·L-1的浓度下, 能够显著表现出对PD-1与PD-L1结合的阻断作用(P < 0.01)。对比阳性药纳武利尤单抗, 其在9 μmol·L-1浓度下的有效抑制率可达阳性对照的76%, 认为人参皂苷Rg1能够在细胞层面上有效地阻断PD-1与PD-L1的结合。

|
Figure 6 Effects of ginsenoside Rg1 on the interaction of PD-L1 and PD-1 Fc in Jurkat T cells. After Jurkat T cells were incubated in the presence of ginsenoside Rg1 (3, 6, 9 μmol·L-1) or opdivo (3, 6, 9 μmol·L-1) for 24 h, microscopy image showing the association of PD-L1 on Jurkat T cells membrane with PD-1/Fc protein. Green fluorescence (Alexa Fluor® 488-labeled PD-1/Fc protein) indicates the conjugated PD-1 Fc, nucleus was stained by DAPI (blue fluorescence). Results were mean ± SD for three individual experiments which, for each condition, were performed in triplicate. **P < 0.01 vs Control |
人参皂苷Rg1对肺癌A549细胞的细胞毒性CCK8实验结果如图 7所示。结果显示, 当人参皂苷Rg1浓度超过50 μmol·L-1时, 才会对A549细胞产生显著的细胞毒效应。因此, 可以排除后续实验中人参皂苷Rg1对A549细胞的细胞毒性干扰。

|
Figure 7 Effects of ginsenoside Rg1 on the cell viability of A549 cells. After A549 cells were incubated in the presence of ginsenoside Rg1 (12.5, 25, 50, 100 μmol·L-1) for 24 h, the cell viability of A549 cells was detected by CCK8 assay, the statistical histogram of cell viability ratio of indicated groups was presented. Results were mean ± SD for three individual experiments which, for each condition, were performed in triplicate. **P < 0.01 vs Control |
最终考察人参皂苷Rg1影响人PBMCs细胞对肺癌A549细胞杀伤力的结果以A549细胞凋亡率作为判断标准, 流式图与统计结果如图 8所示。结果显示, 与空白对照组相比, 人参皂苷Rg1在6和9 μmol·L-1的浓度下能够表现出显著的促进PBMCs细胞对肺癌A549细胞杀伤力的作用, 同时对比阳性对照组, 其最大促进程度可达同浓度水平下纳武利尤单抗的62.6%。结合免疫荧光实验, 可以认为人参皂苷Rg1能够通过阻断PD-L1与PD-1的结合从而解除肿瘤细胞通过高表达hPD-L1而产生的肿瘤逃逸效应, 最终促进人PBMCs细胞对肺癌A549细胞的杀伤力。
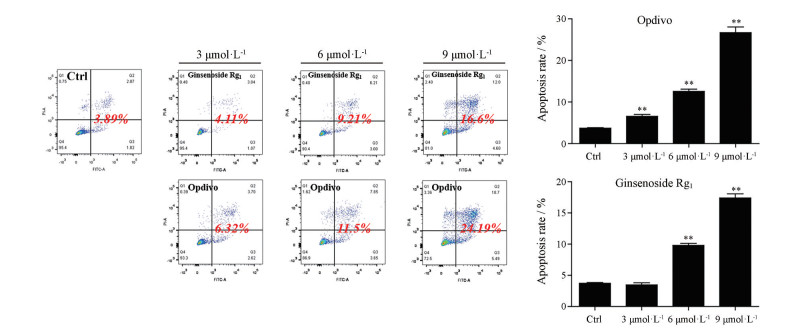
|
Figure 8 Effects of ginsenoside Rg1 on PBMCs cells triggered A549 cells apoptosis. A549 cells and PBMCs cells were co-cultured in the presence of ginsenoside Rg1 (3, 6, 9 μmol·L-1), or opdivo (3, 6, 9 μmol·L-1) for 24 h, followed by apoptosis analysis of A549 cells with flow cytometry. Results were mean ± SD for three individual experiments which, for each condition, were performed in triplicate. **P < 0.01 vs Control |
本研究以人参为研究对象, 通过对照品比对与液质联用分析的方法, 鉴定出了人参中的9个皂苷类成分, 并使用SPR技术对9个化合物进行了PD-1结合活性筛选, 从中筛选出了3个具有PD-1结合活性的化合物, 分别为人参皂苷Rg1、人参皂苷Rb1与人参皂苷Re。依据其结构特点及PD-1结合活性推断人参皂苷中糖基数量可能与结合活性具有相关性, 糖基数量越少, 结合能力越强, 可能的原因是更少的糖基减少了与活性口袋结合时的空间位阻。同时选取其中代表性皂苷类化合物人参皂苷Rg1进行了细胞药理学验证实验。实验表明, 人参皂苷Rg1能够与PD-1蛋白发生有效结合, 并能够通过阻断PD-L1与PD-1的结合从而解除肿瘤细胞通过高表达PD-L1蛋白而产生的肿瘤逃逸效应, 最终促进人PBMCs细胞对肺癌A549细胞的杀伤力, 证实了该筛选方法的有效性。本研究为天然产物中免疫信号通路抑制剂的研究提供了全新思路, 并为PD-1小分子抑制剂的开发提供了参考。
作者贡献: 王岱东为本文第一作者, 负责实验设计、PD-L1表达菌株构建、PD-1/PD-L1蛋白提取纯化、人参药材提取与指纹图谱建立、SPR实验设计与完成、细胞实验; 屠鹏飞教授为本文第二作者, 负责课题支持; 黄亚卓为本文第三作者, 负责SPR实验材料准备; 王弯弯为本文第四作者, 负责质谱解析; 王静为本文第五作者, 负责SPR技术支持; 韩雅为本文第六作者, 负责PD-1表达菌株构建; 王弘、陈世忠教授为本文通讯作者, 负责实验设计指导、论文写作指导与把关。
利益冲突: 本文的研究内容无任何利益冲突。
| [1] |
Kumar V, Chandra AB, Chaudhary N, et al. Current diagnosis and management of immune related adverse events (irAEs) induced by immune checkpoint inhibitor therapy[J]. Front Pharm, 2017, 8: 1-14. |
| [2] |
Liu X, Liu X, Li JJ, et al. Advance in small-molecule inhibitors of programmed cell death-1/programmed cell death-ligand 1 signaling pathway[J]. Prog Pharm Sci (药学进展), 2017, 41: 541-548. |
| [3] |
Zhan MM, Hu XQ, Liu XX, et al. From monoclonal antibodies to small molecules:the development of inhibitors targeting the PD-1/PD-L1 pathway[J]. Drug Discov Today, 2016, 21: 1027-1036. DOI:10.1016/j.drudis.2016.04.011 |
| [4] |
Attele AS, Wu JA, Yuan CS. Ginseng pharmacology:multiple constituents and multiple actions[J]. Biochem Pharmacol, 1999, 58: 1685-1693. DOI:10.1016/S0006-2952(99)00212-9 |
| [5] |
Mohanan P, Subramaniyam S, Mathiyalagan R, et al. Molecular signaling of ginsenosides Rb1, Rg1, and Rg3 and their mode of actions[J]. J Ginseng Res, 2018, 42: 123-132. DOI:10.1016/j.jgr.2017.01.008 |
| [6] |
Bi XL, Xia XC, Mou T, et al. Anti-tumor activity of three ginsenoside derivatives in lung cancer is associated with Wnt/beta-catenin signaling inhibition[J]. Eur J Pharmacol, 2014, 742: 145-152. DOI:10.1016/j.ejphar.2014.08.032 |
| [7] |
Surth YJ, Na HK, Lee JY, et al. Molecular mechanisms underlying anti-tumor promoting activities of heat-processed Panax ginseng C.A. Meyer[J]. J Korean Med Sci, 2001, 16: S38-41. DOI:10.3346/jkms.2001.16.S.S38 |
| [8] |
Luo LM, Shi YN, Jiang YN, et al. Advance in components with antitumor effect of Panax ginseng and their mechanisms[J]. Chin Tradit Herb Drugs (中草药), 2017, 48: 582-596. |
| [9] |
Han Y, Gao YN, He T, et al. PD-1/PD-L1 inhibitor screening of caffeoylquinic acid compounds using surface plasmon resonance spectroscopy[J]. Anal Biochem, 2018, 547: 52-56. DOI:10.1016/j.ab.2018.02.003 |
| [10] |
Wang HP, Zhang YB, Yang XW, et al. Rapid characterization of ginsenosides in the roots and rhizomes of Panax ginseng by UPLC-DAD-QTOF-MS/MS and simultaneous determination of 19 ginsenosides by HPLC-ESI-MS[J]. J Ginseng Res, 2016, 40: 382-394. DOI:10.1016/j.jgr.2015.12.001 |
| [11] |
Huang X, Liu Y, Zhang Y, et al. Multicomponent assessment and ginsenoside conversions of Panax quinquefolium L. roots before and after steaming by HPLC-MSn[J]. J Ginseng Res, 2019, 43: 27-37. DOI:10.1016/j.jgr.2017.08.001 |
| [12] |
Tian T, Li G, Wang L, et al. Rapid characterization of ginseno-sides in Kang-ai injection based on UHPLC-LTQ-Orbitrap mass spectrometer[J]. Chin Hosp Pharm J (中国医院药学杂志), 2019, 39: 156-160. |
| [13] |
Zak KM, Grudnik P, Magiera K, et al. Structural biology of the immune checkpoint receptor PD-1 and its ligands PD-L1/PD-L2[J]. Structure, 2017, 25: 1163-1174. DOI:10.1016/j.str.2017.06.011 |
 2020, Vol. 55
2020, Vol. 55


