2. 呼吸疾病诊疗与新药研发河南省协同创新中心, 河南 郑州 450046
2. Respiratory Disease Diagnosis and Treatment and New Drug Development Henan Collaborative Innovation Center, Zhengzhou 450046, China
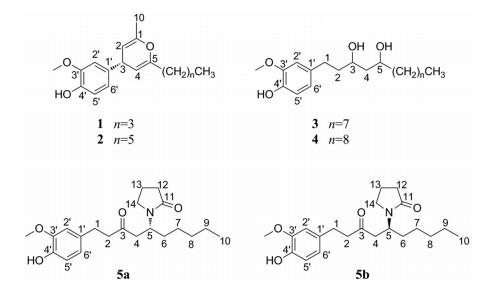
干姜为姜科姜属植物姜(Zingiber offinicinale Rosc.)的干燥根茎[1], 是一种用途广泛的药食两用的中药材[2, 3]。主要产区为热带亚洲地区, 中国境内的姜科植物主要分布在西南部至东南部各省区, 其中云南省种类最多[4]。味辛、性热, 归脾、胃、肾、心、肺经, 具有温中散寒、回阳通脉等功效[5-7]。干姜中主要含有挥发油类、姜辣素类及二苯基庚烷类化学成分。现代药理学研究表明, 干姜中姜辣素具有镇痛抗炎、抗肿瘤、抗溃疡、抗缺氧、改善局部血液循环、止呕等多种药理作用[8-14]。为明确干姜中姜辣素成分, 需对干姜中辣味成分进行系统研究。本实验采用Diaion HP-20、Sephadex LH-20、硅胶、半制备高效液相等多种色谱分离技术从干姜乙酸乙酯提取物中分离得到5个姜辣素成分, 分别是: 4-(2-丁基-6-甲基-4H-吡喃-4-基)-2-甲氧基苯酚(1)、4-(2-己基-6-甲基-4H-吡喃-4-基)-2-甲氧基苯酚(2)、1-(4-羟基-3-甲氧基苯基)十三烷-3, 5-二醇(3)、[10]-gingerdiol (4)和1-[1-(4-羟基-3-甲氧基苯基)-3-氧代-5-基]吡咯烷-2-酮(5), 化合物1~3、5a、5b均为新化合物。结构见图 1。
|
Figure 1 Structures of compounds 1-5 |
化合物1 黄色油状液体, 易溶于甲醇及氯仿, UV (MeOH) λmax (logε): 202 nm (1.09)、224 nm (0.49)、281 nm (0.09);
| Table 1 1H NMR and 13C NMR (500/125 MHz in CD3OD) spectral data of compounds 1 and 2 |
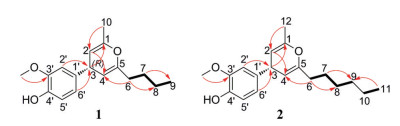
|
Figure 2 1H-1H COSY (  |
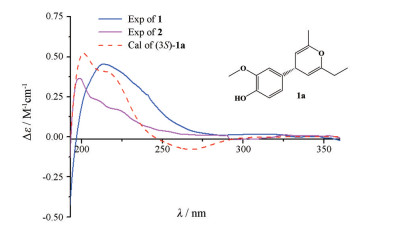
|
Figure 3 Comparison of B3LYP/6-31g (d, p) calculated ECD spectrum for (3S)-1a with the experimental spectra of 1 and 2 in MeOH. σ = 0.33 eV; shift = +3 nm |
化合物2 黄色油状液体, 易溶于甲醇及氯仿, UV (MeOH) λmax (logε): 203 nm (1.63)、224 nm (0.80)、281 nm (0.15); IR谱显示该化合物结构中含有羟基(3 417 cm-1)和双键及苯环(1 652、1 517 cm-1);
化合物3 无色油状物, 易溶于甲醇、氯仿及乙酸乙酯, UV (MeOH) λmax (logε): 203 nm (1.55)、281 nm (0.15);
| Table 2 1H NMR and 13C NMR (500/125 MHz in CDCl3) spectral data of compound 3 |
化合物5 无色油状物, 易溶于甲醇, IR谱显示该化合物结构中含有羟基(3 337 cm-1)和羰基(1 673 cm-1);
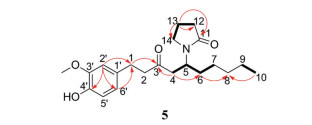
|
Figure 4 1H-1H COSY (  |
|
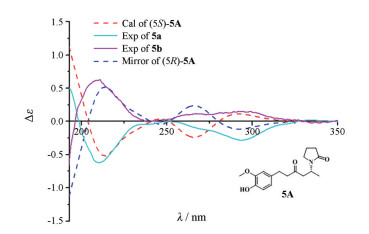
Figure 5 Comparison of B3LYP/6-31g(d, p) calculated ECD spectrum for (5S)-5A with the experimental spectra of 5 in MeOH. σ = 0.25 eV; shift = +3 nm |
| Table 3 1H NMR and 13C NMR (500/125 MHz in CD3OD) spectral data of compound 5 |
TripleTOF 6600型高效液相色谱-四极杆飞行时间高分辨质谱联用仪(AB SCIEX); LC3000型半制备高效相色谱仪(赛普锐思公司); Bruker AM-500MHz核磁共振谱用超导核磁共振仪, TMS做内标; Thermo Nicolet IS10红外光谱仪(Thermo Scientific, USA); Rudolph AP-Ⅳ型旋光仪(Rudolph, USA); Thermo EVO300紫外分光光度计(Thermo Scientific, USA); 1260 1nfinity Ⅱ高效液相色谱仪; RE-5210A型旋转蒸发仪(上海亚荣生化仪器厂); N-1100型旋转蒸发仪(东京理化仪器有限公司); Sephadex LH-20 (Parmacia Biotech公司); SMB100-20/45型反相柱色谱材料RP-1 (日本富士公司); 硅胶正相色谱填料(青岛海洋化工厂); Kromasil 100-5 C18 column型分析色谱柱; CHIRALCEL IC及AD-H手性柱; 色谱纯及分析纯试剂(天津四友精细化学品有限公司)。
干姜购自安徽亳州, 产地为四川省宜宾市, 经河南中医药大学董诚明教授鉴定为姜科草本植物姜Z. offccinale Rosc.的干燥根茎。保存于河南中医药大学中药化学提取分离实验室, 标本号: BS631005。
1 提取分离取干姜50 kg, 粉碎成粗粉后用乙酸乙酯(200 L)浸泡1 h, 之后回流提取(75 ℃, 3×200 L×1.5 h), 45 ℃水浴减压浓缩得总提物稠膏4 kg。总提物用60%的乙醇溶解后, 经Diaion HP-20大孔吸附树脂色谱柱, 依次用60%乙醇、80%乙醇、95%乙醇梯度洗脱, 收集后减压浓缩得到相应的部位(Fr.1~Fr.3)。然后将组分Fr.1 (1.5 kg)上硅胶柱(100~200目), 流动相采用二氯甲烷/甲醇梯度洗脱, 分为7段(Fr.1.1~Fr.1.7)。组分Fr.1.1 (500 g)再次过硅胶柱(200~300目), 流动相采用石油醚/丙酮梯度洗脱, 划分为9小段(Fr.1.1.1~Fr.1.1.9)。将组分Fr.1.1.6 (198 g)再过硅胶柱(100~200目), 流动相采用石油醚/乙酸乙酯梯度洗脱, 得到7个组分(Fr.1.1.6.1~Fr.1.1.6.7)。随后以甲醇为洗脱剂, 组分Fr.1.1.6.3 (19 g)经过Sephadex LH-20柱色谱, 得到5个组分(Ⅰ~Ⅴ)。组分Ⅲ通过半制备型HPLC (210 nm, 254 nm)在YMC HPLC柱(双波长紫外检测器203 nm、254 nm, 250 mm×10 mm, 5 μm, 流速3 mL·min-1)进行纯化得到化合物2 (16.1 mg, 82%甲醇水溶液, tR = 34.651 min)和化合物5 (5.0 mg, MeOH/H2O, 79%, tR = 28.665 min); 组分Ⅳ通过半制备型HPLC在YMC HPLC柱(流速3 mL·min-1)进行纯化得到化合物1 (40.5 mg, MeOH/H2O, 65%, tR = 23.109 min); 组分Fr.1.1.6.6 (25 g)经过Sephadex LH-20柱色谱, 得到5个组分(a~e)。组分a通过半制备型HPLC在YMC HPLC柱(流速3 mL·min-1)进行纯化得到化合物4 (16.6 mg, 65%甲醇水溶液, tR = 20.031 min); 组分b通过半制备型HPLC在YMC HPLC柱(流速3 mL·min-1)进行纯化得到化合物3 (4.1 mg, 58%甲醇水溶液, tR = 25.643 min)。
2 数据归属化合物1 黄色油状液体, 易溶于甲醇及氯仿, 遇FeCl3显色剂显蓝色,
化合物2 黄色油状液体, 易溶于甲醇及氯仿, 遇FeCl3显色剂显蓝色,
化合物3 无色油状物, 易溶于甲醇、氯仿及乙酸乙酯, 遇FeCl3显色剂显蓝色,
化合物4 无色油状物, 易溶于甲醇、氯仿及乙酸乙酯, 遇FeCl3显色剂显蓝色。HR-ESI-MS [M+Na]+ m/z 375.245 0 (Calcd. 375.350 6), 分子式为C21H36O4。1H NMR (500 MHz, CDCl3) δH 6.84 (1H, d, J = 8.2 Hz, H-5′), 6.73 (1H, s, H-2′), 6.71 (1H, d, J = 8.2 Hz, H-6′), 3.99 (2H, overlap, H-3, H-5), 3.89 (3H, s, -OCH3), 2.73、2.64 (2H, m, H-1), 1.85、1.76 (2H, m, H-2), 1.66 (2H, overlap, H-4), 1.54、1.44 (2H, overlap, H-6), 1.24 (14H, overlap, H-6, H-7, H-8, H-9, H-10, H-11, H-12, H-13), 0.85 (3H, t, J = 6.7 Hz, H-14)。13C NMR (125 MHz, CDCl3) δC 146.4 (C-3′), 143.7 (C-4′), 133.9 (C-1′), 120.9 (C-6′), 114.3 (C-5′), 111.0 (C-2′), 69.7 (C-5), 69.0 (C-3), 55.9 (-OCH3), 42.3 (C-4), 39.4 (C-2), 37.5 (C-6), 32.0 (C-12), 31.9 (C-1), 29.6 (C-8), 29.6 (C-9), 29.6 (C-10), 29.3 (C-11), 25.8 (C-7), 22.7 (C-13), 14.1 (C-14)。以上数据与文献[15]对照基本一致, 同为姜辣素类化合物, 故确定化合物4为[10]-gingerdiol (4)。
化合物5a 无色油状物, 易溶于甲醇, 遇FeCl3显色剂显蓝色,
化合物5b 无色油状物, 易溶于甲醇, 遇FeCl3显色剂显蓝色,
作者贡献: 王彦志、张晓娟、冯卫生设计研究; 张晓娟、李曼倩、宋志敏、郭燕和胡雪雨进行了研究并分析了数据; 王彦志给出了关于论文写作的建议, 张晓娟写了论文。所有作者都阅读并批准了最后的手稿。
利益冲突: 作者声明不存在利益冲突。
| [1] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Beijing: China Medical Science Press, 2015: 13.
|
| [2] |
Li BZ, Li F, Piao YG, et al. Extraction of chemical constituents from Rhizoma Zingiberis and its application in cigarette[J]. Guangzhou Chem Ind (广州化工), 2019, 47: 95-97. |
| [3] |
Qi X, Zhang YY. Progress in chemical and pharmacological research of ginger[J]. Shandong Chem Ind (山东化工), 2018, 47: 41-42. |
| [4] |
Sun FJ, Li ZL, Qian SH, et al. Chemical constituents of rhizomes of dried Zingiber officinale[J]. Chin Wild Plant Resour (中国野生植物资源), 2016, 35: 20-24. |
| [5] |
Fang WT, Zhan ZL, Peng HS. Historical evolution and change of differentiation on dried ginger, fresh ginger and baked ginger[J]. China J Chin Mater Med (中国中药杂志), 2017, 42: 1641-1645. |
| [6] |
Cui WH, Wang YZ, Li ZZ. Chemical constituents from Rhizoma Zingiberis[J]. Chin Pharm J (中国药学杂志), 2018, 53: 1160-1164. |
| [7] |
Wang WX. Analysis of the characteristics of chemical constituents pharmacological action and clinical application of ginger[J]. Clin J Chin Med (中医临床研究), 2016, 8: 146-148. |
| [8] |
Jung HW, Yoon CH, Park KM, et al. Hexane fraction of Zingiberis Rhizoma Crudus extract inhibits the production of nitric oxide and proinflammatory cytokines in LPS-stimulated BV2 microglial cells via the NF-kappaB pathway[J]. Food Chem Toxicol, 2009, 47: 1190-1197. DOI:10.1016/j.fct.2009.02.012 |
| [9] |
Yoshikawa M, Hatakeyama S, Chatani N, et al. Qualitative and quantitative analysis of bioactive principles in Zingiberis Rhizoma by means of high performance liquid chromatography and gas liquid chromatography[J]. J Pharm Soc Jpn, 1993, 113: 307-315. DOI:10.1248/yakushi1947.113.4_307 |
| [10] |
Mo SJ, Son EW, Lee SR, et al. CML-1 inhibits TNF-alpha-induced NF-kappaB activation and adhesion molecule expression in endothelial cells through inhibition of IkBalpha kinase[J]. J Ethnopharmacol, 2007, 109: 78-86. DOI:10.1016/j.jep.2006.07.006 |
| [11] |
Saha A, Blando J, Silver E, et al. 6-Shogaol from dried ginger inhibits growth of prostate cancer cells both in vitro and in vivo through inhibition of STAT3 and NF-κB signaling[J]. Cancer Prev Res (Phila), 2014, 7: 627-638. DOI:10.1158/1940-6207.CAPR-13-0420 |
| [12] |
Li Y, Hong Y, Han Y, et al. Chemical characterization and antioxidant activities comparison in fresh, dried, stir-frying and carbonized ginger[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2016, 1011: 223-232. DOI:10.1016/j.jchromb.2016.01.009 |
| [13] |
Semwal RB, Semwal DK, Combrinck S, et al. Gingerols and shogaols:important nutraceutical principles from ginger[J]. Phytochemistry, 2015, 117: 554-568. DOI:10.1016/j.phytochem.2015.07.012 |
| [14] |
Vishwakarma SL, Pal SC, Kasture VS, et al. Anxiolytic and antiemetic activity of Zingiber officinale[J]. Phytother Res, 2002, 16: 621-626. DOI:10.1002/ptr.948 |
| [15] |
Chen H, Soroka DN, Haider J, et al. [10]-Gingerdiols as the major metabolites of [10]-gingerol in zebrafish embryos and in humans and their hematopoietic effects in zebrafish embryos[J]. J Agric Food Chem, 2013, 61: 5353-5360. DOI:10.1021/jf401501s |
 2020, Vol. 55
2020, Vol. 55


