2. 山西大学化学化工学院, 山西 太原 030006
2. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China
哮喘, 又称支气管哮喘, 是由嗜酸性粒细胞、肥大细胞、淋巴细胞、中性粒细胞等多种炎症细胞和细胞组分参与的慢性炎症疾病, 常导致气道高反应性以及气道重塑, 进而引发反复发作的喘息、气促、胸闷以及咳嗽等症状。哮喘的发病机制复杂, 主要受到环境因素和遗传因素的影响。目前的研究表明, 哮喘患者体内免疫失衡, 细胞因子白介素-4 (IL-4)和白介素-13 (IL-13)被过度激活。而IL-4和IL-13可以促进产生免疫球蛋白E (Ig-E), Ig-E进一步刺激炎症细胞增殖以及嗜酸性粒细胞的激活, 从而导致哮喘炎症加重[1]。
在现有的平喘药物中, 糖皮质激素是治疗轻中度哮喘的首选药。但是, 长期使用糖皮质激素会导致代谢紊乱、耐药性等不良反应。此外, β2受体激动剂虽有利于缓解或消除哮喘症状, 但它没有抑制气道炎症的作用, 长期使用也容易产生耐药性。中医药在治疗疾病方面具有独特的优势, 体现在不良反应小、成本低, 特别适用于哮喘等慢性疾病的治疗。现有研究表明, 很多中药活性成分都具有抗哮喘活性, 如甘草次酸[2]、芍药苷[3]、漆黄素[4]、姜黄素[5]、穿心莲内酯[6]等。
款冬花(Flos Farfarae)为菊科植物款冬Tussilago farfara L.的干燥花蕾, 具有润肺下气, 止咳化痰之功效。中医临床广泛用于咳嗽、哮喘等肺部疾病治疗。款冬花化学成分主要包括:苯丙素类、黄酮类、三萜类、倍半萜类和生物碱类化合物。本课题组前期研究发现款冬花石油醚部位具有较好的抗哮喘活性[1], 本课题组推测石油醚部位中的倍半萜类物质为款冬花发挥抗哮喘作用的活性成分。本研究拟采用色谱分离技术从款冬花石油醚提取物中进一步制备款冬花总倍半萜, 并通过卵清蛋白(OVA)诱导大鼠哮喘模型验证款冬花总倍半萜对哮喘的干预作用, 同时利用非靶标代谢组学技术对其作用机制进行分析。
材料与方法实验动物 雄性SPF级SD大鼠(6周龄, 体重200 ± 20 g), 由北京维通利华实验动物技术有限公司提供, 动物许可证号为SCXK (京) 2016-0005。动物自然昼夜节律光照, 适应1周后进行实验。
仪器与试剂 鱼跃402AI超声雾化器(江苏鱼跃医疗设备有限公司); 电子超声组织匀浆器(宁波心之生物科技股份有限公司), XW-80A旋涡混合器(上海精科实业有限公司); Thermo Scientific Q Extractive质谱仪(德国赛默飞世尔); 真空干燥箱(上海一恒科学仪器有限公司); IKA RV-10旋转蒸发器(德国艾卡); LD500-1电子天平(沈阳龙腾电子有限公司); 十万分之一天平(德国赛多利斯); ODS FLASH柱(20~35 μm, 20 g) (美国艾杰尔)。
OVA (上海生工生物); 磷酸盐缓冲液(PBS, 北京索莱宝); 吐温-20 (美国Amresco公司); 乙腈(美国Fisher公司); 甲醛(天津大茂化学试剂厂)。地塞米松磷酸钠注射液(批号: 81758301)购自天津金耀。OVA特异型Ig-E (s-OVA Ig-E) ELISA试剂盒(48T)购自博奥森生物; IL-4、IL-13 ELISA试剂盒(48T)购自上海西塘生物。款冬酮对照品(批号111884-201303, 纯度98.5%)购自中国食品药品检定研究院; 款冬素酯为实验室前期自制。款冬花药材购自山西沁县, 经山西大学中医药现代研究中心秦雪梅教授鉴定为菊科植物款冬Tussilago farfara L.的干燥花蕾, 标本现存于山西大学中医药现代研究中心。
款冬花总倍半萜的制备及分析 取款冬花5 000 g, 加入质量体积比为1:8的石油醚, 超声1 h, 过滤, 重复提取3次, 滤液蒸干得款冬花石油醚提取物9.3 g。选用C18中压制备柱(20 g, 20~35 μm, 美国, 艾杰尔)进一步分离, 色谱条件为: 0~35 min, 85%甲醇。收集5~35 min流分, 旋干即得总倍半萜部分4.8 g。参照《中国药典》款冬花中款冬酮的含量测定条件对总倍半萜进行HPLC分析:岛津Inertsil ODS-3 HPLC色谱柱; 以85%甲醇为流动相; 检测波长为220nm。通过对照品比对的方式确定1号峰为款冬酮, 4号峰为款冬素酯[7]。
OVA诱导的大鼠哮喘动物实验 SD大鼠24只(体重200 g), 随机分为A (空白, Control)、B (模型, Model)、C (阳性药, DEX)、D (款冬花总倍半萜, F.F.S) 4组, 每组6只。除空白组外, 其余各组每只大鼠于第8天、14天分别腹腔注射10% OVA [OVA 100 mg和A1(OH)3 100 mg]的乳化混悬液1 mL致敏, 空白组腹腔注射生理盐水1 mL。从第15天开始, A组和B组超声雾化给予生理盐水20 mL, C组雾化给予地塞米松磷酸钠注射液2 mg·kg-1, D组雾化给予款冬花总倍半萜0.2 g·kg-1, 连续给药14天。每次给药后30 min, 除空白组外其余各组置于自制密闭玻璃盒中给予l% OVA(200 mg OVA溶解于20 mL生理盐水中) 20 mL雾化激发, 每天1次, 每次30 min, 空白组每天给予生理盐水20 mL雾化吸入。给药14天后禁食12 h, 次日将大鼠麻醉后, 腹主动脉取血, 1 500 r·min-1离心15 min后得血清。将大鼠固定, 暴露胸腔, 剥离气管周围组织, 棉线结扎左支气管, 采血针针头轻轻插入右支气管, 另一边用注射器吸取pH 7.2的PBS溶液1 mL注入右肺, 反复抽吸支气管肺泡灌洗液(bronchoalveolar lavage fluid, BALF), 重复3次, BALF置于4 ℃冰箱中保存。取右肺-80 ℃冷冻保存。取左肺保存于福尔马林溶液中, 24 h后换中性福尔马林溶液完成固定。
药效学指标检测 将BALF在1 500 r·min-1下低速离心15 min, 取细胞沉淀重悬于1 mL PBS。取PBS重旋液, 滴于载玻片正中央, 盖片, 自然晾干。瑞士染色, 置Ti-s荧光显微镜下观察, 拍照, 并统计嗜酸性粒细胞、淋巴细胞、单核细胞的细胞数, 并计算其占总细胞数的百分比。ELISA测定血清s-OVA Ig-E、IL-4、IL-13的含量。取肺组织标本做病理学石蜡切片, 进行苏木素-伊红染色(HE染色)、过碘酸-雪夫染色(PAs染色)以及马松染色(Masson染色)后利用Image Pro Plus 6.0软件对染色后切片进行半定量计算。
肺组织的LC-MS分析 取右肺组织100 mg, 加超纯水1 mL匀浆3 min, 加入在4 ℃下预冷的甲醇4 mL涡旋2 min, 超声2 min, 静置10 min后取上清液, 4 ℃、13 000 r·min-1离心10 min, 取上清液, 室温下吹干, 加甲醇200 μL复溶, 在4 ℃条件下13 000 r·min-1离心10 min, 取上清液进样3 μL, 采用UHPLC-Q Extractive质谱仪进行分析。
色谱条件: Waters Acquity UHPLC HSS T3 column(2.1 mm×100 mm, 1.8 µm)色谱柱, 柱温为40 ℃; 流速为0.4 mL·min-1, 自动进样器温度为4 ℃, 流动相: A为乙腈, B为0.1%甲酸水, 梯度洗脱: 0~2 min, 20%~55% A; 2~11 min, 55%~75% A; 11~12 min, 75%~95% A; 12~15 min, 95% A; 15~19 min, 95%~20% A。
质谱条件:采用ESI离子源, 离子化模式为电喷雾正、负离子模式, 正、负离子源电压分别为5 500 V/ -4 500 V, 离子源温度为550 ℃, 雾化气体为N2, 雾化气(Gas1)为379.2 kPa, 辅助气(Gas2)为379.2 kPa, 气帘气(curtain gas)为241.3 kPa, 裂解电压(DP)分别为80 V/-80 V, 碰撞能量(CE)分别为35 eV/-35 eV, 碰撞能量扩展(CES)均为15 eV。TOF MS扫描范围: 80~1 500;产物离子扫描范围50~1 500。扫描方式: IDA设置响应值超过100 cps的8个最高峰进行二级质谱扫描, 并开启动态背景扣除(DBS)。数据采集软件为Analyst TF 1.6 software工作站; 采用CDS质量校正系统在线校正。
数据处理 CD软件计算结合数据库比对以及文献查阅鉴定化合物, 将数据导入SIMCA-P13.0 (Umetrics, 瑞典)软件中进行主成分分析(PCA), 并通过有监督的偏最小二乘判别分析(OPLS-DA)确定差异代谢物, 并利用SPSS 16.0软件对差异代谢物进行单因素方差分析(One-way ANOVA分析)。
Western blot检测大鼠肺组织中p65 NF-κB的表达量 取肺组织20 mg, 加入组织裂解液150 μL, 匀浆, 4 ℃, 12 000 ×g离心15 min, 取上清。按比例吸取蛋白上清液约20 μg, 加适量上样缓冲液, 沸水浴10 min, 离心取上清后进行SDS-PAGE电泳。湿法转膜, 5%脱脂奶粉室温下封闭2 h, 室温孵育一抗1 h, 随后用含0.05%吐温-20的PBS洗涤3次, 每次5 min。根据用量, 按照1:10 000稀释辣根过氧化酶(HRP)标记的二抗, 与膜室温孵育1 h。用含0.05%吐温-20的PBS洗涤3次, 每次5 min。将膜放置在暗室中, 根据用量取ECL发光液A和B等量混匀, 加在膜上并与之充分接触。然后将膜置于全自动化学发光分析仪中检测, 通过TANON GIS软件计算条带灰度值。
结果与讨论 1 BALF细胞计数如图 1所示, 模型组嗜酸性粒细胞占比较空白组BALF中明显升高(P < 0.001), 阳性药(P < 0.001)及款冬花总倍半萜(P < 0.001)对嗜酸性粒细胞占比均有显著回调作用, 但两者回调作用无显著性差异; 模型组淋巴细胞占比较空白组显著降低(P < 0.001), 阳性药(P < 0.001)和款冬花总倍半萜(P < 0.01)对淋巴细胞占比均有上调作用; 模型组单核细胞占比较空白组显著增加(P < 0.05), 阳性药和款冬花总倍半萜给药组单核细胞占比具有降低趋势, 但无统计学差异。
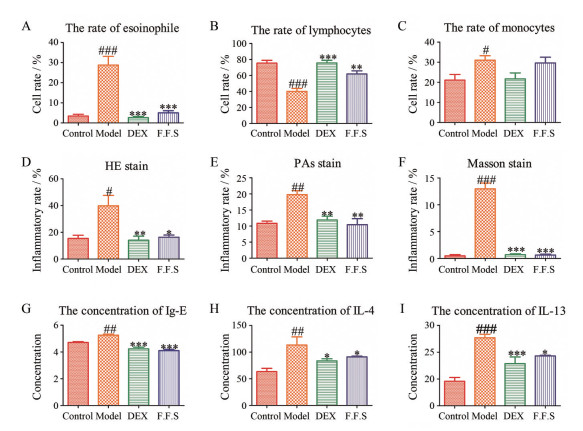
|
Figure 1 The ratio of inflammatory cells to total leukocytes in bronchoalveolar lavage fluid (BALF, A-C); Quantitative results of lung tissue pathological staining (D-F); ELISA detection of serum inflammatory factor concentration (G-I); *P < 0.05, **P < 0.01, ***P < 0.001 vs model, #P < 0.05, ##P < 0.01, ###P < 0.001 vs control |
如图 1所示, 模型组大鼠血清中s-OVA Ig-E (P < 0.01)、IL-4 (P < 0.01)、IL-13 (P < 0.05)较空白组明显升高; 阳性药和款冬花总倍半萜对s-OVA Ig-E、IL-4、IL-13水平均有明显下调作用; 且阳性药组和款冬花总倍半萜组对炎症因子的作用无显著性差异。
3 病理切片染色如图 2所示, HE染色结果显示空白组大鼠肺泡结构正常, 无炎症细胞浸润, 肌肉纤维无异常增生; 模型组大鼠肺部有大量炎性细胞浸润, 平滑肌、基底膜厚度和胶原沉淀显著增加, 肺泡结构不完整, 管腔狭窄, 与空白组相比有显著性差异; 阳性药组大鼠肺部未见显著的炎症细胞浸润, 肺泡结构无明显变化, 可见少量肌肉增生, 与模型组相比有显著性差异; 款冬花总倍半萜组大鼠未见显著的炎症细胞浸润, 肺泡结构无明显变化, 有局部肌肉增生, 与模型组相比有显著性差异, 与空白组相比无显著性差异。模型组炎症面积占总面积比率大于空白组(P < 0.05);阳性药组(P < 0.01)和总倍半萜组(P < 0.05)大鼠肺部炎症面积比率小于模型组, 且阳性药组和总倍半萜组无显著性差异(图 1)。
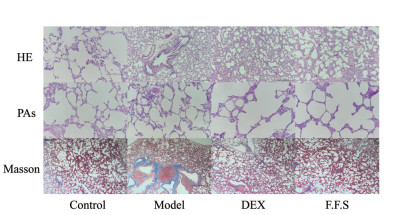
|
Figure 2 Pathological staining of lung tissue |
PAs染色结果显示(图 2), 空白组大鼠肺泡结构完整, 管腔黏膜完整无变形, 未见黏液分泌, 无炎症细胞浸润; 模型组大鼠黏膜皱襞形成, 黏液分泌物增多, 可见大量嗜酸性粒细胞及淋巴细胞浸润, 与空白组相比具有显著性差异; 阳性药组大鼠肺泡结构较为完整, 有轻微黏液分泌, 黏膜完整未变形, 无炎症细胞浸润; 款冬花总倍半萜组大鼠肺泡结构完整, 偶见黏液分泌, 黏膜完整未变形, 无炎症细胞浸润, 与空白组、阳性药组相比无显著性差异。如图 1所示, 模型组糖原指数大于空白组(P < 0.01);阳性药组(P < 0.01)和总倍半萜组(P < 0.01)糖原指数均小于模型组, 且两组无显著性差异。
如图 2所示, Masson染色后, 空白组大鼠肺泡结构完整, 无肌肉纤维增生, 未见胶原纤维, 无炎症浸润; 模型组大鼠肺泡壁增厚, 肌肉纤维明显增生, 形成了大量胶原纤维, 炎症浸润明显, 与空白组比具有显著性差异; 阳性药组大鼠偶见肺泡壁增厚, 无明显肌肉纤维增生, 未见胶原纤维大量形成, 无炎症浸润; 款冬花总倍半萜组大鼠肺泡结构正常, 无明显肌肉纤维增生, 未见胶原纤维大量形成, 无炎症浸润, 与空白组、阳性药组比无显著性差异。Masson染色结果显示, 模型组炎症面积比率大于空白组(P < 0.001);阳性药组(P < 0.001)和总倍半萜组(P < 0.001)炎症面积比率均小于模型组, 且阳性药组与总倍半萜组之间无显著性差异(图 1)。
4 代谢组学分析对空白组和模型组进行PCA分析, 可见空白组与模型组有一定分离趋势(图略), 说明OVA致敏的哮喘大鼠血清内源性代谢物发生变化。但PCA分析不能完全忽视与实验无关的体内误差与随机误差。因此, 进一步采用OPLS-DA确定OVA致敏造模后内源性代谢物的变化(图 3)。采用OPLS-DA进行分析之前, 必须采用偏最小二乘分析(PLS-DA)对模型进行验证。排列实验结果显示左边Q2均小于原始值, R2直线交于负半轴, 说明模型成立。然后通过OPLS-DA分析的S-plot图结合VIP值(VIP > 1.0), 正离子模式下鉴定了17个差异代谢物, 负离子模式下鉴定了8个差异代谢物, 如表 1所示。

|
Figure 3 Control and model OPLS-DA scatter plot of positive ion mode (A) and OPLS-DA scatter plot of negative ion mode (B) |
| Table 1 Different metabolites of ovalbumin (OVA)-sensitized rat model of asthma. a: The positive ion mode; b: The negative ion mode. 5(S)-HETRE: 5S-Hydroxy-6E, 8Z, 11Z-eicosatrienoic acid; 8(S)-HETE: 8-Hydroxy-[S-(E, Z, Z, Z)]-5, 9, 11, 14-eicosatetraenoic acid; DHA ethyl ester: Docosahexaenoic acid ethyl ester; EPA: Eicosapentaenoic acid. VIP: Variable importance projection |
利用SPSS 16.0进行One-way ANOVA分析, 各差异代谢物变化趋势如图 4所示。哮喘模型组大鼠血清中精氨酸及精胺等22个代谢物水平降低, 鞘氨醇等3个代谢物水平升高。给予阳性药后可以回调精氨酸等17个代谢物, 而给予款冬花总倍半萜可以回调精氨酸等18个代谢物。款冬花总倍半萜对精氨酸等10个代谢物回调幅度大于阳性药, 而阳性药对二十碳五烯酸(EPA)等6个代谢物回调幅度大于款冬花总倍半萜。另外, 阳性药与款冬花总倍半萜对肌酸等6个代谢物回调作用无明显差异。
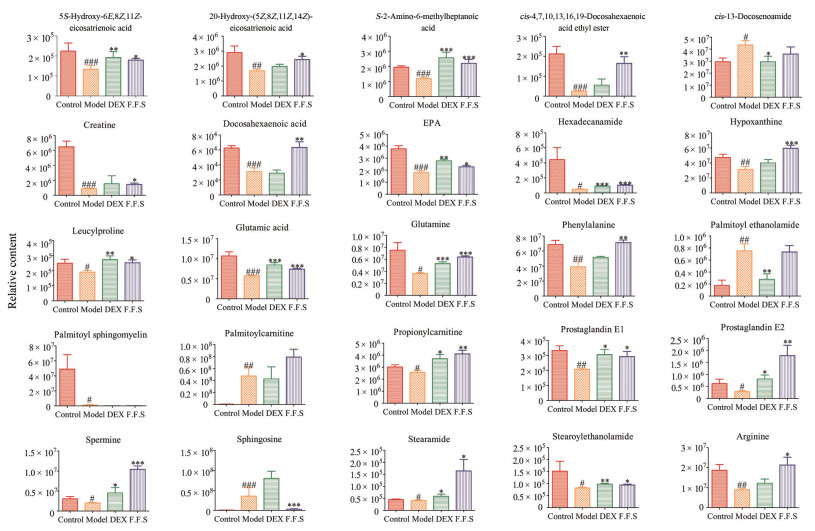
|
Figure 4 The effect of the total sesquiterpenoids of Flos Farfarae (F.F.S) on the relative contents of serum differential metabolites. *P < 0.05, **P < 0.01, ***P < 0.001 vs model; #P < 0.05, ##P < 0.01, ###P < 0.001 vs control |
将差异化合物导入MetaAnalyst网站进行代谢通路分析, 共找到21条代谢通路, 其中精氨酸生物合成, 苯丙氨酸、酪氨酸和色氨酸的生物合成, 精氨酸和脯氨酸代谢, 丙氨酸、天门冬氨酸和谷氨酸代谢, 谷氨酸和谷氨酰胺代谢, 苯丙氨酸代谢等9条代谢通路发生明显变化(图 5)。
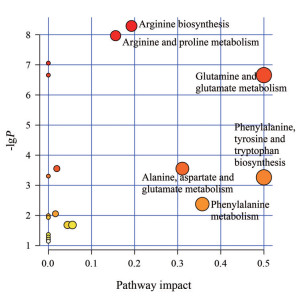
|
Figure 5 Metabolic pathway analysis |
5.1精氨酸合成代谢精氨酸在体内NO合酶的作用下产生内源性NO。虽然内源性NO可以舒张肺部毛细血管内皮细胞、支气管上皮细胞, 改善肺通气, 部分缓解哮喘病症。但过多的内源性NO可以从气道内渗出, 损伤上皮细胞, 引起气道管腔变窄, 引发气道炎症, 诱发哮喘[8, 9]。临床监测显示哮喘患者呼气中NO含量较高。此外, 精氨酸在体内分解为尿素和鸟苷酸, 鸟氨酸可脱羧进一步生成多胺。多胺类化合物能够促进细胞增殖, 哮喘模型组大鼠精氨酸被大量分解代谢产生尿素及多胺, 引起肺部细胞增殖[10]。OVA诱导的大鼠哮喘模型中, 精氨酸含量降低, 可能被大量分解代谢, 给予地塞米松和款冬花总倍半萜后精氨酸水平明显回调, 说明地塞米松和款冬花总倍半萜可以有效地抑制这一过程, 减轻哮喘症状。
5.2苯丙氨酸、酪氨酸和色氨酸生物合成代谢苯丙氨酸脱羧可以形成酪氨酸, 该过程受阻可以导致苯丙氨酸含量增加。哮喘模型组中大鼠苯丙氨酸含量降低, 导致酪氨酸合成不足。同时, 酪氨酸是合成激素的重要原料, 酪氨酸经脱羧氧化生成酪胺, 进而被单胺氧化酶氧化失活。阳性药及款冬花总倍半萜均能明显回调哮喘大鼠苯丙氨酸含量。
5.3脂肪酸代谢 EPA可以在白细胞内经过酶的催化生成白三烯B5, 促进白细胞的聚集, 使炎症加重[11]。哮喘模型组中, EPA含量下降, 哮喘炎症加重, 给予阳性药干预后, EPA含量明显上升, 大鼠哮喘炎症得到抑制。给予款冬花总倍半萜后, EPA水平有所回调, 但较阳性药弱。
前列腺素E1 (PGE1)具有抑制血栓烷A2 (TXA2)合成的作用, 减小粒细胞和血小板在肺内聚集, 改善肺微循环等作用[12]。前列腺素E2 (PGE2)具有抑制肺巨噬细胞释放炎性因子的作用[13]。哮喘模型组中, PGE1、PGE2含量下降, 肺部炎症加重, 给予阳性药干预后, 哮喘大鼠PGE1、PGE2含量明显上升, 炎症减轻。给予款冬花总倍半萜后, PGE1、PGE2均有回调作用, 且与阳性组相比, PGE2的回调趋势更加明显, 其对炎症的抑制作用更强。
5.4精胺代谢哮喘大鼠体内精胺在生物体内由腐胺和S-腺苷蛋氨酸经多种酶催化后生成。精胺主要分布在各组织细胞中, 具有促进细胞增殖分化的作用。同时, 诱导精胺分解代谢能缓解气道上皮损伤[14]。给予阳性药后, 大鼠体内精胺分解代谢加速, 哮喘症状得到缓解, 而款冬花总倍半萜对精胺的回调趋势较阳性药更加明显。
6 款冬花总倍半萜对大鼠肺组织中p65 NF-κB的影响哮喘大鼠体内精氨酸合成代谢受损, 精氨酸含量下降, 导致多胺等促炎因子分泌增加, 从而诱导炎症细胞聚集; PGE2含量下降导致对炎症因子的抑制作用减弱, 进而分泌过量的炎症因子与G蛋白偶联受体结合, 激活胞内p65 NF-κB受体, 进一步增强哮喘炎症。通过检测大鼠肺组织内p65 NF-κB的表达量对该代谢通路加以验证(图 6)。与空白组相比, OVA激发后, 模型组大鼠p65 NF-κB的表达量显著增加(P < 0.05);阳性药组和款冬花总倍半萜组大鼠p65 NF-κB的表达量较模型组显著降低, 但两组之间无显著性差异。
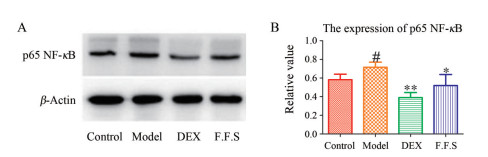
|
Figure 6 The expression of p65 NF-κB (A); the relative value of p65 NF-κB protein (expression of p65 NF-κB/internal standard, %, B); #P < 0.05 vs control, *P < 0.05, **P < 0.01 vs model |
本研究采用代谢组学技术结合炎症因子检测、病理切片分析等传统药效学指标分析了款冬花总倍半萜对哮喘大鼠的干预作用。代谢组学分析结果显示, 哮喘动物模型中有25个代谢物发生改变。哮喘大鼠体内精氨酸含量下降, 导致多胺等促炎因子分泌增加, 进一步导致炎症细胞聚集; PGE2含量下降导致抑制炎症因子的作用减弱, 分泌过量的炎症因子与跨膜G蛋白偶联受体结合, 激活胞内p65 NF-κB受体, 进一步促进炎症细胞、Th2细胞产生的IL-4、IL-13增多。IL-4、IL-13分泌的增多, 会进一步导致体内Ig-E增多, 导致嗜酸性粒细胞过度增殖与分化。同时活化的嗜酸性粒细胞会产生促炎症因子释放因子, 导致肺部炎症进一步加重, 哮喘症状加深。款冬花总倍半萜雾化吸入后, 可以阻断p65 NF-κB过度激活, 阻断促炎因子信号向胞内的传递, 减少炎症细胞的过度激活, 从而抑制炎症因子分泌, 使哮喘炎症进一步缓解。款冬花总倍半萜对前列腺素E2代谢失衡和精胺/精氨酸代谢失衡的回调作用强于地塞米松, 而地塞米松对EPA的回调强于款冬花总倍半萜。除了影响胞内受体外, 款冬花总倍半萜是否还会影响胞外信号途径还需要进一步的研究。
作者贡献:第一作者段亚辉完成实验相关以及论文撰写工作, 通讯作者李震宇负责指导实验和修改论文工作, 秦雪梅负责对本课题实验思路进行指导
利益冲突:所有作者声明不存在利益冲突
| [1] |
Li J, Gao W, Gao JN, et al. Metabolomics reveal the protective effect of Farfarae Flos against asthma using an OVA-induced rat model[J]. RSC Adv, 2017, 7: 39919-39929. |
| [2] |
Chen W, Ma L, Yang LS. Effects of glycyrrhetinic acid on oxidative stress and NF-κB signal pathway in bronchial asthma rats[J]. J Zhengzhou Univ (郑州大学学报), 2016, 51: 762-765. |
| [3] |
Zhang TX, Yang ZC, Yang SH, et al. Immunoregulatory effects of paeoniflorin exerts anti-asthmatic effects via modulation of the Th1/Th2 equilibrium[J]. Inflammation, 2015, 38: 2017-2025. |
| [4] |
Goh FY, Upton N, Guan S, et al. Fisetin, a bioactive flavonol, attenuates allergic airway inflammation through negative regulation of NF-κB[J]. Eur J Pharmacol, 2012, 679: 109-116. |
| [5] |
Oh SW, Cha JY, Jung JE, et al. Curcumin attenuates allergic airway inflammation and hyper-responsiveness in mice through NF-κB inhibition[J]. J Ethnopharmacol, 2011, 136: 414-421. |
| [6] |
Bao Z, Guan S, Cheng C, et al. A novel anti-inflammatory role for andrographolide in asthma via inhibition of the NF-κB pathway[J]. Am J Resp Crit Care, 2009, 179: 657-665. |
| [7] |
Duan YH. The Effects and Mechanism of Total Sesquiterpenes from Tussilago farfara L[J]. Taiyuan: Shanxi University, 2019. |
| [8] |
Shan LL, Zhang YK. Mechanisms of arginine metabolism and its supplementary effects in exercise[J]. Chin J Sports Med (中国运动医学杂志), 2008, 27: 129-132. |
| [9] |
Ge K, Lu SL, Qing C. Arginine metabolism and its effect on wound healing[J]. Chin J Clin Nutr (中华临床营养杂志), 2005, 13: 48-51. |
| [10] |
Zhou Q. Effects of polyamines on inflammation and repair[J]. Chin Pharmacol Bull (中国药理学通报), 1991, 7: 170-174. |
| [11] |
Hu XJ, Geng WJ, Bo J, et al. Protective effects of EPA and DHA on rat mesangial cells stimulated by lipopolysaccharide[J]. Chin J Pathophysiol (中国病理生理杂志), 2010, 26: 513-517. |
| [12] |
Li L, Fang Q, He FF. Intervention effect of prostaglandin E1 on expression of NF-κB in acute lung injury[J]. Chin J Emerg Med (中华急诊医学杂志), 2006, 15: 328-330. |
| [13] |
Greenhough A, Smartt H, Moore A, et al. The COX-2/PGE2 pathway:key roles in the hallmarks of cancer and adaptation to the tumour microenvironment[J]. Carcinogenesis, 2009, 30: 377. |
| [14] |
Dong J, Liu AH, Han LP. Spermine up-regulates the expression of beclin-1 during myocardial ischemia-reperfusion in rats[J]. Chin J Pathophysiol (中国病理生理杂志), 2018, 34: 399-402. |
 2020, Vol. 55
2020, Vol. 55


