2. 上海洛启生物医药技术有限公司, 上海 201203;
3. 上海健康医学院上海市分子影像重点实验室, 上海 201318
2. Shanghai Novamab Biopharmaceuticals Co., Ltd., Shanghai 201203, China;
3. Shanghai Key Laboratory of Molecular Imaging, Shanghai University of Medicine and Health Sciences, Shanghai 201318, China
上皮细胞黏附分子(epithelial cell adhesion molecule, EpCAM), 又称CD326、Trop-1, 是一种Ⅰ型跨膜糖蛋白, 由242个氨基酸的胞外段、23个氨基酸的单次跨膜区域和26个氨基酸的胞内段组成, 为上皮细胞特异性的黏附分子[1]。EpCAM在健康人体中仅表达于正常上皮组织, 病理情况下, 常过表达于多种肿瘤和炎症疾病组织。研究表明, EpCAM参与了细胞黏附、细胞信号转导、细胞迁移、增殖以及分化等功能, 可与其他重要的细胞黏附因子相互作用, 并调节细胞与细胞基质间的结构[2, 3]。近年来, 研究表明EpCAM大量表达在上皮来源的原发以及转移肿瘤上, 特别是结肠癌、膀胱癌、肺癌、前列腺癌、肝癌、乳腺癌和卵巢癌等[4-6]。据报道, 在正常上皮组织中EpCAM大部分以隐蔽状态存在, 而在肿瘤组织中以易结合状态存在, 因此EpCAM被认为是靶向治疗的热门靶标之一[7]。
EpCAM分子与多种肿瘤的发生和预后密切相关, 且是重要的肿瘤细胞表面标志物, 目前以EpCAM作为研究靶点已开展了多项体外实验、动物模型实验或临床试验[8-10]。随着抗体药物研发技术的不断更新和研发经验的不断积累, 尤其得益于基因工程抗体技术突飞猛进的发展, EpCAM抗体药物的开发也经历了更迭与突破。然而, 基于EpCAM靶点的单克隆抗体在治疗效果上仅取得了有限的抗肿瘤效果[11, 12]。由于EpCAM在肿瘤细胞表面特异性表达, EpCAM分子与配体结合后能够高效产生受体介导的内吞作用, 因此, 开发靶向EpCAM的抗体与毒素分子进行偶联, 制成生物导弹, 为治疗EpCAM阳性肿瘤提供了一种新的策略。
目前, 新型抗体药物-纳米抗体(nanobody, Nb)在肿瘤治疗中崭露头角。它是由骆驼中重链抗体HCAb (95 kDa)可变区扩增而来的单域抗体, 又称为VHH抗体(variable domain of heavy chain of heavy-chain antibody, VHH)[13]。VHH抗体直径2.5 nm, 长4 nm, 是目前可与抗原结合的最小片段[14]。大量研究发现, 纳米抗体除具备单克隆抗体的抗原反应性外, 还拥有一些独特的功能特性, 如可以有效浸润组织, 很高的靶向结合效率, 容易克隆, 优秀的重折叠性能, 较高的热稳定性以及在原核系统中高效表达等, 几乎完美克服了传统抗体开发周期长、稳定性较低和保存条件苛刻等缺陷。由此可见, 纳米抗体在生物技术应用和疾病的诊断与治疗方面优于单克隆抗体, 逐渐成为新一代抗体诊断和治疗中的新兴力量[15-17]。
迄今, 首个特异性获得性血栓性血小板减少性紫癜(acquired thrombotic thrombocytopenic purpura, aTTP)治疗纳米抗体药物Cablivi已成功上市[18], 此外, 众多纳米抗体药物研发项目处于不同临床研究阶段, 值得一提的是, 康宁杰瑞生物医药公司开发的程序性死亡受体1 (programmed death ligand 1, PD-L1)单域抗体碎片结晶区(fragment crystallizable region, Fc)融合蛋白目前正在中国、美国和日本开展多个临床试验, 部分适应症已进入Ⅲ期临床试验阶段[19]。由此可见, 纳米抗体在生物医药领域有巨大的应用潜力, 已成为新一代药物研发的热点。基于纳米抗体的特性和应用于临床的现状, 本课题组期望开发新的基于EpCAM的内吞型纳米抗体, 以用于后续的联合免疫毒素研究。
本研究通过骆驼免疫, 成功构建了特异性针对EpCAM的噬菌体展示纳米抗体免疫文库, 并利用噬菌体展示技术进行文库筛选, 获得71株阳性克隆, 通过抗体序列分析、比对进一步将候选抗体锁定在17株, 后续对17株互补决定区(complementarity determining region, CDR) 3完全不同的纳米抗体分子进行肿瘤细胞胞吞活性鉴定, 最终确定3株胞吞活性好、特异性强、亲和力高的纳米抗体, 上述研究为EpCAM阳性肿瘤治疗提供重要的科学依据, 并为EpCAM内吞型特异性纳米抗体药物的开发提供了基础。
材料与方法噬菌体展示纳米抗体文库构建 EpCAM胞外段抗原基因序列从Uniprot网站获取, 通过同源重组的方法构建至真核表达载体pFUSE-hIgG1-Fc2, EpCAM-Fc与用于文库筛选免疫吸附的Fc (IgG1)标签蛋白均采用HEK 293F哺乳动物悬浮表达系统及Protein A亲和纯化获得。骆驼免疫时, EpCAM-Fc抗原蛋白(每次1 mg)与弗氏佐剂按照等体积混合(各5 mL), 用研钵充分研磨直至混合液呈稳定的白色乳胶液滴后进行骆驼多点皮下注射。第1次免疫使用弗氏完全佐剂(德国Merck公司), 其余6次为弗氏不完全佐剂(德国Merck公司), 共免疫7次, 免疫间隔为1周。本研究动物实验经复旦大学药学院实验动物伦理委员会(IACUC)批准。免疫结束后, 使用真空采血管(美国BD公司)采集100 mL外周血, 离心分离外周血单个核细胞(peripheral blood mononuclear cells, PBMC)后进行RNA的提取(美国QIAGEN公司), 并进一步反转录生成cDNA (美国Invitrogen公司), 之后通过两轮PCR扩增VHH片段, 纯化回收VHH片段后, 通过限制性内切酶Pst I及Not I酶切克隆至噬菌粒载体pMECS, 随后将连接产物电转至大肠杆菌TG1中完成特异性针对EpCAM噬菌体文库的构建。最后, 通过文库库容及VHH片段正确插入率检测进行文库质量评估。
噬菌体展示纳米抗体文库筛选 通过噬菌体展示技术进行EpCAM纳米抗体的筛选。由于前期用于免疫的EpCAM抗原含有Fc标签, 因此在筛选的过程中则使用Fc标签负筛法去除针对标签的纳米抗体。每轮筛选使用的上一轮富集噬菌体中添加10 μL浓度10 mg·mL-1的Fc标签蛋白, 免疫吸附去除噬菌体中针对Fc标签的非特异性抗体, 减少大量Fc标签特异性抗体对EpCAM特异性抗体的干扰。本研究通过3轮的“结合-洗涤-富集”的过程获得EpCAM特异性纳米抗体噬菌体的富集。
周质裂解物酶联免疫吸附实验(PE-ELISA)鉴定EpCAM特异性纳米抗体 文库构建使用的噬菌粒载体pMECS长度为4 510 bp, 该载体在VHH插入位点上游含有乳糖操纵子和信号肽序列pelB, 在VHHs插入位点的下游含有血凝素标记(hemagglutinin tag, HA)标签和6个连续的组氨酸(6×histidine, 6×His)标签, 上述标签的下游为Gene Ⅲ基因, 此结构使得纳米抗体片段能够在成熟的噬菌体PIII衣壳蛋白的N端融合表达, HA和His标签为后续的可溶性抗体的筛选鉴定和纯化提供了便利。
在无菌细胞培养24孔板(美国Corning公司)中对挑选单克隆进行37 ℃培养, 并低温诱导过夜, 次日离心去除培养基, 并利用渗透压冲击法裂解菌体释放周质蛋白, 通过ELISA方法初步鉴定阳性克隆。将含有抗体的细胞周质裂解液加至酶标板孔中, 特异性纳米抗体与偶联的EpCAM-Fc反应从而结合于抗原上。ELISA一抗为鼠源HA抗体(美国Biolegend公司), 二抗为山羊抗小鼠免疫球蛋白碱性磷酸酶结合抗体(德国Merck公司), 酶标仪于405 nm处读取A405值。
EpCAM特异性纳米抗体原核表达纯化 由于噬菌粒载体pMECS的Gene Ⅲ基因和His标签基因之间存在一个琥珀终止密码子TAG。该重组噬菌粒载体在大肠杆菌TG1细胞中, TAG终止子无法被正常识别, 蛋白质的翻译能够通过TAG密码子而翻译成谷氨酰胺, 于是VHH、HA和His标签以及Gene Ⅲ蛋白形成融合蛋白以实现噬菌体展示过程, 然而, WK6菌株可正常识别琥珀终止密码子TAG, 从而终止后续Gene Ⅲ的表达, 避免其影响蛋白纯化, 因此本研究将编码纳米抗体的重组质粒转化至表达型大肠杆菌WK6中, 表达形成带有HA和His两个标签的纳米抗体融合蛋白。WK6培养、裂解后, 蛋白提取液与镍柱混合并在4 ℃孵育1 h, 孵育结束后将蛋白液置于纯化管中, 进行洗涤、洗脱、超滤, 并最终通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis, SDS-PAGE)对抗体蛋白分子量、纯度等进行检测。
筛选胞吞活性高的EpCAM特异性纳米抗体 用RPMI-1640培养基培养细胞, 将细胞消化分装为每孔3×105, 加入纳米抗体(终浓度10 μg·mL-1), 4 ℃孵育20 min; 孵育结束后3 000 r·min-1离心4 min, 弃上清, 加入RPMI-1640完全培养基, 分别置于冰浴及37 ℃培养箱中2 h; 3 000 r·min-1离心4 min, 弃掉上清; 按照1:200比例加入anti-HA (Alexa Fluor 488), 4 ℃孵育20 min; 3 000 r·min-1离心4 min, 弃掉上清, 每孔加入200 μL PBS重悬细胞, 流式细胞仪上机检测纳米抗体胞吞比例。
激光共聚焦显微术鉴定候选EpCAM纳米抗体胞吞活性 为了对候选分子进行可视化胞内定位分析, 人结肠癌细胞系HT-29酶解消化后离心, PBS洗涤后将细胞接种于24孔板中, 同时分别加入候选纳米抗体(终浓度10 μg·mL-1)置于37 ℃培养24 h, 培养结束后PBS清洗细胞3次, 并用4%多聚甲醛室温固定10 min, 清洗细胞后, 用0.3%聚对苯二甲酸丁二醇酯(polybutylene terephthalate, PBT)破膜, 随后用5%的胎牛血清(美国Invitrogen公司)封闭1 h, 封闭完成后进行抗体标记, 培养孔中分别加入anti-HA (Alexa Fluor 488)标记纳米抗体, 孵育结束后清洗细胞, 溶酶体标记一抗(兔抗人LAMP1抗体), 之后标记山羊抗兔IgG (H+L)二抗(Alexa Fluor 555) (美国Thermo Fisher公司), 溶酶体标记完成后, 使用带有4', 6-联脒-3-苯吲哚二盐酸盐(4', 6-diamidino-2-phenylidole, DAPI)的封片剂封片。最后, 用激光共聚焦显微镜对样品进行观察拍照。
EpCAM特异性纳米抗体亲和力测定 本研究使用ForteBio Octet® Red 96进行纳米抗体与抗原EpCAM的亲和力测定, 先将EpCAM-Fc抗原稀释至1 μg·mL-1并固相吸附于Protein A探针, 再将待测纳米抗体按照2倍倍比梯度稀释5个浓度梯度并与结合抗原的探针孵育, 最后由磷酸盐吐温缓冲液PBST洗脱, 按照1:1结合模型进行结合曲线拟合。
结果 1 EpCAM高质量噬菌体展示纳米抗体文库的构建及质量评估文库的类型选择及文库质量对特异性纳米抗体的筛选至关重要, 目前已知主要的噬菌体文库类型包括免疫文库、合成文库和天然文库, 本研究采用免疫文库进行EpCAM特异性纳米抗体筛选。EpCAM特异性噬菌体文库的构建、纳米抗体的筛选总体流程如图 1所示:制备EpCAM抗原后进行骆驼免疫, 7次免疫结束后, 收集免疫骆驼外周血, 分离淋巴B细胞, 提取RNA并逆转录生成cDNA, 以此为模板扩增VHH片段进行噬菌体文库构建。
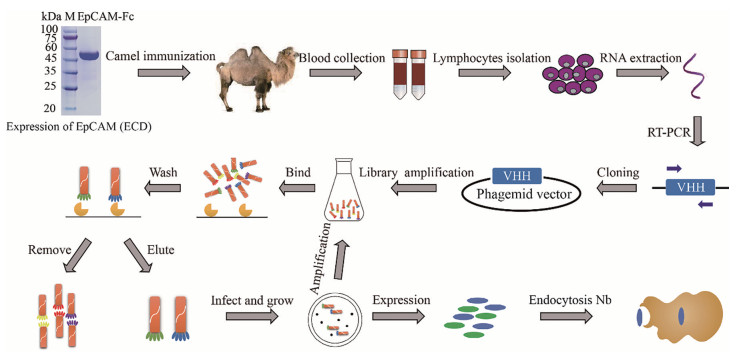
|
Figure 1 Workflow of the identification of anti-EpCAM Nbs. EpCAM: Epithelial cell adhesion molecule; Nb: Nanobody |
纳米抗体编码基因VHH片段通过两轮PCR扩增获得, 第一轮PCR扩增获得了驼源重链抗体的VHH-h-CH2片段, 约为700 bp (图 2A), 以此为模板进行第二轮PCR获得了约400 bp大小的VHH片段(图 2B)。将VHH片段与噬菌粒载体双酶切后连接并电转至TG1细胞中完成文库构建。随后对文库质量从文库库容大小、VHH基因插入正确率两方面进行评估。如图 2C所示, 本研究构建的免疫文库库容为0.5×109 CFU (colony forming units), 随机挑选24个克隆进行菌落PCR验证文库VHH片段正确插入率, 如图 2D显示, 本文库插入率为100%, 上述指标表明本研究获得了高质量的EpCAM噬菌体展示纳米抗体文库, 其文库库容及插入率为多样性EpCAM纳米抗体的筛选提供了保证。
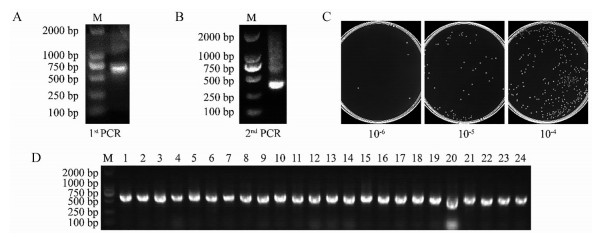
|
Figure 2 Construction of EpCAM specific library. A: The first PCR fragments with an event band of 700 bp; B: The products of second PCR, which of an evident band of 400 bp; C: The library size was estimated by counting of colony numbers; D: 24 colonies were randomly picked to determine the insertion rate of the library |
在获得高质量的噬菌体文库后, 本研究运用噬菌体展示技术进行文库筛选, 筛选过程包含“吸附结合-非特异性洗涤-特异性洗脱-富集扩增”4个阶段。每轮筛选开始, 需要将文库与固相吸附的抗原进行吸附结合, 完成洗涤步骤去除非特异性结合抗原的噬菌体后, 解离洗脱特异性噬菌体并侵染大肠杆菌TG1进行扩增富集用于下一轮筛选, 通过对EpCAM抗原特异性(+)与对照Fc蛋白特异性(-)噬菌体数目对比对每轮文库筛选结果进行评估, 如图 3所示, 经过3轮亲和淘选后, 文库逐渐产生富集, 富集铺板结果如图 3A所示, 富集倍数最终达到了86倍(图 3B), 该程度富集倍数既保证了抗原特异性阳性克隆鉴定, 又可避免纳米抗体基因高度重复而对其多样性产生影响。
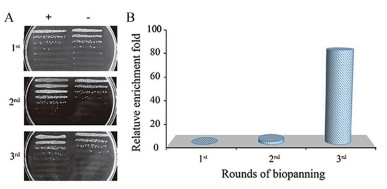
|
Figure 3 The results of bio-panning for EpCAM-specific library. A: Enrichment of each round bio-panning shown by plate; B: The relative enrichment ratio of the total three consecutive rounds of bio-panning |
从第二轮和第三轮筛选平板中随机挑选288颗单克隆培养表达, 并利用渗透压冲击法裂解细胞获得周质蛋白, 通过ELISA方法鉴定阳性克隆。研究采用间接ELISA法识别纳米抗体HA标签进行鉴定, 实验组为EpCAM-Fc抗原, 对照组为等量Fc蛋白, 当实验组A405为对照组3倍及以上时, 判定该克隆为阳性克隆, 如图 4所示, 从挑取的288个阳性克隆中共获得71株阳性克隆, 其比值(实验组/对照组)在3~17之间。
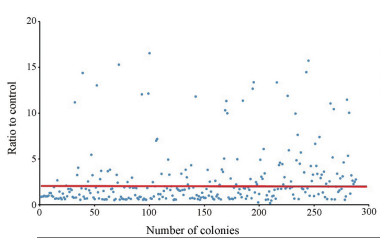
|
Figure 4 Positive colonies of EpCAM were identified by PE-ELISA with the ratio more than 3 |
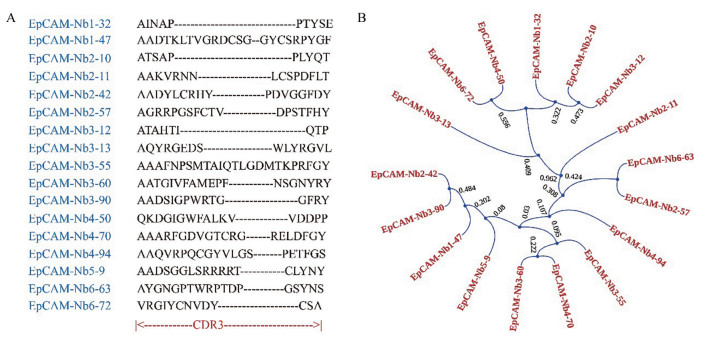
将阳性克隆鉴定获得的71株单克隆进行序列测定, 并比对EpCAM特异性纳米抗体氨基酸序列, 由于CDR3区在抗体与抗原特异性识别中具有关键作用, 本研究根据氨基酸序列先后进行了重复序列剔除和CDR3区抗体家族分类, 以此为标准最终获得17株纳米抗体且从属于不同家族, 此外, 对这17株抗体氨基酸序列按照邻近法进行进化树分析, 比较其序列同源性, 结果如图 5所示, 图 5A显示的是17种纳米抗体完全不同的CDR3区氨基酸序列, 图 5B为其进化树分析数据, 对所获抗体分子按照氨基酸序列同源性程度进行了分类, 结果表示所获17株纳米抗体具有较好的多样性。
|
Figure 5 The sequences analysis of the screened 17 kinds of Nbs. A: Amino acid sequences for CDR3; B: Phylogenetic tree of the isolated EpCAM-directed Nbs, based on the neighbor joining method |
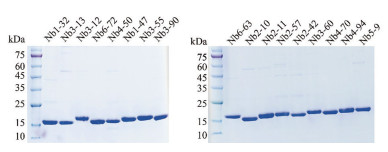
为了对17株纳米抗体的亲和力和内吞活性等进行准确验证, 本研究将上述纳米抗体重组质粒电转至表达菌株WK6, 培养、诱导、纯化以获得高纯度的纳米抗体蛋白, 纯化工艺采用镍柱亲和纯化, 并利用SDS-PAGE对纯化抗体大小及纯度进行鉴定, 如图 6所示, 17株抗体均获得了毫克级表达产量且纯度优于90%的高质量蛋白。
|
Figure 6 Amino acid sequences for CDR3 of the isolated 17 kinds of Nbs |
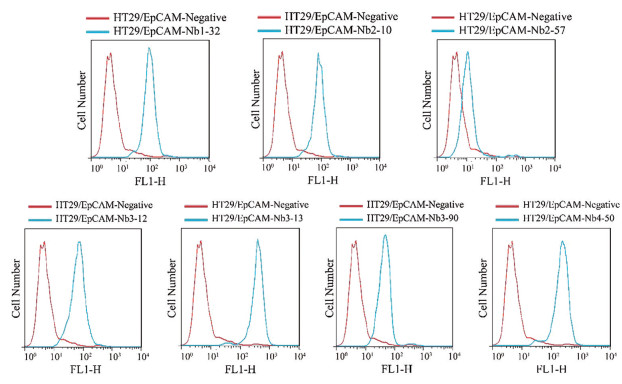
所获纳米抗体特异性仅通过PE-ELISA方法进行过探讨, 考虑到抗体纯度和细胞裂解物等影响, 亦排除重组蛋白抗原与细胞天然表达抗原构象等方面差异, 本研究进行了人结肠癌细胞HT29细胞与纳米抗体结合活性的流式细胞术鉴定, 进一步对纯化的17株纳米抗体与HT29细胞的识别、结合能力及其特异性进行研究, 本实验阴性对照为黄曲霉素纳米抗体AF70。结果如图 7所示, 发现17个抗体中有7个均可特异性识别HT29细胞(EpCAM阳性)并与之结合(Nb1-32、Nb2-10、Nb2-57、Nb3-12、Nb3-13、Nb3-90和Nb4-50)。该结果进一步确定了后续研究对象范围, 排除了非特异性识别的纳米抗体, 后续针对这7个抗体进行胞吞型纳米抗体的筛选鉴定。
|
Figure 7 The identification of binding activity between Nbs and HT29 tumor cells by fluorescent activated cell sorting (FACS) |
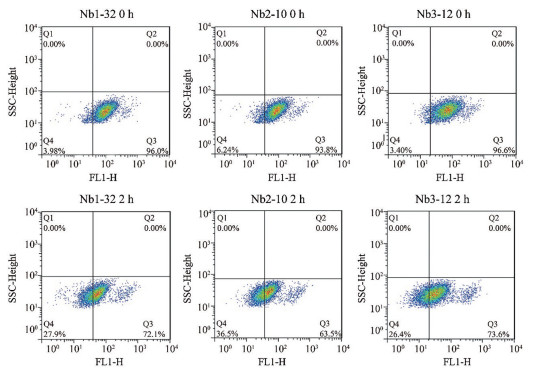
本研究进一步筛选具有肿瘤细胞内吞活性的纳米抗体, 本研究选择HT-29细胞, 利用流式细胞术对获得的7株纳米抗体的肿瘤细胞胞吞活性进行了检测, 抗体分别与HT-29细胞孵育, 通过比较孵育2 h后细胞表面剩余抗体数量间接反映细胞对不同抗体的内吞活性(0 h细胞表面抗体与2 h细胞表面抗体差值与内吞活性呈正比), 结果如图 8所示, Nb1-32、Nb2-10和Nb3-12表现出良好的细胞内吞活性, 分别为23.92%、30.26%和23.0%, 其余抗体胞吞活性均在10%以下(部分结果未显示), 参考细胞水平结合实验可初步得出结论:抗体的细胞内吞活性与抗体和细胞的结合活性无直接相关性。
|
Figure 8 The endocytosis activity identification of selected Nbs by FACS |
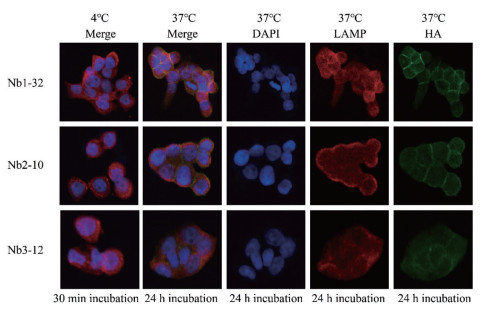
由于EpCAM内吞型纳米抗体通过受体介导的内吞机制进入肿瘤细胞并被转运至溶酶体, 为了对上述3株内吞型纳米抗体的胞吞效果进行可视化鉴定, 本研究使用激光共聚焦显微镜对纳米抗体在37 ℃孵育24 h后在HT29细胞中的定位情况进行分析, 结果如图 9所示, 在EpCAM阳性细胞HT29中, 相比于4 ℃未进行内吞孵育处理的样品, 37 ℃孵育24 h后, 3株纳米抗体(绿色)均大量分布于核周(蓝色)区域, 与溶酶体的分布定位(红色)高度重叠, 证明经流式细胞术鉴定的3株候选分子均有优异的胞吞效果, 纳米抗体在入胞后进入溶酶体降解途径。本研究后续主要对Nb1-32、Nb2-10和Nb3-12纳米抗体开展进一步分子特性研究, 为上述活性分子的应用提供支持。
|
Figure 9 Internalization and colocalization analysis of candidate Nbs by HT29 cells |
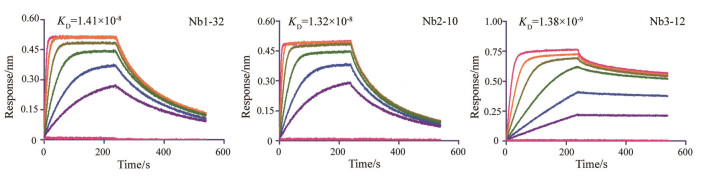
高亲和力通常是抗体筛选所追求的一个重要指标, 本研究基于生物膜干涉技术(biolayer interferometry technology, BLI)对纳米抗体Nb1-32、Nb2-10和Nb3-12进行了亲和力测定。包被EpCAM-Fc抗原于偶联固相, 依次加入5个梯度稀释的纳米抗体进行检测, 亲和力检测结果如图 10所示, Nb1-32亲和力为1.41×10-8, Nb2-10亲和力为1.32×10-8, Nb3-12亲和力为1.38×10-9, 结果表明上述3株抗体均表现出与EpCAM抗原的高亲和力, 尤其是Nb3-12所展示出优异的纳米抗体亲和力, 使其具有巨大的潜力开发成EpCAM特异性纳米抗体药物。
|
Figure 10 The binding activity of Nb1-32, Nb2-10 and Nb3-12 to EpCAM-Fc was assessed by ForteBio Octet® Red 96 system assay |
EpCAM作为重要的上皮细胞黏附因子, 在不同类型的上皮细胞中均有特异性表达, 参与调节细胞间黏附、细胞迁移和分化等过程。相比于健康成人, EpCAM在很多恶性肿瘤中过度表达, 如结肠癌、膀胱癌、肺癌、前列腺癌、肝癌、乳腺癌和卵巢癌等, 目前针对EpCAM的癌症治疗已涉及到疫苗、单克隆抗体、纳米抗体、细菌毒素以及与化疗药物结合抗体等多种方式, 因此, EpCAM被认为是肿瘤治疗研究的热门靶标。
基于EpCAM靶点的单克隆抗体在治疗效果上仅获得有限的抗肿瘤效应, 主要因为肿瘤患者的免疫系统往往遭破坏, 或受肿瘤微环境抑制而限制了单抗抗体依赖的细胞毒作用(antibody-dependent cell-mediated cytotoxicity, ADCC)和补体依赖的细胞毒作用(complement-dependent cytotoxicity, CDC), 因此迫切需要开发更高效的靶向治疗方案[20]。免疫毒素在治疗恶性肿瘤领域取得了显著的成效, 如通过分子生物技术制备的重组免疫毒素制剂ONTAK已被美国FDA批准上市, 同时正处于临床Ⅰ期的新型免疫毒素BL22在白血病临床试验中表现优异[21]。免疫毒素靶向治疗研究正成为研究热点, 其高效特异性杀伤功能的发挥无需依赖机体的免疫功能。然而, 目前主要基于单链抗体或其他抗体片段的免疫毒素在原核表达系统中多以包涵体形式存在, 需要重新折叠复性, 稳定性较差, 生产制备困难[22], 因此迫切需要寻找更适合的抗体片段用于制备免疫毒素。
纳米抗体作为新一代抗体药物的研发热点, 已有首个特异性的aTTP治疗性纳米抗体药物Cablivi成功上市, 并且多个品种进入了Ⅱ/Ⅲ期临床。然而, 国内纳米抗体药物开发还仅仅处于起步状态。本研究通过骆驼免疫构建了高质量的噬菌体展示文库, 通过文库亲和淘选, 获得了多样性好的EpCAM特异性结合纳米抗体候选分子, 后续通过细胞胞吞活性检测, 激光共聚焦显微术定位分析, 鉴定出3株具有较好肿瘤细胞内吞活性的EpCAM纳米抗体且亲和力表现优异, 本研究以EpCAM为靶点, 利用纳米抗体的优势, 为EpCAM阳性相关肿瘤治疗奠定了研究基础, 为治疗药物提供了新的选择。
在后续工作中, 课题组将在鉴定获得的3株胞吞活性好、特异性强、亲和力高的纳米抗体基础上继续开展纳米抗体的特异性和抗原结合表位研究, 并对其进行人源化, 且选择合适的免疫毒素共同构成重组免疫毒素开展体内外的抗肿瘤活性研究, 包括在体外对EpCAM阳性肿瘤细胞的增殖以及凋亡的影响, 在体内免疫毒素对小鼠的毒性以及抗EpCAM阳性肿瘤作用进行分析。
基于纳米抗体的新型免疫毒素研究因纳米抗体的特殊性, 展示出结构更稳定, 生产成本更低, 及对肿瘤的浸润和穿透效果更强等诸多优点。本研究通过EpCAM纳米抗体筛选结合后期重组免疫毒素体外和体内活性的验证, 形成完整的技术体系, 以期带动同类型相关靶点的纳米抗体免疫毒素开发, 为其他治疗靶点的纳米抗体免疫毒素研究提供指导意义。
作者贡献:万亚坤、鞠佃文进行了实验设计、指导以及文章审核工作。先宗树、李光辉负责抗原制备、骆驼免疫、纳米抗体筛选、比对、纯化等工作, 并完成文章撰写。盖军伟、朱敏、马琳琳负责完成噬菌体文库构建、纳米抗体生物学活性鉴定和文章修改等工作
利益冲突:所有作者声明不存在利益冲突
| [1] |
Baeuerle PA, Gires O. EpCAM (CD326) finding its role in cancer[J]. Br J Cancer, 2007, 96: 417-423. DOI:10.1038/sj.bjc.6603494 |
| [2] |
Trzpis M, McLaughlin PM, de Leij LM, et al. Epithelial cell adhesion molecule:more than a carcinoma marker and adhesion molecule[J]. Am J Pathol, 2007, 171: 386-395. DOI:10.2353/ajpath.2007.070152 |
| [3] |
Maetzel D, Denzel S, Mack B, et al. Nuclear signalling by tumour-associated antigen EpCAM[J]. Nat Cell Biol, 2009, 11: 162-171. DOI:10.1038/ncb1824 |
| [4] |
Boesch M, Spizzo G, Seeber A. Concise review:aggressive colorectal cancer:role of epithelial cell adhesion molecule in cancer stem cells and epithelial-to-mesenchymal transition[J]. Stem Cells Transl Med, 2018, 7: 495-501. DOI:10.1002/sctm.17-0289 |
| [5] |
Ni J, Cozzi P, Beretov J, et al. Epithelial cell adhesion molecule (EpCAM) is involved in prostate cancer chemotherapy/radiotherapy response in vivo[J]. BMC Cancer, 2018, 18: 1092. DOI:10.1186/s12885-018-5010-5 |
| [6] |
Guan X. Cancer metastases:challenges and opportunities[J]. Acta Pharm Sin B, 2015, 5: 402-418. DOI:10.1016/j.apsb.2015.07.005 |
| [7] |
Patriarca C, Macchi RM, Marschner AK, et al. Epithelial cell adhesion molecule expression (CD326) in cancer:a short review[J]. Cancer Treat Rev, 2012, 38: 68-75. DOI:10.1016/j.ctrv.2011.04.002 |
| [8] |
Sia KC, Huynh H, Chung AY, et al. Preclinical evaluation of transcriptional targeting strategy for human hepatocellular carcinoma in an orthotopic xenograft mouse model[J]. Mol Cancer Ther, 2013, 12: 1651-1664. DOI:10.1158/1535-7163.MCT-13-0056 |
| [9] |
Abdelgawad IA. Epithelial cell adhesion molecule mRNA can be a potential marker to predict metastasis in hepatocellular carcinoma patients[J]. Asian Pac J Cancer Prev, 2020, 21: 861-866. DOI:10.31557/APJCP.2020.21.3.861 |
| [10] |
Ali NS, Akudugu JM, Howell RW. A preliminary study on treatment of human breast cancer xenografts with a cocktail of paclitaxel, doxorubicin, and 131I-anti-epithelial cell adhesion molecule (9C4)[J]. World J Nucl Med, 2019, 18: 18-24. DOI:10.4103/wjnm.WJNM_9_18 |
| [11] |
Punt CJ, Nagy A, Douillard JY, et al. Edrecolomab alone or in combination with fluorouracil and folinic acid in the adjuvant treatment of stage Ⅲ colon cancer:a randomised study[J]. Lancet, 2002, 360: 671-677. DOI:10.1016/S0140-6736(02)09836-7 |
| [12] |
Onstenk W, Kraan J, Mostert B, et al. Improved circulating tumor cell detection by a combined EpCAM and MCAM cell search enrichment approach in patients with breast cancer undergoing neoadjuvant chemotherapy[J]. Mol Cancer Ther, 2015, 14: 821-827. DOI:10.1158/1535-7163.MCT-14-0653 |
| [13] |
Hamers-Casterman C, Atarhouch T, Muyldermans S, et al. Naturally occurring antibodies devoid of light chains[J]. Nature, 1993, 363: 446-448. DOI:10.1038/363446a0 |
| [14] |
Kong Q, Yao Y, Chen R, et al. Progress in nanobody and its application in diagnosis[J]. Chin J Biothchnol (生物工程学报), 2014, 30: 1351-1361. |
| [15] |
Jovcevska I, Muyldermans S. The therapeutic potential of nanobodies[J]. BioDrugs, 2020, 34: 11-26. DOI:10.1007/s40259-019-00392-z |
| [16] |
Arbabi-Ghahroudi M. Camelid single-domain antibodies:historical perspective and future outlook[J]. Front Immunol, 2017, 8: 1589. DOI:10.3389/fimmu.2017.01589 |
| [17] |
Ma LL, Zhu M, Li GH, et al. Construction and screening of phage display library for TIM-3 nanobody[J]. Acta Pharm Sin (药学学报), 2018, 53: 388-395. |
| [18] |
Duggan S. Caplacizumab:first global approval[J]. Drugs, 2018, 78: 1639-1642. DOI:10.1007/s40265-018-0989-0 |
| [19] |
Zhang F, Wei H, Wang X, et al. Structural basis of a novel PD-L1 nanobody for immune checkpoint blockade[J]. Cell Discov, 2017, 3: 17004. |
| [20] |
Braster R, O'Toole T, van Egmond M. Myeloid cells as effector cells for monoclonal antibody therapy of cancer[J]. Methods, 2014, 65: 28-37. DOI:10.1016/j.ymeth.2013.06.020 |
| [21] |
Lin AY, Dinner SN. Moxetumomab pasudotox for hairy cell leukemia:preclinical development to FDA approval[J]. Blood Adv, 2019, 3: 2905-2910. DOI:10.1182/bloodadvances.2019000507 |
| [22] |
Kitten O, Martineau P. Antibody alternative formats:antibody fragments and new frameworks[J]. Med Sci (Paris), 2019, 35: 1092-1097. DOI:10.1051/medsci/2019217 |
 2020, Vol. 55
2020, Vol. 55


