乳腺癌是女性最常见的恶性肿瘤, 占所有癌症的23%, 每年全球约有100万新增病例[1], 研究发现, 其中约70%的乳腺肿瘤呈现雌激素受体α (ERα)阳性[2]。因此, 临床常采用选择性雌激素受体调节剂(SERM)竞争性结合雌激素受体进行治疗[3]。
他莫昔芬(tamoxifen, TAM)是最常用的选择性雌激素受体调节剂。研究表明, 他莫昔芬或其主要活性代谢物4-羟基他莫昔芬(4-OHT)可拮抗雌激素受体, 阻碍DNA的合成和乳腺癌细胞对雌激素的反应性, 进而促进细胞死亡[4, 5]。临床调查显示, 他莫昔芬可有效降低乳腺癌患者的死亡率[6]。但在治疗过程中, 约50%的患者在使用他莫昔芬后产生耐药性并出现复发[7], 因此, 获得性他莫昔芬耐药成为目前乳腺癌治疗需解决的关键问题。
肿瘤细胞的糖代谢与正常细胞不同, 即使在供氧充足时, 也优先利用有氧糖酵解(aerobic glycolysis)将葡萄糖转化为乳酸产能[8]。研究发现, 有氧糖酵解在癌细胞耐药性发展中具有重要作用。在肿瘤耐药细胞中, 通常观察到葡萄糖摄取和代谢增加, 有氧糖酵解增强[9], 如表柔比星、紫杉醇和顺铂等化疗药物产生抗性的耐药细胞往往呈现更高的有氧糖酵解表型[10, 11], 他莫昔芬耐药的乳腺癌细胞同样也表现出有氧糖酵解水平升高[12]。而高有氧糖酵解水平可以促进肿瘤细胞的生长增殖并减少药物诱导凋亡的作用, 促进肿瘤细胞发生耐药[13]。因此, 抑制有氧糖酵解水平可能是逆转耐药的潜在途径。
3-溴丙酮酸(3-bromopyruvic acid, 3-BrPA)是一种烷基化化合物, 其对于糖酵解过程的己糖激酶Ⅱ和3-磷酸甘油醛脱氢酶等均具有抑制作用, 可抑制肿瘤细胞有氧糖酵解, 减少ATP的产生从而抑制多种癌细胞的生长[14]。已有研究证实, 3-BrPA可以提高肿瘤耐药细胞对多柔比星、顺铂和5-氟尿嘧啶等一线化疗药物的敏感性[15]。因此, 本研究旨在考察3-BrPA能否增加乳腺癌耐药细胞对他莫昔芬的敏感性, 并探讨其作用机制, 为临床应用有氧糖酵解小分子抑制剂治疗他莫昔芬耐药提供理论依据。
材料与方法实验细胞与试剂 人乳腺癌MCF-7细胞系购于中国科学院昆明细胞库; 人乳腺癌他莫昔芬耐药细胞MCF-7/TR购自美国ATCC公司; 4-OHT和乳酸检测试剂盒均购自Abcam公司, 3-BrPA购自源叶生物公司; MTT购于索莱宝公司; DMEM高糖(4 500 mg·L-1)培养基、胎牛血清(fetal bovine serum, FBS)均购于Gibco公司; 葡萄糖转运蛋白1 (glucose transporter 1, GLUT1)、己糖激酶2 (hexokinase 2, HK2)、乳酸脱氢酶A (lactate dehydrogenase A, LDHA)抗体购于Cell Signaling Technology公司; β-actin单克隆抗体、羊抗兔和羊抗鼠IgG-HRP抗体均购于Bioworld公司。
细胞培养 MCF-7/TR耐药细胞用含1 μmol·L-1他莫昔芬和10%胎牛血清的DMEM培养基继续培养以维持其耐药性; 实验时提前用含10%胎牛血清(使用活性炭吸附, 去除内源性类固醇)的无酚红DMEM培养基培养24 h后, 用此条件进行药物处理。
MTT法检测3-BrPA对MCF-7/TR耐药细胞活力的影响 将MCF-7/TR耐药细胞按照8×103个/孔接种于96孔板内, 培养24 h后给予药物3-BrPA (0、20、40、80、160、320和640 μmol·L-1)作用48 h, 另设阴性对照(control组), 每组5个复孔。每孔加入MTT 20 μL孵育4 h, 于酶标仪波长490 nm处测吸光度值, 重复3次, 将所得数据进行计算, 得出各浓度药物下的抑制率(inhibition rate, IR), IR/% = [(OD对照组-OD3-溴丙酮酸组)/OD对照组]×100%。选用抑制率≤15%的3-BrPA浓度为无毒逆转剂量进行后续实验。
MTT法检测3-BrPA对MCF-7/TR耐药的逆转作用 将MCF-7/TR耐药细胞接种于96孔板内(8×103个/孔), 培养24 h后给予药物4-OHT (0、5、10、20、40和80 μmol·L-1)或3-BrPA (40 μmol·L-1)+ 4-OHT (0、5、10、20、40和80 μmol·L-1)作用48 h, 另设阴性对照(control组), 每组5个复孔。每孔加入MTT 20 μL孵育4 h, 于酶标仪波长490 nm处测吸光度值, 分别计算4-OHT和4-OHT联用3-BrPA的IC50, 并计算逆转耐药倍数(RF) =4-OHT组IC50/4-OHT联合3-BrPA组IC50。
Western blot法检测蛋白表达 将MCF-7/TR细胞接种于六孔板内, 培养24 h后按照实验分组(MCF-7、MCF-7+4-OHT、MCF-7/TR、MCF-7/TR+4-OHT、MCF-7/TR+3-BrPA和MCF-7/TR+3-BrPA+4-OHT)给药, 其中4-OHT浓度为1 μmol·L-1, 3-BrPA浓度为40 μmol·L-1。给药48 h后, 向六孔板内加入预先配置的细胞裂解液(RIPA:PMSF=99:1)裂解细胞, 提取各给药组细胞总蛋白离心, 收集上清液并进行BCA蛋白含量检测。按照40 μg共20 μL上样各组蛋白进行凝胶电泳, 采用湿转法转膜后用2% BSA封闭90 min。封闭完成后按照抗体说明书稀释一抗并孵育过夜, 次日用1×TBST洗涤, 再加入二抗(1:10 000)室温孵育90 min, 避光加入化学发光液, 采用自动凝胶成像系统(Bio-Rad)获取图像, 并使用Image Lab分析软件计算蛋白印迹结果的灰度值。
乳酸检测试剂盒检测乳酸含量 按照试剂盒说明书制作标准曲线, 将MCF-7/TR细胞接种于六孔板内, 培养24 h后按照实验分组(MCF-7、MCF-7+4-OHT、MCF-7/TR、MCF-7/TR+4-OHT、MCF-7/TR+3-BrPA和MCF-7/TR+3-BrPA+4-OHT)给药48 h后收集各组细胞, 计数。按照每组1×106个收集细胞离心, 弃上清后加入Lactate Assay Buffer 150 μL并置于-80 ℃反复冻融3次, 每次15 min。4 ℃离心, 收集上清, 加入高氯酸与氢氧化钾调pH值至6.5~8, 再次离心, 收集上清作为乳酸测定样品。按照每50 μL中含有46 μL Lactate Assay Buffer、2 μL Enzyme Mix以及2 μL探针的比例配置混合液, 将混合液加入样品中室温避光孵育30 min后, 于570 nm处测定吸光度值。
统计学处理 采用SPSS 19.0对重复3次的实验数据进行处理和分析, 采用t检验进行两样本之间比较, 釆用单因素方差分析进行多组间比较, 实验结果以均值±标准差表示, P < 0.05表示差异具有统计学意义。
结果 1 3-BrPA逆转耐药浓度的确定MTT实验结果显示, 3-BrPA (20~640 μmol·L-1)呈浓度依赖性抑制MCF-7/TR耐药细胞的活力。3-BrPA浓度低于80 μmol·L-1对MCF-7/TR细胞的抑制率较低(图 1A)。随后, 本研究进一步给予20、40、60、80、100和120 μmol·L-1 3-BrPA处理MCF-7/TR细胞48 h, 于显微镜下观察各组细胞形态(图 1B)。结果显示, 40 μmol·L-1的3-BrPA对MCF-7/TR耐药细胞活力的抑制率为14.18% ± 1.03%, 小于15%, 且该浓度对细胞形态无明显影响, 因此选择其为逆转耐药浓度进行后续实验。
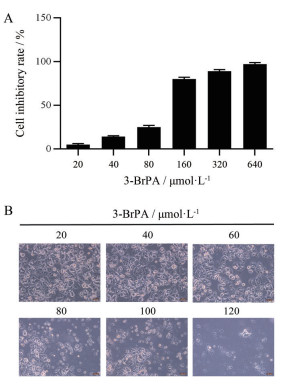
|
Figure 1 The inhibitory effect of 3-bromopyruvic acid (3-BrPA) on the viability of MCF-7/TR cells. A: The inhibitory effects of 20, 40, 80, 160, 320, 640 μmol·L-1 3-BrPA on MCF-7/TR cells were detected by MTT assay. B: The effects of 20, 40, 60, 80, 100, 120 μmol·L-1 3-BrPA on the morphology of MCF-7/TR cells were observed by microscope (×100), scale bar = 100 μm. n = 3, x ± s |
结果显示, 4-OHT单独作用MCF-7/TR耐药细胞的IC50为(33.30 ± 0.23) μmol·L-1, 4-OHT联用3-BrPA (40 μmol·L-1)作用MCF-7/TR耐药细胞的IC50为(17.39 ± 0.22) μmol·L-1, RF为1.91倍(图 2)。3-BrPA与4-OHT联合使用, 可显著增强MCF-7/TR耐药细胞对他莫昔芬的敏感性。
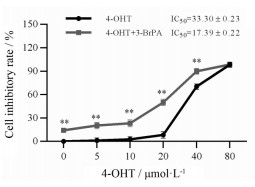
|
Figure 2 The effect of 3-BrPA on the sensitivity of MCF-7/TR cells to 4-hydroxy tamoxifen (4-OHT). n = 3, x ± s. **P < 0.01 vs 4-OHT treated group |
乳酸检测结果显示, MCF-7/TR耐药细胞的乳酸水平显著高于MCF-7细胞; 给予1 μmol·L-1 4-OHT作用后, MCF-7/TR耐药细胞中乳酸含量增加, 给予40 μmol·L-1 3-BrPA, MCF-7/TR耐药细胞中乳酸含量降低, 1 μmol·L-1 4-OHT联用40 μmol·L-1 3-BrPA后MCF-7/TR耐药细胞中乳酸含量与单用4-OHT组或对照组相比显著减少(图 3)。
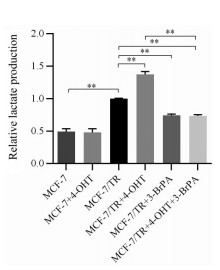
|
Figure 3 The lactate production in MCF-7 and MCF-7/TR cells. n = 3, x ± s. **P < 0.01 |
Western blot结果显示, 与MCF-7细胞相比, MCF-7/TR耐药细胞中GLUT1、HK2、LDHA蛋白呈现高表达; 给予1 μmol·L-1 4-OHT作用后, MCF-7细胞中蛋白表达无明显变化, 而MCF-7/TR耐药细胞中蛋白表达显著增加; 3-BrPA可降低MCF-7/TR耐药细胞中GLUT1、HK2和LDHA的表达; 与单用4-OHT组或对照组相比, 4-OHT联用3-BrPA后GLUT1、HK2和LDHA蛋白的表达显著减少(P < 0.01) (图 4)。表明3-BrPA可通过抑制糖酵解从而增加MCF-7/TR耐药细胞对他莫昔芬的敏感性。

|
Figure 4 The expression of glucose transporter 1 (GLUT1), hexokinase 2 (HK2), lactate dehydrogenase A (LDHA) in MCF-7 and MCF-7/TR cells. n = 3, x ± s. *P < 0.05, **P < 0.01 |
长期以来, 基于他莫昔芬的辅助内分泌治疗一直是临床治疗ER阳性乳腺癌的主要方案[16]。然而, 在治疗乳腺癌的过程中, 获得性耐药问题严重限制了他莫昔芬的临床应用, 成为ER阳性乳腺癌治疗的难点问题。因此, 亟需寻找攻克他莫昔芬耐药的治疗策略, 提高耐药患者的治疗效果和生存率。
有氧糖酵解水平在肿瘤细胞中升高与癌症进展和治疗抵抗有关[17, 18], 通过靶向抑制有氧糖酵解可增加耐药细胞对化疗的敏感性, 提高化疗药物的杀伤作用[19]。靶向糖酵解的抑制剂有氧化硫胺、3-BrPA和伊马替尼等[20]。其中, 3-BrPA作为抑制糖酵解关键限速酶的选择性抑制剂, 在体内外研究中都表现出良好的抗肿瘤活性, 而对正常的细胞和组织几乎没有毒性[21], 且其与顺铂、多柔比星、柔红霉素和5-氟尿嘧啶等化疗药物联用也已被证实可提高耐药细胞的化疗敏感性[22]。因此, 本研究选用3-BrPA作用乳腺癌他莫昔芬耐药细胞MCF-7/TR, 考察其是否具有增敏他莫昔芬的作用。结果显示, 选用无毒剂量的3-BrPA联用4-OHT可显著增强4-OHT对耐药细胞活力的抑制作用, 其逆转耐药倍数为1.91倍。研究发现, 有氧糖酵解水平升高的耐药细胞将大量葡萄糖分解的丙酮酸转化为乳酸[23], 乳酸排出细胞外产生的酸性微环境使癌细胞对化疗药物敏感性降低[24]。因此, 本研究检测了MCF-7和MCF-7/TR耐药细胞的乳酸水平以及他莫昔芬联用3-BrPA对MCF-7/TR耐药细胞中有氧糖酵解代谢主产物乳酸水平的影响。结果显示, MCF-7/TR耐药细胞的乳酸水平显著高于MCF-7细胞; 单用4-OHT增加了MCF-7/TR耐药细胞乳酸的产生, 给予3-BrPA可显著减少MCF-7/TR耐药细胞的乳酸含量, 两者联用与单用4-OHT组或对照组相比乳酸含量显著减少, 该结果提示3-BrPA增敏机制可能与抑制有氧糖酵解有关。
GLUT1、HK2和LDHA是糖酵解途径的关键酶, GLUT1为最早发现的葡萄糖转运蛋白, 其位于细胞膜上, 将大量葡萄糖转运到细胞内促进有氧糖酵解[25]; HK2是糖酵解的第一限速酶, 可催化葡萄糖磷酸化, 对于维持肿瘤细胞高效率糖酵解, 促进细胞增殖具有重要作用[26]; 而LDHA是糖酵解中的主要同工酶, 其将丙酮酸代谢为乳酸改变肿瘤细胞微环境从而促进肿瘤细胞生长和浸润[27]。为了进一步证实3-BrPA的增敏作用与抑制有氧糖酵解有关, 本研究检测了他莫昔芬联用3-BrPA对GLUT1、HK2和LDHA蛋白表达的影响。免疫印迹结果显示, 与MCF-7细胞相比, MCF-7/TR耐药细胞中有氧糖酵解相关蛋白GLUT1、HK2和LDHA呈现高表达, 且给予4-OHT后GLUT1、HK2和LDHA进一步增加, 这一结果可能与获得性耐药的乳腺肿瘤可利用他莫昔芬来刺激其生长有关[28], 单用3-BrPA可显著减少上述蛋白的表达; 与单用4-OHT或对照组相比, 二者联用可显著降低MCF-7/TR细胞中GLUT1、HK2和LDHA蛋白的表达, 表明3-BrPA是通过抑制有氧糖酵解增强MCF-7/TR对他莫昔芬的敏感性。
综上所述, 本研究表明, 3-BrPA可通过抑制有氧糖酵解水平增强乳腺癌他莫昔芬耐药细胞对他莫昔芬的敏感性, 3-BrPA有望作为耐药增敏剂应用于乳腺癌他莫昔芬耐药患者的治疗。
作者贡献:张璟钰负责进行实验及论文撰写工作; 陈宗跃给出实验修改建议; 刘婷婷和张敏琴负责数据分析; 酆啸和邹宇驰负责论文初稿修改; 沈祥春和陈妍负责指导实验与论文最终版本修订
利益冲突:所有作者声明不存在利益冲突
| [1] |
Hsu YL, Chen CY, Hou MF, et al. 6-Dehydrogingerdione, an active constituent of dietary ginger, induces cell cycle arrest and apoptosis through reactive oxygen species/c-Jun N-terminal kinase pathways in human breast cancer cells[J]. Mol Nutr Food Res, 2010, 54: 1307-1317. |
| [2] |
Lumachi F, Brunello A, Maruzzo M, et al. Treatment of estrogen receptor-positive breast cancer[J]. Curr Med Chem, 2013, 20: 596-604. |
| [3] |
Yang X, Zheng SR. Progress in clinical research of selective estrogen receptormodulator raloxifene[J]. Chin J Obstet Gynecol (中华妇产科杂志), 2003, 38: 254-256. |
| [4] |
Day CM, Hickey SM, Song YM, et al. Novel tamoxifen nanoformulations for improving breast cancer treatment:old wine in new bottles[J]. Molecules, 2020, 25: 1182. |
| [5] |
Xiong W, Zhao JJ, Wang L, et al. Advances in the research of pharmacogenomics of tamoxifen[J]. Acta Pharm Sin (药学学报), 2016, 51: 1356-1367. |
| [6] |
Mills JN, Rutkovsky AC, Giordano A. Mechanisms of resistance in estrogen receptor positive breast cancer:overcoming resistance to tamoxifen/aromatase inhibitors[J]. Curr Opin Pharmacol, 2018, 41: 59-65. |
| [7] |
Ding YL, Wang HX, Yu TF. Tamoxifen clinical application:research advances[J]. J Int Pharm Res (国际药学研究杂志), 2016, 43: 275-279. |
| [8] |
Gupta S, Roy A, Dwarakanath BS. Metabolic cooperation and competition in the tumor microenvironment:implications for therapy[J]. Front Oncol, 2017, 7: 68. |
| [9] |
Shen YC, Ou DL, Hsu C, et al. Activating oxidative phosphorylation by a pyruvate dehydrogenase kinase inhibitor overcomes sorafenib resistance of hepatocellular carcinoma[J]. Br J Cancer, 2013, 108: 72-81. |
| [10] |
Bhattacharya B, Mohd Omar MF, Soong R. The Warburg effect and drug resistance[J]. Br J Pharmacol, 2016, 173: 970-979. |
| [11] |
Woo YM, Shin Y, Lee EJ, et al. Inhibition of aerobic glycolysis represses Akt/mTOR/HIF-1α axis and restores tamoxifen sensitivity in antiestrogen-resistant breast cancer cells[J]. PLoS One, 2015, 10: e0132285. |
| [12] |
Radde BN, Ivanova MM, Mai HX, et al. Nuclear respiratory factor-1 and bioenergetics in tamoxifen-resistant breast cancer cells[J]. Exp Cell Res, 2016, 347: 222-231. |
| [13] |
Morandi A, Indraccolo S. Linking metabolic reprogramming to therapy resistance in cancer[J]. Biochim Biophys Acta Rev Cancer, 2017, 1868: 1-6. |
| [14] |
Abdel-Wahab AF, Mahmoud W, Al-Harizy RM. Targeting glucose metabolism to suppress cancer progression:prospective of anti-glycolytic cancer therapy[J]. Pharmacol Res, 2019, 150: 104511. |
| [15] |
Lis P, Dyląg M, Niedźwiecka K, et al. The HK2 dependent "Warburg effect" and mitochondrial oxidative phosphorylation in cancer:targets for effective therapy with 3-bromopyruvate[J]. Molecules, 2016, 21: 1730. |
| [16] |
Briest S, Stearns V. Tamoxifen metabolism and its effect on endocrine treatment of breast cancer[J]. Clin Adv Hematol Oncol, 2009, 7: 185-192. |
| [17] |
Wang ZZ. Aerobic glycolysis in cancer development[J]. Cancer Res Prev Treat (肿瘤防治研究), 2011, 38: 228-233. |
| [18] |
Wang Y, Zhou F. Research progress on the relationship between tumor metabolic rearrangement and tumor resistance[J]. Drug Eval Res (药物评价研究), 2019, 42: 378-384. |
| [19] |
Ma L, Zong XY. Metabolic symbiosis in chemoresistance:refocusing the role of aerobic glycolysis[J]. Front Oncol, 2020, 10: 5. |
| [20] |
Pelicano H, Martin DS, Xu RH, et al. Glycolysis inhibition for anticancer treatment[J]. Oncogene, 2006, 25: 4633-4646. |
| [21] |
Azevedo-Silva J, Queirós O, Baltazar F, et al. The anticancer agent 3-bromopyruvate:a simple but powerful molecule taken from the lab to the bedside[J]. J Bioenerg Biomembr, 2016, 48: 349-362. |
| [22] |
Wu N, Deng YY, Xu J, et al. Research progress on the relationship between tumor metabolic rearrangement and tumor resistance[J]. West China J Pharm Sci (华西药学杂志), 2013, 28: 421-424. |
| [23] |
Lu JR, Tan M, Cai QS. The Warburg effect in tumor progression:mitochondrial oxidative metabolism as an anti-metastasis mechanism[J]. Cancer Lett, 2015, 356: 156-164. |
| [24] |
Xu L, Ji F. Recent progress in tumor acidic microenvironment and strategies against chemotherapy resistance[J]. Int J Dig Dis (国际消化病杂志), 2010, 30: 107-110. |
| [25] |
Li QL, Chen S, Zhao Y, et al. GLUT1 structure and gene expression regulation[J]. Chin Med Biotechnol (中国医药生物技术), 2018, 13: 63-68. |
| [26] |
Jiao JH, Wang P, Li JB, et al. Research progress on key enzymes of aerobic glycolysis in malignant tumors[J]. Transl Med J (转化医学杂志), 2013, 2: 361-365. |
| [27] |
Ippolito L, Morandi A, Giannoni E, et al. Lactate:a metabolic driver in the tumour landscape[J]. Trends Biochem Sci, 2019, 44: 153-166. |
| [28] |
Fan P, Craig JV. Acquired resistance to selective estrogen receptor modulators (SERMs) in clinical practice (tamoxifen & raloxifene) by selection pressure in breast cancer cell populations[J]. Steroids, 2014, 90: 44-52. |
 2020, Vol. 55
2020, Vol. 55


