2. 北京大学医学部药学院, 天然药物与仿生药物国家重点实验室, 北京 100191;
3. 广州大学化学化工学院, 广东 广州 510006
2. State Key Laboratory of Natural and Biomimetic Drugs, School of Pharmaceutical Sciences, Health Science Center, Peking University, Beijing 100191, China;
3. School of Chemistry and Chemical Engineering, Guangzhou University, Guangzhou 510006, China
胰腺癌是一种具有极高致死率的恶性肿瘤, 绝大多数患者在手术后仍会出现转移、复发, 且现有药物对患者生存期的延长十分有限[1, 2]。因此, 亟待寻找更多能够防止胰腺癌转移、复发和延长患者生存期的新药物。
肿瘤干细胞(cancer stem-like cell, CSC)是肿瘤中具有自我更新和分化潜能的细胞, 与肿瘤的转移、复发与耐药密切相关[3-5]。在胰腺癌中, CSC同样在肿瘤的发生发展中扮演重要角色[6, 7]。已有研究发现, 多巴胺受体(dopamine receptor, DR)的5个亚型(D1DR~D5DR)特异性表达于CSC表面, 而在人正常多能干细胞中无表达, 提示DR是可用于靶向CSC的重要靶点[8]。此后不少研究证明, 甲硫哒嗪、三氟拉嗪和舒必利等D2DR拮抗剂类抗精神病药物[9, 10]、D1DR激动剂如非诺多泮[11]、神经递质多巴胺等[12-14]均可抑制多种肿瘤中的CSC。然而, 抗精神病类药物会跨过血脑屏障[15], 非诺多泮、多巴胺等药物不能口服[16, 17], 一定程度上限制了其在肿瘤患者中的应用。基于此, 本实验室与广州大学陈国术教授团队合作, 合成了一系列可口服的小分子化合物如C2、C17等。前期研究发现, C2可以激动D1DR而抑制胰腺癌中的CSC比例、显著提升小分子酪氨酸激酶抑制剂舒尼替尼(sunitinib, SUN)的抗肿瘤药效, 显示了其用于胰腺癌治疗的潜力[18]。此外, C17 (结构如图 1A所示)也可降低乳腺癌中的CSC比例、上皮-间质转化通路进而抑制乳腺癌的肺转移[19], 但其在胰腺癌中的抗肿瘤作用仍有待探索。
因此, 本研究利用胰腺癌细胞SW1990和PANC-1进行了体内外实验, 探索C17能否通过D1DR抑制胰腺癌CSC、增强SUN的抗肿瘤药效, 为今后C17可能用于胰腺癌临床治疗奠定基础。
材料与方法细胞和试剂 胰腺癌细胞SW1990和PANC-1由北京大学肿瘤医院郝纯毅教授馈赠。C17由广州大学陈国术副教授合成(纯度 > 95%); 舒尼替尼碱(纯度 > 98%)、盐酸吉西他滨(gemcitabine, GEM, 纯度 > 98%) (中国大连美仑生物技术有限公司); RPMI-1640培养基、胰酶(北京中科迈晨科技有限公司); 青霉素-链霉素双抗(美国Gibco公司); 胎牛血清(德国PAN-Biotech公司); 三氯乙酸、磺酰罗丹明B (sulforhodamine B, SRB)、Tris碱、D1DR特异性拮抗剂SCH23390、Hoechst33342 (美国Sigma-Aldrich公司); 冰醋酸(北京化工厂); 甲醇(北京市通广精细化工公司); 结晶紫(西陇化工厂); 牛血清白蛋白(北京宝瑞杰科技有限公司); D1DR抗体、山羊抗兔二抗-FITC (美国Abcam公司); Anti-mouse CD133-PE、mouse-IgG2b-PE抗体(德国Miltenyi Biotec公司); ALDEFLUOR试剂盒(加拿大Stemcell Technolgoies公司)。
仪器 HF90型二氧化碳培养箱(上海力申科学仪器有限公司); TY-CJ-2ND型超净工作台(北京亚泰科隆仪器技术有限公司); BDS200型生物倒置显微镜(重庆奥特光学仪器有限公司); YC-300L型4 ℃冰箱、DW-YL270型-20 ℃冰箱(中国中科美菱低温科技股份有限公司); MDF-U53V型-80 ℃冰箱(日本SANYO公司); 1-14K型冷冻离心机(美国Sigma公司); Model 680型酶标仪(美国Bio-Rad公司); L2-5k型台式低速离心机(湖南可成仪器设备有限公司); BT 25S型十万分之一电子天平(德国Sartorius公司); Leica Microsystems TCS-SP8 STED 3X激光共聚焦显微镜(德国Leica公司); FACSCalibur流式细胞仪(美国Becton Dickinson公司); MEK-6318K血项分析仪(日本光电公司)。
分子对接 由于在DR的5个亚型中, D1DR和D5DR的晶体结构尚未得到解析, 因此需要采用同源建模进行构建。对比5个DR亚型的全长蛋白序列后, 采用Schrodinger软件中的Prime组件构建D1DR、D5DR的三维起始模型并进行评价和优化。借助MUBD-DecoyMaker构建DR评价数据集MUBD-Dopamine, 依次经过配体处理器、初步过滤器、精细过滤器处理, 得到由21~30个最优分子构成的目标诱饵分子集, 上传至dude.docking.org形成诱饵分子, 以评价蛋白结构的可靠性。基于评价数据集、以对接为手段进行小规模虚拟筛选, 以评估配体富集能力。根据蛋白质数据库, 以D2DR作为D1DR的模板蛋白, 以D3DR作为D5DR的模板蛋白, 分别选择依替必利(图 1B)、利培酮(图 1C)作为D1DR、D5DR的模式分子, 构建蛋白-配体复合物模型。采用Schrodinger软件以标准精度进行对接。计算不同模型-打分函数组合基于受试者曲线的富集率以及整体富集率, 选择富集率最高的模型与C17进行对接, 分析对接结合模式以评价C17与各DR亚型的结合能力。

|
Figure 1 The molecular structure of C17 (A), eticlopride (B) and risperidone (C) |
免疫荧光考察C17对D1DR表达的影响 分别取处于对数生长期的SW1990和PANC-1细胞, 以每皿8×104个、1×105个的密度接种于15 mm直径的confocal小皿中培养12 h。用DMSO溶解C17、SCH23390, 制得如下分组含药培养基:空白对照(0.5% DMSO)、C17 (4 μmol·L-1)、SCH23390 (2 μmol·L-1)、C17+SCH23390 (4 μmol·L-1+2 μmol·L-1)。继续培养24 h后, 用4%多聚甲醛室温固定细胞20 min。用D1DR抗体(1:500)在4 ℃条件下孵育过夜, 之后加入FITC标记的二抗(1:1 000)在室温下孵育1 h。最后加入5 μg·mL-1 Hoechst33342染液染色30 min, 封片后在激光共聚焦显微镜下观察。
细胞毒实验 将处于对数生长期的SW1990和PANC-1细胞, 以6 000个/孔的密度分别接种于96孔板中。培养24 h后更换0、1、5、10、15、20、25、30、50、100 μmol·L-1 (SW1990), 0、2、4、8、10、12、15、20、30、40 μmol·L-1 (PANC-1)的含药培养基, 继续培养48 h。弃去含药培养基后, 使用10%三氯乙酸在4 ℃条件下固定1 h。用蒸馏水清洗后自然晾干, 加入0.4% SRB染液室温下染色30 min。用1%冰醋酸溶液清洗后自然晾干, 每孔加入10 mmol·L-1 Tris碱溶液200 μL震荡10 min。最后在酶标仪中读取540 nm波长下各孔的吸光度(OD)值。细胞生存率(%) = 100×OD给药组/OD空白对照组。用GraphPad软件计算IC50值。
克隆形成实验 将处于对数生长期的SW1990和PANC-1细胞分别以1 500个/孔的密度接种于6孔板中。培养24 h后, 加入终浓度为0、0.5、1、2 μmol·L-1 (SW1990), 0、1、2、4 μmol·L-1 (PANC-1)的含药培养基给药48 h。之后用不含药的培养基继续培养, 直至每个克隆团含有100~200个细胞。吸弃培养基, 加入甲醇室温固定10 min。弃去甲醇后用结晶紫溶液室温染色8 min。最后用蒸馏水洗净多余染液, 自然晾干后拍照。用ImageQuant TL 7.0软件对克隆团进行计数。相对克隆数目(%) = 100×给药组克隆数目/空白对照组克隆数目。
流式细胞术检测CSC比例 对于SW1990, 使用0、2、4、8 μmol·L-1 C17给药48 h后, 用PBS洗涤并计数, 调整细胞密度为1×106个/样。加入CD133-PE (1:500)或其同型抗体(1:110), 在冰上孵育10 min后用PBS终止, 洗涤3次, 过200目流式筛后用流式细胞仪检测, 并用Flowjo软件进行分析。对于PANC-1细胞, 使用0、2、4、8 μmol·L-1 C17给药48 h。制成细胞悬液后, 用台盼蓝排除死细胞, 随后用ALDEFLUOR®缓冲液调整细胞密度为每毫升1×106个。取每个细胞样品两份各0.05 mL, 分别标记为该样品的对照管和检测管。对照管中加入1.5 mmol·L-1二乙基氨基苯甲醛(DEAB) 5 μL。对照管、检测管中分别加入活化的ALDEFLUOR®底物2.5 μL并立即混匀, 37 ℃水浴孵育45 min。用ALDEFLUOR®缓冲液重悬细胞, 过200目流式筛后用流式细胞仪检测, 并用CELLQUEST软件进行分析。
C17预处理对SW1990细胞体内致瘤性的影响 5周龄雌性nu/nu裸鼠由北京维通利华实验动物技术有限公司提供[实验动物使用许可证编号SCXK (京)-2016-0041], 并饲养于独立通风笼盒。笼内温度控制为22~25 ℃, 湿度控制为50%~60%, 12 h光照/12 h黑暗交替, 自由饮水进食。所有实验操作均严格遵守北京大学生物医学伦理委员会相关规定。分别使用0、2、4、8 μmol·L-1 C17预处理SW1990细胞6天, 取出少量细胞用上述方法测定CSC比例。剩余每组细胞分别以3×106个/只的数量, 接种至同一只裸鼠皮下, 左上(0 μmol·L-1)、右上(2 μmol·L-1)、左下(4 μmol·L-1)、右下(8 μmol·L-1), n = 5。接种16天后, 处死裸鼠、解剖取得肿瘤, 称重并拍照。
C17SW1990在移植瘤中的药效及机制初探 将3×106个SW1990细胞接种至5周龄nu/nu裸鼠右腋下, 平均肿瘤体积达到50~100 mm3时, 将裸鼠随机分组:空白对照、C17 (20或50 mg·kg-1·d-1)、SUN (10或20 mg·kg-1·d-1)、GEM (10 mg·kg-1·3d-1)、C17 20 mg·kg-1·d-1+SUN 10 mg·kg-1·d-1、C17 50 mg·kg-1·d-1+SUN 10 mg·kg-1·d-1、SCH23390 (0.5 mg·kg-1·d-1)、C17 50 mg·kg-1·d-1+SCH23390 0.5 mg·kg-1·d-1。其中, C17和SUN采用灌胃给药, GEM采用静脉注射给药, SCH23390采用瘤内注射给药。从给药当天起, 每两天测量肿瘤长径与短径, 并对动物进行称重。肿瘤体积= 0.5×长径×短径2。用GraphPad软件绘制肿瘤体积-时间曲线和体重-时间曲线。
SW1990移植瘤中各给药方案的安全性研究 除监测动物体重外, 还采用血常规检查和脏器指数分别考察各给药方案的血液毒性和器官毒性。在实验结束当天, 通过眼眶取血得到20 μL血液并进行血常规分析。处死动物后取得心、肝、脾、肺、肾等主要器官并称重。脏器指数(%) = 100×器官重量/(裸鼠体重-肿瘤重量)。
统计学分析实验结果以平均值±标准差(x± s)形式表示, 两组数据间的统计学检验采用t检验, 多组数据间的统计学检验采用单因素方差分析(one-way analysis of variance, one-way ANOVA), 以*、**和***分别表示P < 0.05、P < 0.01和P < 0.001的显著性差异。
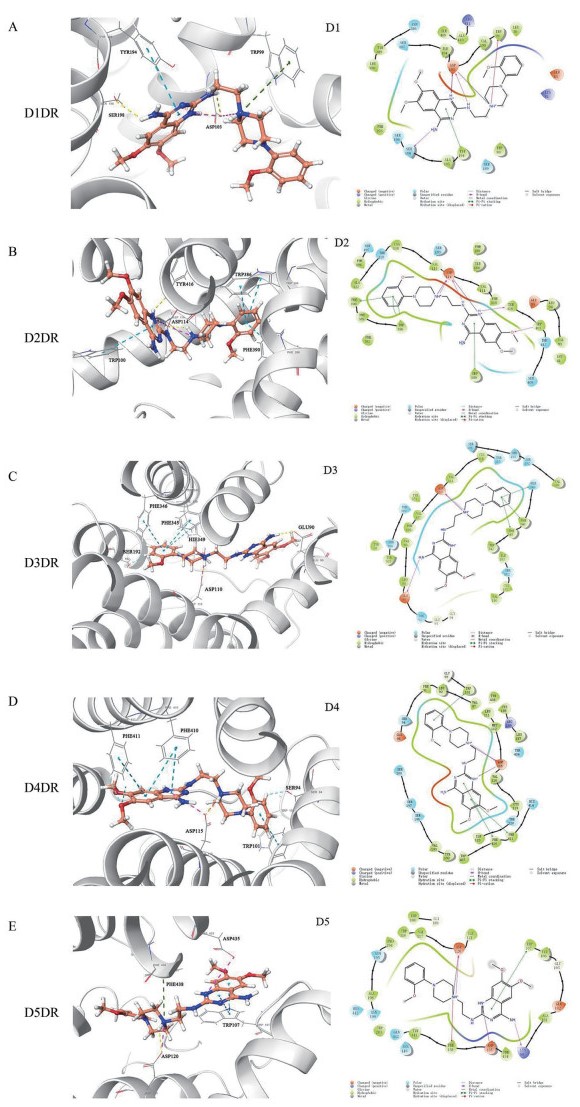
结果 1 C17与各DR亚型的结合能力选择富集率最高的D1DR~D5DR蛋白模型与C17进行对接, 并分析结合模式, 结果如图 2所示。C17的哌嗪、苯并嘧啶等结构与D1DR蛋白的103位天冬氨酸(aspartic acid, Asp)的结合作用更多、更稳定。在对评价数据集的标准精度对接中, 103位Asp显示出非常重要的作用, 大多数阳性分子均与该位点形成了较强的相互作用。C17两个六元氮杂环中的叔胺可形成铵盐, 也可与D1DR中103位的Asp形成较强的盐桥作用和氢键作用。此外, C17的嘧啶环可与D1DR中194位酪氨酸(tyrosine, Tyr)形成π-π堆积, 嘧啶环和哌嗪环之间的氨基还可与103位的Asp形成氢键作用。相比之下, C17与其他DR亚型的结合构象不存在此类特征。另外, D1DR的第416位为精氨酸(arginine, Arg), 其侧链取向面向结合口袋外侧, 因而位阻较小; 而D2DR~D4DR的416位为Tyr, 其朝向结合口袋内侧, 位阻极大。综上, 在5个DR亚型中, C17最有可能与D1DR结合。
|
Figure 2 C17 was most likely to bind to D1 dopamine receptor (D1DR). Interaction models between C17 and D1DR (A), D2DR (B), D3DR (C), D4DR (D), D5DR (E) |
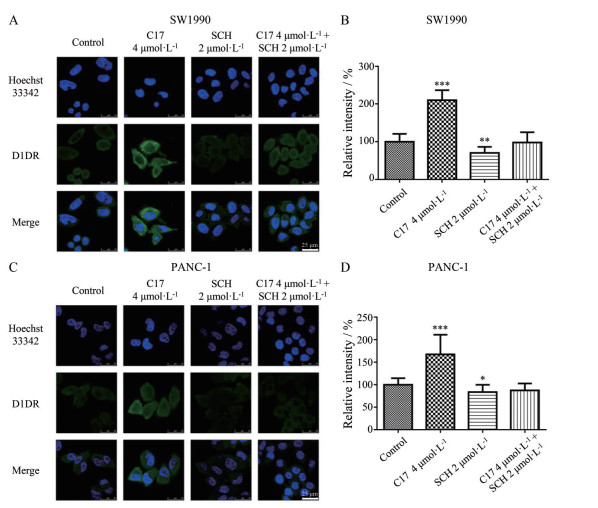
如图 3A和C所示, 在SW1990和PANC-1细胞中, 以绿色荧光标记D1DR, 以蓝色荧光标记细胞核。4 μmol·L-1 C17给药后绿色荧光显著增强, 2 μmol·L-1 SCH23390给药后绿色荧光略微变弱, 且两药联用时绿色荧光与空白对照组无显著差异。荧光强度定量结果分别如图 3B和D所示。上述结果显示, C17可以显著上调两种细胞中的D1DR表达, 且可被SCH23390逆转。
|
Figure 3 C17 could increase the expression of D1DR in SW1990 and PANC-1 cells, which was reversed by SCH23390 (SCH). Immunofluorescence analysis of D1DR expression in SW1990 and PANC-1 cells treated with 4 μmol·L-1 C17, 2 μmol·L-1 SCH23390 or their combination. The white scale bars represent 25 μm. n = 3, x ± s. *P < 0.05, **P < 0.01, ***P < 0.001 vs control |
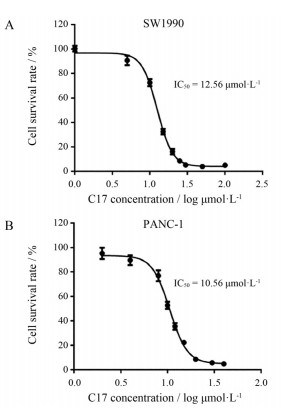
图 4A和B分别为不同浓度C17给药48 h后, SW1990和PANC-1细胞的存活率曲线。运用GraphPad软件拟合可得C17抑制SW1990和PANC-1细胞存活的IC50值分别为12.56和10.56 μmol·L-1, 提示C17对两种细胞有一定的细胞毒作用, 且作用强度相近。
|
Figure 4 The cell survival rate of SW1990 (A) and PANC-1 (B) cells incubated with a series of concentration levels of C17 for 48 h. n = 6, x ± s |
如图 5所示, 0.5、1和2 μmol·L-1 C17给药48 h后, SW1990细胞所形成的克隆团数目依次为对照组的78.10%、69.40%和35.03%, 而1、2和4 μmol·L-1 C17可分别使PANC-1细胞的克隆团数目下降为对照组的72.37%、72.67%和45.71%。此外, C17不仅可以抑制克隆团数目, 也可使克隆团直径显著减小。上述结果显示, C17可以剂量依赖性方式抑制两种细胞的克隆形成能力。

|
Figure 5 C17 could suppress the clone formation ability of SW1990 and PANC-1 cells. The representative photo of the clones formed by SW1990 (A) and PANC-1 cells (C), and corresponding quantification results (B, D). n = 3, x ± s. *P < 0.05, **P < 0.01, ***P < 0.001 vs control |
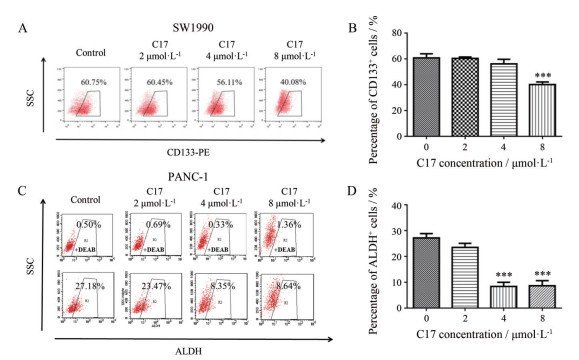
分别采用CD133和ALDH标记SW1990和PANC-1细胞中的CSC。如图 6A和B所示, 与空白对照组相比, 虽然在2、4 μmol·L-1 C17给药48 h后, SW1990细胞中CD133+的CSC比例略有下降, 无统计学显著性差异。但8 μmol·L-1 C17则可显著抑制CSC。在PANC-1细胞中, 4、8 μmol·L-1 C17给药后CSC比例由26.68%分别降至8.02%、7.28% (图 6C和D)。上述结果提示, C17可显著抑制两种细胞中的CSC比例, 且基本呈现剂量依赖性。
|
Figure 6 C17 could inhibit the CD133+ CSC frequency in SW1990 cells and ALDH+ CSC frequency in PANC-1 cells incubated with 0, 2, 4 or 8 μmol·L-1 C17 for 48 h. A, C: The flow cytometry results; B, D: The quantification results of CSC frequency. n = 3, x ± s. ***P < 0.001 vs control |
用0、2、4、8 μmol·L-1 C17处理SW1990细胞6天后, 测定CD133+的CSC比例, 结果如图 7A所示。与空白对照组相比, 2 μmol·L-1组的CSC比例略有下降, 为63.49%。而4和8 μmol·L-1组的CSC比例分别下降至47.69%和22.79%。上述结果表明, C17给药6天也可剂量依赖性地抑制SW1990细胞中的CSC比例。
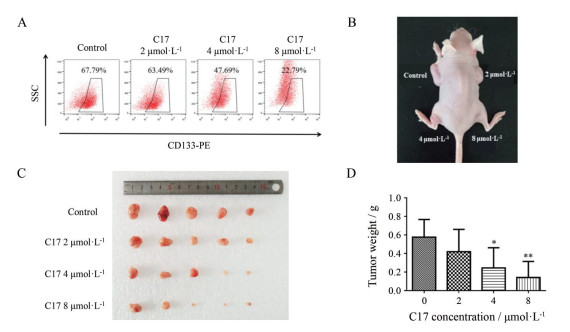
|
Figure 7 C17 pre-treatment could inhibit the tumorigenesis ability of SW1990 cells in vivo. A: The CD133+ CSC frequency in SW1990 cells treated with 0, 2, 4 or 8 μmol·L-1 for 6 days; B: The photo of SW1990 tumor-bearing mice after 16 days; C: The photo of tumor tissues gained from SW1990 tumor-bearing mice after 16 days; D: The tumor weights of different concentration groups. n = 5, x ± s. *P < 0.05, **P < 0.01 vs control |
将这些预处理细胞分别以相同数目(3×106个)同时接种至裸鼠的4个部位。16天后的成瘤情况如图 7B所示。解剖取得肿瘤拍照可见肿瘤体积随C17浓度增大而减小(图 7C)。由称重结果可知, 空白对照组的平均瘤重为0.58 g, 而2、4和8 μmol·L-1处理组的平均瘤重分别为0.42、0.24和0.14 g (图 7D)。上述结果显示, C17可以通过抑制SW1990细胞中的CSC比例而显著抑制SW1990细胞的体内致瘤性, 且呈现剂量依赖性。
7 C17在SW1990移植瘤模型中的药效及机制初探采用SW1990细胞在nu/nu裸鼠中构建异种移植瘤模型, 考察各给药方案对肿瘤体积的抑制作用, 并使用D1DR特异性拮抗剂SCH23390进一步确认C17的作用机制。肿瘤生长曲线及最后一天取得肿瘤组织的拍照结果分别如图 8A和B所示。20 mg·kg-1 C17可使肿瘤体积略有减小, 而50 mg·kg-1 C17则可明显抑制肿瘤体积, 但C17单药的抑制作用有限。
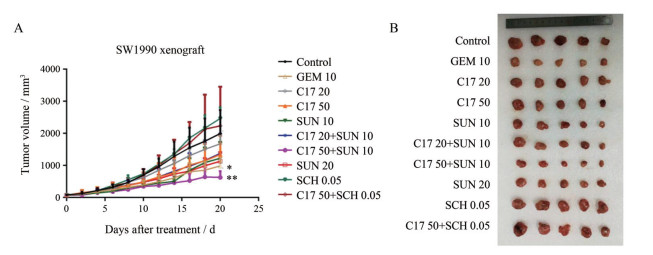
|
Figure 8 The anti-tumor efficacy and primary mechanism study of C17 monotherapy and in combination with SUN in SW1990 xenograft. A: The tumor volume-time curves of all groups; B: The photo of tumor tissues gained from tumor-bearing mice after 20 days. n = 5, x ± s. *P < 0.05, **P < 0.01 vs control. GEM: Gemcitabine; SUN: Sunitinib |
本课题组前期研究发现, 在耐药性乳腺癌和非小细胞肺癌(non-small cell lung cancer, NSCLC)中, 多巴胺(dopamine, DA)可通过激动D1DR抑制CSC, 进而显著提升SUN、阿昔替尼(axitinib, AX)等抗血管生成药物的抗肿瘤药效[12-14], 且同系列化合物也可增强SUN在胰腺癌中的药效[18]。基于此, 本研究也将C17与SUN联用。结果显示, 尽管20 mg·kg-1 C17未显著增强10 mg·kg-1 SUN的药效, 但50 mg·kg-1 C17与10 mg·kg-1 SUN联用时肿瘤体积显著减小, 明显优于10、20 mg·kg-1 SUN组, 且略优于阳性对照药物GEM。
此外, 0.05 mg·kg-1 SCH23390可略微促进肿瘤生长, 但与50 mg·kg-1 C17联用时, C17的肿瘤抑制作用被逆转, 表明C17抑制SW1990肿瘤生长的作用与激动D1DR相关。
8 SW1990移植瘤中各给药方案的安全性研究考察了SW1990移植瘤模型中各给药方案下的体重、血常规检查及主要器官的脏器指数, 从全身、血液及器官3个方面评估各给药方案的安全性。由补充图 1可知, 给药期间各组裸鼠的体重均稳定在20 g左右, 表明各方案的全身安全性良好。而血常规结果显示, 给药组的各项血液指标与空白对照组均无明显差异, 提示血液安全性良好(补充图 2)。给药组的器官指数也与空白对照组无明显差异, 提示各方案无明显器官毒性(补充图 3)。综上, 在SW1990移植瘤模型中, 各给药方案安全性良好。
讨论CSC是肿瘤细胞中一群具有自我更新和分化能力的细胞, 既可自我复制形成与自身相似的子代细胞, 又可分化为普通肿瘤细胞以保持肿瘤的增殖状态[20]。尽管化疗药物可以杀伤普通肿瘤细胞、减小肿瘤负荷, 但CSC通过外排药物、抗凋亡、修复损伤等机制[21], 使得放、化疗等治疗方式无法根除CSC, 往往造成肿瘤的发生发展、耐药、复发与转移[3]。当前, 治愈胰腺癌的唯一手段是手术切除, 但是大部分患者在手术后仍会出现复发和转移[2]。此外, 目前可用于胰腺癌治疗的药物如GEM、氟尿嘧啶和奥沙利铂等均无法显著延长患者生存期[1], 且常常会产生耐药[22, 23]。因此, 寻找可以抑制CSC的药物有望改善胰腺癌患者对药物的响应、延长患者的生存期。
DR是一类G-蛋白偶联受体, 特异性表达在CSC表面, 是一类可用于抑制CSC而不影响人体正常干细胞的潜在靶点[8]。DR共有5个亚型, 其中激动D1DR和D5DR可使细胞内环磷酸腺苷(cyclic adenosine monophosphate, cAMP)增加, 激动D2DR、D3DR和D4DR使得cAMP减少。因此, D1DR、D5DR统称D1样DR, D2DR、D3DR和D4DR为D2样DR, 激动D1样受体与拮抗D2样受体效果相似[24]。课题组前期研究发现, DA可以激动D1DR而提高细胞内cAMP水平, 进而抑制耐药性乳腺癌、NSCLC中的CSC[12-14]。此外, 还发现D1DR激动剂非诺多泮[11]、D2DR拮抗剂舒必利[10]等也具有抑制CSC的效果。此外, C2、C17等可口服的小分子化合物分别初步显示了抑制胰腺癌、转移性乳腺癌中CSC的功能, 并分别起到增效SUN或抑制乳腺癌肺转移的作用[18, 19]。这提示它们今后有望作为抗CSC药物用于多种肿瘤治疗的临床实践之中。值得一提的是, 尽管C2和C17可以部分通过激动D1DR而抑制CSC[18, 19], 然而研究表明, 它们也具有一定的拮抗肾上腺素能受体的作用[25], 但该受体与CSC的关系鲜有报道。因此, C2和C17抑制CSC的其他机制仍有待探寻。
本研究首先通过分子对接确认了在所有DR亚型中, C17最有可能的作用靶点为D1DR, 随后通过一系列体内外实验考查其抗胰腺癌活性。实验结果显示, C17可以抑制SW1990和PANC-1的克隆形成能力、CSC比例及SW1990细胞的体内致瘤性, 这些体外结果与C2效果相似[18]。其中, 克隆形成实验反映了单个细胞在体外分裂而形成克隆团的能力, 既可评价细胞的体外成瘤性, 也可部分反映CSC自我复制和分化的特性[26, 27]。本研究以C17在两种细胞中的IC50值为依据, 选择几乎无细胞毒作用的浓度进行实验, 结果显示C17对SW1990和PANC-1细胞的克隆形成能力均有显著抑制作用, 与C17抑制CSC的功能相吻合。类似地, 在C17预处理接种实验中, 随着C17浓度的升高, SW1990细胞中的CSC比例下降, 相同细胞数目接种后所形成的肿瘤体积也更小, 说明CSC的数量是肿瘤形成的关键因素之一。
目前有多种表面标志物可以标记胰腺癌的CSC亚群, 包括CD133、ALDH、CD44、CD24、EpCAM等[28]。本研究选用CD133表征SW1990细胞中的CSC, 结果显示SW1990中的CSC比例与文献报道相近[29, 30]。而对于PANC-1细胞, 却鲜有以CD133标记其中CSC的文献报道。本研究也曾尝试采用CD133标记PANC-1细胞中的CSC, 但结果显示CD133阳性的细胞比例很低。因此, 本研究最终选用ALDH标记PANC-1中的CSC, 以考察C17对PANC-1细胞中CSC的作用。悬浮培养法也是筛选肿瘤细胞中CSC亚群的重要方法[11]。课题组此前发现, 悬浮培养的4T1细胞中CSC表面标记物的含量显著上升, 且D1DR特异性激动剂非诺多泮可以显著抑制悬浮培养法所筛选出的CSC[11]。由于C17也具有激动D1DR而抑制CSC的潜能, 因此今后有必要进一步考察C17对悬浮培养CSC的作用。此外, 胰腺癌的浸润和转移也是亟待解决的临床问题。课题组曾发现C17可以抑制转移性乳腺癌4T1移植瘤中CSC以及与肿瘤转移密切相关的上皮-间质转化通路[19]。当前的研究初步确认了C17对胰腺癌CSC的抑制作用, 可能也具有抑制胰腺癌浸润和转移的潜能, 但仍需进一步考察C17对肿瘤转移相关蛋白的影响。
SUN、AX等药物虽可抑制血管内皮生长因子受体(vascular endothelial growth factor receptor, VEGFR)而起到抑制肿瘤生长、减小肿瘤负荷的作用, 是包括胰腺癌在内多种肿瘤的潜在治疗靶点[31, 32]。但肿瘤血管密度降低的同时会造成瘤内缺氧, 进而使肿瘤内CSC增加, 一定程度上削弱了其抗肿瘤药效[33]。因此, 本研究将C17与SUN联用, 以期在减小肿瘤负荷的同时抑制CSC, 增强SUN的药效并防止肿瘤的复发。此前课题组的研究也显示了此类联用方案的优越性[10, 12-14, 18]。本研究显示, 50 mg·kg-1 C17与10 mg·kg-1 SUN联用对肿瘤生长的抑制作用不仅显著优于10 mg·kg-1和20 mg·kg-1 SUN, 也稍强于阳性对照药GEM, 且未见明显血液、器官毒性, 实验期间动物的生存状态良好。而GEM是传统的细胞毒类化疗药, 临床上常见厌食、中性粒细胞减少、白细胞降低等不良反应[34]。因此, 当前药效和安全性结果提示C17+SUN的联合用药方案在胰腺癌治疗中具有潜在应用价值。
除C2之外, 课题组此前也发现, 尽管DA、非诺多泮和舒必利等DR激动剂/拮抗剂可以抑制多种肿瘤中的CSC比例而显著增强SUN、AX等抗癌药物的抗肿瘤药效, 但其单独使用时对肿瘤生长几乎无影响[10-14]。相比之下, 本研究发现C17单药即可在一定程度上抑制肿瘤体积, 提示C17除了通过激动D1DR抑制CSC外, 还具有其他潜在抗肿瘤机制。除cAMP以外, D1DR的信号通路还存在cAMP非依赖性的信号传导过程, 通过磷脂酶C (phospholipase C, PLC)调节下游的肌醇三磷酸酯(inositol triphosphate, IP3)和二脂酰甘油(diacylglycerol, DAG)等多种信号分子[35]。如激动D1DR可抑制细胞外调节激酶(extracellular regulated protein kinases, ERK)和磷脂酰肌醇激酶(phosphatidylinositol kinase, PI3K)-蛋白激酶B (protein kinase B)相关通路, 进而抑制骨肉瘤细胞的增殖[36]。另有研究报道, 激动D1DR也可通过环磷酸鸟苷(cyclic guanosine monophosphate, cGMP)-蛋白激酶G (protein kinase G, PKG)等途径诱导乳腺癌细胞凋亡[37]。因此, C17抑制SW1990肿瘤生长的其他信号通路还有待深入研究。
综上, 本研究显示C17作为一种可口服的小分子药物, 可以抑制胰腺癌细胞的克隆形成能力和体内致瘤性, 并可能与激动D1DR而抑制CSC相关。此外, C17也可增强SUN的抗肿瘤药效, 且该联用方案安全性良好。因此, C17具有用于胰腺癌治疗的潜力。
本文中补充图 1、补充图 2、补充图 3见网页:https://kns.cnki.net/kcms/detail/11.2163.R.20200602.1359.001.html
作者贡献:周田彦和陈国术设计实验;冯瑶瑶、薛钧升、焦佩丽和严晓雪进行实验;薛钧升、冯瑶瑶和焦佩丽进行数据分析;薛钧升进行文章撰写
利益冲突:本文作者之间无利益冲突
| [1] |
Gupta R, Amanam I, Chung V. Current and future therapies for advanced pancreatic cancer[J]. J Surg Oncol, 2017, 116: 25-34. DOI:10.1002/jso.24623 |
| [2] |
Kamisawa T, Wood LD, Itoi T, et al. Pancreatic cancer[J]. Lancet, 2016, 388: 73-85. DOI:10.1016/S0140-6736(16)00141-0 |
| [3] |
Adorno-Cruz V, Kibria G, Liu X, et al. Cancer stem cells:targeting the roots of cancer, seeds of metastasis, and sources of therapy resistance[J]. Cancer Res, 2015, 75: 924-929. DOI:10.1158/0008-5472.CAN-14-3225 |
| [4] |
Li M, Wu CF, Zhang JY, et al. Biological characteristics of drug induced tumor cells and its medicine prevention and treatment[J]. Acta Pharm Sin (药学学报), 2016, 51: 182-188. |
| [5] |
Ma HY, He M, Wei MJ. Research progress on targeting effect and regulating mechanisms of the stemness of cancer stem cells[J]. Acta Pharm Sin (药学学报), 2016, 51: 189-196. |
| [6] |
Hermann PC, Sainz B. Pancreatic cancer stem cells:a state or an entity?[J]. Semin Cancer Biol, 2018, 53: 223-231. |
| [7] |
Liu JB, Qi M, Li QQ, et al. The mechanism of cordycepin in inhibition of pancreatic cancer stem cells proliferation and metastasis[J]. Acta Pharm Sin (药学学报), 2017, 52: 1404-1409. |
| [8] |
Sachlos E, Risueno RM, Laronde S, et al. Identification of drugs including a dopamine receptor antagonist that selectively target cancer stem cells[J]. Cell, 2012, 149: 1284-1297. DOI:10.1016/j.cell.2012.03.049 |
| [9] |
Roney MSI, Park SK. Antipsychotic dopamine receptor antagonists, cancer, and cancer stem cells[J]. Arch Pharm Res, 2018, 41: 384-408. DOI:10.1007/s12272-018-1017-3 |
| [10] |
Li J, Yao QY, Xue JS, et al. Dopamine D2 receptor antagonist sulpiride enhances dexamethasone responses in the treatment of drug-resistant and metastatic breast cancer[J]. Acta Pharmacol Sin, 2017, 38: 1282-1296. DOI:10.1038/aps.2017.24 |
| [11] |
Yang L, Yao Y, Yong L, et al. Dopamine D1 receptor agonists inhibit lung metastasis of breast cancer reducing cancer stemness[J]. Eur J Pharmacol, 2019, 859: 172499. DOI:10.1016/j.ejphar.2019.172499 |
| [12] |
Hao FR, Wang SY, Zhu X, et al. Pharmacokinetic-pharmacodynamic modeling of the anti-tumor effect of sunitinib combined with dopamine in the human non-small cell lung cancer xenograft[J]. Pharm Res, 2017, 34: 408-418. DOI:10.1007/s11095-016-2071-5 |
| [13] |
Ma YH, Wang SY, Ren YP, et al. Antitumor effect of axitinib combined with dopamine and PK-PD modeling in the treatment of human breast cancer xenograft[J]. Acta Pharmacol Sin, 2019, 40: 243-256. DOI:10.1038/s41401-018-0006-x |
| [14] |
Wang SY, Mou ZZ, Ma YH, et al. Dopamine enhances the response of sunitinib in the treatment of drug-resistant breast cancer:involvement of eradicating cancer stem-like cells[J]. Biochem Pharmacol, 2015, 95: 98-109. DOI:10.1016/j.bcp.2015.03.013 |
| [15] |
Pollak TA, Drndarski S, Stone JM, et al. The blood-brain barrier in psychosis[J]. Lancet Psychiatry, 2018, 5: 79-92. DOI:10.1016/S2215-0366(17)30293-6 |
| [16] |
O'Hara JF, Mahboobi R, Novak SM, et al. Fenoldopam and renal function after partial nephrectomy in a solitary kidney:a randomized, blinded trial[J]. Urology, 2013, 81: 340-345. DOI:10.1016/j.urology.2012.09.041 |
| [17] |
Kostrzewa RM, Kostrzewa JP, Brown RW, et al. Dopamine receptor supersensitivity:development, mechanisms, presentation, and clinical applicability[J]. Neurotox Res, 2008, 14: 121-128. DOI:10.1007/BF03033804 |
| [18] |
Su H, Xue ZX, Feng YY, et al. N-Arylpiperazine-containing compound (C2):an enhancer of sunitinib in the treatment of pancreatic cancer, involving D1DR activation[J]. Toxicol Appl Pharmacol, 2019, 384: 114789. DOI:10.1016/j.taap.2019.114789 |
| [19] |
Feng YY, Jiao PL, Yan XX, et al. Compound C17 inhibits the lung metastasis of breast cancer[J]. J Chin Pharm Sci, 2019, 28: 716-727. DOI:10.5246/jcps.2019.10.068 |
| [20] |
Nassar D, Blanpain C. Cancer stem cells:basic concepts and therapeutic implications[J]. Annu Rev Pathol, 2016, 11: 47-76. DOI:10.1146/annurev-pathol-012615-044438 |
| [21] |
Zhao J. Cancer stem cells and chemoresistance:the smartest survives the raid[J]. Pharmacol Ther, 2016, 160: 145-158. DOI:10.1016/j.pharmthera.2016.02.008 |
| [22] |
Smigiel JM, Parameswaran N, Jackson MW. Potent EMT and CSC phenotypes are induced by oncostatin-M in pancreatic cancer[J]. Mol Cancer Res, 2017, 15: 478-488. DOI:10.1158/1541-7786.MCR-16-0337 |
| [23] |
Wang L, Dong P, Wang WG, et al. Gemcitabine treatment causes resistance and malignancy of pancreatic cancer stem-like cells via induction of lncRNA HOTAIR[J]. Exp Ther Med, 2017, 14: 4773-4780. |
| [24] |
Pivonello R, Ferone D, Lombardi G, et al. Novel insights in dopamine receptor physiology[J]. Eur J Endocrinol, 2007, 156: S13-S21. DOI:10.1530/eje.1.02353 |
| [25] |
Fang H, Li MY, Xia L. Pharmacophore-guided design, synthesis and evaluation of quinazoline-arylpiperazines as new α1-adrenoceptor antagonists[J]. Chin Chem Lett, 2007, 18: 41-44. DOI:10.1016/j.cclet.2006.11.022 |
| [26] |
Rahn S, Zimmermann V, Viol F, et al. Diabetes as risk factor for pancreatic cancer:hyperglycemia promotes epithelial-mesenchymal-transition and stem cell properties in pancreatic ductal epithelial cells[J]. Cancer Lett, 2018, 415: 129-150. DOI:10.1016/j.canlet.2017.12.004 |
| [27] |
Wu XB, Liu Y, Wang GH, et al. Mesenchymal stem cells promote colorectal cancer progression through AMPK/mTOR-mediated NF-kappaB activation[J]. Sci Rep, 2016, 6: 21420. DOI:10.1038/srep21420 |
| [28] |
Ishiwata T, Matsuda Y, Yoshimura H, et al. Pancreatic cancer stem cells:features and detection methods[J]. Pathol Oncol Res, 2018, 24: 797-805. DOI:10.1007/s12253-018-0420-x |
| [29] |
Chen C, Yu G, Xiao W, et al. Thalidomide inhibits proliferation and epithelial-mesenchymal transition by modulating CD133 expression in pancreatic cancer cells[J]. Oncol Lett, 2017, 14: 8206-8212. |
| [30] |
Huang J, Li C, Wang Y, et al. Cytokine-induced killer (CIK) cells bound with anti-CD3/anti-CD133 bispecific antibodies target CD133(high) cancer stem cells in vitro and in vivo[J]. Clin Immunol, 2013, 149: 156-168. DOI:10.1016/j.clim.2013.07.006 |
| [31] |
Lu Z, Weniger M, Jiang K, et al. Therapies targeting the tumor stroma and the VEGF/VEGFR axis in pancreatic ductal adenocarcinoma:a systematic review and meta-analysis[J]. Target Oncol, 2018, 13: 447-459. DOI:10.1007/s11523-018-0578-x |
| [32] |
Siveen KS, Prabhu K, Krishnankutty R, et al. Vascular endothelial growth factor (VEGF) signaling in tumour vascularization:potential and challenges[J]. Curr Vasc Pharmacol, 2017, 15: 339-351. |
| [33] |
Conley SJ, Gheordunescu E, Kakarala P, et al. Antiangiogenic agents increase breast cancer stem cells via the generation of tumor hypoxia[J]. Proc Natl Acad Sci U S A, 2012, 109: 2784-2789. DOI:10.1073/pnas.1018866109 |
| [34] |
Ikeda M, Takahashi H, Kondo S, et al. Phase 1b study of galunisertib in combination with gemcitabine in Japanese patients with metastatic or locally advanced pancreatic cancer[J]. Cancer Chemother Pharmacol, 2017, 79: 1169-1177. DOI:10.1007/s00280-017-3313-x |
| [35] |
Beaulieu JM, Espinoza S, Gainetdinov RR. Dopamine receptors-IUPHAR Review 13[J]. Br J Pharmacol, 2015, 172: 1-23. DOI:10.1111/bph.12906 |
| [36] |
Gao J, Zhang C, Gao F, et al. The effect and mechanism of dopamine D1 receptors on the proliferation of osteosarcoma cells[J]. Mol Cell Biochem, 2017, 430: 31-36. DOI:10.1007/s11010-017-2951-y |
| [37] |
Borcherding DC, Tong W, Hugo ER, et al. Expression and therapeutic targeting of dopamine receptor-1(D1R) in breast cancer[J]. Oncogene, 2016, 35: 3103-3113. DOI:10.1038/onc.2015.369 |
 2020, Vol. 55
2020, Vol. 55


