肾结石是泌尿系统疾病中发病率较高的一种疾病, 通过对肾结石成分的分析可知大约80%是草酸钙结石, 所以目前对肾结石的研究大部分以草酸钙结石为主[1]。一般认为, 肾结石形成的过程包括晶体的成核、生长、聚集和黏附等一系列的步骤, 结石形成后黏附在细胞上, 细胞损伤并引起后续一系列的氧化应激损伤和炎症反应等, 其中NLRP3炎症小体的激活在草酸钙肾结石形成过程中发挥着重要作用, 可激活caspase-1和HMGB1等炎症因子的释放和活化, 从而加重肾脏的损伤[2-4]。
广金钱草为豆科山蚂蝗属广金钱草Desmodium styracifolium (Osb.) merr.的干燥地上部分, 具有利湿退黄、利尿通淋的功效。现代药理研究表明, 广金钱草主要用于治疗肾结石和尿路结石等泌尿系统结石症, 研究显示广金钱草防治肾结石的药效成分主要是水提物及总黄酮部位, 其作用机制主要是抗氧化应激、抗炎、改变尿液中成石和抑石因素、减轻细胞损伤及调节肾结石相关蛋白的表达等[5-8]。
广金钱草在防治肾结石损伤具有显著疗效, 但其具体药效成分和作用机制尚未完全明确。作者前期利用UPLC-Q-TOF-MS/MS分析了广金钱草在大鼠体内的分布和代谢成分, 因此, 本研究从广金钱草体内成分中选择8个黄酮单体进行药效筛选。本研究旨在利用一水草酸钙(calcium oxalate monohydrate, COM)致人近端肾小管上皮细胞(human proximaltubular epithelial cell, HK-2)损伤模型, 通过MTT法初步筛选出广金钱草中对损伤细胞有保护作用的药效成分, 并测定其对细胞氧化应激指标乳酸脱氢酶(lactate dehydrogenase, LDH)、超氧化物歧化酶(superoxide dismutase, SOD)活力和细胞内活性氧(reactive oxygen species, ROS)的影响, 进一步评价其药效, 通过测定药效成分对NLRP3炎症小体相关蛋白(NLRP3、Caspase-1、HMGB1)的影响探讨其作用机制, 为广金钱草开发利用提供实验支持和理论依据。
材料与方法药品与试剂 HK-2 (ATCC公司); 广金钱草总黄酮(total flavonoids of Desmodium styracifolium, TFDS, 实验室自制); 夏佛塔苷、异夏佛塔苷、维采宁-2、异牡荆素、芹菜素、木犀草素、染料木素、异荭草苷(成都普菲德生物技术有限公司, 对照品纯度≧98%); BCA微量蛋白定量试剂盒(康维世纪生物有限公司); 超氧化物歧化酶测定试剂盒(南京建成生物工程研究所); 乳酸脱氢酶细胞毒性检测试剂盒、活性氧检测试剂盒(上海碧云天生物技术研究所); MTT噻唑蓝(赛默飞世尔科技公司); SDS-PAGE凝胶配制试剂盒、ECL化学发光超敏显色试剂盒(上海翊圣生物科技有限公司); 预染蛋白Marker (上海优宁维生物科技股份有限公司); Anti-NLRP3、Anti-GAPDH (Affinity公司); Anti-Caspase-1 (Proteintech公司); Anti-HMGB1 (Cell Signaling Technology公司)。
主要仪器 IncuCyte长时间动态活细胞成像系统(美国Essen BioScience公司); MultiskanTM GO全波长扫描多功能酶标仪(美国Thermo科技公司); Tanon 5200 CE全自动化学发光图像分析系统(上海天能科技有限公司)。
COM的制备 配制10 mol·L-1草酸钠溶液和10 mol·L-1氯化钙溶液, 将两者等体积充分混匀; 混合液于4 ℃环境中放置3天使之充分沉淀, 将上清液缓慢弃除, 剩下的混合液1 000 r·min-1离心15 min, 弃除上清; 反复用超纯水清洗沉淀物3次, 每次1 000 r·min-1离心15 min, 弃上清, 沉淀物于60 ℃烘箱内干燥, 于干燥阴凉处保存。
TFDS的制备及药液的配制 称取广金钱草, 用50%乙醇按液料比(30:1)浸泡30 min后, 回流提取2次, 每次1.5 h, 过滤得到提取液。提取液减压浓缩至无醇味后, 调节浓缩液到合适浓度, 采用DM-130大孔树脂联合聚酰胺进一步纯化, 得到纯度为75%以上的TFDS。TFDS加入空白培养基超声溶解, 用0.22 μm针式微孔滤膜过滤, 4 ℃冰箱保存, 使用时用空白培养基稀释到所需浓度。
待筛选化合物溶液的配制 所有待筛选的化合物均用DMSO溶解并加入空白培养基配制成1 000 μmol·L-1贮存液, 用0.22 μm针式微孔滤膜过滤, 4 ℃冰箱保存, 实验所需浓度用相应的空白培养液进行稀释, 最终DMSO含量≤0.01%。
MTT法检测细胞活力 将HK-2细胞接种于96孔板(6×103个/孔), 培养过夜待细胞贴壁后, 加入药物处理24 h后, 加入5 mg·mL-1 MTT溶液继续培养, 4 h后终止孵育, 吸去孔内MTT溶液, 每孔加入150 μL DMSO溶解结晶后, 在酶联免疫检测仪490 nm测量各孔的吸光度(OD)值。
不同成分对COM致HK-2损伤细胞活力的影响 将HK-2细胞接种于96孔板(6×103个/孔), 培养过夜待细胞贴壁后, 根据分组情况加入不同成分, 采用100 μg·mL-1 COM与HK-2共同培养24 h造模, 前期通过MTT法确定了各待测成分在HK-2细胞的安全浓度范围, 各成分安全浓度如下: TFDS (3 000 μg·mL-1); 夏佛塔苷、异夏佛塔苷、维采宁2、异牡荆苷、染料木素(10 μmol·L-1)、芹菜素、木犀草素(5 μmol·L-1); 异荭草苷(40 μmol·L-1)。分组情况如下:正常细胞对照组、模型组和不同成分给药组, 将待测成分用DMEM培养基稀释成5个梯度浓度, 其中TFDS (25、50、100、200、400 μg·mL-1); 夏佛塔苷、异夏佛塔苷、维采宁2、异牡荆苷、染料木素(0.625、1.25、2.5、5、10 μmol·L-1); 芹菜素、木犀草素(0.3125、0.625、1.25、2.5、5 μmol·L-1); 异荭草苷(2.5、5、10、20、40 μmol·L-1), 除正常细胞对照组外, 其他组加入终质量浓度为100 μg·mL-1 COM共同培养24 h, MTT法检测细胞活力。
细胞上清液LDH和细胞内SOD酶活力的测定 将HK-2细胞接种于6孔板(3×105个/孔), 每个给药组设置3个浓度, 分组情况如下: TFDS (50、100、200 μg·mL-1); 异荭草苷(10、20、40 μmol·L-1)、芹菜素(0.312 5、0.625、1.25 μmol·L-1)、木犀草素(1.25、2.5、5 μmol·L-1)、染料木素(2.5、5、10 μmol·L-1)。实验终点, 取各组上清液按试剂盒的要求检测LDH释放量, 取细胞裂解液按试剂盒的要求测定SOD酶活力。
ROS检测 将HK-2细胞接种于6孔板(3×105个/孔), 每个给药组设置3个浓度, 分组情况同“细胞上清液LDH和细胞内SOD酶活力的测定”。实验终点, 按试剂盒的要求加入DCFH-DA孵育20 min, 孵育完成后用磷酸盐缓冲液(PBS)清洗3次, 使用488 nm激发波长, 525 nm发射波长, 应用长时间动态成像仪检测荧光强度。
Western blot检测蛋白表达 将HK-2细胞接种于6孔板(3×105个/孔), 每个给药组设置2个浓度, 实验分组如下: TFDS (50、200 μg·mL-1); 异荭草苷(20、40 μmol·L-1)、芹菜素(0.625、1.25 μmol·L-1)、木犀草素(2.5、5 μmol·L-1)、染料木素(5、10 μmol·L-1)。按实验设计给药培养后, 弃去上清液, 加入蛋白裂解液置于冰上提取细胞总蛋白, 调整各组蛋白浓度, 加入上样缓冲液后沸水煮沸10 min使蛋白样品充分变性。取样进行SDS-PAGE电泳, 转膜结束后将膜放入5%脱脂牛奶中封闭, 封闭结束后洗膜, 将膜加入到相应的抗体孵育液中, 其中NLRP3 (1:1 000)、HMGB1 (1:1 000)、caspase-1 (1:500)和GAPDH (1:5 000), 4 ℃冰箱过夜, 加入二抗(1:5 000)孵育2 h。通过ECL显影液进行显影, Image J软件对蛋白条带进行灰度分析, 以目的条带与GAPDH条带的灰度比值作为目的蛋白的相对表达水平, 计算并比较各组灰度值。
数据分析 采用SPSS 22.0统计数据, 计量数据符合正态分布以及方差齐, 采用x ± s表示, 多组资料进行单因素方差分析检验, P < 0.05表示具有显著性差异。
结果 1 不同成分对COM损伤HK-2细胞活力的影响通过MTT法测定不同成分对COM损伤HK-2细胞活力的结果如图 1所示, 模型组较正常组细胞活力显著降低(P < 0.01), 说明100 μg·mL-1 COM可致HK-2细胞损伤。TFDS和异荭草苷、芹菜素、木犀草素、染料木素能显著提高COM损伤HK-2细胞活力(P < 0.01), 对受损细胞具有保护作用。在一定浓度范围内, 夏佛塔苷、异夏佛塔苷、维采宁2和异牡荆苷对COM损伤HK-2细胞的活力无显著性影响。
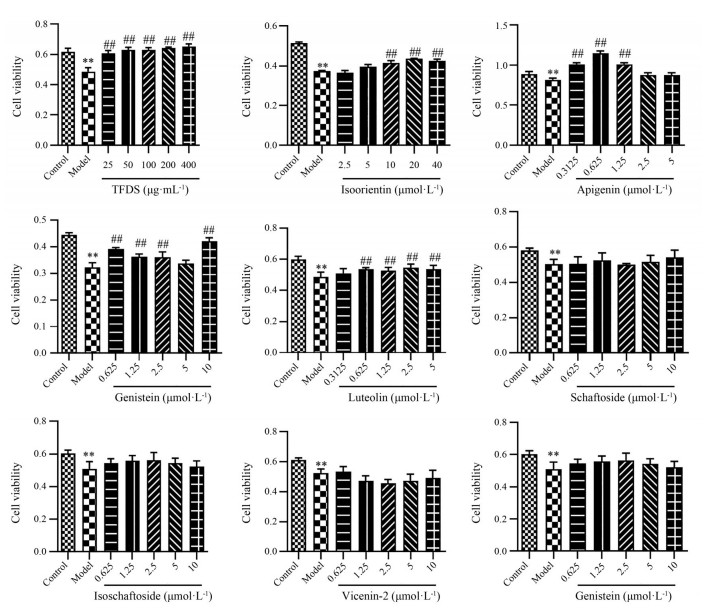
|
Figure 1 Effect of different components on the viability of COM-treated HK-2. COM: Calcium oxalate monohydrate; HK-2: Human proximal tubular epithelial cell; TFDS: Total flavonoids of Desmodium styracifolium. n = 5, x ± s. **P < 0.01 vs control group; ##P < 0.01 vs model group |
通过测定不同成分对COM损伤HK-2细胞氧化应激指标的影响, 结果见表 1, 由数据可知, 模型组上清液LDH泄漏量显著增加(P < 0.01)、细胞内SOD酶活力显著下降(P < 0.01);结合表 1和图 2, 模型组胞内ROS荧光强度显著高于正常对照组(P < 0.01)。结果表明, COM可致HK-2细胞的细胞膜受损, 造成细胞内氧化应激损伤, 细胞抗氧化能力降低。
| Table 1 Effects of indexes of oxidative stress of different components on COM-induced HK-2. LDH: Lactate dehydrogenase; SOD: Superoxide dismutase; ROS: Reactive oxygen species. n = 3, x ± s. **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs model group |

|
Figure 2 ROS fluorescence of different groups. A: Normal control group; B: Model group; C: TFDS group; D: Isoorientin group; E: Apigenin group; F: Luteolin group; G: Genistein group |
TFDS和4个黄酮单体干预后, COM致HK-2损伤细胞的LDH泄漏量及ROS水平显著减少(P < 0.01), 胞内的SOD酶活力均体现不同程度的上调(P < 0.05)。结果表明, TFDS和异荭草苷、芹菜素、木犀草素、染料木素可以通过保护细胞膜损伤及提高细胞抗氧化应激能力, 从而对细胞起到保护作用。
3 不同给药组NLRP3、HMGB1、caspase-1蛋白表达情况与正常对照组相比, COM造模后HK-2细胞NLRP3、caspase-1和HMGB1蛋白表达显著升高(P < 0.05);与模型组相比, TFDS和4个黄酮单体(异荭草苷、芹菜素、木犀草素、染料木素)干预后, NLRP3、caspase-1和HMGB1的蛋白表达水平均出现不同程度的下调作用(P < 0.05), 结果见图 3。

|
Figure 3 Expression of NLRP3, HMGB1, caspase-1 in different groups. A: Control group; B: Model group; C: Isoorientin (20 μmol·L-1); D: Isoorientin (40 μmol·L-1); E: Apigenin (0.625 μmol·L-1); F: Apigenin (1.25 μmol·L-1); G: Luteolin (2.5 μmol·L-1); H: Luteolin (5 μmol·L-1); I: Genistein (5 μmol·L-1); J: Genistein (10 μmol·L-1); K: TFDS (50 μg·mL-1); L: TFDS (200 μg·mL-1). n = 3, x ± s. **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs model group |
作者前期利用UPLC-Q-TOF-MS/MS分析了广金钱草在大鼠体内的分布和代谢成分, 研究结果显示广金钱草中可以被大鼠吸收和代谢的化合物有:维采宁-2、夏佛塔苷、异夏佛塔苷、异牡荆苷、芹菜素、木犀草素、染料木素、异荭草苷、香叶木素、柚皮素、大豆苷、橙皮苷、carlinoside和阿魏酸等。因此, 本研究选择TFDS及其8个黄酮单体进行药效筛选, 以体内成分为研究对象, 可有效地缩小筛选范围[9]。
目前中药品质评价的指标性成分往往与临床安全性和有效性关联不大, 因此基于生物活性成分的基础上选择质控指标, 可为中药的质量控制提供科学依据[10]。《中国药典》中广金钱草的质控成分为夏佛塔苷, 在后续有待将其体内成分新增到质量控制的研究中, 建立指标性成分与有效性的关联, 完善广金钱草的质量评价方法和标准。
炎症反应是泌尿系统结石重要的发病机制, 在实验动物模型或结石患者的肾脏内, 已经发现结石晶体的周围均存在炎性细胞浸润及炎症因子的分泌[11]。研究[5-8]表明, 广金钱草可减轻机体的炎症反应, 减少肾结石患者和肾结石大鼠体内炎性细胞的浸润, 以及调节骨桥蛋白(OPN)、单核细胞趋化蛋白1 (MCP-1)和转化生长因子-β (TGF-β)等炎症相关蛋白的表达, 但广金钱草发挥保护肾结石损伤与炎症的关系还有待进一步研究。其中NLRP3介导的炎症反应是肾结石的一种重要机制, 草酸钙晶体损伤细胞引起ROS的释放, 触发肾间质的NLRP3/ASC/caspase-1轴, 诱导细胞分泌HMGBl, HMGBl本身又能再次促进HMGBl的释放, 因此形成一个正反馈炎症通路, 维持及放大炎症反应[12]。因此, 本研究以NLRP3炎症小体活化通路为切入点, 探究广金钱草药效成分保护肾结石损伤的作用机制。结果显示, TFDS及异荭草苷、芹菜素、木犀草素、染料木素4种化合物可降低COM模型细胞中NLRP3、caspase-1和HMGB1的蛋白表达水平。
由本研究可知, TFDS及异荭草苷、芹菜素、木犀草素、染料木素4种化合物对COM模型细胞均表现出显著的保护作用, 包括提高模型细胞的细胞活力、抑制LDH释放、提高细胞SOD酶活力和减少胞内ROS的产生, 体现了中药“多成分、多靶点”的作用特点。其作用机制可能是通过调控NLRP3/caspase-1/HMGB1信号通路, 减少机体分泌的炎症因子, 减轻机体的炎症反应, 从而发挥保护作用。
作者贡献:李明慧提出研究思路, 设计实验、实施研究、采集和分析数据、起草文章; 王术玲提出研究思路, 设计实验, 指导研究工作; 曹骋提出研究思路, 设计实验, 指导研究工作; 陈丰连提出研究思路, 设计实验, 指导研究工作, 文章修订
利益冲突:作者声明本文不对任何方造成利益冲突
| [1] |
Deng YL, Ye ZQ, Li H. Clinical Diagnosis and Treatment of Urinary Stones (泌尿系结石临床诊断治疗学)[M]. Beijing: Beijing People's Medical Publishing House, 2009: 86.
|
| [2] |
Li CY, Wang Y, Deng YL. Research progress of the relationship between inflammatory responses and nephrolithiasis[J]. J Clin Urol (临床泌尿外科杂志), 2015, 30: 1150-1153. |
| [3] |
Knauf F, Asplin JR, Granja I, et al. NALP3-mediated inflammation is a principal cause of progressive renal failure in oxalate nephropathy[J]. Kidney Int, 2013, 84: 895-901. DOI:10.1038/ki.2013.207 |
| [4] |
Mulay SR, Kulkarni OP, Rupanagudi KV, et al. Calcium oxalate crystals induce renal inflammation by NLRP3-mediated IL-1β secretion[J]. J Clin Invest, 2013, 123: 236-246. DOI:10.1172/JCI63679 |
| [5] |
Zhou J, Jin J, Li X, et al. Total flavonoids of Desmodium styracifolium attenuates the formation of hydroxy-L-proline-induced calcium oxalate urolithiasis in rats[J]. Urolithiasis, 2018, 46: 231-241. DOI:10.1007/s00240-017-0985-y |
| [6] |
Hou J, Chen W, Lu H, et al. Exploring the therapeutic mechanism of Desmodium styracifolium on oxalate crystal-induced kidney injuries using comprehensive approaches based on proteomics and network pharmacology[J]. Front Pharmacol, 2018, 9: 620. DOI:10.3389/fphar.2018.00620 |
| [7] |
Mi J, Duan J, Zhang J, et al. Evaluation of antiurolithic effect and the possible mechanisms of Desmodium styracifolium and Pyrrosiae petiolosain[J]. Urol Res, 2012, 40: 151-161. DOI:10.1007/s00240-011-0401-y |
| [8] |
Xie H, Li J, Gao H, et al. Total flavone of Desmodium styracifolium relieved apoptosis and autophagy of COM-induced HK-2 cells by regulating KIM-1via p38/MAPK pathway[J]. Mol Cell Biochem, 2018, 442: 169-175. DOI:10.1007/s11010-017-3201-z |
| [9] |
Rao Z, Zhang F, Zhang GQ, et al. Screening for potential bioactive components of Yin-zhi-huang using high bilirubin HepaRG cells incubating with serum from animals[J]. Acta Pharm Sin (药学学报), 2019, 54: 645-652. |
| [10] |
Tan P, Wang JB, Zhang DK. Application of an effect-constituents index for the quality evaluation of the traditional Chinese medicine rhubarb[J]. Acta Pharm Sin (药学学报), 2019, 54: 2141-2148. |
| [11] |
Khan SR. Crystal-induced inflammation of the kidneys:results from human studies, animal models, and tissue-culture studies[J]. Clin Exp Nephrol, 2004, 8: 75-88. |
| [12] |
Wang Y, Sun C, Li C, et al. Urinary MCP-1, HMGB1 increased in calcium nephrolithiasis patients and the influence of hypercalciuria on the production of the two cytokines[J]. Urolithiasis, 2017, 45: 159-175. DOI:10.1007/s00240-016-0902-9 |
 2020, Vol. 55
2020, Vol. 55


