2. 湖北民族大学附属民大医院, 湖北 恩施 445000;
3. 天津益倍生物科技集团有限公司, 天津 300000
2. University Hospital of Hubei University for Nationalities, Enshi 445000, China;
3. Tianjin Ubasio Biotechnology Group Co. Ltd., Tianjin 300000, China
急性痛风性关节炎(acute gouty arthritis, AGA)是单钠尿酸盐(monosodium urate, MSU)晶体沉积于关节及关节周围组织引起的一种急性炎症性反应[1]。目前认为巨噬细胞吞噬MSU是AGA炎症过程的核心[2]。沉积于人体内的MSU能与巨噬细胞等多种细胞发生反应, 合成和分泌肿瘤坏死因子α (tumour necrosis factor-α, TNF-α)等多种炎性因子, 从而引起炎症反应和组织破坏, 同时抑制炎症细胞凋亡进一步影响AGA的发展[3]。研究发现氧化应激在AGA急性炎症反应的发生发展过程中发挥重要作用[4]。当机体受到氧化应激刺激时能够激活核因子E2相关因子2 (nuclear factor erythroid-2-related factor 2, Nrf2)信号通路, 激活下游靶蛋白表达[5]。有研究证实MSU能够刺激RAW264.7巨噬细胞产生炎症因子, 还能诱导大鼠出现疼痛加剧的反应并产生白介素-1β (interleukin-1β, IL-1β)和TNF-α, 可能通过Nrf2途径激活氧化应激反应[6]。白藜芦醇(resveratrol)又名茋三酚, 是一种存在于葡萄、虎杖、蓝莓和桑椹等植物中的多酚化合物, 是天然的抗氧化剂和自由基清除剂, 具有抗炎、抗氧化、抗菌、心脏保护和抗肿瘤等多种治疗作用[7]。研究发现白藜芦醇能够明显减轻AGA小鼠足部肿胀, 并减少炎性细胞浸润[8]; 能够通过Nrf2/血红素氧合酶1 (heme oxygenase 1, HO-1)信号通路发挥抗氧化作用[9]。对于白藜芦醇能否通过Nrf2/HO-1信号通路抑制MSU诱导炎症模型的氧化损伤尚未见相关报道。本实验使用MSU诱导RAW264.7巨噬细胞建立炎症细胞模型, 观察不同浓度白藜芦醇对MSU诱导RAW264.7巨噬细胞的炎症因子、氧化应激指标及Nrf2/HO-1信号通路相关基因的影响, 探讨白藜芦醇的抗炎及抗氧化作用机制, 为AGA的治疗提供理论依据。
材料与方法材料 小鼠RAW264.7巨噬细胞株购自北京北纳创联生物技术研究院; 白藜芦醇由天津益倍生物科技集团有限公司提供, 溶于二甲基亚砜, 储备液浓度400 mmol·L-1, 使用时用培养基稀释至工作浓度; 0.25%胰酶(浙江森瑞生物科技有限公司, 批号: 1907190101); DMEM培养基(Gibco公司, 批号: 1927561);胎牛血清(澳洲CLARK公司, 批号: JC63483);活性氧自由基(reaction oxygen species, ROS)检测试剂盒(大连美仑生物技术有限公司, 批号: MA0219);鼠TNF-α ELISA试剂盒(Novus Biologicals公司, 批号: VAL609);超氧化物歧化酶(superoxide dismutase, SOD)测定试剂盒(批号: A001-3)、细胞丙二醛(malonaldehyde, MDA)测试盒, 批号: A003-4) (南京建成生物工程有限公司); MSU (美国Sigma公司, 批号: BCBS7438); Cell counting kit-8 (CCK-8, 批号: CK04, 东仁化学科技有限公司); TRIzol Reagent (Ambion公司, 批号: 113605); Prime script RT reagent kit with gDNA Eraser (Perfect Real Time) (批号: AK4401)及SYBR Premix Ex Taq (Tli RNase H Plus, 批号: AK8904) (TaKaRa公司); BCA蛋白浓度测定试剂盒(上海碧云天生物技术有限公司, 批号: P0012S); 引物购自上海生物工程技术服务有限公司。
仪器 OD-1000+超微量分光光度计(南京五义科技有限公司); 5810R高速冷冻离心机(德国Eppendorf公司); MULTISKAN GO酶标检测仪(德国Thermo公司); LC480实时荧光定量PCR仪(Roche公司); 电泳仪(美国Bio-Rad公司); IX71荧光倒置显微镜(日本Olympus公司)。
细胞培养 使用含10%胎牛血清的DMEM培养RAW264.7细胞, 置于37 ℃、5% CO2培养箱中培养。实验共分5组:对照组、MSU组(MSU终浓度为100 μg·mL-1)、白藜芦醇20 μmol·L-1组、40 μmol·L-1组和80 μmol·L-1组, 每组重复3次。
MSU制备 参考文献[10]方法将尿酸盐1 g和NaOH溶液(1 mol·L-1) 6 mL加至194 mL蒸馏水中, 煮沸, 使尿酸盐完全溶解, 自然降温并搅拌, 滴入HCl (1 mol·L-1)调pH值至7.2, 3 000 r·min-1离心20 min, 取沉淀, 再3 000 r·min-1离心至沉淀不再析出, 60 ℃烘干, 置4 ℃冰箱保存。实验前取MSU置于180 ℃干燥箱干燥2 h, 称取干燥MSU 100 mg, 高压灭菌烘干后, 加入DMEM培养液10 mL, 配制成质量浓度为10 mg·mL-1的MSU溶液。
CCK-8法检测细胞增殖 用含10%胎牛血清的DMEM培养液将RAW264.7巨噬细胞数调整为5×104个/mL, 接种于96孔板中每孔100 μL, 3个复孔, 细胞贴壁后加入不同浓度白藜芦醇(终浓度为10、20、40、80、120、160、200 μmol·L-1)作用24及48 h后, 弃上清, 每孔加入含10 μL CCK-8溶液的DMEM 100 μL, 放置培养箱内孵育2 h。用酶标仪测定各组在450 nm波长处的吸光度值(OD), 计算细胞存活率(CV)。
| $ {\rm{CV}}\left( % \right) = \left( {{\rm{O}}{{\rm{D}}_{实验组}} - {\rm{O}}{{\rm{D}}_{空白孔}}} \right)/\left( {{\rm{O}}{{\rm{D}}_{{\rm{对照组}}}} - {\rm{O}}{{\rm{D}}_{{\rm{空白孔}}}}} \right) \times 100% $ | (1) |
ELISA法检测细胞上清TNF-α水平 将RAW264.7巨噬细胞接种于96孔板中, 每孔5×103个, 加入不同浓度白藜芦醇(终浓度为20、40、80 μmol·L-1)作用5 h后, 加入MSU终浓度100 μg·mL-1作用24 h, 收集细胞上清, 4 ℃、3 000 r·min-1离心10 min后, 按鼠TNF-α ELISA检测试剂盒说明书检测细胞上清中TNF-α水平。
ROS检测 将RAW264.7巨噬细胞接种于96孔板, 上述5组细胞培养24 h后, 去除上清, 用无血清DMEM培养基清洗细胞1次, 加入10 μmol·L-1 DCFH-DA稀释液100 μL, 37 ℃下培养箱中避光孵育30 min, 用无血清DMEM清洗细胞3次, 充分去除未进入细胞内的DCFH-DA, 在荧光显微镜下观察。
SOD和MDA检测 将RAW264.7巨噬细胞接种于6孔板, 上述5组细胞培养24 h后, 去除上清, 收集各组细胞并检测细胞蛋白浓度。按说明书检测, 计算SOD (U·mg-1)、MDA (nmol·mg-1)含量。
| $ {\rm{SOD活力 = }}\left[ {\left( {{\rm{SOD抑制率/50% }}} \right) \times 反应体系稀释倍数} \right]/样本蛋白浓度 $ | (2) |
| $ {\rm{MDA含量 = }}\left[ {\left( {{\rm{O}}{{\rm{D}}_{样本}} - {\rm{O}}{{\rm{D}}_{空白}}} \right)\left( {{\rm{O}}{{\rm{D}}_{标准}} - {\rm{O}}{{\rm{D}}_{空白}}} \right) \times 标准品浓度} \right]/样本蛋白浓度 $ | (3) |
Real-time PCR法检测mRNA表达 收集各组细胞, 按照TRIzol Reagent说明书提取RNA, 测定RNA纯度及浓度, A260/A280比值为1.8~2.0。按逆转录试剂盒说明书合成cDNA, 反应条件: 42 ℃ 2 min、37 ℃ 15 min和85 ℃ 5 s。cDNA储存于-20℃。引物序列如下, Nrf2上游引物:5'-CCATTTACGGAGACCCAC-3', 下游引物: 5'-GGATTCACGCATAGGAGC-3';醌氧化还原酶1 [NAD(P)H quinoneoxidoreductase 1, NQO1]上游引物: 5'-GAGAAGAGCCCTGATTGT-3', 下游引物: 5'-AAAGGACCGTTGTCGTAC-3'; Kelch样ECH相关蛋白1 (Kelch-like ECH-associated protein 1, Keap1)上游引物: 5'-GGTCGCCCTGTGCCTCTAT-3', 下游引物: 5'-ACGCCAATCCTCCGTGTC-3'; HO-1上游引物: 5'-AGATGGCGTCACTTCGTC-3', 下游引物: 5'-GGC AAGATTCTCCCTTACAG-3'; GAPDH上游引物:5'-CCCTTCATTGACCTCAACTACATG-3', 下游引物:5'-TGGGATTTCCATTGATGACAAGC-3'。RT-RCP反应体系10 μL, 反应条件: 95 ℃预变性30 s、95 ℃变性5 s、58 ℃退火30 s和72 ℃延伸30 s, 40个循环。基因表达量以2-△△CT表示实验组目的基因表达相对于对照组的变化倍数。
统计学方法 使用SPSS19.0统计软件分析数据, 计量资料以均数±标准差(x ± s)表示, 对符合正态分布满足方差齐性的采用单因素方差分析(ANOVA)进行组间两两比较, 不符合的采用非参数(秩和)检验, P < 0.05表示差异有统计学意义。
结果 1 白藜芦醇对RAW264.7巨噬细胞增殖的影响如图 1所示, 20、40、80和160 μmol·L-1白藜芦醇作用于RAW264.7巨噬细胞24 h, 细胞存活率分别为101.08%、89.97%、72.81%和46.08%;作用48 h后, 细胞存活率均有所降低, 分别为89.01%、61.44%、36.31%和19.64%。结果说明, 白藜芦醇能够抑制RAW264.7巨噬细胞增殖, 在24和48 h的IC50值分别为144.51和78.84 μmol·L-1, 具有浓度及时间依赖性。为避免药物的细胞毒性影响, 本研究选择细胞存活率大于70%的白藜芦醇的浓度20、40和80 μmol·L-1、作用时间为24 h, 进行后续实验。
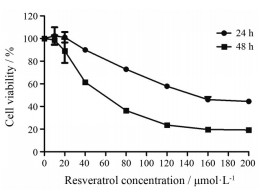
|
Figure 1 Effect of resveratrol on the survival rate of RAW264.7 cells. RAW264.7 cells were treated with resveratrol (10, 20, 40, 80, 120, 160, 200 μmol·L-1) for 24 h and 48 h, respectively. Cell viability was determined by CCK-8 assay. n = 3, x ± s |
如图 2所示, 与对照组相比, MSU组细胞上清中TNF-α水平明显增高(P < 0.05);加入20、40和80 μmol·L-1白藜芦醇后, TNF-α水平均降低; 与MSU组相比, 80 μmol·L-1白藜芦醇降低最为明显(P < 0.05)。结果提示, MSU能够诱导RAW264.7巨噬细胞炎症反应的发生, 白藜芦醇能明显抑制MSU诱导RAW264.7巨噬细胞分泌TNF-α水平。

|
Figure 2 Resveratrol inhibits TNF-α secretion of RAW264.7 cells induced by MSU. The secretion of TNF-α was measured in the supernatant of RAW264.7 cells by ELISA. MSU: Monosodium urate; TNF-α: Tumour necrosis factor-α. n = 3, x ± s. *P < 0.05 vs control group; #P < 0.05 vs MSU group |
如图 3所示, 与对照组相比, MSU组细胞内ROS和MDA含量明显增高(P < 0.05), SOD含量明显减少(P < 0.05);加入20、40和80 μmol·L-1白藜芦醇后, ROS及MDA表达均有所降低, SOD含量均增高; 与MSU组相比, 80 μmol·L-1白藜芦醇作用最为明显(P < 0.05)。结果提示, MSU能够促进RAW264.7巨噬细胞的氧化应激反应, 白藜芦醇能明显抑制MSU所诱导的氧化应激。
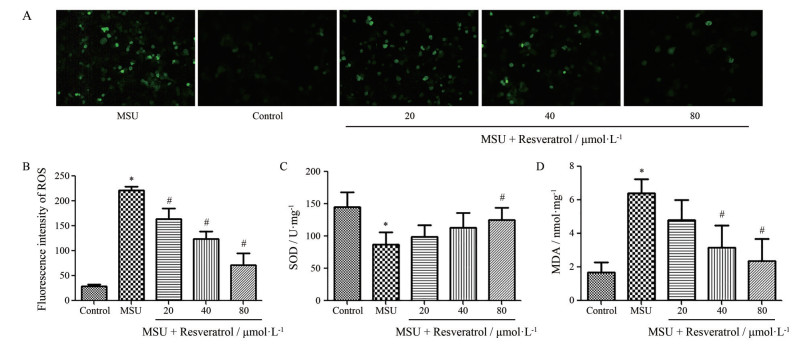
|
Figure 3 Effects of resveratrol on ROS, SOD, MDA stimulated by MSU in RAW264.7 cells. A, B: Expression of ROS was detected in RAW264.7 cells by DCFH-DA fluorescence probe; C: Expression of SOD was detected in RAW264.7 cells by the SOD assay; D: Expression of MDA was detected in RAW264.7 cells by the MDA assay. ROS: Reaction oxygen species; SOD: Superoxide dismutase; MDA: Malonaldehyde. n = 3, x ± s. *P < 0.05 vs control group; #P < 0.05 vs MSU group |
如图 4A~D所示, 与对照组相比, MSU组细胞内Keap1 mRNA表达量明显增高(P < 0.05), Nrf2、NQO1和HO-1 mRNA表达量均明显减少(P < 0.05);加入20、40和80 μmol·L-1白藜芦醇后, Keap1 mRNA表达量降低, Nrf2、NQO1和HO-1 mRNA表达量均增高, 白藜芦醇80 μmol·L-1组Keap1 mRNA表达量为MSU组的0.746倍(P < 0.05), Nrf2、NQO1和HO-1 mRNA表达量分别为MSU组的2.176、3.237和16.76倍(P < 0.05), 作用最为明显。结果提示, MSU能够激活Keap1/Nrf2信号通路, 白藜芦醇通过抑制Keap1 mRNA表达, 增加Nrf2、NQO1和HO-1 mRNA的表达起到抗氧化作用。

|
Figure 4 Effects of resveratrol on the expression of Nrf2, Keap1, NQO1, HO-1 mRNA stimulated by MSU in RAW264.7 cells. A, B, C, D: Relative expression of Nrf2, Keap1, NQO1, HO-1 mRNA were detected in RAW264.7 cells by Real time PCR, respectively. Nrf2: nuclear factor erythroid-2-related factor 2; Keap1: Kelch-like ECH-associated protein 1; NQO1: NAD(P)H quinoneoxidoreductase 1; HO-1: Heme oxygenase 1. n = 3, x ± s. #P < 0.05 vs MSU group |
痛风是由于嘌呤代谢紊乱所致的一组慢性炎症性疾病, AGA是痛风最常见的首发症状[11]。MSU是AGA的关键诱导因素, 其诱导的炎症是痛风的病理基础[12]。单核巨噬细胞系统在MSU触发的痛风炎症启动、进展及缓解中均起到核心作用[13]。研究发现, MSU可直接刺激单核/巨噬细胞产生TNF-α, 从而促发痛风炎性反应[14]。在MSU诱导的AGA模型中, 通过阻断TNF-α的产生能明显抑制内皮细胞的激活和多形核白细胞的募集, 从而抑制炎症的发生[15]。说明TNF-α在AGA的发生、发展中起着极其重要的作用。本实验使用MSU刺激RAW264.7巨噬细胞, 发现细胞上清中TNF-α水平明显增高, 说明MSU能够通过诱导RAW264.7巨噬细胞炎症反应的发生, 建立炎症细胞模型。
白藜芦醇广泛存在于自然界植物中, 多项研究证明其具有治疗痛风的作用, 但具体机制尚未阐明[16]。Xiao等[17]认为白藜芦醇可能通过促进巨噬细胞M2极化, 抑制炎性因子产生, 缓解小鼠AGA。本实验使用不同浓度白藜芦醇作用于RAW264.7细胞, 发现白藜芦醇能抑制RAW264.7巨噬细胞增殖, 具有浓度和时间依赖性, 并发现白藜芦醇能明显抑制MSU诱导RAW264.7巨噬细胞分泌的TNF-α水平, 以80 μmol·L-1作用最为明显, 说明白藜芦醇能抑制MSU所诱导的细胞炎症反应的发生。
氧化应激损伤主要由活性氧物质所致, 当机体受到外来刺激干扰, 会加速ROS形成, 并加剧脂质氧化反应。MDA是脂质过氧化产物, 含量的大小可反映机体内脂质过氧化的程度, 间接地反映出细胞损伤的程度[18]。大量ROS和MDA的产生能够导致关节的损伤, 出现剧烈疼痛和功能障碍。SOD是抗氧化防御系统的重要组成部分, 能够清除机体内过多的ROS和MDA, 具有保护细胞和组织的作用, SOD活力的高低间接反映了机体抗氧化应激能力[19]。本实验证实, MSU能明显增高RAW264.7巨噬细胞内ROS和MDA含量, 并显著降低SOD含量, 说明MSU能够促进RAW264.7巨噬细胞的氧化应激反应。研究发现, 使用过氧化氢(H2O2)诱导THP-1源性巨噬细胞氧化损伤模型, 白藜芦醇能使氧化损伤巨噬细胞MDA含量明显下降, SOD活力性显著升高, 并明显降低巨噬细胞的IL-1β、IL-6和TNF-α表达[20]。还有研究发现佐剂性关节炎(AA)大鼠存在氧化应激, 白藜芦醇能够显著降低AA大鼠足肿胀度, 降低MDA含量, 提高SOD活性, 发挥抗氧化能力[21]。本实验以RAW264.7巨噬细胞为研究对象, 发现白藜芦醇能明显抑制MSU诱导RAW264.7巨噬细胞内的ROS和MDA表达, 增加SOD表达, 以80 μmol·L-1浓度作用最为明显。说明白藜芦醇能够明显抑制MSU所诱导的氧化应激。
Nrf2信号通路为重要的内源性抗氧化通路, Nrf2是调节体内氧化应激进行自我保护并与炎症相关的关键转录因子, 几乎在全身各组织器官中都有表达[22]。静息状态下, Nrf2与胞质中的Keap1相结合, 处于非活性状态; 当机体受到其他亲核物质刺激或处于氧化应激状态时, Nrf2与Keap1解偶联后转入核内, 与抗氧化反应元件(ARE)结合, 激活NQO1和HO-1等下游Ⅱ相代谢酶及抗氧化蛋白基因的表达, 以减少氧化损伤, 发挥保护细胞的作用[23]。HO-1是血红素降解的限速酶, 在抗炎和抗氧化性组织损伤中具有重要作用[24]。NQO1在胞浆内属于Ⅱ相抗氧化解毒酶, 能阻止氧化应激反应, 并减少ROS的产生, 使细胞免受氧化损伤[25]。研究发现, 白藜芦醇能够抑制脂多糖(LPS)诱导RAW264.7巨噬细胞所产生的炎症因子, 并促进HO-1表达[26]。白藜芦醇还能抑制黄曲霉毒素B1诱导的MAC-T牛乳腺上皮细胞ROS升高, 并通过Nrf2信号通路发挥抗氧化作用[27]。本实验使用MSU刺激RAW264.7巨噬细胞, 明显增高细胞内Keap1mRNA表达, 明显减少Nrf2、NQO1和HO-1mRNA表达量。说明MSU能够激活RAW264.7巨噬细胞Keap1/Nrf2信号通路。白藜芦醇干预后, Keap1 mRNA表达量降低, Nrf2、NQO1和HO-1 mRNA表达量均增高, 以80 μmol·L-1浓度作用最为明显。说明白藜芦醇能够通过Keap1/Nrf2信号通路起到抗氧化作用。
综上, 白藜芦醇能抑制MSU诱导RAW264.7巨噬细胞产生的炎症反应, 并通过调节Nrf2/HO-1信号通路提高巨噬细胞抗氧化能力, 为白藜芦醇防治AGA提供了实验依据。
作者贡献:冯佳、袁林负责提出研究选题及设计研究方案; 冯佳、黄侠、鞠单负责实施研究过程; 李赫宇负责材料支持; 杨年安、田瑞负责采集整理数据; 冯佳、夏燕负责起草、修改论文; 袁林负责技术指导
利益冲突:本研究不存在研究者与公开研究成果有关的利益冲突
| [1] |
Cronstein BN, Sunkureddi P. Mechanistic aspects of inflammation and clinical management of inflammation in acute gouty arthritis[J]. J Clin Rheumatol, 2013, 19: 19-29. DOI:10.1097/RHU.0b013e31827d8790 |
| [2] |
Zhou M, Wang YF, Yuan JQ, et al. Research progress on the immune-pathogenesis of acute gouty arthritis[J]. World Clin Drug (世界临床药物), 2018, 39: 62-65. |
| [3] |
Kingsbury SR, Conaghan PG, Mcdermott MF. The role of the NLRP3 inflammasome in gout[J]. J Inflamm Res, 2011, 4: 39-49. |
| [4] |
Trevisan G, Hoffmeister C, Rossato MF, et al. TRPA1 receptor stimulation by hydrogen peroxide is critical to trigger hyperalgesia and inflammation in a model of acute gout[J]. Free Radic Biol Med, 2014, 72: 200-209. DOI:10.1016/j.freeradbiomed.2014.04.021 |
| [5] |
Krajka-Kuźniak V, Paluszczak J, Baer-Dubowska W, et al. The Nrf2-ARE signaling pathway:an update on its regulation and possible role in cancer prevention and treatment[J]. Pharmacol Rep, 2017, 69: 393-402. DOI:10.1016/j.pharep.2016.12.011 |
| [6] |
Dinesh P, Rasool MK. Berberine, an isoquinoline alkaloid suppresses TXNIP mediated NLRP3 inflammasome activation in MSU crystal stimulated RAW 264[J]. Int Immunopharmacol, 2017, 44: 26-37. DOI:10.1016/j.intimp.2016.12.031 |
| [7] |
Dong W, Wang R. Effects of resveratrol-induced cellular autophagy in control of neurodegenerative diseases[J]. Acta Pharm Sin (药学学报), 2016, 51: 24-28. |
| [8] |
Li HM, Ou GC, He YL, et al. Resveratrol attenuates the MSU crystal-induced inflammatory response through the inhibition of TAK1 activity[J]. Int Immunopharmacol, 2019, 67: 62-68. DOI:10.1016/j.intimp.2018.12.004 |
| [9] |
Yadav A, Sunkaria A, Singhal N, et al. Resveratrol loaded solid lipid nanoparticles attenuate mitochondrial oxidative stress in vascular dementia by activating Nrf2/HO1 pathway[J]. Neurochem Int, 2018, 112: 239-254. DOI:10.1016/j.neuint.2017.08.001 |
| [10] |
Xu W, Sun WF, Li J. Influence of monosodium urate crystals on vitality and chemotaxis to the neutrophils of cells related to gouty arthritis[J]. Military Med J South China (华南国防医学杂
志), 2015, 29: 4-7. |
| [11] |
Zhou JG. Gout and its multiple system damage[J]. Chin J Clin (中华临床医师杂志), 2013, 7: 15-17. |
| [12] |
Guo YX, Xiong H, Yi FY, et al. Effect of Juanbi Lijieqing Formula on TLR4, NF-κB and PPARγ in synovial membrane of rats with amelioration of gouty arthritis[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2018, 24: 126-133. |
| [13] |
Zhang MY, Li Z, Li XQ, et al. Effects of differentiated macrophages on gouty inflammation[J]. Acta Acad Med Wannan (皖南医学院学报), 2016, 35: 320-323. |
| [14] |
Amaral FA, Costa VV, Tavares LD, et al. NLRP3 inflammasomemediated neutrophil recruitment and hyper nociceptio depend on leukotriene (B)4 in a murine model of gout[J]. Arthritis Rheum, 2012, 64: 474-484. DOI:10.1002/art.33355 |
| [15] |
Chapman PT, Yarwood H, Harrison AA, et al. Endothelial activation in monosodium urate monohydrate crystal-induced inflammation:in vitro and in vivo studies on the roles of tumor necrosis factor alpha and interleukin-1[J]. Arthritis Rheum, 1997, 40: 955-965. DOI:10.1002/art.1780400525 |
| [16] |
Yang QB, He YL, Zhong XW, et al. Resveratrol ameliorates gouty inflammation via upregulation of sirtuin 1 to promote autophagy in gout patients[J]. Inflammopharmacology, 2019, 27: 47-56. DOI:10.1007/s10787-018-00555-4 |
| [17] |
Xiao WZ, Zhao L, Zou HJ. Resveratrol promotes macrophage M2 polarization and alleviates acute gouty arthritis in mice[J]. Acad J Sec Mil Med Univ (第二军医大学学报), 2019, 40: 860-865. |
| [18] |
Huang F, Sheng XX, Zhang HJ. DUSP26 regulates podocyte oxidative stress and fibrosis in a mouse model with diabetic nephropathy through the mediation of ROS[J]. Biochem Biophys Res Commun, 2019, 515: 410-416. DOI:10.1016/j.bbrc.2019.05.032 |
| [19] |
Liu LJ, Qian H, Yin HM, et al. Unsaturated fatty acid of Actinidia chinesis Planch seed oil enhances the antioxidative stress ability of rats with pulmonary fibrosis through activating Keap 1/Nrf 2 signaling pathway[J]. Chin J Cell Mol Immunol (细胞与分子免疫学杂志), 2016, 32: 479-483. |
| [20] |
Song DQ. Study of the Protective Effect and the Mechanism of Resveratrol on THP-1 Macrophages Following Oxidative Injury (白藜芦醇对 THP-1源性巨噬细胞氧化损伤的保护作用及机制
· 2373 ·药学学报 Acta Pharmaceutica Sinica 2020, 55(10): 2368 −2374
研 究)[D].Guangzhou: Guangdong Pharmaceutical University,2018
|
| [21] |
Zhang JQ, Song XB, Cao W, et al. Autophagy and mitochondrial dysfunction in adjuvant-arthritis rats treatment with resveratrol[J]. Sci Rep, 2016, 6: 32928. DOI:10.1038/srep32928 |
| [22] |
Zhang W, Song JK, Yan R, et al. Salvianolic acid A alleviate the brain damage in rats after cerebral ischemia-reperfusion through Nrf2/HO-1 pathway[J]. Acta Pharm Sin (药学学报), 2016, 51: 1717-1723. |
| [23] |
Li W, Kong AN. Molecular mechanisms of Nrf2-mediated antioxidant response[J]. Mol Carcinog, 2009, 48: 91-104. DOI:10.1002/mc.20465 |
| [24] |
Loboda A, Damulewicz M, Pyza E, et al. Role of Nrf2/HO-1 system in development, oxidative stress response and diseases:an evolutionarily conserved mechanism[J]. Cell Mol Life Sci, 2016, 73: 3221-3247. DOI:10.1007/s00018-016-2223-0 |
| [25] |
Yadav U, Kumar P, Rai V, et al. NQO1 gene C609T polymorphism (dbSNP:rs1800566) and digestive tract cancer risk:a meta-analysis[J]. Nutr Cancer, 2018, 70: 557-568. DOI:10.1080/01635581.2018.1460674 |
| [26] |
Son Y, Chung HT, Pae HO. Differential effects of resveratrol and its natural analogs, piceatannol and 3, 5, 4'-trans-trimethoxystilbene, on anti-inflammatory heme oxigenase-1 expression in RAW264[J]. Nutr Cancer, 2014, 40: 138-145. |
| [27] |
Zhou YF, Jin YC, Yu H, et al. Resveratrol inhibits aflatoxin B1-induced oxidative stress and apoptosis in bovine mammary epithelial cells and is involved the Nrf2 signaling pathway[J]. Toxicon, 2019, 6: 10-15. |
 2020, Vol. 55
2020, Vol. 55


