脑卒中已成为世界范围内严重威胁人类健康的神经系统疾病, 是致死、致残的主要原因之一[1]。美国食品药品监督管理局(Food and Drug Administration, FDA)唯一批准的治疗急性缺血性脑卒中的方法, 是通过静脉注射组织纤溶酶原激活剂(tissue plasminogen activator, tPA)溶解血栓恢复正常血流[2]。然而, 由于治疗时间窗很短(< 4.5 h), 只有小部分患者能够接受这种治疗[2, 3], 同时大大增加了脑出血的风险, 限制其广泛使用[3]。大量研究在临床试验的转换中失败后, 美国国家神经疾病和脑卒中研究所(National Institutes of Neurological Disease and Stroke, NINDS)在2006年和2011年将脑卒中后神经修复(neurorestoration)列为主要研究事项[4, 5]。脑卒中后神经修复过程主要包括神经发生、血管生成和突触可塑性的增强等[6]。不同于神经保护策略, 神经修复治疗不再将重点放在减缓细胞损伤、缩小脑梗死的体积和减少继发性细胞死亡等, 而是希望通过快速重建缺血大脑组织来保持血管完整性, 尽量减少实质细胞死亡来实现神经血管部分功能的恢复。
基于细胞的修复性疗法能够显著改善脑卒中后的神经功能, 其中间充质干细胞(mesenchymal stem cells, MSCs)是干细胞移植治疗中应用最广泛的。研究表明MSCs源性外泌体(exosome)在治疗中发挥重要作用, 参与诱导缺血大脑血管生成、神经发生和胶质细胞生成等神经修复过程。外泌体在体内广泛存在, 以其独有的优势介导生理病理条件下的细胞通讯。本文主要介绍了外泌体、microRNA (miRNA)的基本特点, 对缺血性脑卒中后神经功能恢复及大脑重塑的重要作用, 并讨论MSCs-外泌体用于脑卒中治疗的前景, 以及基于外泌体的治疗策略进一步运用于临床的机遇和挑战。
1 缺血性脑卒中后的神经修复过程约87%的脑卒中是由于血管栓塞, 导致大脑缺血损伤从而引发功能障碍的缺血性脑卒中[7]。脑卒中发生后, 大脑的内源性修复涉及一系列高度互动的过程, 包括血管生成、神经发生、胶质增生、突触形成和轴突生长等, 增强脑可塑性, 共同调控神经系统的恢复[8]。
血管生成是脑卒中后恢复的治疗靶点之一, 大量证据表明, 血管重塑能够增强神经修复过程, 该过程包括神经发生和突触形成, 有助于脑卒中后神经功能的恢复[9]。神经发生即神经干细胞和祖细胞分化成新的实质细胞, 刺激可塑性及少突胶质细胞生成, 恢复神经元信号传导[9]。成年哺乳动物神经发生主要在海马体的颗粒下区(subgranular zone, SGZ)和室下区(subventricular zone, SVZ)。实验大鼠发生缺血性脑卒中后, SVZ中神经祖细胞数量显著增加, 神经母细胞被招募至缺血半暗带并分化成为成熟神经元[10]。
临床前研究发现, 脑卒中后2~3周开始轴突的重塑, 恢复脑内各组织间的联系, 皮质脊髓系统的轴突重塑也有助于脑卒中后大脑自发功能恢复[11]。新生的少突胶质细胞形成髓鞘包裹着轴突促进神经传导, 因此少突胶质细胞的发育在缺血后行为学功能的恢复中也起着至关重要的作用[12]。
小胶质细胞占成人脑细胞的5%~10%, 是大脑中数量最庞大的免疫细胞[13]。在病理条件下, 如脑卒中、感染和其他神经退行性病变, 会诱导中枢神经系统(central nervous system, CNS)炎症反应的发生, 通过激活小胶质细胞改变血脑屏障(blood-brain barrier, BBB)通透性, 随后外周免疫细胞浸润到脑实质, 分泌炎症细胞因子导致神经元的损伤和死亡[14]。小胶质细胞由促炎表型M1型转化为抗炎表型M2型后引起抗炎细胞因子、营养因子的释放, 促进神经发生、轴突重塑、血管生成、少突胶质细胞发生和再髓鞘化等一系列神经修复过程[15]。
2 外泌体基本特性 2.1 外泌体介绍外泌体是一类膜结合囊泡, 直径在30~100 nm, 生理条件下所有活细胞都能产生, 随体液广泛分布于全身各处。外泌体形成的分子机制根据是否依赖于内吞体转运复合物(endosomal-sorting complex response for transport, ESCRT)分为两类, 具体过程可分为3个阶段, 首先形成早期内吞体(early endosomes, EEs), 成熟为晚期内吞体(late endosomes)后经过膜内向出芽作用, 形成众多包裹细胞质及细胞膜表面成分的管腔囊泡(intraluminal vesicles, ILVs), 并在晚期内吞体中积累, 因此晚期内吞体也被称为多囊泡体(multivesicular body, MVB)[16]。随后, 部分MVB与质膜融合后以胞吐的形式将ILV释放进入胞外, 即外泌体; 而剩余MVB被转运至溶酶体降解后供细胞重新利用[16]。
外泌体作为活性物质的“仓库”携带丰富的“货物”, 其中蛋白质主要包括细胞骨架蛋白、热休克蛋白(heat shock protein, HSP)如HSP70、HSP90, 以及参与生物合成和运输的四次跨膜蛋白家族(CD81、CD63、CD9)等[17], 同时, 外泌体还含有反映其细胞来源的特异性蛋白从而调控不同的生物过程[18]。另外, 外泌体内富含细胞因子、核酸(如miRNA、mRNA、DNA)及胆固醇、鞘磷脂等脂质[17]。
受体细胞摄取外泌体主要通过以下几种方式: ①外泌体膜蛋白与靶细胞表面受体相互作用, 从而激活受体细胞内信号; ②外泌体膜蛋白被蛋白酶水解后的可溶性成分作为配体与靶细胞表面受体结合; ③通过与靶细胞融合非选择性转移外泌体内蛋白质与RNA等生物活性物质[19]。生理条件下, 外泌体通过传递这些“货物”介导细胞间的通讯, 在维持细胞正常生理功能运转中具有重要的意义[20]。
在外泌体携带的众多“货物”中, miRNA的功能研究较多, 并被证实是参与外泌体治疗作用的核心因素[21]。研究发现, 敲除一种miRNA加工过程中的关键核糖核酸酶, 结果显示缺少miRNA的外泌体失去了对急性肾损伤的治疗效应[22]。miRNA是一种短链(22~25个核苷酸)非编码RNA, 来源于初级转录产物, 经过加工成为成熟的双链miRNA, 具有广泛的生物功能[21, 23]。每个miRNA都有几个甚至数百个靶基因, 使其成为整个基因网络的高效调节因子, 调控基因转录, 参与众多生物学功能的正常表达[23]。脑卒中导致的神经功能损伤会影响体内多个信号通路, 尽管目前还未发现确切的机制, 但是针对多种神经系统疾病的研究发现, 外泌体能够增强神经系统的重塑, 进一步恢复CNS内细胞信息的远距离交流, 从而为脑卒中的治疗提供了新的思路。
2.2 外泌体与神经修复所有脑细胞都能分泌外泌体[3]。体内外实验证实, 外周血液循环中存在内皮祖细胞, 外泌体将与磷脂酰肌醇3激酶(phosphatidylinositol 3 kinase, PI3K)/蛋白激酶B (protein kinase B, PKB/Akt)信号通路有关的miRNA和促血管生成的miRNA转移至受体内皮细胞, 激活PI3K/Akt信号通路, 增加血管生成[3]。另外, miR-210在正常小鼠大脑中的过度表达促进血管的形成, 同时也与血管内皮生长因子(vascular endothelial growth factor, VEGF)的表达增加有关[24]。VEGF是一种高效血管肽, 可以促进血管内皮细胞的迁移增殖以及血管形成。
在体外将脑脊液外泌体与胚胎神经干细胞共同孵育能够激活神经干细胞中胰岛素样生长因子(insulin-like growth factor, IGF)/哺乳动物雷帕霉素复合物1 (mammalian target of rapamycin complex 1, mTORC1)通路, 促进干细胞增殖[25]。miR-124是最丰富的神经元miRNA之一, 在成年啮齿动物SVZ处的神经祖细胞中表达[26]。实验证明, 缺血性脑损伤后, 外泌体通过介导miR-124的转运促进神经发生, 因此上调miR-124的表达可以作为一种针对神经保护和神经重塑的有效治疗策略[26]。
少突胶质细胞和星形胶质细胞也可通过释放外泌体与多种神经细胞进行交流。少突胶质细胞释放的外泌体携带髓鞘蛋白, 如脂蛋白(proteolipid protein, PLP)、2'3'-环核苷酸-磷酸二酯酶(2'3'-cyclic-nucleotide-phosphodiesterase, CNP)和髓鞘碱性蛋白(myelin basic protein, MBP), 证明其能够调节少突胶质细胞轴突髓鞘化[27, 28]。另外, 外泌体携带的miRNA在控制少突胶质细胞祖细胞(oligodendrocyte progenitor cell, OPC)的生成和分化过程中起着关键作用[29]。例如, miR-219和miR-338在OPC中的过表达可通过抑制靶基因-血小板衍生生长因子受体α (platelet-derived growth factor receptor alpha, PDGFRα)和性别决定区Y框6 (sex-determining region Y box 6, SOX6)促进少突胶质细胞的分化[30]。星形胶质细胞在正常生理和病理条件下发挥着多种生物学功能, 包括维持BBB完整性和突触的调节, 有证据表明这些功能由外泌体介导[21]。例如, 有研究证明突触可塑性在一定程度上取决于星形胶质细胞释放的携带miR-26的外泌体[31]。此外, 由于星形胶质细胞在形态上的独特性质, 单个细胞的终足往往会接触BBB和突触间隙, 使得释放的外泌体能够在神经元与外周之间建立联系[32], 从而为脑卒中后神经系统整体的恢复提供了有利的条件(图 1)。
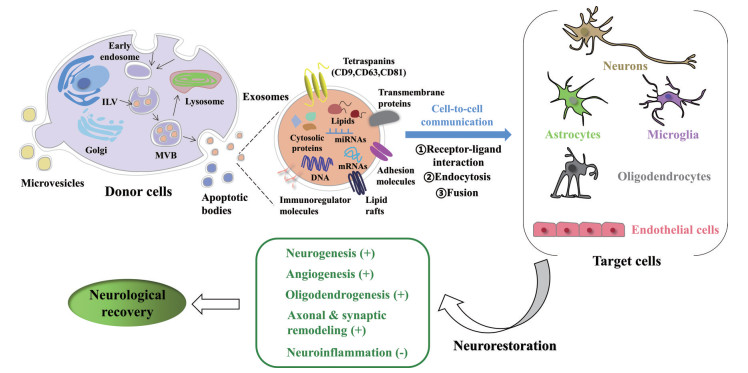
|
Figure 1 Graphical representation of the generation and therapeutic effects of exosomes in ischemic stroke. ① The process of exosome formation and secretion is shown. Early endosomes mature into late endosomes and then a large number of ILVs of MVBs are generated by inward budding from the limiting membrane, which accumulate in the lumen of endosomes. Subsequently, MVBs can be either fused with the plasma membrane, releasing ILVs into the extracellular space which designated as exosomes, or carried to the degradation pathway in lysosomes. ② Exosomes are enriched with nucleic acids (DNA, mRNA, and miRNA), lipid rafts, and a variety of proteins including tetraspanins, adhesion molecules, transmembrane proteins, cytosolic proteins, etc. ③ Exosomes are taken up by target cells selectively by receptor-ligand interaction, endocytosis route, fusion with cell membrane directly. ④ Prominently involved in intercellular communication by transferring bio-information to brain parenchymal cells, exosomes induce enhancement of endogenous neurogenesis, angiogenesis, oligodendrogenesis, axonal and synaptic remodeling as well as reduction of neuroinflammation, and therefore lead to neurorestorative actions and improvement in neurological function after ischemic stroke. ILV: intraluminal vesicles; MVB: multivesicular body |
细胞治疗策略特别是MSCs在缺血性脑卒中的临床前研究中已显示出较好的前景。细胞治疗的目的不是取代受损的细胞, 而是通过增强神经可塑性、血管生成和免疫调节产生积极效应[33]。研究证实, 脑卒中后给予MSCs通过旁分泌效应释放外泌体, 促进CNS的可塑性以及神经血管重塑, 有利于功能恢复。
目前普遍认为MSCs主要通过与脑实质细胞相互作用促进神经恢复。MSCs诱导实质细胞产生具有生物效应的分子, 如神经营养因子、蛋白酶和形态发生素, 从而增强受损部位周围的神经血管微环境, 重塑更远区域的组织[33]。实验中向大脑中动脉闭塞(middle cerebral artery occlusion, MCAO)模型大鼠静脉注射MSCs-外泌体, 大大改善了神经功能, 促进神经发生和血管生成, 增强神经血管重塑[34]。MSCs还可通过外泌体将miRNA (如miR-133b)转移到神经细胞内调节突起的生成[35]。研究人员发现, MCAO大鼠脑中miR-133b水平明显下调, 给予MSCs后缺血脑组织中miR-133b水平显著提高; 将释放的外泌体用于原代培养的神经元和星形胶质细胞, 结果显示细胞中miR-133b水平提高, 证明外泌体确实介导了miR-133b从MSCs向神经元和星形胶质细胞的转移, 体外实验进一步将MSCs内miR-133b敲除, 同样证实星形胶质细胞中升高的miR-133b来源于MSCs[35]。另外, MSCs-外泌体携带的miR-133b能够促进神经突起分支数量和总长度的增加, 大脑中的结缔组织生长因子(connective tissue growth factor, CTGF)主要由星形胶质细胞表达, miR-133b靶向抑制突起生长的CTGF和RhoA, 体内外实验显示外泌体介导miR-133b从MSCs转移到星形胶质细胞后下调CTGF的表达, 可能会使胶质瘢痕变薄, 有利于突起的生长[35]。上述研究表明, 从MSCs中释放的外泌体作为移动的活性物质“仓库”, 在脑缺血后携带多种miRNA穿梭于星形胶质细胞和神经元等脑实质细胞之间, 这可作为外源性MSCs促进脑卒中后神经恢复最有说服力的证据之一。
除了直接影响脑实质细胞的功能, 外源性外泌体还具有间接的神经修复作用。在大鼠局灶性脑缺血模型中, 从miR-133b过表达的MSCs中提取的外泌体被证实可增强对脑卒中大鼠的治疗作用, 同时MSCs-外泌体刺激星形胶质细胞自主释放外泌体, 随后新生成的外泌体促进培养的皮层神经元的突起生长, 参与缺血损伤后的大脑恢复[36]。另外, 经MSCs-外泌体诱导后的星形胶质细胞释放的外泌体, 比未经处理的星形胶质细胞释放的外泌体能更大程度地增强大脑可塑性[36]。上述结果提示, 外源性外泌体可能会与受体脑细胞相互作用, 使受体细胞释放出自身的外泌体从而介导与其他脑细胞之间的信息交流, 促进神经恢复。
免疫应答和炎症反应对脑卒中的临床进展和预后具有重要的影响, 目前, 免疫干预作为急性脑卒中的治疗策略正在被积极地探索中[37]。在小鼠脑卒中模型中, 给予MSCs-外泌体能够减轻缺血后亚急性期的免疫抑制, 但并不影响脑内免疫细胞的浸润[38]。一项研究显示, 在脂肪间充质干细胞(adipose-derived mesenchymal stem cell, ADMSC)与ADMSCs-外泌体联合治疗大鼠急性缺血性脑卒中的长期实验中, 脑卒中28天后显著降低脑梗死体积, 改善神经功能以及增加血管生成[39]。值得注意的是, 脑卒中后第60天联合治疗组脑梗死区域炎症和氧化应激的生物标志物, 如基质金属蛋白酶9 (matrix metalloproteinase 9, MMP-9)、白细胞介素-1β(interleukin-1β, IL-1β)、肿瘤坏死因子α (tumor necrosis factor-α, TNF-α)、调节活化正常T细胞表达和分泌因子(regulated upon activation, normal T cell expressed and secreted, RANTES)、纤溶酶原激活物抑制剂-1 (plasminogen activator inhibitor-1, PAI-1)、核因子-κB (nuclear factor-κB, NF-κB)和诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)的表达量显著降低, 同时, 作为炎症指标的CD11和CD68细胞表达也明显下降, 揭示了ADMSCs-外泌体的抗炎与免疫调节作用[39]。
除了MSCs-外泌体, 其他多种细胞分泌的外泌体同样具有神经保护和神经修复作用。在90天的长期实验中, 血小板衍生微粒(platelet derived microparticles, PMP)与血小板分泌的外泌体混合物能够剂量依赖性促进脑卒中大鼠脑梗死边界区细胞增殖、神经发生和血管生成, 显著改善行为缺陷, 潜在的机制可能与改变存活神经元的代谢和功能状态, 以及PMP影响干细胞介导的免疫调节有关[40]。另一项实验数据显示, 与MSCs相比, 体外培养脑内皮细胞衍生的外泌体携带更高水平的miR-126, 介导2型糖尿病(type 2 diabetes mellitus, T2DM)小鼠脑卒中后神经和认知功能的改善, 以及增加轴突、髓鞘、血管的密度和动脉直径, 诱导缺血边界区M2巨噬细胞极化等神经修复过程[41]。在大鼠短暂性局灶脑缺血模型中, 与单纯给予外泌体相比, 脂多糖(lipopolysaccharide, LPS)刺激巨噬细胞RAW264.7细胞分泌的外泌体也能显著减小脑梗死体积, 改善神经功能, 其神经保护作用与小胶质细胞M2表型极化增强、抑制炎症反应有关[42]。
与其他细胞相比, MSC是已知的唯一具有大规模生成外泌体能力的人源细胞, 在药物递送中具有的优势包括: ①通过自体和异体的方式抑制和调节获得性和先天性免疫细胞, 提高MSCs-外泌体衍生的药物载体寿命及药物的生物利用度; ②虽然永生化一定程度上损害了MSCs的分化潜能, 但不影响外泌体生成的数量和治疗效果; ③人源MSCs易获得, 并且是衍生外泌体数量最多的细胞; ④安全性高[43]。因此, MSCs是理想的外泌体药物递送系统的大规模生产者。
在实际研究中, 将外泌体从细胞系及体液中分离纯化的技术主要包括3种: ①将差速离心法与膜过滤法结合, 排除过大的囊泡便于得到大小相近的外泌体颗粒; ②速度区带离心法:获得的外泌体纯度较高(1.10~1.21 g·mL-1), 但耗时较长, 步骤繁琐; ③磁珠免疫法基于抗体的特异性和灵敏性, 分离得到高纯度且形态完整的外泌体, 缺点是产量较低[19]。
4 外泌体的人工修饰研究表明, 单独给予从MSCs中分离的外泌体能够显著改善神经功能, 促进神经血管的重塑[34]。与细胞治疗相比, 单独给予外泌体具有多种优势, 包括低免疫原性[44], 无血管阻塞效应, 能够穿过BBB进入脑实质[33], 毒性小、稳定性高、运输效率高[45], 安全性已得到初步验证等。
根据实际研究及临床应用的需要, 外泌体特异性靶向CNS内受体细胞的策略正在被积极地开发中, 然而科研人员面临的挑战之一即BBB的存在会阻止绝大多数分子的进入, 以便维持脑组织内环境的相对稳定。狂犬病病毒糖蛋白(rabies viral glycoprotein, RVG)能与神经细胞上的烟碱型乙酰胆碱受体(nicotinic acetylcholine receptor, AchR)特异性结合, 使病毒进入细胞内[46], 将来源于RVG的短肽修饰于外泌体表面, 选择性靶向神经细胞和大脑内皮细胞能够促进外泌体携带的活性分子透过BBB。在一项有关毒品戒断的研究中, 修饰后的外泌体膜表面表达神经元特异性RVG多肽片段, 将携带的μ阿片受体(opioid receptor mu, MOR) siRNA特异性转运至Neuro2A细胞和小鼠大脑中, 显著降低了MOR mRNA和蛋白质水平, 为有效抑制毒品复吸提供了新思路[47]。
相较于在外泌体合成过程中载入特定的活性成分, 将治疗药物装载于分离后的外泌体更为常见易行[48]。例如将姜黄素包裹在胚胎干细胞源性外泌体中, 经鼻腔给药于缺血性脑卒中小鼠, 结果显示能够显著抑制星形胶质细胞活化, 促进NeuN和血管内皮紧密连接蛋白的表达[49]。在另一项实验中, 外泌体搭载姜黄素迅速进入脑内后被小胶质细胞摄取, 减少活化的小胶质细胞(CD45.2+IL-1β+)数量, 抑制LPS诱导的炎症反应以及髓鞘少突胶质细胞糖蛋白诱导的自身免疫应答[50]。
由于外泌体内包含种类丰富的miRNA等信息分子, 通过改变所携带的miRNA的性质, 可能会提高外泌体诱导的治疗效果[45]。已有实验对携带特定miRNA外泌体的治疗作用进行考察, 向脑卒中大鼠给予MSCs-外泌体与富含miR-17-92团簇的MSCs-外泌体, 发现均可显著促进神经功能恢复, 但富含miR-17-92团簇的MSCs-外泌体能进一步诱导改善功能预后, 并促进缺血大脑神经发生、少突胶质细胞生成以及神经元树突可塑性[51]。此外, 根据疾病的进程, 在脑缺血再灌注急性期修饰外泌体使其携带具有神经保护效应的miRNA, 而在侧重于恢复的慢性期给予内含神经修复功能miRNA的外泌体, 从而尽可能将其治疗的优势最大化[21]。
5 MSCs-外泌体应用于其他神经疾病的修复治疗近年来, 大量研究发现MSCs-外泌体在治疗其他一系列神经疾病中同样具有巨大的潜力, 包括阿尔茨海默症(Alzheimer's disease, AD)、帕金森病(Parkinson's disease, PD)、出血性脑卒中(intracerebral hemorrhage, ICH)等。ADMSCs-外泌体含有脑啡肽酶, 能够降解β淀粉样蛋白(Aβ), 与产生大量Aβ的细胞共培养时, 这些外泌体显著降低了Aβ40和Aβ42的水平[52]。经过修饰后的特殊外泌体在帕金森病的治疗中也显示出积极的作用。研究人员考察了携带siRNA的外泌体经转运, 下调小鼠大脑中与PD发病相关的蛋白α-synuclein的能力, 发现PD小鼠中多巴胺能神经元内蛋白质的沉积显著减少[53]。MSCs-外泌体对ICH的治疗作用同样已被证实。在ICH大鼠模型中, 将miR-133b修饰后的MSCs-外泌体经尾静脉注射入大鼠24 h后, 脑组织内miR-133b水平升高后下调RhoA表达量, 促进细胞外信号调节激酶1/2 (extracellular signal regulated protein kinase 1/2, ERK1/2)-环磷腺苷效应元件结合蛋白(cAMP-response element binding protein, CREB)磷酸化, 从而抑制神经元凋亡和神经退行性病变, 表现出对ICH实验大鼠脑损伤的神经保护作用[54]。在另一项实验中, 向ICH大鼠静脉注射MSCs-外泌体后通过增强纤维束完整性、脑白质修复以及轴突“萌芽”促进脑白质/轴突的重塑[55]。
除了上述神经疾病, 外泌体还被广泛应用于其他临床问题的研究。越来越多的证据表明, 外泌体对众多机制未明的疾病具有潜在的治疗效应。
6 总结与展望外泌体在体内发挥着调节生理病理过程作用的同时, 也能够应用于各种疾病的治疗研究中。近年来, 外泌体作为脑卒中和其他神经疾病的治疗手段经历了迅速的发展。众多临床前研究表明, 无论是天然的还是经过修饰后的外泌体, 都对脑卒中具有强大的神经修复作用[21], 其双层膜结构及纳米级尺寸能够避免包裹的多种活性分子被清除, 提高生物活性[56]。然而这些“货物”如何影响受损后脑内受体细胞内源性基因和蛋白的表达, 并发挥神经血管重塑、抑制炎症反应、改善脑内微环境等有利效应的确切分子机制仍有待进一步探索。如前所述, 尽管外泌体已成为治疗包括缺血性脑卒中在内的多种神经疾病的关键突破口之一, 但是它的产量低, 纯度不高, 携带的遗传信息种类及功能还未全部阐明, 并且可能会被相应的酶降解而失活。
目前, 大量基于外泌体治疗疾病的临床试验已通过注册, 然而, 将临床前研究转换为正式的临床试验仍面临多种挑战。临床试验需要扩大外泌体生产, 必须将过程标准化, 严格控制外泌体的纯度、分离方法、细胞培养条件和储存方法, 这些都可能对外泌体功能产生重大影响[33, 45]。最重要的是, 还应对外泌体治疗作详尽的安全性研究, 包括可能存在的多种并发症, 同时必须确保用于神经修复治疗的外泌体不会致癌。由于基因系统的重叠, 某些miRNA在促进脑卒中后CNS内细胞新生和组织重塑的同时, 可能也增加了患恶性肿瘤的风险[57]。
综上, 外泌体应用于缺血性脑卒中的诊断或治疗还有待进一步的研究, 围绕神经系统疾病与外泌体的大量探索和发现将为开发全新治疗手段带来曙光。
作者贡献:陈渺负责文章的数据信息收集、起草、撰写及修改; 李莉、杜冠华负责对文章指导、文章知识性内容作批评性审阅及获取研究经费; 申艳佳、杨冉、宋俊科负责对文章内容进行指导。
利益冲突:所有作者声明不存在利益冲突。
| [1] |
Azad TD, Veeravagu A, Steinberg GK. Neurorestoration after stroke[J]. Neurosurg Focus, 2016, 40: E2. |
| [2] |
Zhang L, Zhang ZG, Chopp M. The neurovascular unit and combination treatment strategies for stroke[J]. Trends Pharmacol Sci, 2012, 33: 415-422. DOI:10.1016/j.tips.2012.04.006 |
| [3] |
Zhang ZG, Chopp M. Exosomes in stroke pathogenesis and therapy[J]. J Clin Invest, 2016, 126: 1190-1197. DOI:10.1172/JCI81133 |
| [4] |
Grotta JC, Jacobs TP, Koroshetz WJ, et al. Stroke program review group[J]. Stroke, 2008, 39: 1364-1370. DOI:10.1161/STROKEAHA.107.510776 |
| [5] |
Final Report of the Stroke Progress Review Group-January2012|National Institute of Neurological Disorders and Stroke[EB/OL].[2020/5/4]. https://www.ninds.nih.gov/About-NINDS/Strategic-Plans-Evaluations/Strategic-Plans/Final-Report-Stroke-Progress-Review-Group-1#Top.
|
| [6] |
Chen J, Chopp M. Neurorestorative treatment of stroke:cell and pharmacological approaches[J]. NeuroRx, 2006, 3: 466-473. DOI:10.1016/j.nurx.2006.07.007 |
| [7] |
Benjamin EJ, Muntner P, Alonso A, et al. Heart disease and stroke statistics-2019 update:a report from the american heart association[J]. Circulation, 2019, 139: e56-e528. |
| [8] |
Li Y, Liu Z, Xin H, et al. The role of astrocytes in mediating exogenous cell-based restorative therapy for stroke[J]. Glia, 2014, 62: 1-16. DOI:10.1002/glia.22585 |
| [9] |
Chen J, Venkat P, Zacharek A, et al. Neurorestorative therapy for stroke[J]. Front Hum Neurosci, 2014, 8: 382. |
| [10] |
Zhang ZG, Chopp M. Neurorestorative therapies for stroke:underlying mechanisms and translation to the clinic[J]. Lancet Neurol, 2009, 8: 491-500. DOI:10.1016/S1474-4422(09)70061-4 |
| [11] |
Liu Z, Zhang RL, Li Y, et al. Remodeling of the corticospinal innervation and spontaneous behavioral recovery after ischemic stroke in adult mice[J]. Stroke, 2009, 40: 2546-2551. DOI:10.1161/STROKEAHA.109.547265 |
| [12] |
Zhang RL, Chopp M, Roberts C, et al. Ascl1 lineage cells contribute to ischemia-induced neurogenesis and oligodendrogenesis[J]. J Cereb Blood Flow Metab, 2011, 31: 614-625. DOI:10.1038/jcbfm.2010.134 |
| [13] |
Thion MS, Ginhoux F, Garel S. Microglia and early brain development:an intimate journey[J]. Science, 2018, 362: 185-189. DOI:10.1126/science.aat0474 |
| [14] |
González H, Elgueta D, Montoya A, et al. Neuroimmune regulation of microglial activity involved in neuroinflammation and neurodegenerative diseases[J]. J Neuroimmunol, 2014, 274: 1-13. DOI:10.1016/j.jneuroim.2014.07.012 |
| [15] |
Hu X, Leak RK, Shi Y, et al. Microglial and macrophage polarization-new prospects for brain repair[J]. Nat Rev Neurol, 2015, 11: 56-64. DOI:10.1038/nrneurol.2014.207 |
| [16] |
Yuan L, Li J. Exosomes in Parkinson's disease:current perspectives and future challenges[J]. ACS Chem Neurosci, 2019, 10: 964-972. DOI:10.1021/acschemneuro.8b00469 |
| [17] |
Boyiadzis M, Whiteside TL. Information transfer by exosomes:a new frontier in hematologic malignancies[J]. Blood Rev, 2015, 29: 281-290. DOI:10.1016/j.blre.2015.01.004 |
| [18] |
Lai RC, Chen TS, Lim SK. Mesenchymal stem cell exosome:a novel stem cell-based therapy for cardiovascular disease[J]. Regen Med, 2011, 6: 481-492. DOI:10.2217/rme.11.35 |
| [19] |
Mathivanan S, Ji H, Simpson RJ. Exosomes:extracellular organelles important in intercellular communication[J]. J Proteomics, 2010, 73: 1907-1920. DOI:10.1016/j.jprot.2010.06.006 |
| [20] |
Schneider A, Simons M. Exosomes:vesicular carriers for intercellular communication in neurodegenerative disorders[J]. Cell Tissue Res, 2013, 352: 33-47. DOI:10.1007/s00441-012-1428-2 |
| [21] |
Zhang ZG, Buller B, Chopp M. Exosomes-beyond stem cells for restorative therapy in stroke and neurological injury[J]. Nat Rev Neurol, 2019, 15: 193-203. DOI:10.1038/s41582-018-0126-4 |
| [22] |
Collino F, Bruno S, Incarnato D, et al. AKI recovery induced by mesenchymal stromal cell-derived extracellular vesicles carrying microRNAs[J]. J Am Soc Nephrol, 2015, 26: 2349-2360. DOI:10.1681/ASN.2014070710 |
| [23] |
Chopp M, Zhang ZG. Emerging potential of exosomes and noncoding microRNAs for the treatment of neurological injury/diseases[J]. Expert Opin Emerg Drugs, 2015, 20: 523-526. DOI:10.1517/14728214.2015.1061993 |
| [24] |
Zeng L, He X, Wang Y, et al. MicroRNA-210 overexpression induces angiogenesis and neurogenesis in the normal adult mouse brain[J]. Gene Ther, 2014, 21: 37-43. DOI:10.1038/gt.2013.55 |
| [25] |
Feliciano DM, Zhang S, Nasrallah CM, et al. Embryonic cerebrospinal fluid nanovesicles carry evolutionarily conserved molecules and promote neural stem cell amplification[J]. PLoS One, 2014, 9: e88810. DOI:10.1371/journal.pone.0088810 |
| [26] |
Yang J, Zhang X, Chen X, et al. Exosome mediated delivery of miR-124 promotes neurogenesis after ischemia[J]. Mol Ther Nucleic Acids, 2017, 7: 278-287. DOI:10.1016/j.omtn.2017.04.010 |
| [27] |
Fruhbeis C, Frohlich D, Kuo WP, et al. Extracellular vesicles as mediators of neuron-glia communication[J]. Front Cell Neurosci, 2013, 7: 182. |
| [28] |
Kramer-Albers EM, Bretz N, Tenzer S, et al. Oligodendrocytes secrete exosomes containing major myelin and stress-protective proteins:trophic support for axons?[J]. Proteomics Clin Appl, 2007, 1: 1446-1461. DOI:10.1002/prca.200700522 |
| [29] |
He X, Yu Y, Awatramani R, et al. Unwrapping myelination by microRNAs[J]. Neuroscientist, 2012, 18: 45-55. DOI:10.1177/1073858410392382 |
| [30] |
Zhang ZG, Chopp M. Promoting brain remodeling to aid in stroke recovery[J]. Trends Mol Med, 2015, 21: 543-548. DOI:10.1016/j.molmed.2015.07.005 |
| [31] |
Lafourcade C, Ramirez JP, Luarte A, et al. MiRNAs in astrocyte-derived exosomes as possible mediators of neuronal plasticity[J]. J Exp Neurosci, 2016, 10: 1-9. |
| [32] |
Luarte A, Cisternas P, Caviedes A, et al. Astrocytes at the hub of the stress response:potential modulation of neurogenesis by miRNAs in astrocyte-derived exosomes[J]. Stem Cells Int, 2017, 2017: 1719050. |
| [33] |
Xin H, Li Y, Chopp M. Exosomes/miRNAs as mediating cell-based therapy of stroke[J]. Front Cell Neurosci, 2014, 8: 377. |
| [34] |
Xin H, Li Y, Cui Y, et al. Systemic administration of exosomes released from mesenchymal stromal cells promote functional recovery and neurovascular plasticity after stroke in rats[J]. J Cereb Blood Flow Metab, 2013, 33: 1711-1715. DOI:10.1038/jcbfm.2013.152 |
| [35] |
Xin H, Li Y, Buller B, et al. Exosome-mediated transfer of miR-133b from multipotent mesenchymal stromal cells to neural cells contributes to neurite outgrowth[J]. Stem Cells, 2012, 30: 1556-1564. DOI:10.1002/stem.1129 |
| [36] |
Xin H, Wang F, Li Y, et al. Secondary release of exosomes from astrocytes contributes to the increase in neural plasticity and improvement of functional recovery after stroke in rats treated with exosomes harvested from microRNA 133b-overexpressing multipotent mesenchymal stromal cells[J]. Cell Transplant, 2017, 26: 243-257. DOI:10.3727/096368916X693031 |
| [37] |
Fu Y, Liu Q, Anrather J, et al. Immune interventions in stroke[J]. Nat Rev Neurol, 2015, 11: 524-535. DOI:10.1038/nrneurol.2015.144 |
| [38] |
Doeppner TR, Herz J, Gorgens A, et al. Extracellular vesicles improve post-stroke neuroregeneration and prevent postischemic immunosuppression[J]. Stem Cells Transl Med, 2015, 4: 1131-1143. DOI:10.5966/sctm.2015-0078 |
| [39] |
Chen K, Chen C, Wallace CG, et al. Intravenous administration of xenogenic adipose-derived mesenchymal stem cells (ADMSC) and ADMSC-derived exosomes markedly reduced brain infarct volume and preserved neurological function in rat after acute ischemic stroke[J]. Oncotarget, 2016, 7: 74537-74556. DOI:10.18632/oncotarget.12902 |
| [40] |
Hayon Y, Dashevsky O, Shai E, et al. Platelet microparticles induce angiogenesis and neurogenesis after cerebral ischemia[J]. Curr Neurovasc Res, 2012, 9: 185. DOI:10.2174/156720212801619018 |
| [41] |
Venkat P, Cui C, Chopp M, et al. MiR-126 mediates brain endothelial cell exosome treatment-induced neurorestorative effects after stroke in type 2 diabetes mellitus mice[J]. Stroke, 2019, 50: 2865-2874. DOI:10.1161/STROKEAHA.119.025371 |
| [42] |
Zheng Y, He R, Wang P, et al. Exosomes from LPS-stimulated macrophages induce neuroprotection and functional improvement after ischemic stroke by modulating microglial polarization[J]. Biomater Sci, 2019, 7: 237-249. |
| [43] |
Yeo RW, Lai RC, Zhang B, et al. Mesenchymal stem cell:an efficient mass producer of exosomes for drug delivery[J]. Adv Drug Deliv Rev, 2013, 65: 336-341. DOI:10.1016/j.addr.2012.07.001 |
| [44] |
EL AS, Mager I, Breakefield XO, et al. Extracellular vesicles:biology and emerging therapeutic opportunities[J]. Nat Rev Drug Discov, 2013, 12: 347-357. DOI:10.1038/nrd3978 |
| [45] |
Chen J, Chopp M. Exosome therapy for stroke[J]. Stroke, 2018, 49: 1083-1090. DOI:10.1161/STROKEAHA.117.018292 |
| [46] |
Kumar P, Wu H, McBride JL, et al. Transvascular delivery of small interfering RNA to the central nervous system[J]. Nature, 2007, 448: 39-43. DOI:10.1038/nature05901 |
| [47] |
Liu Y, Li D, Liu Z, et al. Targeted exosome-mediated delivery of opioid receptor Mu siRNA for the treatment of morphine relapse[J]. Sci Rep, 2015, 5: 17543. DOI:10.1038/srep17543 |
| [48] |
Rufino-Ramos D, Albuquerque PR, Carmona V, et al. Extracellular vesicles:novel promising delivery systems for therapy of brain diseases[J]. J Control Release, 2017, 262: 247-258. DOI:10.1016/j.jconrel.2017.07.001 |
| [49] |
Kalani A, Chaturvedi P, Kamat PK, et al. Curcumin-loaded embryonic stem cell exosomes restored neurovascular unit following ischemia-reperfusion injury[J]. Int J Biochem Cell Biol, 2016, 79: 360-369. DOI:10.1016/j.biocel.2016.09.002 |
| [50] |
Zhuang X, Xiang X, Grizzle W, et al. Treatment of brain inflammatory diseases by delivering exosome encapsulated anti-inflammatory drugs from the nasal region to the brain[J]. Mol Ther, 2011, 19: 1769-1779. DOI:10.1038/mt.2011.164 |
| [51] |
Xin H, Katakowski M, Wang F, et al. MiR-17-92 cluster in exosomes enhance neuroplasticity and functional recovery after stroke in rats[J]. Stroke, 2017, 48: 747-753. DOI:10.1161/STROKEAHA.116.015204 |
| [52] |
Katsuda T, Tsuchiya R, Kosaka N, et al. Human adipose tissue-derived mesenchymal stem cells secrete functional neprilysin-bound exosomes[J]. Sci Rep, 2013, 3: 1197. DOI:10.1038/srep01197 |
| [53] |
Cooper JM, Wiklander PB, Nordin JZ, et al. Systemic exosomal siRNA delivery reduced alpha-synuclein aggregates in brains of transgenic mice[J]. Mov Disord, 2014, 29: 1476-1485. DOI:10.1002/mds.25978 |
| [54] |
Shen H, Yao X, Li H, et al. Role of exosomes derived from miR-133b modified MSCs in an experimental rat model of intracerebral hemorrhage[J]. J Mol Neurosci, 2018, 64: 421-430. DOI:10.1007/s12031-018-1041-2 |
| [55] |
Otero-Ortega L, Gomez DFM, Laso-Garcia F, et al. Exosomes promote restoration after an experimental animal model of intracerebral hemorrhage[J]. J Cereb Blood Flow Metab, 2018, 38: 767-779. DOI:10.1177/0271678X17708917 |
| [56] |
Sun Z, Shi K, Yang S, et al. Effect of exosomal miRNA on cancer biology and clinical applications[J]. Mol Cancer, 2018, 17: 147. DOI:10.1186/s12943-018-0897-7 |
| [57] |
Carmichael ST. Emergent properties of neural repair:elemental biology to therapeutic concepts[J]. Ann Neurol, 2016, 79: 895-906. DOI:10.1002/ana.24653 |
 2020, Vol. 55
2020, Vol. 55


