2. 南京中医药大学江苏省中医药防治肿瘤协同创新中心, 江苏 南京 210023
2. Jiangsu Collaborative Innovation Center of Traditional Chinese Medicine Prevention and Treatment of Tumor, Nanjing University of Chinese Medicine, Nanjing 210023, China
血管生成素(angiopoietin, Ang)/Tie轴是介导血管重塑和血管新生成熟过程的信号通路[1]。在肿瘤血管生成过程中, Ang1与Tie2结合, 维持血管稳定, 而Ang2则竞争性拮抗Ang1, 使肿瘤血管处于不稳定状态。肿瘤组织内部含有丰富的血管网络, Ang2在肿瘤血管内皮细胞(endothelial cells, ECs)中高表达, 使肿瘤血管周细胞覆盖减少、基底膜被破坏、ECs和周细胞分离, 导致血管结构异常和功能性减弱, 肿瘤血管呈现紊乱、渗漏的特点, 进而抗肿瘤药物难以递送至肿瘤组织内部。肿瘤内部处于高酸、低氧微环境, 异常的血管结构也为肿瘤细胞的侵袭和转移提供了途径。靶向Ang/Tie轴的药物能够促进肿瘤血管正常化, 在防止肿瘤转移的同时能够与化疗药物或免疫检查点抑制剂联合使用, 增强药物的递送效率。促进肿瘤血管正常化的抗血管生成疗法与其他疗法的联合是治疗肿瘤的新策略[2]。本文就Ang/Tie轴在肿瘤血管生成和转移方面的作用进行阐述, 以期为临床治疗提供新思路, 为深入机制研究提供依据。
1 Ang/Tie轴的生物学功能Ang/Tie轴的生物学功能主要是调控血管的成熟和重塑过程。Tie是Ang的受体, 包含Tie1和Tie2。其中, Tie1是孤儿受体, 不与Ang结合, 在内皮细胞和少数造血干细胞表达, 通过异二聚化调节Tie2活性从而影响其信号传导[3]。Tie2表达于ECs、周细胞、单核细胞和巨噬细胞等, 可与Ang家族结合, 在血管的发育和稳定过程中发挥重要调节作用[4]。Ang家族主要包括Ang1、Ang2、Ang3和Ang4。Ang1和Ang2以相似亲和力与Tie2结合, 但是对ECs具有不同调控作用; Ang3和Ang4相关研究较少, 其特征与功能尚无定论。Ang1主要表达于周细胞和平滑肌细胞, 以旁分泌形式与Tie2结合, 维持血管稳定和ECs存活。Ang2仅在ECs表达, 并以自分泌形式作用于ECs, 是Ang1对Tie2的部分竞争性拮抗剂:即当Ang1缺失时, Ang2对Tie2具有激动作用, 可短暂替代Ang1发挥促血管稳定作用; 但当Ang1存在时, Ang2是其剂量依赖性拮抗剂, 可阻断Ang1对Tie2的磷酸化作用[5]。除了与Tie2结合, Ang2还可与整合素结合, 调节肌动蛋白骨架和细胞间的紧密连接。
Ang/Tie轴在妊娠期的血管和淋巴管发育中扮演重要角色, 参与调节血管生成、血管重塑和改变通透性等, 涉及癌症、败血症、糖尿病、动脉粥样硬化和眼部疾病等, 例如Tie1的缺失会导致肿瘤血管密度降低和血管灌注增加[6]。过度激活Tie2会引起败血症和炎症的发生, 抑制Tie2能够抑制肿瘤的血管生成[7]。Ang2的高水平表达能够阻断Ang1的促血管稳定作用, 并破坏基底膜, 增加血管通透性和炎症反应, 导致血管病变, 从而引起血管功能性疾病。
2 Ang/Tie轴的信号传导机制Ang/Tie轴的信号传导与细胞微环境密切相关, 并与整合素和血管内皮酪氨酸磷酸酶(vascular endothelial tyrosine phosphatase, VE-PTP)相互作用, 调节ECs和周细胞之间的连接, 影响血管稳定过程。Ang1与Tie2结合后, 可使Tie2磷酸化, 发挥促进血管稳定的作用。当Ang1存在时, Ang2通过阻断Tie2的磷酸化作用影响下游磷脂酰肌醇-3-激酶(phosphoinositide-3-kinase, PI3K)、生长因子受体结合蛋白2 (growth factor receptor-bound protein 2, GRB2)、大鼠肉瘤(rat sarcoma, RAS)信号通路。Ang2也可与整合素结合, 影响下游细胞外调节蛋白激酶(extracellular regulated protein kinases, ERK)信号通路, 破坏血管的稳定, 引起周细胞脱落, 与ECs分离, Tie1能在胞内调节Tie2活性, 胞外干扰Ang1与Tie2的结合, VE-PTP能够发挥对Tie2的去磷酸化作用, 增加血管通透性(图 1)。
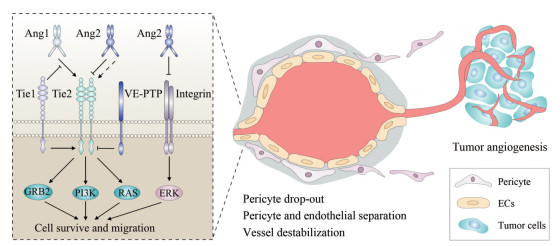
|
Figure 1 Part of angiopoietin (Ang)/Tie axis signaling mechanism and characteristics of tumor angiogenesis. Ang2 which is highly expressed in tumor vascular endothelial cells (ECs), antagonizes the binding of Ang1 and Tie2, and affects downstream phosphatidylinositol-3-kinase (PI3K), growth factor receptor-bound protein 2 (GRB2), and rat sarcoma (RAS) signaling pathways. Ang2 can also be combined with integrin, affecting the downstream extracellular regulated protein kinase (ERK) signaling pathway, disrupting the stability of blood vessels, causing pericytes to drop out and separate from ECs. Tie1 can regulate Tie2 activity intracellularly. External interference with the combination of Ang1 and Tie2, vascular endothelial tyrosine phosphatase (VE-PTP) can play the role of dephosphorylation of Tie2, increase vascular permeability |
Ang/Tie轴的信号传导依赖于细胞微环境, Ang受到炎性因子刺激后易位至ECs之间的连接处, Tie则易位至细胞外基质处[8]。Tie1和Tie2是ECs的受体, Ang2在炎症环境中从激动作用转化为抑制作用的过程与Tie1的切割作用有关[9]。Ang1通过PI3K激活Tie2, 抑制了转录因子叉头盒蛋白O1 (forkhead box protein O1, FOXO1)及其靶向的下游信号, Ang2竞争性阻断Ang1对Tie2的激活, 抑制Tie2磷酸化, 从而影响下游PI3K通路和ECs的迁移与存活[10]。Ang1和Tie2通过ECs的连接和肌动蛋白骨架的支撑维持血管稳定, 促进细胞间的紧密连结和维持肌动蛋白骨架的稳定, 能够有效避免因血管渗漏引发的组织水肿和缺氧[11]。在炎症环境中, 炎性因子会增加FOXO1活性, 增强ECs自分泌Ang2, 减弱Ang1/Tie2的信号传导[12]。Ang2的过多释放不仅抑制Tie2磷酸化水平并影响PI3K通路, 还会通过GRB2信号通路影响ECs的增殖和迁移[13]。在低氧条件刺激下, Ang2可通过缝隙连接蛋白43影响环磷酸腺苷和诱导型一氧化氮合酶的表达, 从而发挥血管调控作用[14]。在静息状态下, Ang1能够与Tie2结合而激活下游Ras信号, 减少细胞骨架重排, 维持血管稳定; 而在凝血酶刺激下, 则会引起血管内皮屏障的破坏[11, 15]。由此可见, 炎性因子、低氧、凝血酶等因素都会影响Ang/Tie信号, 从而引起对血管的调节作用。
2.2 Ang/Tie轴与整合素的相互作用整合素是异源二聚体构成的膜受体家族, 经α和β两个亚基通过非共价键连接而成, 是细胞黏附分子。Ang/Tie轴的信号传导受整合素调节, 整合素αVβ1能增强ECs中的Tie1和Tie2磷酸化及FOXO1活性, 使得ECs可合成大量黏附蛋白并释放到血管周围基质中[9, 16]。Tie2与整合素通过各自的胞外域相互作用, 其中αVβ3在肿瘤新生血管中高表达, 可影响细胞迁移并调节ECs增殖。有研究设计了同时靶向Tie2和αVβ3的双向抑制剂, 可有效抑制肿瘤侵袭和血管生成[17]。ECs中的整合素αVβ1作用于Tie1和Tie2胞外域的纤连蛋白, 并且在Tie2配体Ang1的配合下特异性地激活ERK通路的信号传导, 影响了ECs的存活和迁移, 表明Tie2对细胞外基质十分敏感[18]。在血管退化异常引起的缺血性视网膜疾病中, Ang1可同时激活Tie2和星形胶质细胞中的αVβ5, 发挥双重信号传导作用, 促进纤连蛋白向内皮细胞的积聚和径向分布, 刺激引导性血管生成与成熟, 促进成熟血管网络形成并抑制异常血管生成[19]。在高葡萄糖环境下, 来源于ECs的Ang2可诱导周细胞凋亡, 整合素αIIIβ1可作为Ang2的受体参与周细胞凋亡过程, 而通过血糖控制或阻断Ang2与整合素αⅢβ1的相互作用, 可作为早期糖尿病预防周细胞丢失而引起血管病变的治疗策略[20]。上述结果表明, Ang1、Ang2和Tie2与整合素共同调节了ECs与细胞外基质的相互作用, 整合素也可作为非内皮细胞或低水平表达Tie2的内皮细胞的Ang受体。
2.3 Ang/Tie轴与VE-PTP的相互作用酪氨酸激酶信号传导通路由酪氨酸磷酸酶调节, 其中包括VE-PTP。VE-PTP在ECs中表达, VE-PTP缺陷小鼠会发生胚胎死亡和血管生成受阻[21]。Ang1能够将VE-PTP招募至ECs的连接处, 促进血管内皮钙黏蛋白(vascular endothelial cadherin, VE-cadherin)发挥黏附活性和血管内皮屏障的作用[22]。当ECs缺乏VE-PTP时, VE-cadherin功能降低, 血管通透性增加[23]。但是, VE-PTP存在与Tie2胞内域相互作用的情况, VE-PTP可使Tie2去磷酸化, 增加血管的通透性[8]。在肿瘤血管中, 血管内皮生长因子(vascular endothelial growth factor, VEGF)和血管内皮生长因子受体2 (vascular endothelial growth factor receptor 2, VEGFR2)的高度表达使VE-PTP的作用发生改变。Ang1通过RhoA阻断VEGF和VEGFR2的结合, 降低VEGF对血管内皮屏障的破坏[24]。VE-PTP以依赖于Tie2的方式发挥对VEGFR2的去磷酸化作用, 促进内皮细胞极化和管腔形成[25], 活化的Tie2刺激下游Ras, 引起径向应力纤维的溶解, 保证血管内皮屏障的完整性[26]。
3 Ang/Tie轴对肿瘤的影响肿瘤内部有丰富的血管网络, 但这些血管不具有完整的血管功能, 呈现紊乱、渗漏等特点。Ang1和Ang2与Tie2的结合分别介导了血管的稳定化和去稳定化过程, 发挥着截然相反的调节作用, 影响肿瘤的发生发展。
3.1 Ang/Tie轴调控肿瘤血管生成有研究发现, Tie2不仅在ECs表达, 也在一些单核细胞中表达, Ang2通过刺激单核细胞Tie2可诱导人脐静脉内皮细胞生成更多的小管, Ang2在小鼠体内的过度表达可增加微血管密度, 减少周细胞覆盖, 增强肿瘤的缺氧程度, 并且可增强巨噬细胞在肿瘤中的浸润[27]。内皮细胞上的Tie1不与Ang结合, 主要与Tie2作用, 小鼠Tie1的缺失可以降低肿瘤血管密度, 增加肿瘤内皮细胞的凋亡, 从而抑制肿瘤血管生成, 并且该作用不影响正常血管。另外, Tie1缺失能增强Notch信号, 因此Tie1被认为是肿瘤血管生成的正向调节因子[6, 28]。
除了ECs和单核细胞, 一些巨噬细胞也表达Tie2, 这些巨噬细胞具有促进肿瘤血管生成的功能。在自发性乳腺癌小鼠模型和胰腺癌小鼠模型中, 阻断Ang2能有效诱导乳腺癌和胰腺癌血管的退化, 抑制乳腺癌和胰腺癌的生长。虽然阻断Ang2不能抑制肿瘤对表达Tie2巨噬细胞的募集, 但是可以阻碍Tie2水平的上调, 从而抑制肿瘤血管生成[29]。巨噬细胞浸润肿瘤组织, 可释放VEGF、白介素-8等因子, 维持肿瘤微环境, 促进肿瘤组织生长和血管生成[30]。特异性抑制Ang2可显著降低巨噬细胞Tie2的mRNA水平, 这可能是Ang2在转录水平上刺激了巨噬细胞中Tie2的表达, 也可能是通过Ang2调节酪氨酸激酶实现了对Tie2的作用[3]。下调Ang2的表达可显著抑制膀胱癌移植瘤的血管生成, 而上调Ang2表达可显著增加肿瘤组织内部的血管密度[31, 32]。肿瘤组织中Ang2的高表达使肿瘤血管处于不稳定状态, 靶向Ang进行干预, 激活Ang1和抑制Ang2可以使肿瘤生成的血管趋于正常化, 成为不渗漏的成熟血管。
3.2 Ang/Tie轴影响肿瘤转移Ang/Tie轴除了影响肿瘤血管生成, 对调节内皮屏障及肿瘤转移也发挥作用。肿瘤中Ang2高水平表达, 预示肿瘤更易转移和侵入。浸润性乳腺癌、转移性黑色素瘤和神经胶质瘤的转移潜能都与Ang2水平呈正相关。在B16F10黑色素瘤模型中, Ang2、基质金属蛋白酶3 (matrix metalloprotein 3, MMP3)和基质金属蛋白酶10 (matrix metalloprotein 10, MMP10)共同破坏了血管完整性, 导致血管通透性增加和循环肿瘤细胞外渗, 使用慢病毒转染敲低Ang2、MMP3和MMP10能有效抑制肿瘤转移[13]。Ang2介导的血管渗漏和通透性增加使得MMP渗漏至内皮细胞间隙, 促进肿瘤细胞的内渗, 进而增强其转移能力。在肿瘤转移过程中, 肿瘤细胞和ECs可相互作用, 转移的肿瘤细胞会侵入渗漏血管, 随后到达远端发生转移。肿瘤转移的微环境中ECs、巨噬细胞和肿瘤细胞相互接触, 肿瘤转移前微环境的情况能预示肿瘤远端转移的风险[33]。在肿瘤转移早期, VEGF水平的增加触发了钙调神经磷酸酶信号通路, 导致ECs过度活化, Ang2在肺部的ECs中上调, 破坏血管静息状态, 促使血管渗漏, 增加了肿瘤转移[34]。临床报道肺癌患者的瘤组织中的Ang2表达显著增加, Ang2水平与疾病恶化程度相关[35]。临床肝癌样本的免疫组化显示, Ang2和Tie2表达增强, Ang2/Ang1的mRNA比值在有血管浸润的病例中显著升高[36]。有研究报道, 缺失Ang2基因的小鼠在移植转移性结肠癌细胞后, 其肺转移降低, 而肝脏转移增加, 这可能与趋化因子配体1表达增加、中性粒细胞增加和肿瘤浸润有关, 表明Ang2对于肿瘤细胞的转移可能具有亲器官性[37]。
4 靶向Ang/Tie轴的抗肿瘤治疗策略Ang/Tie轴在肿瘤血管方面的作用已经受到广泛关注, 因此, 越来越多的研究开始关注于靶向Ang/Tie轴进行抗肿瘤血管生成的治疗策略。有研究报道[38], 在对Ang抑制剂最为敏感的Colo205肿瘤模型中, 使用Ang2抑制剂L1-7 (N)能降低肿瘤生长和肿瘤血管密度, 使肿瘤血管具有正常血管的诸多特征, 比如钙黏蛋白和黏附分子的积聚、周细胞覆盖增加、ECs芽生减少和血管分布更加均匀等, 而调控Ang1则对于肿瘤血管系统没有显著影响。这说明相比于Ang1, 抑制Ang2更具有治疗肿瘤的潜力[38]。使用人源化的Ang2单克隆抗体Clone3.19.3能够靶向Ang2/Tie2途径并有效抑制肿瘤血管生成、生长和转移, 可抑制肿瘤浸润性巨噬细胞的促血管生成活性, 避免肿瘤细胞对抗血管生成疗法出现抗性[31]。
Ang2抑制剂(Ang2-blocking antibody, ABA)能特异性阻断Ang2, 使肿瘤异常血管减少, 其联合化疗药物可加强肿瘤内部的血液灌注和药物递送, 改善肿瘤的缺氧和酸中毒状态, 抑制肿瘤生长和转移, 破坏肿瘤微环境[39]。Ang2抑制剂联合Tie2激活剂(Ang2-binding and Tie2-activating antibody, ABTAA)能同时抑制Ang2和活化Tie2, 促进肿瘤功能性血管生成, 增强ECs之间的紧密连接, 同时增加肿瘤血管的周细胞和基底膜覆盖, 使血管渗漏减少、灌注增强、氧含量和酸水平降低, 阻止肿瘤进一步恶化, 其与化疗药物联合应用可增强药物递送效率, 提高化疗药的药效[39]。除与化疗药物联合应用之外, Ang2抑制剂也与程序性死亡受体-1 (programmed cell death protein-1, PD-1)抑制剂联合使用。有研究报道[40], Ang2和血管内皮生长因子A (vascular endothelial growth factor A, VEGFA)的双特异性抗体(Ang2 and VEGFA blockade, A2V)能同时阻断Ang2和VEGFA, 并通过肿瘤内的吞噬细胞促进肿瘤血管消退, 促进血管正常化和周细胞的积聚, 其药效优于单独使用VEGFA抑制剂。A2V与PD-1抑制剂联合使用时, 可通过激活T淋巴细胞表达的干扰素降低肿瘤细胞免疫检查点程序性死亡配体-1 (programmed cell death ligand 1, PD-L1)的表达, 另外, 阻断PD-1能增强A2V在不同肿瘤模型中对肿瘤血管的控制, 显示了抗血管生成疗法和免疫疗法联用的广泛前景[40]。据3 000余例患者的临床实验研究报道, 抗血管生成疗法和免疫疗法的联合使用药效要优于各自单独使用[41]。免疫疗法中免疫检查点抑制剂的使用常会引起免疫过度激活, 造成炎症反应、肠道损伤和肝损伤等不良反应, 而抗血管生成药物能够促进肿瘤血管正常化, 增强淋巴细胞浸润, 提高免疫检查点抑制剂的疗效, 减少临床使用剂量, 进而减少药物带来的不良反应[42]。靶向Ang2/Tie2轴的抗血管生成疗法能够促进肿瘤血管的正常化, 联合化疗药物或免疫疗法则能更为有效地实现药物递送和发挥杀伤肿瘤作用, 以达到最佳抗肿瘤目的。
有关靶向Ang2药物的临床试验正在进行中, AMG780、MEDI3617、REGN910等Ang2抑制剂均处于对实体瘤治疗的临床Ⅰ期试验阶段[43, 44]。靶向Ang1和Ang2的AMG386处于治疗卵巢癌的临床Ⅲ期试验阶段, 也有同时靶向Ang2和VEGF的双向抑制剂CVX-241、RG7221等正处于临床前实验研究中[45-47]。这些研究为未来肿瘤的治疗提供了更多策略, 其相应药物的作用靶点、治疗肿瘤类型和作用机制总结见表 1。
| Table 1 Summary of Ang/Tie axis targeted agents in the treatment of cancer and mechanisms of action. Ang: Angiopoietin; ABA: Ang2-blocking antibody; ABTAA: Ang2-binding and Tie2-activating antibody; VEGF: Vascular endothelial growth factor; VEGFA: Vascular endothelial growth factor A; A2V: Ang2 and VEGFA blockade |
过度的血管新生是肿瘤十大特征之一, 肿瘤依靠血管维持自身生存[48]。肿瘤血管系统不同于正常血管系统, 正常血管处于静息状态, ECs增殖较少, ECs之间连接紧密, 并与平滑肌细胞、周细胞相互接触, 共同调节血管通透性。而肿瘤血管具有高增殖性的ECs以及松散的细胞间连接, 呈现血管渗漏的表型, 渗漏的肿瘤血管无法完全发挥血管运输作用, 这导致了肿瘤处于酸性、低氧环境中, 也使化疗药物无法到达肿瘤内部, 导致药效降低。抗肿瘤血管生成疗法最初是针对肿瘤内部血管数量过多而靶向血管生成过程中发挥重要作用的促血管生长因子及相关通路的抗血管生成剂而开发的, 最著名的为VEGF/VEGFR2抑制剂, 但是并非所有患者都对该抑制剂有反应, 有些患者在长期使用后出现了耐药性[49]。于是, 通过恢复肿瘤的血液灌注和氧气供应以使肿瘤血管正常化的学说被提出, 并开始了第二代抗血管生成剂的研发, 即靶向Ang/Tie轴的药物[49, 50]。Ang/Tie轴调节血管发育、血管稳态、病理性炎症和血管生成反应, 尤其在肿瘤血管生成中发挥重要作用。Ang2在肿瘤血管中的高表达可使肿瘤血管的周细胞分离、基底膜不完整、细胞间有间隙, 循环肿瘤细胞可以通过渗漏的肿瘤血管与肿瘤外部的管腔相连而发生肿瘤转移。基于Ang1、Ang2可介导血管稳定化与去稳定化之间的平衡, 更多的研究投入到Ang2的抑制剂以及Tie2的激动剂的开发中。这些研究都旨在通过调控Ang/Tie以纠正肿瘤血管的异常, 促使肿瘤血管正常化, 从而增强化疗药物或免疫疗法药物的递送, 增强药效, 发挥抗肿瘤的协同作用。靶向肿瘤血管的治疗从抑制血管生成发展到改善血管结构和功能, 从单一治疗发展到联合治疗, 未来研究可着眼于肿瘤细胞与ECs之间的信号交互, 解析肿瘤血管复杂的机制, 为新一代靶向肿瘤血管药物的开发提供依据和思路。
作者贡献:钱程负责图表制作及文章撰写; 郑维维和邹伟负责语句修改及文章润色; 杨春媚和张珊负责文献查找及段落分段建议; 吴媛媛和陆茵负责小结与展望撰写指导; 王爱云负责文章方向和思路的指导及文章修改意见回复。
利益冲突:所有作者均不存在利益冲突。
| [1] |
Jeltsch M, Leppänen VM, Saharinen P, et al. Receptor tyrosine kinase-mediated angiogenesis[J]. Cold Spring Harb Perspect Biol, 2013, 5: a009183. DOI:10.1101/cshperspect.a009183 |
| [2] |
Jain RK. Normalization of tumor vasculature:an emerging concept in antiangiogenic therapy[J]. Science, 2005, 307: 58-62. DOI:10.1126/science.1104819 |
| [3] |
De Palma M, Naldini L. Angiopoietin-2 TIEs up macrophages in tumor angiogenesis[J]. Clin Cancer Res, 2011, 17: 5226-5232. DOI:10.1158/1078-0432.CCR-10-0171 |
| [4] |
Teichert M, Milde L, Holm A, et al. Pericyte-expressed Tie2 controls angiogenesis and vessel maturation[J]. Nat Commun, 2017, 8: 16106. |
| [5] |
Yuan HT, Khankin EV, Karumanchi SA, et al. Angiopoietin 2 is a partial agonist/antagonist of Tie2 signaling in the endothelium[J]. Mol Cell Biol, 2009, 29: 2011-2022. |
| [6] |
La Porta S, Roth L, Singhal M, et al. Endothelial Tie1-mediated angiogenesis and vascular abnormalization promote tumor progression and metastasis[J]. J Clin Invest, 2018, 128: 834-845. DOI:10.1172/JCI94674 |
| [7] |
Parikh SM. Angiopoietins and Tie2 in vascular inflammation[J]. Curr Opin Hematol, 2017, 24: 432-438. DOI:10.1097/MOH.0000000000000361 |
| [8] |
Saharinen P, Eklund L, Miettinen J, et al. Angiopoietins assemble distinct Tie2 signalling complexes in endothelial cell-cell and cell-matrix contacts[J]. Nat Cell Biol, 2008, 10: 527-537. DOI:10.1038/ncb1715 |
| [9] |
Korhonen EA, Lampinen A, Giri H, et al. Tie1 controls angiopoietin function in vascular remodeling and inflammation[J]. J Clin Invest, 2016, 126: 3495-3510. DOI:10.1172/JCI84923 |
| [10] |
Wilhelm K, Happel K, Eelen G, et al. FOXO1 couples metabolic activity and growth state in the vascular endothelium[J]. Nature, 2016, 529: 216-220. DOI:10.1038/nature16498 |
| [11] |
David S, Ghosh CC, Mukherjee A, et al. Angiopoietin-1 requires IQ domain GTPase-activating protein 1 to activate Rac1 and promote endothelial barrier defense[J]. Arterioscler Thromb Vasc Biol, 2011, 31: 2643-2652. DOI:10.1161/ATVBAHA.111.233189 |
| [12] |
Ghosh CC, Thamm K, Berghelli AV, et al. Drug repurposing screen identifies Foxo1-dependent angiopoietin-2 regulation in sepsis[J]. Crit Care Med, 2015, 43: e230-e240. DOI:10.1097/CCM.0000000000000993 |
| [13] |
Huang H, Bhat A, Woodnutt G, et al. Targeting the ANGPT-TIE2 pathway in malignancy[J]. Nat Rev Cancer, 2010, 10: 575-585. DOI:10.1038/nrc2894 |
| [14] |
Xu J, Yang GM, Li T, et al. cAMP transfer across MEGJ mediates regulatory effect of Ang2 on hypo-reactivity after hypoxia in vascular smooth muscle cells[J]. Chin J Pathophysiol (中国病理生理杂志), 2018, 34: 41-46. |
| [15] |
Birukova AA, Zebda N, Cokic I, et al. p190RhoGAP mediates protective effects of oxidized phospholipids in the models of ventilator-induced lung injury[J]. Exp Cell Res, 2011, 317: 859-872. DOI:10.1016/j.yexcr.2010.11.011 |
| [16] |
Zhang J, Lu JJ, Li H, et al. Study of integrin α6β1 and Ang-1/Tie-2 on cerebral ischemic vascular nerve regeneration[J]. Mod Tradit Chin Med (现代中医药), 2018, 38: 122-129. |
| [17] |
Shlamkovich T, Aharon L, Koslawsky D, et al. Targeting the Tie2-αvβ3 integrin axis with bi-specific reagents for the inhibition of angiogenesis[J]. BMC Biol, 2018, 16: 92. DOI:10.1186/s12915-018-0557-9 |
| [18] |
Dalton AC, Shlamkovitch T, Papo N, et al. Constitutive association of Tie1 and Tie2 with endothelial integrins is functionally modulated by angiopoietin-1 and fibronectin[J]. PLoS One, 2016, 11: e0163732. DOI:10.1371/journal.pone.0163732 |
| [19] |
Lee J, Kim KE, Choi DK, et al. Angiopoietin-1 guides directional angiogenesis through integrin αvβ5 signaling for recovery of ischemic retinopathy[J]. Sci Transl Med, 2013, 5: 203ra127. |
| [20] |
Park SW, Yun JH, Kim JH, et al. Angiopoietin 2 induces pericyte apoptosis via α3β1 integrin signaling in diabetic retinopathy[J]. Diabetes, 2014, 63: 3057-3068. |
| [21] |
Dominguez MG, Hughes VC, Pan L, et al. Vascular endothelial tyrosine phosphatase (VE-PTP)-null mice undergo vasculogenesis but die embryonically because of defects in angiogenesis[J]. Proc Natl Acad Sci U S A, 2007, 104: 3243-3248. DOI:10.1073/pnas.0611510104 |
| [22] |
Mori M, Murata Y, Kotani T, et al. Promotion of cell spreading and migration by vascular endothelial-protein tyrosine phosphatase (VE-PTP) in cooperation with integrins[J]. J Cell Physiol, 2010, 224: 195-204. |
| [23] |
Broermann A, Winderlich M, Block H, et al. Dissociation of VE-PTP from VE-cadherin is required for leukocyte extravasation and for VEGF-induced vascular permeability in vivo[J]. J Exp Med, 2011, 208: 2393-2401. DOI:10.1084/jem.20110525 |
| [24] |
Zhao ZX, Pan Y. Relationship between Rho GTPase family regulation and vascular endothelial barrier function[J]. Acta Pharm Sin (药学学报), 2019, 54: 587-593. |
| [25] |
Hayashi M, Majumdar A, Li XJ, et al. VE-PTP regulates VEGFR2 activity in stalk cells to establish endothelial cell polarity and lumen formation[J]. Nat Commun, 2013, 4: 1672. DOI:10.1038/ncomms2683 |
| [26] |
Frye M, Dierkes M, Küppers V, et al. Interfering with VE-PTP stabilizes endothelial junctions in vivo via Tie-2 in the absence of VE-cadherin[J]. J Exp Med, 2015, 212: 2267-2287. DOI:10.1084/jem.20150718 |
| [27] |
Coffelt SB, Tal AO, Scholz A, et al. Angiopoietin-2 regulates gene expression in TIE2-expressing monocytes and augments their inherent proangiogenic functions[J]. Cancer Res, 2010, 70: 5270-5280. DOI:10.1158/0008-5472.CAN-10-0012 |
| [28] |
D'Amico G, Korhonen EA, Anisimov A, et al. Tie1 deletion inhibits tumor growth and improves angiopoietin antagonist therapy[J]. J Clin Invest, 2014, 124: 824-834. DOI:10.1172/JCI68897 |
| [29] |
Mazzieri R, Pucci F, Moi D, et al. Targeting the ANG2/TIE2 axis inhibits tumor growth and metastasis by impairing angiogenesis and disabling rebounds of proangiogenic myeloid cells[J]. Cancer Cell, 2011, 19: 512-526. DOI:10.1016/j.ccr.2011.02.005 |
| [30] |
Wu JW, Cao YZ, Yu SY, et al. Research progress in role of myeloid cells in tumor microenvironment and its mechanisms[J]. Chin Pharmacol Bull (中国药理学通报), 2018, 34: 149-153. |
| [31] |
Tu YT, Shu J, Tian WL, et al. Effects of down-regulation of human angiogenin on the growth of transplanted bladder cancer and the expression of p-Akt, p-GSK3β and p-mTOR[J]. Guangdong Med J (广东医学), 2015, 36: 501-504. |
| [32] |
Kunz P, Hoffend J, Altmann A, et al. Angiopoietin-2 overexpression in morris hepatoma results in increased tumor perfusion and induction of critical angiogenesis-promoting genes[J]. J Nucl Med, 2006, 47: 1515-1524. |
| [33] |
Rohan TE, Xue X, Lin HM, et al. Tumor microenvironment of metastasis and risk of distant metastasis of breast cancer[J]. J Natl Cancer Inst, 2014, 106: dju136. |
| [34] |
Minami T, Jiang S, Schadler K, et al. The calcineurin-NFAT-angiopoietin-2 signaling axis in lung endothelium is critical for the establishment of lung metastases[J]. Cell Rep, 2013, 4: 709-723. DOI:10.1016/j.celrep.2013.07.021 |
| [35] |
Cao YX, Peng YL, Deng HJ, et al. Analysis of serum angiopoietin-2 levels in patients with lung cancer[J]. China Med Pharm (中国医药科学), 2019, 9: 204-206. |
| [36] |
Deng W, Liang LJ. Effects of angiopioetins/Tie-2 and VEGF expression on hepatocellular carcinoma angiogenesis[J]. Chin J Gen Surg (中国普通外科杂志), 2005, 6: 436-440. |
| [37] |
Im JH, Tapmeier T, Balathasan L, et al. G-CSF rescues tumor growth and neo-angiogenesis during liver metastasis under host angiopoietin-2 deficiency[J]. Int J Cancer, 2013, 132: 315-326. DOI:10.1002/ijc.27677 |
| [38] |
Falcón BL, Hashizume H, Koumoutsakos P, et al. Contrasting actions of selective inhibitors of angiopoietin-1 and angiopoietin-2 on the normalization of tumor blood vessels[J]. Am J Pathol, 2009, 175: 2159-2170. DOI:10.2353/ajpath.2009.090391 |
| [39] |
Park JS, Kim IK, Han S, et al. Normalization of tumor vessels by Tie2 activation and Ang2 inhibition enhances drug delivery and produces a favorable tumor microenvironment[J]. Cancer Cell, 2016, 30: 953-967. DOI:10.1016/j.ccell.2016.10.018 |
| [40] |
Schmittnaegel M, Rigamonti N, Kadioglu E, et al. Dual angiopoietin-2 and VEGFA inhibition elicits antitumor immunity that is enhanced by PD-1 checkpoint blockade[J]. Sci Transl Med, 2017, 9: eaak9670. DOI:10.1126/scitranslmed.aak9670 |
| [41] |
Schmidt EV. Developing combination strategies using PD-1 checkpoint inhibitors to treat cancer[J]. Semin Immunopathol, 2019, 41: 21-30. DOI:10.1007/s00281-018-0714-9 |
| [42] |
Naidoo J, Page DB, Li BT, et al. Toxicities of the anti-PD-1 and anti-PD-L1 immune checkpoint antibodies[J]. Ann Oncol, 2015, 26: 2375-2391. DOI:10.1093/annonc/mdv383 |
| [43] |
Daly C, Eichten A, Castanaro C, et al. Angiopoietin-2 functions as a Tie2 agonist in tumor models, where it limits the effects of VEGF inhibition[J]. Cancer Res, 2013, 73: 108-118. DOI:10.1158/0008-5472.CAN-12-2064 |
| [44] |
Leow CC, Coffman K, Inigo I, et al. MEDI3617, a human anti-angiopoietin 2 monoclonal antibody, inhibits angiogenesis and tumor growth in human tumor xenograft models[J]. Int J Oncol, 2012, 40: 1321-1330. |
| [45] |
Doppalapudi VR, Huang J, Liu D, et al. Chemical generation of bispecific antibodies[J]. Proc Natl Acad Sci U S A, 2010, 107: 22611-22616. DOI:10.1073/pnas.1016478108 |
| [46] |
Molnar N, Siemann DW. Combined Ang-2 and VEGF targeting therapies in renal cell carcinoma[J]. J Cancer Ther, 2013, 4: 1-6. |
| [47] |
Biel NM, Siemann DW. Targeting the angiopoietin-2/Tie-2 axis in conjunction with VEGF signal interference[J]. Cancer Lett, 2016, 380: 525-533. DOI:10.1016/j.canlet.2014.09.035 |
| [48] |
Hanahan D, Weinberg RA. Hallmarks of cancer:the next generation[J]. Cell, 2011, 144: 646-674. DOI:10.1016/j.cell.2011.02.013 |
| [49] |
Viallard C, Larrivée B. Tumor angiogenesis and vascular normalization:alternative therapeutic targets[J]. Angiogenesis, 2017, 20: 409-426. DOI:10.1007/s10456-017-9562-9 |
| [50] |
Jain RK. Antiangiogenesis strategies revisited:from starving tumors to alleviating hypoxia[J]. Cancer Cell, 2014, 26: 605-622. DOI:10.1016/j.ccell.2014.10.006 |
 2020, Vol. 55
2020, Vol. 55


