纳米载体给药系统可以提高药物的口服生物利用度, 近年来在改善药物口服吸收方面受到了广泛关注[1]。尽管其具有不可替代的优势, 但由于“突释”严重, 药物快速释放, 给患者造成不良影响; 载体材料与很多药物的相容性差, 导致有些药物无法包载或载药量低; 药物容易泄露, 难以实现规模化生产等问题, 对口服吸收的改善十分有限[2-4]。因此, 如何利用新技术, 克服给药系统本身及体内吸收的问题是目前口服药物递送的热点研究之一[5]。
研究者们基于前药原理, 发展了药物-脂质共轭物(lipid-drug conjugates, LDC)技术, 该技术将药物和脂质通过共价结合形成新的化合物, 即采用中长链的脂肪酸(fatty acid)、甘油酯(glyceride)或磷脂(phospholipid)对药物进行亲脂性修饰, 赋予药物新的溶解特性[6-8]。LDC在药物递送方面有很多优势:首先, 亲脂性修饰能明显改变药物分子的物理化学性质, 显著提高药物的亲脂性和被脂质载体的包载能力, 并能增加跨膜能力, 从而改善药物的药动学和药效学行为[9, 10]; 其次, 亲脂性修饰, 可认为是将脂质配体引入药物分子的结构中, 更有利于生物膜上的多种活性受体识别并摄取LDC, 促进药物的主动转运吸收[11-13]。同时, 亲脂性修饰可以增加药物稳定性, 避免首过效应, 改善生物利用度[14]。另外, 亲脂性修饰的LDC具有控制释放、靶向肿瘤细胞、增强疗效、延长作用时间、减少原药不良反应和降低毒性等优点[15, 16]。目前, 美国食品药品监督管理局(Food and Drug Administration, FDA)已经批准通过了几个多肽类脂肪酸共轭物, 如地特胰岛素注射液(insulin detemir)和利拉普特(liraglutide)等。LDC是促进药物吸收、靶向肿瘤和增强疗效的突破口之一, 也是当前药学及相关科学研究领域的热点, 具有令人瞩目的应用前景[17, 18]。因此, 本文对目前LDC主要研究进行综述。
1 LDC共价键结合的方式方法LDC通常采用的脂质材料为脂肪酸、甘油酯和磷脂, 其结构中的羧基、羟基或磷酸基均为反应的活性位点, 这些活性官能团与药物通过酰化反应生成共价键, 旨在增加药物的脂溶性。不同脂质材料与药物共价键结合的方式如图 1[19]。
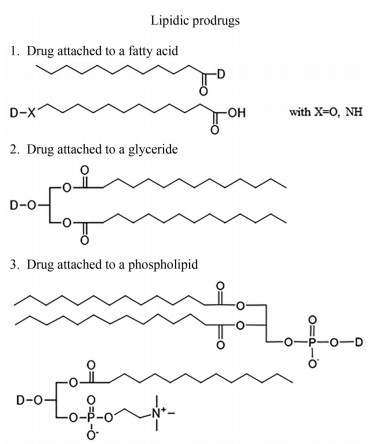
|
Figure 1 Types of lipids and conjugation sites used in lipid-drug conjugates (LDC): fatty acids, glycerides and phospholipids. Adapted from Ref. 19 with permission. Copyright ©2000 Elsevier Science B.V. |
药物与脂肪酸共轭物生成的共价键多以酯键或酰胺键的形式存在, 饱和脂肪酸中含羧基(-COOH), 药物结构中多含有羟基(-OH)或氨基(-NH2)。为了增加脂肪酸的反应活性, 通常先将脂肪酸转变为活性更强的脂肪酰氯, 再与药物在弱碱性的环境下进行酰化反应, 得到药物-脂质共轭物[20]。对于药物与不饱和脂肪酸的反应, 除了羧基的结合位点以外, 还可以在不饱和键(ω-position)的位置进行加成反应, 将脂肪链引入到药物的结构中。
药物与甘油酯的结合方式类似于脂肪酸, 由于甘油二酯和甘油单酯的结构中分别含有两个和单个羟基(-OH), 通常含羧基的药物被认为是很好的候选物, 如果药物结构中没有羧基, 在反应时可以引入中间体琥珀酸(succinic acid), 但是其有可能会影响药物释放[19], 进而影响药物活性。
磷脂结构中不仅含羟基, 而且含有磷酸基, 因此具有两个结合位点, 但大多反应集中在磷酸基的羟基上, 此外, 最近报道的一些磷脂与药物的合成方法是将药物取代磷脂分子中sn-2位的脂肪链部分[21, 22], 该合成多采用酶催化反应的方式, 通过磷脂酶A2 (phospholipases A2, PLA2)水解甘油磷酸酯sn-2位的酯键, 脱去1分子的脂肪酸, 使sn-2位具有活性反应基团羟基, 药物分子再与羟基以共价键的形式结合[23, 24]。
2 LDC的种类及其对原药生物活性的影响脂肪酸、甘油酯和磷脂大多来源于天然的动植物油脂, 不仅亲脂性强, 而且具有良好的安全性和相容性, 因此是制备LDC的最佳材料。根据脂质材料的种类将LDC分为脂肪酸、甘油酯、磷脂和胆固醇(应用较少)-药物共轭物, 不同的药物-脂质共轭物产生不同的生物活性。
2.1 药物-脂肪酸共轭物由于脂肪酸的种类很多, 分别以饱和脂肪酸和不饱和脂肪酸的两种类型进行论述。
2.1.1 药物-饱和脂肪酸共轭物目前有很多文献报道用饱和脂肪酸对药物进行亲脂性修饰, 包括短、中和长链的脂肪酸, 涵盖药物的品种也很广泛。Olbrich等[4]将亲水性的二脒那秦(diminazene)用硬脂酸(C18)修饰后, 发现共轭物的亲脂性增强, 延长了药物在体内的释放速度, 间接地起到了靶向治疗嗜眠病的作用。Neupane等[7]合成的硬脂酸(C18)-地西他滨(decitabine)明显增加了大鼠小肠的渗透性, 进而促进了原药吸收。月桂酸(C12)-促甲状腺素(thyrotropin releasing hormone)增加了原药的亲脂性, 通过肠灌流实验证明共轭物明显增加肠段部位的吸收, 并且保持原有的活性不变[10]。Ma等[25]研究的二十二酸(C22)-紫杉醇(paclitaxel)不仅增加了药物在血浆中的浓度, 提高了生物利用度, 而且抗转移性乳腺癌的活性也明显增强。Zhang等[10]合成了3种脂肪酸(C5、C8和C12)-伊立替康(irinotecan)共轭物, 采用HPLC检测发现, 共轭物的脂溶性随着脂肪链的增长而增强, 3种共轭物对人结肠癌细胞的毒性强于原药。Potter等[26]在姜黄素衍生物的基础上继续修饰了一系列不同链长的脂肪酸(C4、C12、C14、C16和C18等)共轭物, 发现大多数LDC在体外对多种肿瘤细胞(murine leukemic L1210 cells、human T-lymphocyte CEM cells和cervical HeLa cells)有明显的抑制作用, 并具有抗氧化的活性, 对人纤维细胞(human fibroblasts)的损伤程度低于常用的抗肿瘤药索拉菲尼(sorafenib), LDC的安全性良好, 不良反应低。以棕榈酸、硬脂酸、棕榈酸十六烷基酯和单硬脂酸甘油酯为主要原料, 与紫杉醇结合的共轭物, 增加溶解度, 降低与血浆蛋白的结合力, 降低与P-gp的亲和力, 进而增加靶细胞内药物的含量[27]。药物与饱和脂肪酸共轭物增加了原药的脂溶性, 使药物能更好地穿透细胞膜, 提高其在血浆中的浓度, 增强药物活性。
2.1.2 药物-不饱和脂肪酸共轭物用不饱和脂肪酸制备的LDC主要应用在抗肿瘤方面, 大多是十六碳(C16)以上的长链不饱和脂肪酸, 如:油酸(oleic acid)、亚麻酸(linolenic acid)、二十二碳六烯酸(docosahexaenoic acid, DHA)和三十碳六烯(squalene)等。喜树碱及其衍生物具有较强的抗肿瘤作用, 由于其结构含有内酯环, 导致其水溶性和稳定性都很差, 在喜树碱衍生物的结构中引入脂质后, 首先, 在稳定性方面有了较大改善(空间位阻效应避免内酯环开环降解), 并且避免了原药进入体内后与血浆蛋白结合后的代谢失活; 其次, 对多种肿瘤细胞(T-47D、Caco-2和Raji cells)显示出了高抗癌活性, 并且增强了Caco-2细胞吸收率[28]。Bradley等[29]合成的二十二碳六烯酸(DHA)-紫杉醇共轭物, 进入体内后没有活性, 直至降解释放出紫杉醇后发挥抗肿瘤作用, 其在组织中的分布和体内清除率分别低于原药的74和94倍, 而且在血浆中以高浓度前药的形式长时间循环, 靶向及抑制肿瘤生长的作用明显强于原药, 由于该共轭物具有较高的治疗指数, 通过了FDA的审批, 目前进行Ⅲ期临床试验[12]。另外, DHA与多柔比星(doxorubicin)的共轭物在白血病细胞(L1210 leukemia cells)和黑色素瘤的动物模型(L1210 leukemia和B16 melanoma)上具有强于原药多柔比星的抗肿瘤效果[30]。关于三十碳六烯(squalene)与不同药物的设计也有很多报道, 如:核苷类衍生物(nucleoside analogues)[31]、紫杉醇 [32]和顺铂(cisplatin)[33, 34]等, 这些LDC均对肿瘤细胞展现出了重要的细胞毒性作用。药物与不饱和脂肪酸共轭物增强了药物的稳定性, 使药物在血浆中长时间循环, 提高药物靶向肿瘤细胞的能力, 增强抗肿瘤效果。
2.2 药物-甘油酯共轭物甘油酯与多种不同活性的药物都有结合[35], 涉及的药物包括抗病毒药、非甾体抗炎药和抗肿瘤药等。
2.2.1 甘油酯与抗病毒药的共轭物比较典型的药物是地达诺新(didanosine), 属于核苷类抗HIV病毒药, 其亲水性强, 易发生首过效应, 生物利用度低, Skanji等[36, 37]设计了地达诺新与甘油二酯共轭物, 药动学研究发现地达诺新-脂质共轭物的半衰期延长了3倍, 在24 h时间点仍然有大量共轭物存在于不同组织中, 而且共轭物具有明显抑制HIV-1病毒的作用。
2.2.2 甘油酯与非甾体抗炎药的共轭物由于非甾体抗炎药(nonsteroidal antiinflammatory drugs, NSAIDs)具有胃肠道刺激的不良反应, 因此, 用甘油酯对布洛芬(ibuprofen)或甲灭酸(mefenamic acid)进行了亲脂性修饰, 以期获得安全有效的抗炎药。布洛芬、甲灭酸-甘油酯共轭物在血浆中的浓度均高于原药, 改善了口服生物利用度, 最大抗炎活性时间均有延迟, 尤其甲灭酸-甘油酯共轭物表现出较强的镇痛作用, 两种LDC对胃部刺激作用均低于原药[38, 39]。
2.2.3 甘油酯与抗肿瘤药的共轭物为了增加药物的抗肿瘤效果, 设计亲脂性的抗肿瘤药已成为药剂学领域研究的热点之一, 如将美法仑(melphalan)和甲氨蝶呤(methotrexate)分别用甘油二酯修饰后, 原药的亲脂性明显增加, 尤其甲氨蝶呤-甘油酯共轭物克服了肿瘤细胞的耐药性, 对肿瘤细胞生长必需的叶酸载体(folate carrier)有显著抑制作用, 抑制叶酸的作用是原药的114倍[40, 41]。
2.3 药物-磷脂共轭物目前有关磷脂前药的研究主要集中在抗肿瘤药方面, 也有少数文献报道关于非甾体抗炎药和抗病毒药的磷脂修饰, 下面介绍几种采用磷脂修饰药物的典型例子。
前列腺素类药物具有抑制肿瘤细胞生长的作用, 其抗肿瘤活性与药物的亲脂性成正比, 因此, Pedersen等[22]设计了前列腺素-磷脂共轭物, 通过稳定性实验发现PLA2可以水解LDC。在细胞毒性实验中, 不论PLA2是否存在, 前列腺素-磷脂共轭物均对HT-29和Colo205肿瘤细胞产生致死作用, 说明共轭物抑制肿瘤细胞生长。脱氧胞苷(deoxycytidine)类似物-磷脂共轭物对MCF-7肿瘤细胞和代表多药耐药表达的BC-19细胞产生毒性, 表明LDC对易产生耐药的肿瘤细胞有明显抑制作用。此外, 脱氧胞苷类似物中的吉西他滨(gemcitabine)-磷脂共轭物具有良好的耐受性且能延长患者的存活时间, 提高存活率[42]。贝沙罗汀(bexarotene)-磷脂共轭物细胞毒性实验显示抗肿瘤活性强于其原药[43]。而克拉屈滨(cladribine)和氟达拉滨(fludarabine)-磷脂共轭物虽然口服生物利用度与原药等同, 但对恶性肿瘤细胞的抑制作用低于原药, 通过降解实验得知, LDC水解释放原药的速度缓慢, 而只有原药具有抗肿瘤活性, 因此表现出持续低缓的生物活性[44]。
Lichtenberger等[45]合成的非甾体抗炎药(NSAIDs)-磷脂共轭物克服了原药活性pH值依赖的缺点, 在动物实验中预先给予奥美拉唑或雷尼替丁等胃酸分泌抑制剂时, LDC组明显减轻胃溃疡和胃出血的程度, 进而表明前药可以大大降低NSAIDs类药物对胃部刺激的不良反应。
病毒唑(ribavirin)是广谱的抗病毒药, 由于对红细胞产生溶血作用, 影响其在临床方面的应用。为了克服这一缺点, Dong等[46, 47]设计了病毒唑-磷脂共轭物, 发现其对有核细胞有选择性, 而对无核的红细胞不识别。通过与原药比较, LDC提高了对丙型肝炎复制子(hepatitis C virus replicon)和流感病毒的抗病毒活性, 而不影响红细胞中ATP酶的水平, 表明LDC不但削弱了红细胞的摄取而且增强了HepG2肝细胞的摄取。LDC也增加了原药的口服生物利用度、耐受性良好, 且持续在肝脏中积累, 这些结果均表明病毒唑-磷脂共轭物具有安全低毒和高效的优点。因此药物与磷脂共轭物可显著增加原药的口服生物利用度, 增强疗效, 降低不良反应。
3 LDC在纳米给药系统方面的应用纳米载体给药系统具有较小的粒径和较大的分散性, 有利于保持药物以溶解分散状态存在, 并可增大药物与胃肠道的接触面积, 促进药物溶出[8, 48]。目前常见的药物-脂质共轭物纳米载体制剂包括:生物降解型纳米粒(脂质纳米粒和聚合物纳米粒)、脂质体和胶束等[49]。由于固体脂质纳米粒(solid lipid nanoparticles, SLNs)和脂质体的材料大多是甘油酯和磷脂, 其与LDC的生物相容性好, 特别是SLNs更易实现高载药量、高包封率的目标, 因此是LDC纳米载体的常用剂型[50]。
3.1 生物降解型纳米粒根据所用纳米粒材料的种类, 将纳米粒具体分为脂质纳米粒和聚合物纳米粒两种类型, 其中脂质纳米粒是制备LDC纳米给药系统的首选剂型。
3.1.1 脂质纳米粒Yu等[51]采用物理凝聚法将水溶性的5-氟尿嘧啶(5-FU)-硬脂酸(C18)共轭物制成脂质纳米粒, 其平均粒径为240.19 nm, 载药量提高至20.53%, 具有明显的肝靶向效果。同样, 亲水性的二脒那秦很难制成脂质纳米粒, 而二脒那秦-硬脂酸共轭物纳米粒的载药量高达33% (w/w), 显著提高了脂质载体对原药的包载能力[4]。Li等[52]用硬脂酸-八聚精氨酸(stearic acid-octaarginine)修饰的紫杉醇(paclitaxel)固体脂质纳米粒, 可显著促进紫杉醇的口服吸收。Stevens等[53]将紫杉醇用胆固醇修饰后, 采用透析法制得SLNs, 其平均粒径为130 nm, 药/脂比为1:20, 包封率高达90%, 具有靶向叶酸受体的作用。有些药物的结构中引入脂质分子后, 脂溶性增加, 在制备纳米粒时, 不需要其他脂质材料, 共轭物本身就可作为骨架材料制备SLNs, Minelli等[54, 55]合成的丁酸-胆固醇共轭物, 采用微乳法自组装成脂质纳米粒, 其平均粒径约80 nm, 粒径分布为0.24, 呈现出良好的稳定性, 能有效抑制肿瘤的生长。同样, 通过高压均质法将卡培他滨(capecitabine)-脂肪酸共轭物自组装成粒径约700 nm的SLNs, 其对动物乳腺癌有较强的抑制作用[56, 57]。Bui等[58]利用三十碳六烯(squalene, Sq)设计了一种自组装的多功能性纳米粒: ①吉西他滨(gemcitabine)-三十碳六烯(Gem-Sq), 对抑制实体瘤有很好的效果; ②罗丹明(rhodamine)-三十碳六烯(Rho-Sq), 仍然保持发射荧光的特性[59]; ③生物素(biotin)-三十碳六烯(Biotin-Sq)[60], 凭借生物素受体选择性靶向肿瘤细胞。通过调整以上3种共轭物的比例, 采用纳米沉淀法自组装成粒径为150 nm、多分散指数(PDI)为0.15的多功能性纳米粒, 其明显增加细胞的摄取率, 成功地靶向多种肿瘤细胞, 其结构及自组装过程见图 2[61]。
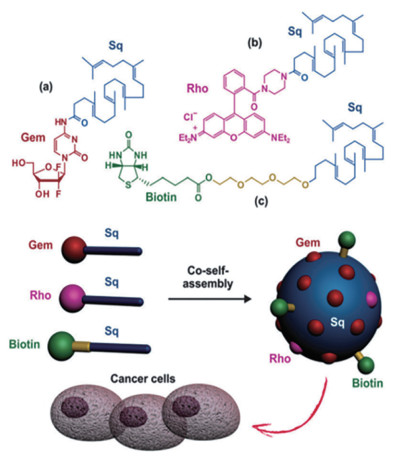
|
Figure 2 Structure of gemcitabine-squalene (Gem-Sq, a), rhodamine-squalene (Rho-Sq, b) and biotin-squalene (Biotin-Sq, c), and their co-self-assembly to prepare multifunctional nanoparticles for cancer cell targeting. Adapted from Ref. 61 with permission. Copyright ©2014 The Royal Society of Chemistry |
药物与脂质结合后脂溶性增加, 与脂质载体材料的相容性好, 易制成脂质纳米粒, 极大地增加了原药的载药量和包封率。有些共轭物本身作为骨架材料可以自组装成纳米粒, 减少处方中脂质材料的使用, 制备的纳米粒呈现出良好的稳定性, 提高了肿瘤细胞对药物的摄取率, 使更多的药物能够靶向肿瘤细胞。
3.1.2 聚合物纳米粒仅有少数文献报道有关LDC聚合物纳米粒, 虽然其包封率较高, 但载药量很低, 因此不能实现工业化生产, 有待进一步提高。Zhu等[62]将吉西他滨-硬脂酸共轭物制成PLGA纳米粒, 平均粒径为206 nm, PDI为0.18, 包封率和载药量分别为72.6%和2.4%。同样, 吉西他滨-棕榈酸共轭物PLGA纳米粒包封率大于85%, 而载药量仍然没有明显提高[63]。为了提高吉西他滨在聚合物材料中的载药量, Harrisson等[64]用聚异戊二烯(polyisoprene, PI)对吉西他滨进行共轭修饰, 自组装形成聚合物纳米粒, 粒径在约130 nm左右, 分布较窄, 如图 3。这些研究结果进一步说明, 药物与脂质材料的相容性对纳米粒的制备有着至关重要的影响[64], LDC更适合包载在脂质材料的纳米载体中。
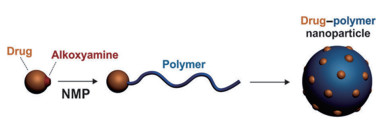
|
Figure 3 Strategy to achieve well-defined drug-polymer conjugate nanoparticles by nitroxide-mediated polymerization (NMP). Adapted from Ref. 64 with permission. Copyright©2013 Wiley-VCH Verlag GmbH & Co. |
脂质体具有出色的包封力、生物相容性和安全性[65], 因此脂质体也是制备LDC纳米载体的常用剂型。Pedersen等[21]分别用棕榈酸(C16)和硬脂酸(C18)与苯丁酸氮芥(chlorambucil)共轭后, 制得的脂质体粒径约86~125 nm, PLA2酶能水解LDC, 在酶存在的条件下, LDC对HT-29、MT-3和ES-2肿瘤细胞产生毒性。Gabizon等[66, 67]采用高压均质法制备丝裂霉素C (mitomycin-C)-脂质共轭物脂质体, 其粒径约为45~56 nm, 药/脂比为5:95 (w/w), 药物动力学研究结果显示, LDC组半衰期明显延长, 抗肿瘤效果强于对照组。另外, 将吉西他滨[68, 69]、5-氟尿嘧啶脱氧核苷(5-fluorodeoxyuridine)[70]、柔红霉素(daunorubicin)[71]等的LDC均制成了脂质体, 并对抗肿瘤活性进行了研究, 这些LDC脂质体的抗肿瘤活性均高于原药。
在LDC脂质体的研究中, 很少报道载药量和包封率的数据, 仅有的数据中最大载药量也低于5%, 表明LDC在脂质体中的载药量较低。
3.3 胶束载LDC胶束的研究甚少, 主要是采用不同材料制备吉西他滨-硬脂酸(C18)共轭物纳米胶束。Zhu等[72]设计了载吉西他滨-C18共轭物新型酸敏感胶束, 当载药量为9.7%时, 包封率为95%, 粒径约为52 nm, 动物体内实验表明, 通过胶束载体, 延长了LDC在体内的循环时间, 有利于药物在肿瘤部位累积, 载LDC胶束组抗肿瘤活性远远强于LDC及吉西他滨溶液组。同样是吉西他滨-C18共轭物, Wang等[73]制备的PEG-DSPE/TPGS混合胶束, 粒子的粒径为11.8 nm, PDI为0.38, 载药量和包封率分别约为13%和95%。对照原药, 载LDC混合胶束组显著延长了循环时间, 在肿瘤部位的累计量是对照组的3倍, 对胰腺癌具有良好的治疗作用。
本课题组制备了不同链长脂肪酸(C6、C12、C18)-水飞蓟宾(silybin, SB)共轭物磷脂/胆盐混合胶束, 平均粒径均在50 nm左右, 6C-SB、12C-SB和18C-SB混合胶束的载药量分别为8.78%、9.06%和8.91%, 包封率均达到100%, 以水飞蓟宾固体分散体微丸为参比制剂, 6C-SB、12C-SB和18C-SB混合胶束的生物利用度分别是固体分散体微丸的7.13、8.71和7.85倍。在水飞蓟宾的结构上引入脂肪链后, 显著增加了水飞蓟宾的脂溶性和在脂质载体材料中的包载量与包载效率, 均能显著提高水飞蓟宾的生物利用度[74]。尽管LDC胶束方面的研究较少, 但其延长了药物的半衰期, 提高了生物利用度, 生物活性也有明显提高。
4 LDC在体内的吸收机制研究 4.1 LDC在体内的降解通常LDC既要在胃酸及肠道消化酶作用下保持稳定、避免代谢, 又要在血液和组织中能被相关酶水解释放出原药而发挥作用。随着研究的不断深入, 越来越多的文献报道关于LDC在体内的稳定性。
对于药物-脂肪酸共轭物, 有文献[75, 76]报道, 存在于细胞中的羧酸酯酶(carboxylesterases)能水解药物-脂肪酸共轭物的酯键, 最终释放出有活性的原药, 而羧酸酯酶对碳链长度为C2~C12的LDC有很好的水解活性, 当链长增加到C16时, 水解能力几乎消失, 随着烷基链增长, 羧酸酯酶的降解活性逐渐减弱, LDC也越来越稳定。该结论与本课题组前期关于不同链长脂肪酸(C6、C12、C18)-水飞蓟宾共轭物的稳定性结果吻合。另外, 细胞摄取和跨膜转运结果显示:共轭物C6-SB稳定性差, 在胞内完全被水解, 中长链的共轭物(C12-SB和C18-SB)稳定性较好, 尤其长链的C18-SB结构较稳固, 只有部分在胞内发生水解, 长链脂肪酸共轭物不易降解可能与其空间位阻有关[77]。Yamada等[78]对促甲状腺素(thyrotropin-releasing hormone)-月桂酸的稳定性进行了研究, 发现药物-脂肪酸共轭物在血浆中稳定, 但在小肠黏膜中逐渐降解释放出原药。此外, 齐多夫定(zidovudine)与月桂酸、油酸共轭物经口服后, 在进入肠上皮细胞的过程中进行生物转化, 降解释放出原药[79]。
对于甘油酯和磷脂LDC在体内的降解研究主要集中在PLA2对酯键的水解作用。多数的甘油酯和磷脂LDC在体内能被PLA2水解释放出原药, 也有少数药物与磷脂的共轭物在体内稳定, 降解几乎不发生, 而且前药共轭物仍然具有原药的活性, 下面举例说明: ①降解的药物-甘油酯共轭物:多肽(peptides)-甘油酯共轭物不能以完整的前药形式跨过肠道屏障, 在吸收过程中易降解[80]。通过比较麦考酚酸(mycophenolic acid)与脂肪酸、甘油酯共轭物的稳定性, 发现两种性质的共轭物都能被酶水解, 但脂肪酸共轭物更易发生降解[81]。酪洛芬(ketoprofen)-甘油酯共轭物在脑毛细血管中和脑组织中能发生降解, 脂溶性的LDC穿过血脑屏障, 随后快速地发生水解释放出酪洛芬[82]。甲氨蝶呤-甘油酯共轭物在细胞内酯酶(intracellular esterases)的水解作用下释放出原药[41]; ②降解的药物-磷脂共轭物:吲哚美辛(indomethacin)-磷脂共轭物在小肠吸收和进入系统循环的过程中被PLA2逐渐水解, 释放出原药发挥活性, 起到了控制释放的作用。体外降解实验显示, 大约60% LDC被降解[83]。前列腺素-磷脂共轭物可以被PLA2水解, 但是不同的前列腺素衍生物-磷脂共轭物表现出不同的降解程度[22]。贝沙罗汀-磷脂共轭物在中性条件下稳定, 而在弱酸性环境下发生有效降解, 释放出原药[43]。克拉屈滨、氟达拉滨-磷脂共轭物在体内发生水解释放原药的速度缓慢[44]; ③稳定、不易降解的药物-磷脂共轭物:丙戊酸(valproic acid)-磷脂共轭物在体外血清中稳定, 仅有4.8% LDC降解, 在体内胃肠道环境下以共轭物的形式存在, 不易发生降解, 并且已完整形态进入肠上皮细胞[84]。同样, 丙戊酸、布洛芬-磷脂共轭物的PLA2降解实验发现, PLA2仅降解磷脂结构sn-2位的脂肪酸, 而用布洛芬代替sn-2位脂肪酸制得的布洛芬-磷脂共轭物表现出明显的抑制酶水解的作用, 并且具有良好的耐酶性, 因此布洛芬-磷脂共轭物不易被PLA2水解[85]。丝裂霉素C-脂质共轭物在血浆中表现出稳定性质, 24 h的累积降解率为5%, 当在强还原剂(dithiotreitol)存在下, LDC几乎完全降解释放出丝裂霉素C[66]。丝裂霉素C脂质共轭物所获得的结果表明, 精心设计的药物-脂质共轭物是改善药物药代动力学特性的有效手段[86]。
4.2 LDC的淋巴吸收转运淋巴转运可避免肝脏首过效应, 增加亲脂性药物的口服生物利用度[87-90], 口服亲脂性药物(logP>5)后, 有潜在通过淋巴途径转运的可能[91], 见图 4[92]。藉此途径, 将口服吸收差的药物进行亲脂性修饰, 以达到促进其口服吸收的目的。
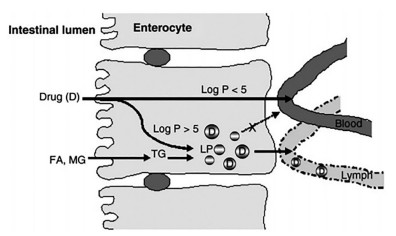
|
Figure 4 Drug absorption via the intestinal lymphatic system and portal vein. FA: Fatty acid; MG: Monoglyceride. Adapted from Ref.92 with permission. Copyright© 2007 Elsevier B.V. |
有不少文献报道关于药物-脂质共轭物通过淋巴途径进入体循环。如:对萘普生(naproxen)、烟酸(nicotinic acid)-不同链长的甘油酯共轭物进行淋巴吸收的比较, 发现淋巴吸收的程度与烷基链的长度成正比[93]。丙戊酸-磷脂共轭物的口服吸收机制研究中, 发现60% LDC通过淋巴途径转运, LDC与肠上皮细胞中的乳糜微粒结合后进入体循环[84]。麦考酚酸-甘油酯共轭物与油酸等脂质成分一起服用时, 发现多于97% LDC与乳糜微粒结合, 显著增加LDC在淋巴中的转运[94]。睾酮-甘油酯共轭物通过淋巴途径进入体循环, 避免了原药的高首过效应, 使血浆中的睾酮含量增加了90倍。因此, LDC技术为易产生首过效应的药物开辟了新的吸收途径[95]。
4.3 LDC通过转运体促进药物的吸收药物-脂质共轭物可认为是将脂质配体引入药物分子的结构中, 更利于生物膜上的多种活性受体识别, 并以受体介导的内吞方式摄取LDC[11]。此外, 用脂肪酸修饰得到的LDC, 容易与生物膜上的脂蛋白(即脂肪酸转运体)结合, 具有靶向生物膜上的脂肪酸转运体的作用, 并通过脂肪酸转运体促进药物的主动转运吸收[12, 13]。
5 总结与展望为了克服药物的口服吸收差、疗效低、毒副作用和首过效应等缺点, 基于前药原理, 采用脂质材料(脂肪酸、甘油酯、磷脂和胆固醇等)与药物进行共价键结合, 得到药物-脂质共轭物, 增加了药物的亲脂性, 促进了其与生物膜的融合, 使其容易透过生物屏障, 促进吸收, 进而提高了原药的生物活性。另外, 从制备纳米载体的角度出发, LDC显著增加药物被脂质载体的包载能力, 有些LDC可以自组装成脂质纳米粒, 减少了制剂辅料的使用, 易于工业化生产。
大多数LDC进入体内后被多种酶水解释放出原药, 脂质材料的脂肪链越长, 脂溶性越大, 越不容易降解, 有些LDC的酯键可能由于受到空间位阻等保护作用, 具有良好的耐酶性, 不易降解。LDC通过淋巴途径进行体循环的可能是存在的, 为促进药物的吸收开辟了新的途径。然而, 要想将LDC广泛应用到诸多药物中, 还需解决其本身固有的缺陷, 首先, LDC是药物和脂质材料通过活性位点共价键结合的产物, 这就要求药物分子的结构中必须含有羟基、氨基和羧基等活性基团, 然而很多药物分子, 如生物碱等结构中不含这些活性基团, 为共轭物的产生带来了难题; 其次, LDC改变了原药的物理化学属性, 目前的研究仅集中在对原有活性是否有所提高, 很多抗肿瘤LDC的研究只是检测对肿瘤细胞的抑制作用, 至于LDC是否存在其他药理活性, 以及对正常细胞的毒性少有阐述。另外, 对LDC进入体内后的生物利用度及促进药物吸收的机制研究相对缺乏。总之, LDC体内吸收机制及体内命运对LDC技术的发展具有重要意义。
作者贡献:马玉花为本文的第一作者和通讯作者, 负责综述整体结构的设计和撰写工作; 方玉和保怡负责前沿文献调研整理和稿件修改; 林鹏程负责部分内容的撰写、审核与校订; 潘国庆负责相关文献收集和整理; 盖祥云参与了部分内容的撰写。
利益冲突: 本文的所有作者不存在利益冲突。
| [1] |
Xing Q, Song J, You X, et al. Microemulsions containing long-chain oil ethyl oleate improve the oral bioavailability of piroxicam by increasing drug solubility and lymphatic transportation simultaneously[J]. Int J Pharm, 2016, 511: 709-718. |
| [2] |
Date T, Paul K, Singh N, et al. Drug-lipid conjugates for enhanced oral drug delivery[J]. AAPS PharmSciTech, 2019, 20: 41. DOI:10.1208/s12249-018-1272-0 |
| [3] |
Luo C, Sun J, Liu D, et al. Self-assembled redox dual-responsive prodrug-nanosystem formed by single thioether-bridged paclitaxel-fatty acid conjugate for cancer chemotherapy[J]. Nano Lett, 2016, 16: 5401-5408. DOI:10.1021/acs.nanolett.6b01632 |
| [4] |
Olbrich C, Gessner A, Kayser O, et al. Lipid-drug-conjugate (LDC) nanoparticles as novel carrier system for the hydrophilic antitrypanosomal drug diminazenediaceturate[J]. J Drug Target, 2002, 10: 387-396. DOI:10.1080/1061186021000001832 |
| [5] |
Kollipara S, Gandhi RK. Pharmacokinetic aspects and in vitro-in vivo correlation potential for lipid-based formulations[J]. Acta Pharm Sin B, 2014, 4: 333-349. DOI:10.1016/j.apsb.2014.09.001 |
| [6] |
Zaro JL. Lipid-based drug carriers for prodrugs to enhance drug delivery[J]. AAPS J, 2015, 17: 83-92. DOI:10.1208/s12248-014-9670-z |
| [7] |
Neupane YR, Sabir MD, Ahmad N, et al. Lipid drug conjugate nanoparticle as a novel lipid nanocarrier for the oral delivery of decitabine:ex vivo gut permeation studies[J]. Nanotechnology, 2013, 24: 415102. DOI:10.1088/0957-4484/24/41/415102 |
| [8] |
Das S, Chaudury A. Recent advances in lipid nanoparticle formulations with solid matrix for oral drug delivery[J]. AAPS PharmSciTech, 2011, 12: 62-76. DOI:10.1208/s12249-010-9563-0 |
| [9] |
Zaro JL. Lipid-based drug carriers for prodrugs to enhance drug delivery[J]. AAPS J, 2015, 17: 83-92. DOI:10.1208/s12248-014-9670-z |
| [10] |
Zhang C, Jin S, Xue X, et al. Tunable self-assembly of irinotecan-fatty acid prodrugs with increased cytotoxicity to cancer cells[J]. J Mater Chem, 2016, 4: 3286-3291. |
| [11] |
Muranishi S, Sakai A, Yamada K, et al. Lipophilic peptides:synthesis of lauroyl thyrotropin-releasing hormone and its biological activity[J]. Pharm Res, 1991, 8: 649-652. |
| [12] |
Wang J, Luo T, Li S, et al. The powerful applications of polyunsaturated fatty acids in improving the therapeutic efficacy of anticancer drugs[J]. Expert Opin Drug Del, 2012, 9: 1-7. |
| [13] |
Wang TY, Liu M, Portincasa P, et al. New insights into the molecular mechanism of intestinal fatty acid absorption[J]. Eur J Clin Invest, 2013, 43: 1203-1223. |
| [14] |
Andonova V, Peneva P. Characterization methods for solid lipid nanoparticles (SLN) and nanostructured lipid carriers (NLC)[J]. Curr Pharm Des, 2017. DOI:10.2174/1381612823666171115105721 |
| [15] |
Irby D, Du C, Li F. Lipid-drug conjugate for enhancing drug delivery[J]. Mol Pharm, 2017, 14: 1325-1338. DOI:10.1021/acs.molpharmaceut.6b01027 |
| [16] |
Banerjee S, Pillai J. Solid lipid matrix mediated nanoarchitectonics for improved oral bioavailability of drugs[J]. Expert Opin Drug Metab Toxicol, 2019, 15: 499-515. DOI:10.1080/17425255.2019.1621289 |
| [17] |
Kurtzhals P, Havelund S, Jonassen IB, et al. Effect of fatty acids and selected drugs on the albumin binding of a long-acting, acylated insulin analogue[J]. J Pharm Sci, 1997, 86: 1365-1368. DOI:10.1021/js9701768 |
| [18] |
Kaithwas V, Dora CP, Kushwah V, et al. Nanostructured lipid carriers of olmesartan medoxomil with enhanced oral bioavailability[J]. Colloids Surf B Biointerfaces, 2017, 154: 10-20. DOI:10.1016/j.colsurfb.2017.03.006 |
| [19] |
Lambert DM. Rationale and applications of lipids as prodrug carriers[J]. Eur J Pharm Sci, 2000, 11: S15-S27. DOI:10.1016/S0928-0987(00)00161-5 |
| [20] |
Gazak R, Purchartova K, Marhol P, et al. Antioxidant and antiviral activities of silybin fatty acid conjugates[J]. Eur J Med Chem, 2010, 45: 1059-1067. |
| [21] |
Pedersen PJ, Christensen MS, Ruysschaert T, et al. Synthesis and biophysical characterization of chlorambucil anticancer ether lipid prodrugs[J]. J Mater Chem, 2009, 52: 3408-3415. |
| [22] |
Pedersen PJ, Adolph SK, Andresen TL, et al. Prostaglandin phospholipid conjugates with unusual biophysical and cytotoxic properties[J]. Bioorg Med Chem Lett, 2010, 20: 4456-4458. DOI:10.1016/j.bmcl.2010.06.054 |
| [23] |
Linderoth L, Peters GH, Madsen R, et al. Drug delivery by an enzyme-mediated cyclization of a lipid prodrug with unique bilayer-formation properties[J]. Angew Chem Int Ed, 2009, 48: 1823-1826. DOI:10.1002/anie.200805241 |
| [24] |
Rosseto R, Hajdu J. Peptidophospholipids:synthesis, phospholipase A2 catalyzed hydrolysis, and application to development of phospholipid prodrugs[J]. Chem Phys Lipids, 2014, 183: 110-116. DOI:10.1016/j.chemphyslip.2014.06.001 |
| [25] |
Ma P, Benhabbour SR, Feng L, et al. 2'-Behenoyl-paclitaxel conjugate containing lipid nanoparticles for the treatment of metastatic breast cancer[J]. Cancer Lett, 2013, 334: 253-262. DOI:10.1016/j.canlet.2012.08.009 |
| [26] |
Potter E, Jha M, Bhullar KS, et al. Investigation of fatty acid conjugates of 3, 5-bisarylmethylene-4-piperidone derivatives as antitumor agents and human topoisomerase-Ⅱα inhibitors[J]. Bioorg Med Chem, 2015, 23: 411-421. |
| [27] |
Kaushik L, Srivastava S, Panjeta A, et al. Exploration of docetaxel palmitate and its solid lipid nanoparticles as a novel option for alleviating the rising concern of multi-drug resistance[J]. Int J Pharm, 2020, 578: 119088. DOI:10.1016/j.ijpharm.2020.119088 |
| [28] |
Du Y, Ling L, Ismail M, et al. Redox sensitive lipid-camptothecin conjugate encapsulated solid lipid nanoparticles for oral delivery[J]. Int J Pharm, 2018, 549: 352-362. DOI:10.1016/j.ijpharm.2018.08.010 |
| [29] |
Bradley MO, Webb NL, Anthony FH, et al. Tumor targeting by covalent conjugation of a natural fatty acid to paclitaxel[J]. Clin Cancer Res, 2001, 7: 3229-3238. |
| [30] |
Wang Y, Li L, Jiang W, et al. Synthesis and preliminary antitumor activity evaluation of a DHA and doxorubicin conjugate[J]. Bioorg Med Chem Lett, 2006, 16: 2974-2977. DOI:10.1016/j.bmcl.2006.02.066 |
| [31] |
Couvreur P, Stella B, Reddy LH, et al. Squalenoyl nanomedicines as potential therapeutics[J]. Nano Lett, 2006, 6: 2544-2548. DOI:10.1021/nl061942q |
| [32] |
Dosio F, Reddy LH, Ferrero A, et al. Novel nanoassemblies composed of squalenoyl-paclitaxel derivatives:synthesis, characterization, and biological evaluation[J]. Bioconjugate Chem, 2010, 21: 1349-1361. DOI:10.1021/bc100154g |
| [33] |
Barnes KR, Kutikov A, Lippard SJ. Synthesis, characterization, and cytotoxicity of a series of estrogen-tethered platinum (Ⅳ) complexes[J]. Chem Biol, 2004, 11: 557-564. DOI:10.1016/j.chembiol.2004.03.024 |
| [34] |
Reithofer MR, Valiahdi SM, Jakupec MA, et al. Novel di-and tetracarboxylatoplatinum (Ⅳ) complexes:synthesis, characterization, cytotoxic activity, and DNA platination[J]. J Mater Chem, 2007, 50: 6692-6699. |
| [35] |
Shrivastava P, Gautam L, Jain A, et al. Lipid drug conjugates for improved therapeutic benefits[J]. Curr Pharm Des, 2020. DOI:10.2174/1381612826666200311124003 |
| [36] |
Skanji R, Andrieux K, Lalanne M, et al. A new nanomedicine based on didanosine glycerolipidic prodrug enhances the long term accumulation of drug in a HIV sanctuary[J]. Int J Pharm, 2011, 414: 285-297. |
| [37] |
Lalanne M, Paci A, Andrieux K, et al. Synthesis and biological evaluation of two glycerolipidic prodrugs of didanosine for direct lymphatic delivery against HIV[J]. Bioorg Med Chem Lett, 2007, 17: 2237-2240. DOI:10.1016/j.bmcl.2007.01.062 |
| [38] |
Khan MSY, Akhter M. Synthesis, pharmacological activity and hydrolytic behavior of glyceride prodrugs of ibuprofen[J]. Eur J Med Chem, 2005, 40: 371-376. |
| [39] |
Khan MSY, Akhter M. Glyceride derivatives as potential prodrugs:synthesis, biological activity and kinetic studies of glyceride derivatives of mefenamic acid[J]. Pharmazie, 2005, 60: 110-114. |
| [40] |
Vodovozova EL, Kuznetsova NR, Kadykov VA, et al. Liposomes as nanocarriers of lipid-conjugated antitumor drugs melphalan and methotrexate[J]. Nanotechnol Rus, 2008, 3: 228-239. DOI:10.1134/S1995078008030105 |
| [41] |
Vodovozova EL, Evdokimov DV, Molotkovsky JG. Synthesis of a lipid derivative of the antitumor agent methotrexate[J]. Russ J Bioorg Chem, 2004, 30: 599-601. DOI:10.1023/B:RUBI.0000049779.60159.c5 |
| [42] |
Pickin KA, Alexander RL, Morrow CS, et al. Phospholipid/deoxycytidine analogue prodrugs for the treatment of cancer[J]. J Drug Deliv Sci Tec, 2009, 19: 31-36. DOI:10.1016/S1773-2247(09)50004-4 |
| [43] |
He R, Du Y, Ling L, et al. Nanoformulation of dual bexarotene-tailed phospholipid conjugate with high drug loading[J]. Eur J Pharm Sci, 2017, 100: 197-204. DOI:10.1016/j.ejps.2017.01.012 |
| [44] |
Tsybulskaya I, Kulak T, Kalinicheko E, et al. Phospholipid derivatives of cladribine and fludarabine:synthesis and biological properties[J]. Bioorg Med Chem, 2015, 23: 3287-3296. |
| [45] |
Lichtenberger LM, Ulloa C, Romero JJ, et al. Nonsteroidal anti-inflammatory drug and phospholipid prodrugs:combination therapy with antisecretory agents in rats[J]. Gastroenterology, 1996, 111: 990-995. DOI:10.1016/S0016-5085(96)70066-5 |
| [46] |
Dong SD, Lin CC, Schroeder M. Synthesis and evaluation of a new phosphorylated ribavirin prodrug[J]. Antivial Res, 2013, 99: 18-26. DOI:10.1016/j.antiviral.2013.04.014 |
| [47] |
Guo H, Sun S, Yang Z, et al. Strategies for ribavirin prodrugs and delivery systems for reducing the side-effect hemolysis and enhancing their therapeutic effect[J]. J Control Release, 2015, 209: 27-36. DOI:10.1016/j.jconrel.2015.04.016 |
| [48] |
Buse J, Elaneed A. Properties, engineering and applications of lipid-based nanoparticle drug-delivery systems:current research and advances[J]. Nanomedicine, 2010, 5: 1237-1260. DOI:10.2217/nnm.10.107 |
| [49] |
Tao J, Chow SF, Zheng Y. Application of flash nanoprecipitation to fabricate poorly water-soluble drug nanoparticles[J]. Acta Pharm Sin B, 2019, 9: 4-18. DOI:10.1016/j.apsb.2018.11.001 |
| [50] |
Ghasemiyeh P, Mohammadi-Samani S. Solid lipid nanoparticles and nanostructured lipid carriers as novel drug delivery systems:applications, advantages and disadvantages[J]. Res Pharm Sci, 2018, 13: 288-303. DOI:10.4103/1735-5362.235156 |
| [51] |
Yu BT, Sun X, Zhang ZR. Enhanced liver targeting by synthesis of N1-stearyl-5-Fu and incorporation into solid lipid nanoparticles[J]. Arch Pharmacol Res, 2003, 26: 1096-1101. DOI:10.1007/BF02994764 |
| [52] |
Li CC, Zhang ZH, Zhang YL, et al. In situ rat intestine absorption of paclitaxel-loaded solid lipid nanoparticles modified with cell-penetrating peptides[J]. Acta Pharm Sin (药学学报), 2013, 48: 131-137. |
| [53] |
Stevens PJ, Sekido M, Lee RJ. A folate receptor-targeted lipid nanoparticle formulation for a lipophilic paclitaxel prodrug[J]. Pharm Res, 2004, 21: 2153-2157. |
| [54] |
Minelli R, Occhipinti S, Gigliotti CL, et al. Solid lipid nanoparticles of cholesteryl butyrate inhibit the proliferation of cancer cells in vitro and in vivo models[J]. Br J Pharmacol, 2013, 170: 233-244. DOI:10.1111/bph.12255 |
| [55] |
Minelli R, Serpe L, Pettazzoni P, et al. Cholesteryl butyrate solid lipid nanoparticles inhibit the adhesion and migration of colon cancer cells[J]. Br J Pharmacol, 2012, 166: 587-601. DOI:10.1111/j.1476-5381.2011.01768.x |
| [56] |
Gong X, Moghaddam MJ, Sagnella SM, et al. Nanostructured self-assembly materials from neat and aqueous solutions of C18 lipid pro-drug analogues of capecitabine——a chemotherapy agent. Focus on nanoparticulate Cubosomes™ of the oleyl analogue[J]. Soft Matter, 2011, 7: 5764-5776. DOI:10.1039/c1sm05330b |
| [57] |
Gong X, Moghaddam MJ, Sagnella SM, et al. Lamellar crystalline self-assembly behaviour and solid lipid nanoparticles of a palmityl prodrug analogue of capecitabine——a chemotherapy agent[J]. Colloids Surf B Biointerfaces, 2011, 85: 349-359. DOI:10.1016/j.colsurfb.2011.03.007 |
| [58] |
Bui NQ, Wang DS, Hiniker SM. Contemporary management of metastatic soft tissue sarcoma[J]. Curr Probl Cancer, 2019, 43: 289-299. DOI:10.1016/j.currproblcancer.2019.06.005 |
| [59] |
Nguyen T, Francis MB. Practical synthetic route to functionalized rhodamine dyes[J]. Org Lett, 2003, 5: 3245-3248. DOI:10.1021/ol035135z |
| [60] |
Russell JG, Mctavish K, Mcewan J, et al. Vitamin-mediated targeting as a potential mechanism to increase drug uptake by tumours[J]. J Inorg Biochem, 2004, 98: 1625-1633. DOI:10.1016/j.jinorgbio.2004.07.009 |
| [61] |
Bui DT, Nicolas J, Maksimenko A, et al. Multifunctional squalene-based prodrug nanoparticles for targeted cancer therapy[J]. Chem Commun, 2014, 50: 5336-5338. DOI:10.1039/C3CC47427E |
| [62] |
Zhu S, Li X, Kumar A, et al. A nanoparticle depot formulation of 4-(N) -stearoyl gemcitabine shows a strong anti-tumour activity[J]. J Pharm Pharmacol, 2013, 65: 236-242. DOI:10.1111/j.2042-7158.2012.01599.x |
| [63] |
Karra N, Nassar T, Ripin AN, et al. Antibody conjugated PLGA nanoparticles for targeted delivery of paclitaxel palmitate:efficacy and biofate in a lung cancer mouse model[J]. Small, 2013, 9: 4221-4236. DOI:10.1002/smll.201301417 |
| [64] |
Harrisson S, Nicolas J, Maksimenko A, et al. Nanoparticles with in vivo anticancer activity from polymer prodrug amphiphiles prepared by living radical polymerization[J]. Angew Chem Int Ed, 2013, 52: 1678-1682. DOI:10.1002/anie.201207297 |
| [65] |
He H, Lu Y, Qi J, et al. Adapting liposomes for oral drug delivery[J]. Acta Pharm Sin B, 2019, 9: 36-48. DOI:10.1016/j.apsb.2018.06.005 |
| [66] |
Gabizon A, Amitay Y, Tzemach D, et al. Therapeutic efficacy of a lipid-based prodrug of mitomycin C in pegylated liposomes:studies with human gastro-entero-pancreatic ectopic tumor models[J]. J Control Release, 2012, 160: 245-253. DOI:10.1016/j.jconrel.2011.11.019 |
| [67] |
Gabizon A, Tzemach D, Horowitz AT, et al. Reduced toxicity and superior therapeutic activity of a mitomycin C lipid-based prodrug incorporated in pegylated liposomes[J]. Clin Cancer Res, 2006, 12: 1913-1920. DOI:10.1158/1078-0432.CCR-05-1547 |
| [68] |
Brusa P, Immordino ML, Rocco F, et al. Antitumor activity and pharmacokinetics of liposomes containing lipophilic gemcitabine prodrugs[J]. Anticancer Res, 2007, 27: 195-199. |
| [69] |
Castelli F, Sarpietro MG, Ceruti M, et al. Characterization of lipophilic gemcitabine prodrug-liposomal membrane interaction by differential scanning calorimetry[J]. Mol Pharm, 2006, 3: 737-744. DOI:10.1021/mp060059y |
| [70] |
Koning GA, Kamps J, Scherphof GL. Efficient intracellular delivery of 5-fluorodeoxyuridine into colon cancer cells by targeted immunoliposomes[J]. Cancer Detect Prev, 2002, 26: 299-307. DOI:10.1016/S0361-090X(02)00087-9 |
| [71] |
Versluis AJ, Rump ET, Rensen PC, et al. Stable incorporation of a lipophilic daunorubicin prodrug into apolipoprotein E-exposing liposomes induces uptake of prodrug via low-density lipoprotein receptor in vivo[J]. J Pharmacol Exp Ther, 1999, 289: 1-7. |
| [72] |
Zhu S, Lansakara PD, Li X, et al. Lysosomal delivery of a lipophilic gemcitabine prodrug using novel acid-sensitive micelles improved its antitumor activity[J]. Bioconjugate Chem, 2012, 23: 966-980. DOI:10.1021/bc2005945 |
| [73] |
Wang Y, Fan W, Dai X, et al. Enhanced tumor delivery of gemcitabine via PEG-DSPE/TPGS mixed micelles[J]. Mol Pharm, 2014, 11: 1140-1150. DOI:10.1021/mp4005904 |
| [74] |
Ma YH, He HS, Fan WF, et al. In vivo fate of biomimetic mixed micelles as nanocarriers for bioavailability enhancement of lipid-drug conjugates[J]. ACS Biomater Sci Engine, 2017, 3: 2399-2409. DOI:10.1021/acsbiomaterials.7b00380 |
| [75] |
Satoh T, Hosokawa M. The mammalian carboxylesterases:from molecules to functions[J]. Annu Rev Pharmacol, 1998, 38: 257-288. DOI:10.1146/annurev.pharmtox.38.1.257 |
| [76] |
Tanaka M, Lio T, Tabata T. Purification and characterization of a carboxylesterase from rabbit liver lysosomes[J]. J Biochem, 1987, 101: 619-624. DOI:10.1093/jb/101.3.619 |
| [77] |
Ma YH, He HS, Xia F, et al. In vivo fate of lipid-silybin conjugate nanoparticles:implications on enhanced oral bioavailability[J]. Nanomed Nanotechnol, 2017, 13: 2643-2654. DOI:10.1016/j.nano.2017.07.014 |
| [78] |
Yamada K, Murakami M, Yamamoto A, et al. Improvement of intestinal absorption of thyrotropin-releasing hormone by chemical modification with lauric acid[J]. J Pharm Pharmacol, 1992, 44: 717-721. DOI:10.1111/j.2042-7158.1992.tb05506.x |
| [79] |
Bibby DC, Charman WN, Charman SA, et al. Synthesis and evaluation of 5' alkyl ester prodrugs of zidovudine for directed lymphatic delivery[J]. Int J Pharm, 1996, 144: 61-70. |
| [80] |
Delie F, Letourneux Y, Nisato D, et al. Oral administration of peptides:study of a glycerolipidic prodrug[J]. Int J Pharm, 1995, 115: 45-52. |
| [81] |
Han S, Quach T, Hu L, et al. Targeted delivery of a model immunomodulator to the lymphatic system:comparison of alkyl ester versus triglyceride mimetic lipid prodrug strategies[J]. J Control Release, 2014, 177: 1-10. DOI:10.1016/j.jconrel.2013.12.031 |
| [82] |
Deguchi Y, Hayashi H, Fujii S, et al. Improved brain delivery of a nonsteroidal anti-inflammatory drug with a synthetic glyceride ester:a preliminary attempt at a CNS drug delivery system for the therapy of Alzheimer's disease[J]. J Drug Target, 2000, 8: 371-381. DOI:10.3109/10611860008997913 |
| [83] |
Dahan A, Duvdevani R, Dvir E, et al. A novel mechanism for oral controlled release of drugs by continuous degradation of a phospholipid prodrug along the intestine:in-vivo and in-vitro evaluation of an indomethacin-lecithin conjugate[J]. J Control Release, 2007, 119: 86-93. DOI:10.1016/j.jconrel.2006.12.032 |
| [84] |
Dahan A, Duvdevani R, Shapiro I, et al. The oral absorption of phospholipid prodrugs:in vivo and in vitro mechanistic investigation of trafficking of a lecithin-valproic acid conjugate following oral administration[J]. J Control Release, 2008, 126: 1-9. DOI:10.1016/j.jconrel.2007.10.025 |
| [85] |
Kurz M, Scriba GKE. Drug-phospholipid conjugates as potential prodrugs:synthesis, characterization, and degradation by pancreatic phospholipase A2[J]. Chem Phys Lipids, 2000, 107: 143-157. DOI:10.1016/S0009-3084(00)00167-5 |
| [86] |
Signorell RD, Luciani P, Brambilla D, et al. Pharmacokinetics of lipid-drug conjugates loaded into liposomes[J]. Eur J Pharm Biopharm, 2018, 128: 188-199. DOI:10.1016/j.ejpb.2018.04.003 |
| [87] |
Han L, Yang Q, Shen T, et al. Lymphatic transport of orally administered probucol-loaded mPEG-DSPE micelles[J]. Drug Deliv, 2016, 23: 1955-1961. |
| [88] |
Vishwakarma N, Jain A, Sharma R, et al. Lipid-based nanocarriers for lymphatic transportation[J]. AAPS PharmSciTech, 2019, 20: 83. DOI:10.1208/s12249-019-1293-3 |
| [89] |
Hokkanen K, Tirronen A, Ylä-Herttuala S. Intestinal lymphatic vessels and their role in chylomicron absorption and lipid homeostasis[J]. Curr Opin Lipidol, 2019, 30: 370-376. DOI:10.1097/MOL.0000000000000626 |
| [90] |
Managuli RS, Raut SY, Reddy MS, et al. Targeting the intestinal lymphatic system:a versatile path for enhanced oral bioavailability of drugs[J]. Expert Opin Drug Deliv, 2018, 15: 787-804. DOI:10.1080/17425247.2018.1503249 |
| [91] |
Markovic M, Ben-Shabat S, Keinan S, et al. Lipidic prodrug approach for improved oral drug delivery and therapy[J]. Med Res Rev, 2019, 39: 579-607. DOI:10.1002/med.21533 |
| [92] |
Trevaskis NL, Charman WN, Porter CJH. Lipid-based delivery systems and intestinal lymphatic drug transport:a mechanistic update[J]. Adv Drug Deliv Rev, 2008, 60: 702-716. DOI:10.1016/j.addr.2007.09.007 |
| [93] |
Sugihara J, Furuuchi S, Ando H, et al. Studies on intestinal lymphatic absorption of drugs. Ⅱ. Glyceride prodrugs for improving lymphatic absorption of naproxen and nicotinic acid[J]. J Pharmacobiodyn, 1988, 11: 555-562. DOI:10.1248/bpb1978.11.555 |
| [94] |
Han S, Hu L, Quach T, et al. Constitutive triglyceride turnover into the mesenteric lymph is unable to support efficient lymphatic transport of a biomimetic triglyceride prodrug[J]. J Pharm Sci, 2016, 105: 786-796. DOI:10.1002/jps.24670 |
| [95] |
Hu L, Quach T, Han S, et al. Glyceride-mimetic prodrugs incorporating self-immolative spacers promote lymphatic transport, avoid first-pass metabolism, and enhance oral bioavailability[J]. Angew Chem Int Ed, 2016, 55: 13700-13705. DOI:10.1002/anie.201604207 |
 2020, Vol. 55
2020, Vol. 55


