2. 中国医学科学院、北京协和医学院药用植物研究所, 北京 100193
2. Institute of Medicinal Plant Development, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100193, China
五味子Schisandra chinensis (Turcz.) Baill.为五味子科五味子属多年生落叶木质藤本植物, 主要分布于辽宁、吉林、黑龙江等地, 是我国温带针阔叶混交林和暖温带针叶阔叶林区域, 经历第四纪冰川时期后保留下来的第三纪古老植物种之一。其皮肉甘酸, 核中辛苦, 甘、酸、辛、苦、咸五味俱有, 故名“五味子”。五味子是临床常用中药, 具有收敛固涩、益气生津、补肾宁心的功效, 用于久嗽虚喘、梦遗滑精、遗尿尿频、久泻不止、自汗盗汗、津伤口渴、内热消渴、心悸失眠等症的治疗[1-3]。目前国内外学者已从五味子中分离出100多种木脂素类化合物[4-7], 近期课题组发现五味子中亦含有芳基萘类木脂素—鬼臼毒素类化合物。现代药理研究表明鬼臼毒素可以通过抑制微管蛋白的聚合、阻断中期相细胞分裂, 或者抑制DNA拓扑异构酶活性, 从而起到显著的抗尖锐湿疣、抗艾滋病毒、抗肿瘤等作用[8-11]。鬼臼毒素经过化学修饰后, 获得的高效低毒的半合成衍生物GP7、VP-16、VM-26、NK611等对小细胞肺癌、淋巴癌、子宫癌、皮肤癌、乳腺癌等多种肿瘤疾病均有很好的疗效, 具有广阔的应用前景[12, 13]。然而, 目前鬼臼毒素的传统和主要来源是从资源稀少或濒危的鬼臼类植物中提取, 且含量很低, 期望通过寻找可替代植物, 并通过基因工程手段提高植物中鬼臼毒素含量, 或利用异源生物反应器生产鬼臼毒素, 是解决资源短缺问题的可行途径。五味子果实中鬼臼毒素的发现给鬼臼毒素的研究和利用开辟了新的方向。
2-酮戊二酸依赖性双加氧酶(2-oxoglutarate-dependent dioxygenase, 2-ODD)催化Yatein合成去氧鬼臼毒素, 是鬼臼毒素合成途径的关键酶[14]。2-ODD基因家族是含铁非血红素氧激活酶超级家族中的最大亚家族, 广泛分布在病毒、细菌、真菌、植物、动物包括人类中, 催化包括羟基化、卤化、去饱和、差向异构、扩环、环氧化在内的各种反应, 其底物包括氨基酸、苯丙素类化合物、黄酮类化合物、生物碱、糖、非核糖体肽、聚酮和生物大分子, 如蛋白质、脂质、DNA和RNA等, 在催化复杂反应方面表现出明显的多功能性[15]。目前研究表明2-ODD基因家族成员的序列保守性约为17%~75%, 参与不同代谢的基因保守性有一定差异, 因而不同的2-ODD蛋白具有不同的生物活性, 2-ODD家族基因在赤霉素和黄酮类化合物的合成途径研究比较清楚, 如赤霉素合酶(gibberellin 20 oxidase, GA20 ox)、黄酮合酶(flavonol synthase, FLS)、黄烷酮羟化酶(flavanone 3-hydroxylase, F3H)、花青素合成酶(anthocyanidin synthase, ANS)[16-21]。目前对五味子Sc2-ODD基因的相关研究还未见报道, 对五味子Sc2-ODD基因的研究有助于阐明五味子芳基萘类木脂素代谢途径。本研究克隆得到了五味子Sc2-ODD基因的全长cDNA序列, 构建原核表达载体诱导重组蛋白大量表达, 并对该蛋白进行纯化, 为进一步深入研究五味子Sc2-ODD基因功能及其酶促动力学等奠定基础。
材料与方法材料 供试五味子叶片及果实采自沈阳农业大学五味子种质资源圃。五味子展叶期采集五味子幼嫩叶片, 用去离子水冲洗干净, 滤纸吸干水分后放于液氮中, 带回实验室置于-80 ℃超低温冰箱保存, 用于后续克隆及定量分析。五味子进入结果期时, 即花后20天, 每隔30天定期采摘五味子不同发育阶段的果实(图 1), 去离子水冲洗干净, 滤纸吸干水分后放入液氮中, 带回实验室, 放入-80 ℃冰箱中保存备用。

|
Figure 1 The four periods (F1, F2, F3 and F4) for fruit development of Schisandra chinensis |
试剂 LB培养基购自北京拜尔迪生物技术有限公司; 凝胶回收试剂盒、克隆载体pMDTM 18-T、大肠杆菌DH5α菌株、感受态细胞TOP10、Rosetta (DE3)、2×SuperReal PreMix Plus购自天根生化科技有限公司; 柱式植物RNAout试剂盒(CAT#: 71203-50)购自天泽基因有限公司; pGS21T、pET32T、T4 DNA Ligase、2×Taq Master Mix、PCR产物回收试剂盒、胶回收试剂盒、DL2000 bp Marker、DL5000 bp Marker、中分子量蛋白Marker、6XHis标签蛋白纯化试剂盒(Ni-IDA)、BCA蛋白浓度测定试剂盒、GST融合蛋白纯化试剂盒购自ProbeGene公司; 十二烷基硫酸钠(SDS)购自Amresco公司; 异丙基硫代β-D-半乳糖苷(IPTG)、氨苄青霉素(Amp)、三羟甲基氨基甲烷(Tris)购自Sigma公司; 其他常规试剂购自国药集团。引物由苏州金唯智生物科技有限公司合成。测序工作由上海生工生物工程公司完成。
Sc2-ODD基因克隆 根据五味子果实SMRT转录组测序结果获得的全长Sc2-ODD序列, 利用Primer软件设计特异性引物, 引物序列见表 1。采用Trizol法[22]提取五味子RNA, 并用DNAase去除DNA污染, 然后按照SMART RACE cDNA Amplification Kit试剂盒(Clontech公司)实验操作步骤反转录为cDNA, 以此为模板, 按照下列体系对五味子Sc2-ODD进行PCR扩增: 2 μL dNTP (2.5 mmol·L-1), 上、下游引物各1 μL, 2.5 μL 10×PCR Buffer, 0.2 μL Taq DNA聚合酶(5 U·μL-1), ddH2O 17.3 μL, 1 µL模板cDNA, 终反应体系为25 µL。PCR扩增条件: 94 ℃预变性5 min; 94 ℃变性30 s, 58 ℃退火30 s, 72 ℃延伸1 min, 35个循环; 72 ℃延伸10 min。用回收试剂盒纯化回收PCR产物, 纯化后与pMD18-T载体过夜连接, 然后转化DH5α感受态, 在含氨苄青霉素的LB培养基上培养, 并进行蓝白斑筛选, 将含有目的产物的阳性克隆测序。
| Table 1 Primer sequence |
生物信息学分析 利用NCBI中的ORF Finder (http://www.ncbi.nlm.nih.gov/projects/gorf/)在线分析开放阅读框; 采用ExPASy中ProtParam (http://web.expasy.org/compute_pi/)分析Sc2-ODD氨基酸的组成及理化性质; SignalP 5.0 Server (http://www.cbs.dtu.dk/services/SignalP/)分析Sc2-ODD蛋白信号肽; ProtScale (http://web.expasy.org/protscale/)预测Sc2-ODD蛋白水性; TMpred (http://www.ch.embnet.org/software/TMPRED_form.html)和TMHMM (http://www.cbs.dtu.dk/services/TMHMM/)分析Sc2-ODD蛋白的跨膜结构域; NCBI-CDD (http://www.ncbi.nlm.nih.gov/Structu-re/cdd/wrpsb.cgi)预测Sc2-ODD蛋白的保守结构域; Sc2-ODD蛋白二级结构和三级结构由SOPMA (http://npsa-pbil.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html)和Phyre (http://www.sbg.bio.ic.ac.uk/phyre/)在线完成。WoLF PSORT (https://www.genscript.com/wolf-psort.html)和SoftBerry ProtComp 9.0 (http://www.softberry.com/berry.phtml?topic=protcomppl&group=programs&sub-group=pro-loc)进行亚细胞定位预测; 利用NCBI的protein blastp检索Sc2-ODD的同源蛋白, 选取与Sc2-ODD基因编码的蛋白相似度较高的其他植物的2-ODD蛋白的氨基酸序列, 利用Mega7.0软件构建五味子Sc2-ODD和其他物种2-ODD的Neighbor-joining系统进化树, 进化距离的计算采用泊松校正法。
五味子Sc2-ODD的qRT-PCR表达分析 五味子不同发育时期果实总RNA提取参照柱式植物RNAout试剂盒(CAT#: 71203-50)说明书进行。选用GAPDH基因作为目标基因定量表达的内参基因, 测定Sc2-ODD的相对表达量。内参基因的引物序列、扩增所用引物序列见表 1。PCR反应体系: 2×SYBR Green qPCR Master Mix 5 μL, 上、下游引物各0.1 μL, 模板10 μL, 用超纯水补至终体积20 μL。PCR反应在Gene 9600实时荧光定量PCR仪上运行。反应程序为: 95 ℃预变性30 s; 定量分析(95 ℃ 15 s→60 ℃ 30 s)×40;熔解曲线: (95 ℃ 15 s→60 ℃ 60 s)×1;降温50 ℃ 30 s。采用2-ΔΔCt法进行相对定量分析。
原核表达载体的构建 根据原核表达载体pGS21T的序列信息和测序所得Sc2-ODD基因序列设计带NcoI和XhoI双酶切位点的特异引物(表 1), 扩增Sc2-ODD基因(accession No.MT812948)完整cDNA序列。利用NcoI和XhoI对PCR产物和pGS21T原核表达载体分别进行双酶切, 酶切体系50 μL。按1:2量比(载体-目的基因)过夜连接, 42 ℃热激法转化至感受态细胞TOP10, 涂布于含卡那霉素的LB固体培养基上, 挑选单菌落生长后用T7通用引物PCR扩增筛选阳性克隆, 提取质粒测序, 将构建正确的表达载体命名为pGS21T-Sc2-ODD。
融合蛋白的诱导表达 将pGS21T-Sc2-ODD质粒转化Rosetta (DE3)感受态细胞, 从转化平板中挑取单克隆接种至LB液体培养基(含50 mg·L-1的氨苄青霉素), 37 ℃培养至OD600为0.6左右, 加入终浓度为0.5 mmol·L-1的IPTG诱导LHB-pGS21T的表达, 37 ℃诱导2 h后收集菌液, 提取细菌总蛋白进行SDS-PAGE分析。
Sc2-ODD融合蛋白的纯化 取含有pGS21T-Sc2-ODD重组质粒的Rosetta (DE3)菌株, 接种于LB液体培养基中放大培养, 收集细胞用冰浴的Buffer D (20 mmol·L-1 Tris-HCl pH 8.0, 50 mmol·L-1 NaCl, 0.1% Triton-100) 35 mL重悬, 600~800 W超声裂解细胞30 min, 10 000 r·min-1离心15 min后取上清过GST柱, 用GST融合蛋白纯化试剂盒对融合蛋白进行纯化, 并用SDS-PAGE电泳检测融合表达蛋白的纯化效果。
结果与分析 1 Sc2-ODD克隆及序列分析基因序列分析表明, Sc2-ODD基因cDNA全长1 085 bp, 利用NCBI的ORF Finder发现该序列含有完整的全长为1 077 bp的ORF, 共编码358个氨基酸(图 2)。通过NCBI数据库对该基因进行功能结构域预测, 结果表明Sc2-ODD是2-oxoglutarate (2OG) and Fe(Ⅱ)-dependent oxygenase超家族蛋白。

|
Figure 2 Nucleotide and amino acid sequence of Sc2-ODD |
ProtParam分析预测Sc2-ODD基因编码蛋白的分子质量约40.16 kD, 理论等电点5.37, 正电荷残基36个, 负电荷残基47个, 总共5 626个原子, 分子式为C1812H2790N476O539S9, 脂肪指数为84.13, 不稳定指数为35.18, ProtScale分析显示Sc2-ODD中亲水性氨基酸多于疏水性氨基酸, 均匀分布在肽链中, 亲水性指数(GRAVY)的平均水平为-0.246, 由此推断该蛋白属于稳定性亲水蛋白(图 3)。

|
Figure 3 Hydrophilic and hydrophobic analysis of Sc2-ODD protein |
SignalP5.0在线预测显示Sc2-ODD蛋白无明显信号肽序列, 是一种非分泌蛋白。TMHMM2.0在线预测Sc2-ODD蛋白无明显跨膜结构域。SMART结构域分析显示其含有1个具2-酮戊二酸/Fe (Ⅱ)依赖性双加氧酶活性蛋白的高度保守N端区域、1个2OG-FeII_Oxy结构域和1个低复杂区域。
利用SOMPA预测Sc2-ODD蛋白质二级结构(图 4), 其中α-螺旋(H)所占比例最大, 为39.11%, 无规卷曲(C)为38.55%, 延伸链(E)为17.04%, β-转角(T)为5.31%, 由此可见, Sc2-ODD为混合型蛋白, α-螺旋(H)和无规卷曲(C)是其主要的结构元件。运用Phyre2数据库预测分析Sc2-ODD蛋白质三级结构, 三级结构预测结果与二级结构相符(图 5)。

|
Figure 4 Predicted secondary structure of Sc2-ODD protein |

|
Figure 5 Predicted tertiary structure of Sc2-ODD protein |
利用SoftBerry ProtComp 9.0对Sc2-ODD蛋白进行亚细胞定位预测, 结果显示该蛋白定位在细胞质的预测数值最高, 为8.64, 其次是叶绿体、液泡, 预测数值分别为0.57、0.39。采用WoLF PSORT在线对Sc2-ODD蛋白亚细胞定位进一步预测, Sc2-ODD蛋白同样主要定位于细胞质, 推测其为细胞质蛋白。
4 Sc2-ODD系统发育分析利用NCBI的blastp功能将Sc2-ODD的氨基酸序列与nr非冗余数据库进行比对, 将Sc2-ODD蛋白序列与其他物种进行同源性比较得知, Sc2-ODD与桃儿七、扁桃、长蒴黄麻、豇豆等物种的2-ODD序列同源性较高, 序列一致性在50%~58%之间。用MEGA7.0的邻接法(neighbour-joining, NJ)对五味子、桃儿七等16个物种的2-ODD蛋白的氨基酸序列构建系统进化树(图 6), 结果表明整个进化树分成两大分支, 五味子Sc2-ODD与红花、黄花蒿、桃儿七、独脚金、博落回等12个物种共聚一支, 与长蒴黄麻、扁桃、豇豆的2-ODD的亲缘关系相对较近。
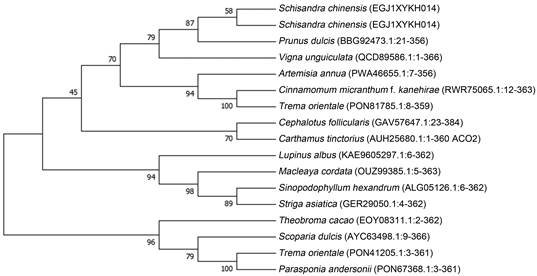
|
Figure 6 Phylogenetic tree of 2-ODD protein from Schisandra chinensis and other plants |
利用qRT-PCR分析Sc2-ODD在五味子果实不同发育阶段的表达特性, 结果显示, Sc2-ODD在五味子果实发育的不同阶段均有表达, Sc2-ODD表达量呈现先增加后降低的变化趋势(图 7)。五味子完成授粉受精后, 子房逐渐膨大成绿色幼果, 花后20天(5月下旬)Sc2-ODD表达量较低; 花后20~50天(5月下旬至6月下旬)果穗、果粒迅速生长, Sc2-ODD的表达量也随之大幅提高, 花后50天其表达量达到整个发育时期的最高值; 花后50~80天(6月下旬至7月下旬)果粒进一步膨大, Sc2-ODD表达量较花后50天降低73.4 %; 花后80天(7月下旬)果实生长基本停止, 进入着色期, Sc2-ODD表达量继续下降。

|
Figure 7 qRT-PCR expression analysis of Sc2-ODD at different development stages of S. chinensis fruits |
本研究采用pGS21T为载体, 利用双酶切的方法构建了pGS21T-Sc2-ODD的原核表达载体, 表达载体pGS21T-Sc2-ODD双酶切鉴定表明, 目的基因已经成功连接到pGS21T载体上(图 8)。
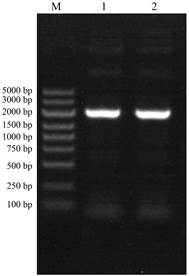
|
Figure 8 Double digestion and identification of induced protein of recombined vector pGS21T-Sc2-ODD by agarose gel electrophoresis |
用已经构建好的原核表达载体pGS21T-Sc2-ODD, 转化Rosetta (DE3)菌株, 挑取单克隆37 ℃培养至OD600为0.6左右, 加入IPTG诱导表达。SDS-PAGE电泳检测表明, 经IPTG诱导后, pGS21T-Sc2-ODD在66 kD处存在明显的特异蛋白质条带(图 9), Sc2-ODD生物信息学预测的分子质量约为40 kD, 加上GST标签后约为66 kD, 据此判断其为诱导表达的Sc2-ODD重组蛋白。

|
Figure 9 SDS-PAGE analysis of the recombinant plasmid-induced protein of Sc2-ODD. M: Medium molecular weight protein marker; 0: Non-induced proteins; 1, 2: Induced proteins |
对五味子Sc2-ODD融合蛋白进行大量表达, 重悬、超声裂解、离心后分别收集上清和沉淀进行SDS-PAGE电泳分析, 发现沉淀和上清中都有蛋白特异条带, 表明该重组蛋白一部分以包涵体形式存在, 一部分以可溶蛋白形式存在。取上清用GST融合蛋白纯化试剂盒对Sc2-ODD蛋白进行纯化, 在66 kD处检测到很亮的蛋白纯化条带(图 10)。但由于纯化后蛋白有轻微降解, 在理论分子质量附近出现了两条分子质量相近的蛋白条带。Sc2-ODD目的蛋白的获得为进一步深入研究该基因功能及表达调控等奠定了基础。
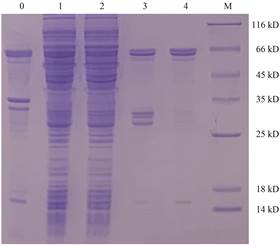
|
Figure 10 Purification analysis of Sc2-ODD protein. M: Medium molecular weight protein marker; 0: Sediment after ultrasonic treatment; 1: Supernatant after ultrasonic treatment; 2: Protein effluent after binding to the GST column; 3, 4: Effluent washed by wash Buffer |
2-ODD家族中多数蛋白都是参与次生代谢物合成的下游关键酶, 且对植物响应非生物胁迫具有重要的作用, 目前已在拟南芥、丹参、毛曼陀罗、蓖麻、红花、毛果杨、南极黄丝瓜藓、黄花红砂等植物中分离并进行了功能验证, 现有研究表明不同2-ODD蛋白在高级结构和功能上存在一定差异, 在不同物种细胞中的分布亦存在差异[16-21]。2-ODD基因在五味子芳基萘类木脂素合成中的功能尚未明确, 为此, 本实验首次克隆了Sc2-ODD的cDNA序列, 并对其蛋白进行了生物信息学分析, Sc2-ODD蛋白的分子质量约40 kD, 理论等电点5.37, 是一稳定性亲水蛋白, 主要定位于细胞质, 且具有2-ODD的基本功能保守结构域。通过比对发现, Sc2-ODD与桃儿七、扁桃、长蒴黄麻、豇豆等物种的2-ODD序列同源性较高, 在50%~58%之间, 不同植物中的2-ODD蛋白大小有一定差异, 这意味着五味子中Sc2-ODD蛋白与其他植物的2-ODD蛋白可能存在结构或功能上的差异。
基因表达模式的分析可为基因功能研究提供线索, 不同植物中2-ODD表达模式不同[17, 21, 23]。本研究中Sc2-ODD在五味子果实发育不同阶段其表达量呈现先增加后降低的变化趋势, 与五味子芳基萘类木脂素代谢途径中关键酶基因PLR的表达模式类似, 这为进一步深入研究该基因在五味子芳基萘类木脂素生物合成中的功能及表达调控提供了理论依据。
原核表达系统具有遗传背景清楚、表达水平高、稳定性好、成本低及周期短等优势, 是目前科学研究中酶活性体外表达及功能研究的重要方法, 已经广泛应用于生命科学、中药学等领域[23-25]。为了探究Sc2-ODD在五味子芳基萘类木脂素代谢途径中的作用, 本研究首次从五味子中分离出Sc2-ODD基因, 构建了其原核表达载体, 在DE3宿主菌株中可以表达目的蛋白, 并对融合蛋白进行了纯化, Sc2-ODD目的蛋白的获得为进一步深入研究该基因功能及表达调控等奠定了重要的物质基础。
总之, 本研究通过克隆五味子Sc2-ODD基因, 构建Sc2-ODD基因的原核表达载体, 诱导并纯化Sc2-ODD目的蛋白, 为进一步揭示Sc2-ODD在五味子芳基萘类木脂素合成中的作用机制及其基因的调控与表达奠定基础, 也为未来利用植物基因工程提高五味子活性成分含量、改善药材品质提供科学依据。
作者贡献: 李海燕参与本研究的实验设计, 并完成数据分析与论文撰写; 刘久石参与实验设计; 王婷、刘宇阳、王熙昂是本实验研究的执行人; 李宏博是项目的构思者及负责人, 指导实验设计、数据分析、论文写作与修改。全体作者都阅读并同意最终的文本。
利益冲突: 本文的研究内容无任何利益冲突。
| [1] |
Editing Committee of Chinese Flora, Chinese Academy of Sciences. Flora of China (中国植物志)[M]. Vol 30(1). Beijing: Science Press, 1996: 252.
|
| [2] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Vol 1. Beijing: China Medical Science Press, 2015.
|
| [3] |
Bensky D, Gamble A, Kaptchuk T. Chinese Herbal Medicine: Materia Medica[M]. Revised Edition. Seattle: Eastland Press, 1993: 376-378.
|
| [4] |
Szopa A, Ekiert R, Ekiert H, et al. Current knowledge of Schisandra chinensis (Turcz.) Baill. (Chinese magnolia vine) as a medicinal plant species:a review on the bioactive components, pharmacological properties, analytical and biotechnological studies[J]. Phytochem Rev, 2017, 16: 195-218. DOI:10.1007/s11101-016-9470-4 |
| [5] |
Zhu L, Li B, Liu X, et al. Purification of six lignans from the stems of Schisandra chinensis by using high-speed countercurrent chromatography combined with preparative high performance liquid chromatography[J]. Food Chem, 2015, 186: 146-152. DOI:10.1016/j.foodchem.2014.09.008 |
| [6] |
Jiang P, Lu Y, Chen D. Authentication of Schisandra chinensis and Schisandra sphenanthera in Chinese patent medicines[J]. J Pharm Biomed Anal, 2016, 131: 263-271. DOI:10.1016/j.jpba.2016.08.040 |
| [7] |
Piao J, Liu L, Wang S, et al. Magnetic separation coupled with high-performance liquid chromatography mass spectrometry for rapid separation and determination of lignans in Schisandra chinensis[J]. J Sep Sci, 2018, 41: 2056-2063. DOI:10.1002/jssc.201701098 |
| [8] |
Broomhead AJ, Dewick PM. Tumour-inhibitory aryltetralin ligans in Podophyllum versipelle, Diphylleia cymosa, and Diphylleia grayi[J]. Phytochemistry, 1990, 29: 3831-3837. DOI:10.1016/0031-9422(90)85342-D |
| [9] |
Lv M, Xu H. Recent advances in semisynthesis, biosynthesis, biological activities, mode of action, and structure-activity relationship of podophyllotoxins:an update (2008-2010)[J]. Mini-Rev Med Chem, 2011, 11: 901-909. DOI:10.2174/138955711796575461 |
| [10] |
Zhao CQ, Zhu YY, Chen SY, et al. Lignan glucoside from Sinopodophyllum emodi and its cytotoxic activity[J]. Chin Chem Lett, 2011, 22: 181-184. DOI:10.1016/j.cclet.2010.10.013 |
| [11] |
Tian DL, Liang CP, Chen H. Synthesis and cytotoxic activities of podophyllotoxin derivatives[J]. Chin Tradit Herb Drugs (中草药), 2019, 50: 4281-4287. |
| [12] |
Mei X, Jiang YG, Lv JJ, et al. Anti-MDR tumor mechanism of CIP-36, a podophyllotoxin derivative[J]. Acta Pharm Sin (药学学报), 2011, 46: 1193-1198. |
| [13] |
Ardalani H, Avan A, Ghayour-Mobarhan M. Podophyllotoxin:a novel potential natural anticancer agent[J]. Avicenna J Phytomed, 2017, 7: 285-294. |
| [14] |
Nag A, Choudhary S, Masand M, et al. Spatial transcriptional dynamics of geographically separated genotypes revealed key regulators of podophyllotoxin biosynthesis in Podophyllum hexandrum[J]. Ind Crops Prod, 2020, 147: 112247. DOI:10.1016/j.indcrop.2020.112247 |
| [15] |
Guo CX, Hu YL, Zhang Y, et al. Developing a colorimetric assay for Fe(II)/2-oxoglutarate-dependent dioxygenase[J]. Anal Biochem, 2018, 548: 109-114. DOI:10.1016/j.ab.2018.02.013 |
| [16] |
Anzellotti D, Ibrahim RK. Novel flavonol 2-oxoglutarate dependent dioxygenase:affinity purification, characterization, and kinetic properties[J]. Arch Biochem Biophys, 2000, 382: 161-172. DOI:10.1006/abbi.2000.2002 |
| [17] |
Liu WC, Wang DH, Wang ZZ, et al. Cloning and expression analysis of 2-oxoglutarate dependent dioxygenase from Salvi amiltiorrhiza Bunge[J]. Acta Bot Boreal-Occid Sin (西北植物学报), 2012, 32: 1289-1294. |
| [18] |
Martens S, Preuβ A, Matern U. Multifunctional flavonoid dioxygenases:flavonol and anthocyanin biosynthesis in Arabidopsis thaliana L[J]. Phytochemistry, 2010, 71: 1040-1049. DOI:10.1016/j.phytochem.2010.04.016 |
| [19] |
Zhang HR, Du C, Wang Y, et al. The Reaumuria trigyna leucoanthocyanidin dioxygenase (RtLDOX) gene complements anthocyanidin synthesis and increases the salt tolerance potential of a transgenic Arabidopsis LDOX mutant[J]. Plant Physiol Biochem, 2016, 106: 278-287. DOI:10.1016/j.plaphy.2016.05.005 |
| [20] |
Li Q, Zhu TT, Zhang R, et al. Molecular cloning and functional analysis of hyoscyamine 6β-hydroxylase (H6H) in the poisonous and medicinal plant Datura innoxia mill[J]. Plant Physiol Biochem, 2020, 153: 11-19. DOI:10.1016/j.plaphy.2020.04.021 |
| [21] |
Tu YH, Li DQ, Fan LJ, et al. DOXC-class 2-oxoglutarate-dependent dioxygenase in safflower:gene characterization, transcript abundance, and correlation with flavonoids[J]. Biochem Syst Ecol, 2018, 80: 14-20. DOI:10.1016/j.bse.2018.04.001 |
| [22] |
Wei RC, Zhao H, Ma XJ, et al. Extraction of total RNA and cloning of SgDHAR gene from Siraitia grosvenorii[J]. Acta Pharm Sin (药学学报), 2014, 49: 115-123. |
| [23] |
Li TZ, Zheng YZ, Rong YQ, et al. Gene cloning, subcellular localization and expression analysis of the AsERF1 gene from Aquilaria sinensis[J]. Acta Pharm Sin (药学学报), 2020, 55: 1957-1964. |
| [24] |
Guan FF. Molecular Evolution and Functional Divergence of ODD Gene Family Related to GA Synthesis in Popolus trichocarpa (毛果杨赤霉素合成相关的ODD基因家族分子进化和功能分析)[D]. Beijing: Beijing Forestry university, 2018.
|
| [25] |
Zhou C, Tian R, Gu W, et al. Prokaryotic expression, function verification and immunoassay activity of farnesyl pyrophosphate synthase of Alisma orientale (Sam.) Juzep[J]. Acta Pharm Sin (药学学报), 2018, 53: 1571-1577. |
 2020, Vol. 55
2020, Vol. 55


