2. 北京中医药大学中药学院中药资源与鉴定系, 北京 100029;
3. 包头医学院药学院, 内蒙古 包头 014060
2. Department of Resources and Identification of Traditional Chinese Medicine, School of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 100029, China;
3. School of Pharmacy, Baotou Medical College, Baotou 014060, China
磷酸戊糖途径(pentose phosphate pathway)是葡萄糖氧化分解的一种方式, 为生物体内的生物反应提供还原力, 即还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced nicotinamide adenine dinucleotide phosphate, NADPH)及调节细胞内的氧化还原状态[1, 2]。葡萄糖-6-磷酸脱氢酶(glucose-6-phosphate dehydrogenase, G6PDH)是磷酸戊糖途径的限速酶和关键酶, 催化6-磷酸葡萄糖氧化生成6-磷酸葡萄糖酸-δ-内酯, 同时生成NADPH[3]。G6PDH可以分为胞质G6PDH和质体G6PDH两类, 分别存在于细胞质和质体中[4]。近年来的研究表明G6PDH在植物抵御生物及非生物胁迫时起到重要作用。如G6PDH活性高的植株抗病性高于其他植株[5]; 马铃薯花叶病毒侵染烟草, 会使烟草胞质和质体中G6PDH活性升高[6]; 小麦中高盐、低温能够诱导小麦中质体和胞质型G6PDH基因的表达, 提高植物体内G6PDH酶活性[7, 8]; 在大豆根中, 干旱条件下能够提高根中质体和胞质型G6PDH基因的转录水平, 提高根中G6PDH酶活性, 从而提高植物的抗旱性[9]。
白木香(Aquilaria sinensis)是我国名贵药材沉香的唯一正品药用植物来源, 目前已经被列为《濒危野生动植物种国际贸易公约》 (CITES)附录Ⅱ[10]和国家濒危二级保护植物[11]。沉香是我国传统名贵中药, 具有行气止痛、温中止呕、纳气平喘等功效, 对于胸腹胀闷疼痛、胃寒呕吐呃逆、肾虚气逆喘急等有显著疗效[12]。沉香的临床应用广泛, 具有消化系统和中枢神经系统保护等药理作用。沉香是独有龙涎香和檀香混合物香味的一种香料, 融合动物界与植物界的精华, 至今无法复制这种香味, 因而极其珍贵[13]。健康的白木香并不产生沉香, 只有通过自然因素(雷劈、火烧等)或者人为因素(砍伤、接菌等)的作用才能够形成沉香, 但是沉香形成的分子机制一直没有揭示, 严重制约高效人工结香技术的建立[14]。近年来研究表明, 利用真菌提取物、盐胁迫、干旱、伤害胁迫能够诱导白木香的悬浮细胞和愈伤组织产生沉香特征性成分2-(2-苯乙基)色酮类化合物和倍半萜类化合物[15-19], 因此白木香的防御反应在沉香形成过程中起到重要作用。研究白木香中G6PDH的生物信息学、组织特异性表达、在非生物胁迫下的表达有利于丰富G6PDH基因在植物防御反应中的重要作用研究, 进一步阐明白木香的结香机制。
材料及方法材料 白木香种苗是2019年6月从广州移植, 由北京大学医学部药学院屠鹏飞教授鉴定后, 现种植于北京中医药大学中药现代研究中心温箱, 成活后于2019年6月采集白木香的根、茎、茎尖及叶提取总RNA, 检测AsG6PDHs基因在不同器官中的特异性表达。利用白木香叶片和茎尖诱导的愈伤组织按照文献报道方法进行[17], 选取长势相同的白木香愈伤组织, 分别经NaCl (150 mmol·L-1)、低温(4 ℃)、CdCl2 (500 μmol·L-1)、甘露醇(200 mmol·L-1) 4种非生物胁迫处理[20, 21]后0、12、24、36、48 h提取RNA作为样品检测AsG6PDHs基因在各种处理下的表达差异。所用菌种为大肠杆菌(Escherichia coli) DH5α, 购自天根生物科技有限公司。
白木香根、茎、叶及愈伤组织中RNA的提取和cDNA的合成 按照植物RNA快速提取试剂盒(Omega, R6827-02, 中国)实验操作步骤进行植物总RNA提取, 利用NanoDrop 2000C检测RNA浓度, 同时利用1.2%琼脂糖凝胶电泳检测RNA的完整性和质量。利用Sigma公司的反转录酶M-MLV将白木香总RNA反转录为第一链(cDNA), 反转录条件按照说明书进行。
白木香AsG6PDHs基因序列全长克隆 从白木香愈伤组织转录组测序结果中获得3个有表达序列标签拼接而成的序列, 依据两端序列利用Primer软件设计特异性引物, 引物序列见表 1。以白木香总RNA的反转录产物为模板, 按照下列体系对白木香中AsG6PDH1和AsG6PDH2基因进行扩增: cDNA 1 μL, 10×LA-Taq buffer 5 μL, dNTP Mix (2.5 mmol·L-1) 4 μL, LA-Taq (2.5 U·μL-1) 0.5 μL, 10 μmol·L-1引物各1 μL, 终体积为50 μL。反应程序: 94 ℃预变性5 min; 然后进行30个循环, 94 ℃ 1 min, 55 ℃ 30 s, 72 ℃ 1 min, 循环结束后72 ℃延伸反应10 min, 4 ℃保存。1%的琼脂糖凝胶电泳检测PCR产物, 凝胶成像分析系统检测, 目的片段回收和纯化按照胶回收试剂盒说明书进行。将回收后的PCR产物与pMD19-T连接, 转化到DH5α菌株, 在氨苄抗性的平板上进行筛选, 经菌落PCR检测后送上海英潍捷基公司测序。
| Table 1 Primer sequence |
白木香AsG6PDHs生物信息学分析 采用ExPASy Proteomics Server在线软件ProtParam (http://www.expasy.ch/tools/protparam.html)进行3个G6PDH基因编码蛋白的理化性质分析; 利用PSORT (http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)进行蛋白亚细胞定位分析; 使用SPOMA (http://npsa-pbil.ibcp.fr/cgi-bin/secpres_sopmal.pl)预测蛋白质的二级结构; 采用SWISS-MODEL (http://swissmodel.expasy.org)进行AsG6PDHs蛋白质三维建模分析; 将所获得的AsG6PDHs基因编码的氨基酸序列在GenBank数据库中进行Blast P对比分析, 利用DNAMAN对其他物种AsG6PDHs基因编码的氨基酸序列进行同源性分析; 通过MEGA 6.0软件构建Neighbor-joining系统进化树, 进化距离的计算采用泊松校正法, Bootstrap重复次数为1 000次。
白木香AsG6PDHs的蛋白表达 利用特异引物扩增AsG6PDH1、AsG6PDH2和AsG6PDH3基因的全长(表 1)。利用双酶切包含有目的基因的PCR产物及表达载体pET-28a, 酶切产物经过纯化后, 利用T4连接酶进行连接, 连接产物转化大肠杆菌DH5α感受态细胞, 经菌落PCR、测序后提取质粒pET28a-AsG6PDH1、pET28a-AsG6PDH2和pET28a-AsG6PDH3, 将质粒转化大肠杆菌BL21 (DE3)感受态细胞。挑取单菌落接种于含有卡那霉素的LB液体培养基中, 37 ℃活化过夜, 然后按照1:100比例加入新鲜的含有卡那霉素的LB液体培养基中, 37 ℃振荡培养至OD600为0.4~0.6, 调节温度为16 ℃, 加入IPTG后振荡培养24 h。之后4 ℃、12 000 r·min-1离心收集大肠杆菌, 悬浮于40 mmol·L-1 KPB缓冲液(pH 7.9, 含有100 mmol·L-1 NaCl, 5 mmol·L-1咪唑)中。将菌体放置于冰上, 利用超声破碎仪(Colo Parmer)破碎细胞, 之后4 ℃、12 000 r·min-1离心30 min以上。取上清液, 利用镍离子亲和色谱纯化重组蛋白, 先以20 mmol·L-1 KPB缓冲液(pH 7.9, 含有500 mmol·L-1 NaCl和40 mmol·L-1咪唑)洗脱目的蛋白, 利用SDS-PAGE检测重组蛋白表达。
白木香AsG6PDHs基因在不同组织和不同胁迫处理下的表达分析 利用实时荧光定量PCR (quantitative real-time PCR, qRT-PCR)的方法检测白木香3个AsG6PDHs基因在不同组织中和不同胁迫处理下的表达情况。分析使用SYBR Green I荧光染料法, 在qRT-PCR仪上进行。选取白木香GAPDH基因作为目标基因定量表达的内参基因, 引物序列见表 1。每个样品设3个重复, 重复3次。反应体系中含有10 μL STBR Premix Ex Taq酶, 上下游引物(10 μmol·L-1)各0.4 μL, 模板0.5 μL, 总体系为20 μL。反应程序是: 95 ℃预变性3 min, 95 ℃变性30 s, 60 ℃退火/延伸30 s (每次循环后采集荧光), 40个循环后, 95 ℃变性10 s, 65~95 ℃做熔解曲线分析, 每个温度以每步0.5 ℃上升, 每个温度停留5 s。根据熔解曲线判断RT-PCR产物的特异性, 相对定量分析采用2-ΔΔCt方法进行分析。
白木香愈伤组织中G6PDH酶活性的测定 G6PDH的提取按照文献报道的研究方法进行[22], 液氮研磨0.5 g愈伤组织后, 加入1 mL提取缓冲液(50 mmol·L-1 Hepes-Tris (pH 7.8), 3 mmol·L-1 MgCl2, 1 mmol·L-1 EDTA, 1 mmol·L-1 phenylmethylsulfonyl fluoride和1 mmol·L-1 DTT), 振荡混匀, 12 000 ×g在4 ℃离心20 min, 取上清, 作为粗酶液。G6PDH的活性是根据NADPH产生的速率来测定。磷酸戊糖途径的6-磷酸葡糖酸脱氢酶(6-phosphogluconate dehydrogenase, 6PGDH)也能形成NADPH, 所以为了精确地获得G6PDH的活性, 测定了6PGDH和总G6PDH+6PGDH的活性, 利用两者之差计算得出G6PDH的酶活。总G6PDH+6PGDH的活性测定: 3 mL反应体系中含有50 mmol·L-1 Hepes-Tris (pH 7.8)、3.3 mmol·L-1 MgCl2、0.5 mmol·L-1 D-glucose-6-phosphate disodium salt、0.5 mmol·L-1 6-phosphogluconate、100 μL粗酶液、0.5 mmol·L-1 NADPNa2。记录反应起始5 min内的340 nm处光吸收值的变化(消光系数6.22 m3·mol-1·cm-1)。6PGDH的活性测定: 3 mL反应体系中含有50 mmol·L-1 Hepes-Tris (pH 7.8)、3.3 mmol·L-1 MgCl2、0.5 mmol·L-1 6-phosphogluconate、100 μL粗酶液、0.5 mmol·L-1 NADPNa2。记录反应起始5 min内340 nm处光吸收值的变化(消光系数6.22 m3·mol-1·cm-1)。
结果与讨论 1 白木香AsG6PDHs基因全长cDNA的克隆根据白木香愈伤组织转录组测序结果, 以白木香愈伤组织的cDNA为模板进行扩增, 利用RT-PCR方法扩增得到一个约1 500 bp和两个约1 800 bp的片段, 扩增结果见图 1, 将PCR产物连接到pMD19-T载体上, 测序结果经过NCBI的BLAST的比对, 确定扩增产物是白木香中AsG6PDHs基因的全长, 分别命名为AsG6PDH1、AsG6PDH2和AsG6PDH3。AsG6PDH1序列全长1 809 bp, 编码602个氨基酸; AsG6PDH2序列全长为1 767 bp, 编码588个氨基酸; AsG6PDH3序列全长为1 548 bp, 编码516个氨基酸。AsG6PDH1、AsG6PDH2和AsG6PDH3基因序列已提交NCBI, 登录号分别是MT538204、MT538203和MT538202。

|
Figure 1 PCR amplification of AsG6PDHs genes. M: DNA marker; 1, 2, 3: PCR products of AsG6PDH1, AsG6PDH2 and AsG6PDH3 gene, respectively |
通过Protparam软件预测AsG6PDH1、AsG6PDH2、AsG6PDH3基因编码的蛋白的理化性质。推测AsG6PDH1编码的蛋白分子式为C3022H4742N848O906S18, 相对分子质量为68 027.11, 理论等电点为8.40, 不稳定系数Ⅱ为46.39, 属于不稳定蛋白, 总平均亲水性GRAVY为-0.415, 为亲水性蛋白; AsG6PDH2编码的蛋白分子式为C2992H4669N829O881S21, 相对分子质量为67 023.27, 理论等电点为6.90, 不稳定系数Ⅱ为41.41, 属于不稳定蛋白, 总平均亲水性GRAVY为-0.410, 为亲水性蛋白; AsG6PDH3编码的蛋白分子式为C2675H4178N722O784S11, 相对分子质量为59 349.63, 理论等电点为5.74, 不稳定系数Ⅱ为49.77, 属于不稳定蛋白, 总平均亲水性GRAVY为-0.429, 为亲水蛋白。通过蛋白质亚细胞定位软件WolFPSORT预测结构表明, 白木香AsG6PDH1和AsG6PDH2蛋白主要定位于细胞质体中, AsG6PDH3定位于细胞质中。利用TMHMM2.0预测白木香AsG6PDHs的跨膜区域, 预测结果表明AsG6PDH1、AsG6PDH2和AsG6PDH3都没有跨膜区域。
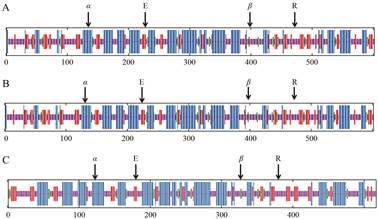
2.2 AsG6PDHs蛋白的二级结构分析及三维结构预测运用ExPASY中的SOPMA工具预测AsG6PDHs基因编码蛋白的二级结构, 结果显示AsG6PDH1蛋白的二级结构是由40.70%的随机卷曲(random coil)、37.04%的α-螺旋(α-helices)、17.28%的延伸链(extended strand)和4.98%的β-折叠(β-turn)组成(图 2A), 推测随机卷曲是其最多的二级结构元件, 而α-螺旋、延伸链和β-折叠散布于整个蛋白中。AsG6PDH2蛋白的二级结构是由40.75%的随机卷曲、40.07%的α-螺旋、13.92%的延伸链和5.26%的β-折叠组成(图 2B), 推测随机卷曲和α-螺旋是其最多的二级结构元件, 延伸链和β-折叠散布于整个蛋白中。AsG6PDH3蛋白的二级结构是由40.04%的α-螺旋、39.85%的随机卷曲、14.89%的延伸链和5.22%的β-折叠组成(图 2C), 推测α-螺旋是其最多的二级结构元件, 随机卷曲、延伸链和β-折叠散布于整个蛋白中。
|
Figure 2 Predicted secondary structure of AsG6PDHs protein with SOPMA. A, B, C: Predicted secondary structure of AsG6PDH1, AsG6PDH2 and AsG6PDH3, respectively. α: α-Helices; β: β-Turn; E: Extended strand; R: Random coil |
将白木香AsG6PDHs的氨基酸序列通过SWISS-MODEL Workspace在线分析软件建立了AsG6PDHs的三维结构模型, 选择拟南芥中AtG6PDH1的结构模型为模板, 对白木香AsG6PDH1、AsG6PDH2和AsG6PDH3的三维结构进行预测, 结果表明, 白木香AsG6PDH1、AsG6PDH2和AsG6PDH3与拟南芥中AtG6PDH1的相似性分别为47.38%、45.28%和52.10%, 具有参考价值, 具体三维结构如图 3A~C所示。

|
Figure 3 The deduced three-dimensional structure of AsG6PDHs protein. A, B, C: The tree-dimensional structure of AsG6PDH1, AsG6PDH2 and AsG6PDH3, respectively |
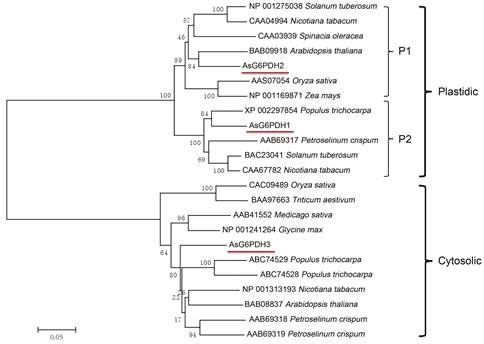
将白木香AsG6PDH1、AsG6PDH2、AsG6PDH3氨基酸序列与NCBI数据库中已经报道的G6PDH蛋白的氨基酸利用BLAST进行比对, 结果表明白木香中的G6PDH序列与其他植物的相似性比较高, 3个蛋白的相似性分别为80%~85%、78%~85%、84%~89%。利用DNAMAN软件将AsG6PDH1、AsG6PDH2、AsG6PDH3的氨基酸序列与已经报道的拟南芥中的质体G6PDH和胞质G6PDH进行序列比对(图 4), 发现AsG6PDH1、AsG6PDH2、AsG6PDH3中都包含3个G6PDH的特征序列, 分别为GASGDLAKK (Rossman fold)、DHYLGKE (active site)、NELVI (NAPD+ binding) (图 4中用红线标出), AsG6PDH1和AsG6PDH2比AsG6PDH3多了一段转运肽序列。将白木香AsG6PDH1、AsG6PDH2和AsG6PDH3氨基酸序列与其他植物中的不同G6PDH氨基酸序列进行比对, 通过进化树构建软件MEGA6, 采用相邻连接法构建G6PDH进化树, 进行G6PDH的聚类分析。通过软件构建的进化树如图 5所示, 结果表明AsG6PDH1的氨基酸序列与杨树中定位于细胞质体G6PDH蛋白序列相似性比较高, AsG6PDH2的氨基酸序列与拟南芥中细胞质体的G6PDH蛋白序列相似性比较高; AsG6PDH3氨基酸序列与杨树中的胞质型G6PDH的蛋白序列相似性比较高。聚类分析结果表明, 根据结构及蛋白质序列的相似性, 植物中的G6PDH蛋白分为两种类型, 一类G6PDH蛋白定位于细胞质体中, 氨基酸序列N端含有能够定位于质体的信号肽, AsG6PDH1和AsG6PDH2属于这一类, 质体G6PDH又分为P1-G6PDH和P2-G6PDH, 其中AsG6PDH1属于P2-G6PDH, AsG6PDH2属于P1-G6PDH; 而另一类属于胞质型G6PDH, 这类G6PDH定位于细胞质中, 白木香AsG6PDH3蛋白属于胞质型G6PDH, 这与亚细胞定位预测结果一致。

|
Figure 4 Multiple sequence alignment of AsG6PDHs and G6PDH Arabidopsis thaliana. Black shading indicates amino acid identities, red and blue shading indicates amino acid with different similarity. The conserved domain of G6PDH proteins are shown with red boxes. At: Arabidopsis thaliana; AtG6PDH1: Q43727.2; AtG6PDH2: Q9FY99.2 |
|
Figure 5 Phylogenetic analysis of G6PDH proteins from plants |
将原核表达载体pET28a-AsG6PDH1、pET28a-AsG6PDH2和pET28a-AsG6PDH3质粒转化大肠杆菌BL21 (DE3)后, 使用0.8 mmol·L-1的异丙基-β-D-硫代半乳糖苷(IPTG)于16 ℃诱导24 h的最佳诱导条件进行蛋白的原核表达诱导。通过镍离子亲和色谱纯化AsG6PDH1、AsG6PDH2和AsG6PDH3蛋白, 利用SDS-PAGE检测发现只有AsG6PDH3能够在BL21 (DE3)菌株中表达, 在60 kDa左右出现一条AsG6PDH3蛋白纯化条带(图 6)。

|
Figure 6 SDS-PAGE analysis of recombinant AsG6PDHs protein. A, B, C: SDS-PAGE analysis of recombinant AsG6PDH1, AsG6PDH2 and AsG6PDH3 protein, respectively. M: Marker; 1: Soluble fraction from the induced E. coli containing pET28a-AsG6PDH1, pET28a-AsG6PDH2 and pET28a-AsG6PDH3; 2: Insoluble protein from induced E. coli containing pET28a-AsG6PDH1, pET28a-AsG6PDH2 and pET28a-AsG6PDH3; 3: The purified recombinant AsG6PDHs protein |
利用荧光定量PCR检测AsG6PDHs基因的组织特异性表达, 结果显示AsG6DPHs在所有的组织中均有表达, 但是表达方式不同。AsG6PDH1主要在根中表达, 叶和茎尖次之, 在茎中表达量最低(图 7A); AsG6PDH2主要在根中表达, 茎和叶次之, 茎尖中表达量最少(图 7B); AsG6PDH3主要在茎中表达, 根和茎尖次之, 叶中表达量最少(图 7C)。这些实验结果说明AsG6PDHs基因表达具有器官特异性。

|
Figure 7 Relative expression level of AsG6PDHs genes in different tissues. A, B, C: Transcript level of AsG6PDH1, AsG6PDH2 and AsG6PDH3 gene, respectively. Note: Repeat 3 samples, each for 3 times |
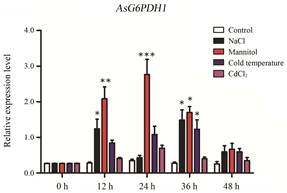
为验证白木香中AsG6PDHs基因在植物非生物胁迫中的作用, 分别对白木香愈伤组织进行盐、干旱、高温、低温和重金属胁迫, 以相同生长情况下未进行任何处理的愈伤组织作为对照, 不同时间点取样提取RNA后进行实时荧光定量PCR分析, 检测3个AsG6PDHs基因的表达水平。盐胁迫下, AsG6PDH1的表达水平出现双峰现象, 在12 h内显著升高, 是对照该基因表达量的4.4倍, 之后降低, 36 h后达到最高, 是对照表达量的5.5倍, 随后表达量缓慢降低(图 8); 甘露醇诱导产生的干旱胁迫下, AsG6PDH1的表达水平在24 h内显著升高, 并在24 h达到最高, 是对照表达量的8.0倍, 之后表达量逐渐降低(图 8); 低温胁迫下, AsG6PDH1的表达水平在36 h内显著升高, 并在36 h达到最高表达量, 是对照表达量的4.5倍, 随后逐渐降低(图 8); 重金属胁迫下, AsG6PDH1的表达水平在24 h内逐渐升高, 并在24 h达到最高, 之后逐渐降低(图 8)。结果表明, 盐、干旱、低温和重金属胁迫均可诱导AsG6PDH1基因的表达, 其中干旱胁迫对AsG6PDH1基因的表达水平影响最显著。
|
Figure 8 Relative expression level of AsG6PDH1 gene under different abiotic stresses in Aquilaria sinensis Calli. *P < 0.05, **P < 0.01, ***P < 0.001 vs control. Note: Repeat 3 samples, each for 3 times |
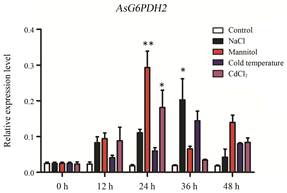
盐胁迫下, AsG6PDH2的表达水平36 h内逐渐升高, 并在36 h达到最高, 是对照表达量的10.0倍, 随后逐渐降低(图 9); 干旱胁迫下, AsG6PDH2的表达水平出现双峰现象, 在24 h内显著升高, 24 h达到最高表达量, 是对照表达量的16.1倍, 之后表达量降低, 之后48 h表达量上升(图 9); 低温胁迫下, AsG6PDH2的表达水平36 h内逐渐升高, 之后逐渐降低(图 9); 重金属胁迫下, AsG6PDH2的表达水平在24 h内逐渐升高, 24 h达到最高, 是对照表达量的10.0倍, 之后表达量逐渐降低(图 9)。结果表明, AsG6PDH2的表达水平也均可受到盐、干旱、低温和重金属胁迫的诱导, 其中干旱胁迫对其表达水平影响最显著。
|
Figure 9 Relative expression level of AsG6PDH2 gene under different abiotic stresses in Aquilaria sinensis Calli. *P < 0.05, **P < 0.01 vs control. Note: Repeat 3 samples, each for 3 times |
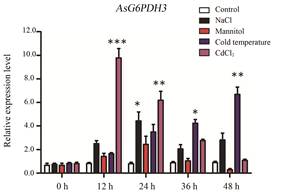
盐胁迫下, AsG6PDH3的表达水平出现双峰现象, 在24 h内显著升高, 24 h表达量达到最高, 是对照该基因表达量的5.6倍, 随后表达量在48 h又升高, 是对照该基因表达量的3.1倍(图 10); 甘露醇诱导产生的干旱胁迫下, AsG6PDH3的表达水平在24 h显著升高, 24 h表达量达到最高, 随后表达量降低(图 10); 低温诱导下, AsG6PDH3的表达水平在48 h内逐渐升高, 48 h的表达量达到最高, 是对照该基因表达量的7.5倍(图 10); 重金属胁迫下, AsG6PDH3的表达水平在12 h达到最高, 是对照表达量的12.1倍, 之后表达水平逐渐减低(图 10), 这些实验结果表明盐、干旱、低温和重金属胁迫均能够诱导AsG6PDH3的表达, 其中重金属胁迫对AsG6PDH3基因的表达水平影响最为显著。
|
Figure 10 Relative expression level of AsG6PDH3 gene under different abiotic stresses in Aquilaria sinensis Calli. *P < 0.05, **P < 0.01, ***P < 0.001 vs control. Note: Repeat 3 samples, each for 3 times |
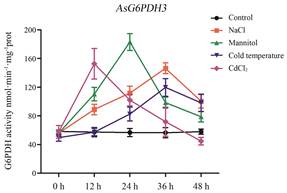
上述实验结果表明, 非生物胁迫条件下对白木香中AsG6PDHs基因的表达量影响比较大, 因此非生物胁迫很可能影响植物中的G6PDH酶活性, 因此本研究也检测了不同胁迫条件下的总G6PDH活性, 如图 11所示, 盐胁迫和低温胁迫下, G6PDH酶活性在36 h内逐渐升高, 36 h达到最高, 分别是对照酶活性的2.6倍和2.1倍, 之后降低; 干旱胁迫下, 愈伤组织的G6PDH活性在24 h内逐渐增高, 24 h达到最高, 是对照的3.2倍, 之后酶活性逐渐减低; 重金属胁迫下, 12 h内酶活性达到最高, 是对照的2.7倍, 之后逐渐降低。这些实验结果表明, 盐、干旱、冷、重金属胁迫均能够影响G6PDH的酶活性, 其中干旱胁迫对白木香的G6PDH酶活性影响最大。
|
Figure 11 Changes of G6PDH activity in Aquilaria sinensis Calli under different abiotic stresses. n = 3, |
G6PDH催化戊糖磷酸途径的第一步反应, 即6-磷酸葡萄糖的脱氢, 是磷酸戊糖途径的限速步骤[1, 2]。在高等植物中的胞质和质体中都存在G6PDH, 质体G6PDH的氨基酸序列比胞质G6PDH多一段转运肽序列。近期的研究表明质体G6PDH又可以分为P1 (P1-G6PDH)和P2 (P2-G6PDH)两种亚型, 不同亚型的G6PDH活性有所差别[23]。G6PDH在植物生长发育和胁迫响应中发挥重要作用。目前已经在多种植物中研究了G6PDH家族基因的功能, 但是关于白木香中的基因研究尚未见报道。本研究根据NCBI的序列和白木香愈伤组织转录测序结果分析, 通过RT-PCR方法从白木香愈伤组织中克隆得到3条AsG6PDHs基因的全长cDNA序列。AsG6PDH1、AsG6PDH2、AsG6PDH3都含有植物G6PDH的保守序列Rossman fold、活性位点和NAPD+的结合位点, 通过与NCBI中的植物中其他的G6PDH序列进行比对, 白木香中的3个AsG6PDHs蛋白与其他植物中的G6PDH蛋白同源性比较高, 分别是80%~85%、78%~85%、84%~89%。进化树结果表明AsG6PDH1属于质体P2-G6PDH, AsG6PDH2属于质体P1-G6PDH, AsG6PDH3属于胞质G6PDH。首次在大肠杆菌尝试表达白木香的AsG6PDHs蛋白, 希望能够在蛋白水平上研究白木香中AsG6PDHs的生物学功能。通过构建原核表达载体pET28a-AsG6PDH1、pET28a-AsG6PDH2和pET28a-AsG6PDH3在BL21 (DE3)菌株中诱导白木香AsG6PDHs蛋白, 实验结果表明AsG6PDH3重组蛋白能够以可溶性蛋白存在, 而AsG6PDH1和AsG6PDH2可能由于含有转运肽, 在BL21 (DE3)菌株不能够被诱导产生重组蛋白。这些实验结果为进一步研究AsG6PDHs的功能奠定基础。
基因在不同组织中的表达模式可为基因功能研究提供初步线索[24]。通过基因组分析发现拟南芥中含有6个G6PDH基因, 其中包括4个质体G6PDH和2个胞质G6PDH, 其中质体AtG6PDH1主要在花中表达, AtG6PDH2和AtG6PDH3主要在根中表达, AtG6PDH4主要在茎中表达; 胞质AtG6PDH5主要在叶和茎中表达, 而质体AtG6PDH6在组织中分布比较均匀[25]。土豆中质体G6PDH基因主要在根和叶中表达[4]。甘蔗中胞质ScG6PDH在各组织中的表达量都比较高, 在茎中表达量最高[26]。与以前的研究结果相似, 在白木香中, 质体AsG6PDH1和AsG6PDH2主要在根中表达, 胞质AsG6PDH3在各组织中表达量都比较高, 在茎中表达量最高。
白木香只有在受到各种胁迫伤害产生防御反应后才能够产生沉香, 因此研究白木香响应胁迫的分子机制对于阐明沉香的结香机制具有重要意义。近期研究结果表明G6PDH在植物防御反应过程起到重要作用。盐胁迫、干旱胁迫是植物最常见的胁迫, 严重制约着植物的生长发育。目前研究表明G6PDH在植物抗盐、抗干旱过程中起到非常积极的作用。如芦苇愈伤组织抗盐过程中G6PDH能够通过调节愈伤组织中谷胱甘肽含量, 从而提高愈伤组织的抗干旱能力[22]; 小麦中高盐能够诱导小麦中质体和胞质型G6PDH基因的表达, 提高植物体内G6PDH酶活性[8]; 在大豆根中, 干旱条件下能够提高根中质体和胞质型G6PDH基因的转录水平, 提高跟中G6PDH酶活性, 从而调节根的谷胱甘肽含量, 促进根在干旱条件下的生长发育[9]。本研究表明, 盐、干旱胁迫都能够诱导白木香中3个AsG6PDHs基因的表达, 其中盐胁迫显著提高AsG6PDH1和AsG6PDH3的表达水平, 而干旱胁迫能够显著提高AsG6PDH1和AsG6PDH2的转录水平, 同时盐、干旱胁迫也能够显著提高G6PDH酶活性。因此G6PDH在白木香抗盐和抗干旱胁迫过程中起到重要作用。
G6PDH在植物抗低温胁迫过程中起到重要的作用。烟草中过表达胞质PsG6PDH基因能够提高植物的抗冻性[27]; 腊梅中的胞质G6PDH的表达受到低温的诱导, 说明其在腊梅抗冻过程中起到重要作用[28]; 小麦中质体G6PDH和胞质G6PDH都受到低温胁迫的影响, 但是胞质G6PDH的基因表达量的变化远高于质体G6PDH的表达量的变化, 表明胞质亚型在冬小麦响应低温胁迫中发挥重要作用[7]。本研究表明, 白木香中质体型G6PDH基因AsG6PDH1和AsG6PDH2及胞质型AsG6PDH3的表达均受到低温胁迫的诱导, 其中AsG6PDH3基因转录水平变化最显著, 此外G6PDH酶活性也受到低温的诱导, 因此白木香中G6PDH能够响应低温胁迫, AsG6PDH3可能发挥主要作用。
相比之下, 关于不同类型的G6PDH基因在植物抗重金属胁迫中的作用研究的比较少。以前的研究表明, 当土壤中的铝浓度增加时, 植物中G6PDH酶活性增加[29]; 甘蔗的胞质ScG6PDH在重金属镉的诱导下, 其表达水平显著升高, 同时植物的G6PDH活性也显著升高。但是关于质体G6PDH对重金属胁迫的影响目前未见报道[26]。本研究表明, 重金属镉胁迫下, 白木香中3个AsG6PDHs基因的表达量均升高, 其中质体AsG6PDH3和胞质AsG6PDH2的转录水平显著升高, G6PDH酶活性也在12 h显著增加, 因此G6PDH在白木香响应重金属胁迫中起到重要作用, 其中AsG6PDH3和AsG6PDH2可能发挥主要作用。白木香中3个AsG6PDHs基因的克隆、器官特异性分析、非生物胁迫下的表达分析及G6PDH酶活性在非生物胁迫下的影响分析为进一步研究G6PDH在植物胁迫应答中的作用机制研究奠定基础, 同时也有利于进一步研究白木香的结香机制。
作者贡献: 高博闻主要负责AsG6PDHs基因克隆和原核表达; 戎玉清主要负责AsG6PDHs生物信息学分析和不同胁迫下的表达分析; 李铁铮负责实验中数据收集和分析; 魏胜利为本研究提供实验指导并对论文初稿进行修改; 王晓晖和屠鹏飞负责设计论文的实验思路, 指导学生实验, 论文撰写及修改。
利益冲突: 本文里的研究内容无任何利益冲突。
| [1] |
Bedhomme M, Adamo M, Marchand CH, et al. Glutathionylation of cytosolic glyceraldebyde-3-phosphate dehydrogenase from the model plant Arabidopsis thaliana is reversed by both glutaredoxins and thioredoxins in vitro[J]. Biochem J, 2012, 445: 337-347. DOI:10.1042/BJ20120505 |
| [2] |
Spielbauer G, Li L, Romisch-margl L, et al. Chlorplast-localized 6-phosphogluconate dehydrogenase is critical for maize starch accumulation[J]. J Exp Bot, 2013, 64: 2231-2242. DOI:10.1093/jxb/ert082 |
| [3] |
Bussell JD, Keech O, Fenske R, et al. Requirement for the plastidial oxidative pentose phosphate pathway for nitrate assimilation in Arabidopsis[J]. Plant J, 2013, 75: 578-591. DOI:10.1111/tpj.12222 |
| [4] |
Schaewen AV, Scheibe R. Molecular characterization of the plastidic glucose-6-phosphate dehydrogenase from potato in comparison to its cytosolic counterpart[J]. Plant Physiol, 1995, 109: 1327-1335. DOI:10.1104/pp.109.4.1327 |
| [5] |
Ye JR, Huang SH. Studies on the relation of glucose-6-phosphate dehydrogenase and phenylalanine ammonia lyase in slash needles with resistance to brown spot needle blight[J]. Sci Silva Sin, 1994, 30: 430-436. |
| [6] |
Zhang L, Liu J, Wang X, et al. Glucose-6-phosphate dehydrogenase acts as a regulator of cell redox balance in rice suspension cell under salt stress[J]. Plant Growth Regul, 2013, 69: 139-148. DOI:10.1007/s10725-012-9757-4 |
| [7] |
Tian Y, Peng KK, Song CH, et al. Bioinformatics analysis of wheat G6PDH genes and their expression patterns in tillering node and leaf under cold stress[J]. J Tririceae Crops, 2019, 39: 1-8. |
| [8] |
Nemoto Y, Sasakuma T. Specific expression of glucose-6-phosphate dehydrogenase (G6PDH) gene by salt stress in wheat (Triticum aestivum L.)[J]. Plant Sci, 2000, 158: 53-60. DOI:10.1016/S0168-9452(00)00305-8 |
| [9] |
Liu J, Wang XM, Hu YF, et al. Glucose-6-phosphate dehydrogenase plays a pivotal role in tolerance to drought stress in soybean roots[J]. Plant Cell Rep, 2013, 32: 415-429. DOI:10.1007/s00299-012-1374-1 |
| [10] |
CITES. Amendments to Appendix I and Ⅱ of CITES[C]. In Proceedings of Thirteenth Meeting of the Conference of the Parties, Bangkok, Thailand, 2004: 2-14.
|
| [11] |
State Environmental Protection Administration of China. Institute of Botany, the Chinese Academy of Sciences List of Rare and Endangered Plants in China (Vol 1) (中国珍稀濒危保护植物名录:第一册)[M]. Beijing: Science Press, 1987.
|
| [12] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典: 一部)[S]. Beijing: China Medical Science Press, 2015.
|
| [13] |
Li G, Duan LS, Yang CY, et al. Advances in studies on technology of agarwood formation in Aquilaria sinensis[J]. J Anhui Agric Sci (安徽农业科学), 2009, 37: 12012-12013. |
| [14] |
Zhang Z, Yang Y, Wei JH, et al. Advances in studies on mechanism of agarwood formation in Aquilaria sinensis and its hypothesis of agarwood formation induced by defense response[J]. Chin Tradit Herb Drugs (中草药), 2010, 41: 156-159. |
| [15] |
Xu Y, Zhang Z, Wang M, et al. Identification of genes related to agarwood formation:transcriptome analysis of healthy and wounded tissues of Aquilaria sinensis[J]. BMC Genomics, 2013, 14: 227-243. DOI:10.1186/1471-2164-14-227 |
| [16] |
Qi SY, He ML, Lin LD, et al. Production of 2-(2-phenylethyl)chromones in cell suspension cultures of Aquilaria sinensis[J]. Plant Cell Tiss Org, 2005, 83: 217-221. DOI:10.1007/s11240-005-5479-x |
| [17] |
Wang XH, Gao BW, Liu X, et al. Salinity stress induces the production of 2-(2-phenylethyl)chromones and regulates novel classes of responsive genes involved in signal transduction in Aquilaria sinensis Calli[J]. BMC Plant Biol, 2016, 16: 119. DOI:10.1186/s12870-016-0803-7 |
| [18] |
Wang XH, Dong XJ, Feng YY, et al. H2O2 and NADPH oxidases involve in regulation of 2-(2-phenylethyl) chromones accumulation during salt stress in Aquilaria sinensis Calli[J]. Plant Sci, 2018, 269: 1-11. |
| [19] |
Dong XJ, Gao BW, Feng YY, et al. Production of 2-(2-phenylethyl)chromones in Aquilaria sinensis Calli under different treatments[J]. Plant Cell Tiss Org, 2018, 135: 53-62. DOI:10.1007/s11240-018-1442-5 |
| [20] |
Dong XJ, Feng YY, Liu X, et al. Cloning and expression analysis of S-adenosylmethionine synthetase gene from Aquilaria sinensis[J]. Acta Pharm Sin (药学学报), 2018, 53: 1743-1752. |
| [21] |
Dong XJ, Li TZ, Feng YY, et al. Cloning and expression analysis of allene oxide cyclase gene from Aquilaria sinensis[J]. Acta Pharm Sin (药学学报), 2018, 53: 467-475. |
| [22] |
Wang XM, Ma YY, Huang CH, et al. Glucose-6-phosphate dehydrogenase plays a central role in modulating reduced glutathione levels in reed callus under salt stress[J]. Planta, 2008, 227: 611-623. DOI:10.1007/s00425-007-0643-7 |
| [23] |
Cardi M, Castiglia D, Ferrara M, et al. The effects of slat stresss cause a diversion of basal metabolism in barley roots:possible different roles for glucose-6-phosphate dehydrogenase isoforms[J]. Plant Physiol Biochem, 2015, 86: 44-54. DOI:10.1016/j.plaphy.2014.11.001 |
| [24] |
Li YM, Zhang N, Shen X, et al. Identification and expression analysis of four CIPKs genes froma rare and medicinal plant, Dendrobium officinale[J]. Acta Pharm Sin (药学学报), 2018, 53: 304-312. |
| [25] |
Wakao S, Benning C. Genome-wide analysis of glucose-6-phosphate dehydrogenases in Arabidopsis[J]. Plant J, 2005, 41: 243-256. |
| [26] |
Yang YT, Fu ZW, Su YC, et al. A cytosolic glucose-6-phosphate dehydrogenase gene, ScG6PDH, plays a positive role in response to various abiotic stresses in sugarcane[J]. Sci Rep, 2014, 4: 388. |
| [27] |
Lin YZ, Lin SZ, Guo H, et al. Functional analysis of PsG6PDH, a cytosolic glucose-6-phosphate dehydrogenase gene from Populus suaveolens and its contribution to cold tolerance improvement in tobacco plants[J]. Biotechnol Lett, 2013, 35: 1509-1518. DOI:10.1007/s10529-013-1226-2 |
| [28] |
Wang XH, Liu X, Gao BW, et al. Cloning and expression analysis of glucose-6-phosphate dehydrogenase 1(G6PDH1) gene from Chimonanthus praecox[J]. China J Chin Mater Med (中国中药杂志), 2015, 40: 4160-4164. |
| [29] |
Ślaski JJ, Zhang GC, Basu U, et al. Aluminum resistance in wheat (Triticum aestivum) is associated with rapid, Al-induced changes in activities of glucose-6-phosphate dehydrogenase and 6-phosphogluconate dehydrogenase in root apices[J]. Physiol Plant, 1996, 98: 477-484. DOI:10.1111/j.1399-3054.1996.tb05702.x |
 2020, Vol. 55
2020, Vol. 55


