2. 北京中医药大学中药学院, 北京 102488
2. School of Chinese Pharmacy, Beijing University of Chinese Medicine, Beijing 102488, China
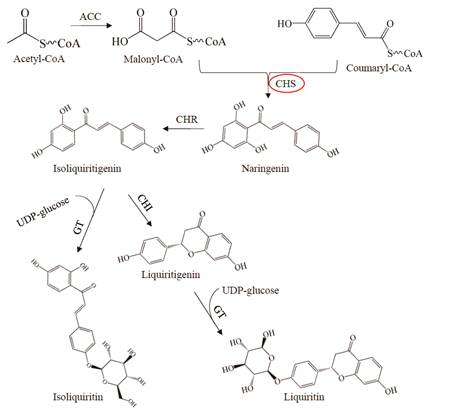
甘草为豆科甘草属多年生草本植物, 其始载于《神农本草经》, 在我国具有两千多年的药用历史, 素有“国老药”、“十方九草”之美誉。2015版《中华人民共和国药典》规定, 药用植物甘草的检测指标为黄酮类化合物甘草苷和三萜类化合物甘草酸[1]。黄酮类化合物是甘草中一类重要的活性成分, 是其发挥抗炎[2]、抗肿瘤[3]、抗氧化[4, 5]、抗糖尿病[6]等药理作用不可替代的成分。甘草中最主要的黄酮类化合物包括:甘草苷(liquiritin)、异甘草苷(isoliquiritin)、甘草素(liquiritigenin)和异甘草素(isoliquiritigenin), 其生物合成途径如图 1所示: 3分子丙二酰辅酶A和1分子香豆酰辅酶A在查尔酮合酶(chalcone synthase, CHS)催化下生成柚皮素查尔酮(naringenin), 继而在查尔酮还原酶(chalcone reductase, CHR)催化下生成异甘草素; 异甘草素和UDP-葡萄糖可被糖基转移酶(glycosyl transferase, GT)催化生成异甘草苷; 同时异甘草素也可被查尔酮异构酶(chalcone isomerase, CHI)催化生成甘草素; 而甘草素可在GT催化下获得糖基, 生成甘草苷。CHS是该途径的第一个限速酶, 在黄酮类化合物生物合成中发挥着重要调控作用。
|
Figure 1 Biosynthetic pathway of liquiritin. ACC: Acetyl-CoA carboxylase; CHS: Chalcone synthase; CHR: Chalcone reductase; CHI: Chalcone isomerase; GT: Glycosyltransferase |
自1983年报道荷兰芹(Petroselinum crispum)[7]的CHS基因以来, 已从丹参(Salvia miltiorrhiza)[8]、丁香(Syringa oblata)[9]、葡萄(Vitis vinifera)[10]、紫茉莉(Mirabilis himalaca)[11]等近百种植物中克隆得到该基因。目前, GenBank上注册了13 000余条植物CHS基因, 包括DNA 7 500余条, mRNA 5 500余条。CHS基因属于多基因家族, 结构保守, 多数CHS基因由一个内含子和两个外显子组成, 其家族成员在黄酮生物合成途径的多个环节发挥作用[12], 可被多种因子调控[13]。研究表明, 在烟草(Nicotiana tabacum)中过表达CHS基因可提高黄酮类化合物含量, 而沉默CHS基因则使黄酮类化合物含量降低[14]。青蒿(Artemisia annua)中CHS基因表达量上调时, 黄酮类化合物含量显著提高[15]。
植物在长期进化的过程中, 由于自然突变的作用, 遗传基因会发生不同程度的变异, 形成基因多态性, 其中功能基因的多态性对于调控产物的合成具有显著影响。就药材而言, 药效物质的含量高低是评价其质量的决定性因素, 因此功能基因的多态性同样是导致其质量差异的分子基础。本课题组前期研究发现甘草三萜生物合成途径中β-香树酯醇合酶(β-amyrin synthase, β-AS)[16]、鲨烯合酶(squalene synthase, SQS)[17]、3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methylglutary-coenzyme A reductase, HMGR)[18]的基因多态性会明确影响甘草酸的含量。因此, 推测甘草苷等黄酮类化合物的生物合成也受到功能基因多态性的影响。
辐照诱变技术由于具有突变率高、育种周期短等优点, 近年来已成为获得药用植物新种质资源的有效途径之一[19]。Gao等[20]对空间飞行后的甘草进行分子标记, 发现其基因组多态性的变化会影响次生代谢产物的积累。本课题组前期利用X射线辐照处理乌拉尔甘草种子, 栽培一年后进行HPLC含量测定, 结果显示辐照组三萜类和黄酮类成分含量均显著高于空白对照组[21]。因此, 本文仍采用X射线辐照处理甘草样品, 丰富其基因多样性, 寻找CHS的功能位点, 并深入解析CHS基因多态性影响甘草黄酮类化合物生物合成的分子机制。
材料与方法植物材料 经X射线辐照处理的乌拉尔甘草种子, 在北京中医药大学药草园栽培一年, 利用HPLC检测样品中4种黄酮类化合物的含量, 挑选含量最高的3株X射线辐照处理样品和含量最低的3株空白对照样品作为本实验的植物材料, 样品信息见表 1。
| Table 1 Information of six Glycyrrhiza uralensis samples |
试剂 ESPY spin植物RNA快速提取试剂盒、Oligo dT、琼脂糖凝胶纯化回收试剂盒、M-MLV (Rnase H-)、大肠杆菌DH5α感受态细胞等均购于北京博迈德基因技术有限公司; 引物合成由生工生物工程(上海)股份有限公司完成; 氨苄青霉素(ampicillin, Amp)和LB培养基所需药品均购于北京冠星宇科技有限公司; pMD-19T载体、LA Taq DNA聚合酶等购于TaKaRa公司。
仪器 1-13000型离心机(Sigma公司); TC-3000 PCR扩增仪(英国Techne公司); DYY-6C电泳仪(北京市六一仪器厂); H6-1微型电泳槽(上海精益有机玻璃制品仪器厂); 酶标仪(美国Biotek Epoch公司); 恒温金属浴(德国Eppendorf公司); 恒温震荡培养箱(北京东联哈尔滨仪器制造有限公司); 凝胶成像系统(Gene Genius公司); LRH-250生化培养箱(上海一恒科技有限公司)。
甘草总RNA提取及逆转录 取6份甘草主根于液氮中研磨至粉末, 使用ESPY spin植物RNA快速提取试剂盒提取总RNA, 采用1%琼脂糖凝胶电泳检测RNA完整性, 使用酶标仪测定OD260/OD280以确定RNA纯度和浓度。以所提RNA为模板, Oligo dT为引物, 使用M-MLV (Rnase H-)逆转录试剂盒反转录生成cDNA。
甘草CHS基因的PCR扩增 根据GenBank上已注册的胀果甘草CHS序列(EU706287), 运用软件Primer Premier 5.0设计引物序列如下:
F: 5'-CAATGGTGAGCGTAGCTGAAATTC-3'
R: 5'-CAATCATATAGCCACACTGTGCAG-3'
以cDNA为模板, 25 μL PCR扩增体系包括: 1 μL cDNA、18.25 μL H2O、0.5 μL上游引物F (10 μmol·L-1)、0.5 μL下游引物R (10 μmol·L-1)、2.0 μL dNTP、2.5 μL 10× Buffer、0.25 μL LA Taq酶。PCR扩增程序: 94 ℃ 5 min; 94 ℃ 15 s, 56 ℃ 30 s, 72 ℃ 90 s (30个循环); 72 ℃ 10 min; 4 ℃保存。
CHS基因片段胶回收、连接、转化及测序 采用北京博迈德基因技术有限公司的琼脂糖凝胶纯化回收试剂盒, 严格按照操作说明回收目的条带。将回收产物与pMD-19T载体于16 ℃金属浴中连接12 h, 连接产物转化大肠杆菌DH5α感受态细胞, 37 ℃、180 r·min-1复苏45 min后涂布于含50 mg·L-1 Amp的LB平板上, 37 ℃倒置培养过夜, 挑取单克隆, 接种于LB液体培养基(含50 mg·L-1 Amp), 37 ℃、220 r·min-1培养过夜。以菌液为模板进行PCR, 阳性克隆送生工生物工程(上海)股份有限公司测序。对所有序列进行重复测序, 同时结合碱基质量峰图, 最大限度降低因测序误差造成的基因多态性误差。
序列分析及同源模建 使用软件DNAMAN 6.0.3.99比对全部CHS cDNA序列; 使用软件Editseq 7.1.0进行序列翻译; 利用在线软件Swiss-model进行同源模建; 利用SAVES服务器分析评价同源模建蛋白; 以丙二酰辅酶A和香豆酰辅酶A为底物, 采用Discovery Studio 2.5预测模建蛋白结合位点。
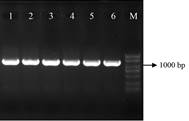
结果与讨论 1 甘草CHS基因的PCR扩增及测序结果如图 2所示, PCR扩增获得了长度约为1 200 bp的特异性条带, 测序结果显示所得片段长度为1 175 bp, 包含长度为1 170 bp的完整开放阅读框, 编码1条由389个氨基酸残基组成的多肽链。BLAST分析发现该片段与乌拉尔甘草CHS基因序列(KY810370)一致性为99%, 表明CHS基因序列克隆成功。6份甘草样品共克隆得到109条CHS基因cDNA序列, DNAMAN比对分析确定了85种单倍型, 共编码65种氨基酸序列类型, 在GenBank中对所有序列进行注册, 列于表 2中。其中, 红色标出的单倍型仅存在于X射线辐照处理后的黄酮高含量组中(38种), 未采用红色标记的单倍型仅存在于空白组中(47种)。黄酮高含量组的38种单倍型一致性为98.84%, 其中单倍型28占比最高(15.09%), 其次为单倍型63 (9.43%), 为该组的主流单倍型; 空白对照组的47种单倍型一致性为99.35%, 单倍型12占比最高(10.71%), 为该组的主流单倍型。65种氨基酸序列中, 黄酮高含量组具有23种, 序列一致性为99.43%, 其中aa-20占比最高(43.40%), 其次为aa-45 (16.98%), 是该组的主流CHS氨基酸序列类型; 空白对照组具有42种, 序列一致性为99.32%, 其中aa-11占比最高(16.08%), 是该组的主流CHS氨基酸序列类型。
|
Figure 2 CHS cloning result. M: Marker, 1-6: Samples |
| Table 2 GenBank accession number of 85 haplotypes and 65 amino acid sequences cloned from the 6 G. uralensis samples. Notes: Haplotypes marked by red only present in X-ray irradiated group |
85种CHS cDNA单倍型共存在220个变异位点, 其中错义突变位点为116个, 统计结果如表 3所示。65种CHS氨基酸序列共存在96个变异位点, 统计结果如表 4所示。在X射线辐照处理黄酮高含量组的全部氨基酸序列中, 193位点的Ⅴ/Ⅰ变异频率为35.85%; 229位点的Ⅰ/Ⅴ变异频率为37.74%; 383位点的Ⅰ/Ⅴ变异频率为100%。在空白对照组的全部氨基酸序列中, 193位点的Ⅴ/Ⅰ变异频率为4.84%; 229位点的Ⅰ/Ⅴ变异频率为4.84%; 383位点的Ⅰ/Ⅴ变异频率为24.20%。黄酮高含量组样品在这3个位点的变异频率均显著高于空白对照组样品, 故推测这3个位点的突变与黄酮的积累水平相关。
| Table 3 Variable sites of the 85 CHS haplotypes. Notes: "0" refers to synonymous mutation, "1" refers to missense mutation, mutation sites marked by red only present in X-ray irradiated group |
| Table 4 Variable sites in the 65 CHS amino acid sequences. Notes: Mutation sites marked by red only present in X-ray irradiated group |
85种甘草CHS单倍型聚类分析结果如图 3所示。整体而言, 黄酮高含量组和空白对照组甘草样品CHS cDNA序列区分度良好, 表明辐照处理后黄酮高含量组和空白对照组间CHS序列差异明显。

|
Figure 3 Clusters of 85 CHS cDNA sequences cloned from 6 G. uralensis samples. Red: X-ray irradiated samples; Green: Black control samples |
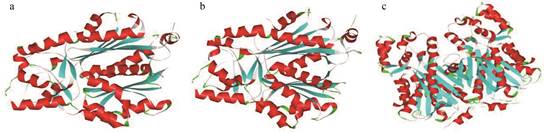
利用在线软件Swiss-model对黄酮高含量组的主流CHS氨基酸序列类型aa-20、aa-45及空白对照组的主流CHS氨基酸序列类型aa-11进行同源模建, 结果如图 4所示。三条氨基酸序列共用一个模版(PDB数据库ID: 1BI5)。利用SAVES服务器对同源模建蛋白进行评价分析, aa-11、aa-20、aa-45三维模型的Verify-3D值分别为89.85%、89.85%、91.26%; ERRAT值分别为98.6877、98.6877、98.1627;拉氏图的最适残基量分别为93.1%、93.1%、92.8%, 以上结果表明aa-11、aa-20及aa-45的模建蛋白均具有良好的空间结构和立体化学参数, 可用于后续分析。
|
Figure 4 The homology modeling results of aa-11, aa-20 and aa-45. a: aa-11; b: aa-20; c: aa-45 |
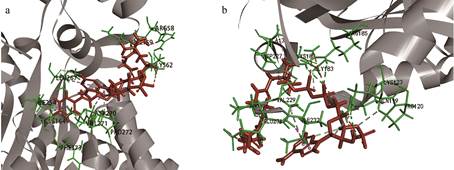
利用Discovery Studio 2.5预测模建蛋白的结合位点, 结果如图 5所示, aa-20的383位缬氨酸(valine, Ⅴ)位于结合位点区域, 能够与香豆酰辅酶A结合, aa-45的229位缬氨酸位于结合位点区域, 能够与丙二酰辅酶A结合, 而aa-11的229位和383位的异亮氨酸(isoleucine, I)均与底物结合无关。以上结果与黄酮高/低含量组CHS氨基酸序列变异位点分析结果一致, 进一步解释了229、383位点处的变异与黄酮积累水平相关。
|
Figure 5 Binding sites prediction between coumaryl-CoA and aa-20 (a), and malonyl-CoA and aa-45 (b) |
甘草中发现的黄酮类化合物超过300余种, 囊括了花青素之外的所有黄酮小类[22]。近些年报道较多的黄酮类化合物是甘草苷、异甘草苷、甘草素和异甘草素, 研究主要集中在药理活性方面, 而对其次生代谢途径分子调控的研究较少。本文以甘草黄酮类生物合成途径入口酶CHS为研究对象, 探讨其基因多态性对黄酮类化合物生物合成的影响作用。
CHS属于多基因家族, 近年来, 越来越多的CHS基因从大豆(Glycine max)[23]、桑树(Morus atropurpurea)[24]、玉米(Zea mays)[25]中克隆得到, 进一步丰富了CHS基因库。CHS的功能多样, 在植物色素沉着[26]、抗胁迫[27]、抵抗病原菌入侵[28]等方面发挥重要作用。本课题组前期研究发现过表达CHS基因的甘草毛状根中黄酮类化合物的积累水平显著提高[29], 证明CHS对甘草黄酮类化合物的生物合成具有重要的调控作用。然而, CHS在甘草中以多拷贝的形式存在, 筛选出功能最佳的基因型, 不仅有助于CHS功能的阐释, 更可作为分子标记运用于甘草的人工选育。
此前其他学者针对CHS基因单核苷酸多态性(single nucleotide polymorphism, SNP)进行了相关研究。Ghosh等[30]分析了不同品种姜(Zingiber officinale)的CHS基因和氨基酸序列的多态性, 发现氨基酸序列142位点和336位点突变对CHS功能影响较大。本课题组前期对自然生长的甘草CHS基因多态性进行了分析[31], 发现CHS氨基酸序列229位点的变异会影响甘草苷的生物合成。相较于其他学者以及本课题组的前期研究, 在本研究中采用X射线辐照处理甘草种子, 栽培一年后作为实验材料, 这大大提高了甘草样品基因变异的频率, 丰富了CHS基因多样性, 在此基础上确定了黄酮高/低含量组共计85种CHS单倍型, 从丰富的单倍型中进一步筛选出黄酮高/低含量组对应的主流CHS单倍型及氨基酸序列, 并分析其功能, 深入挖掘酶的活性位点。根据氨基酸序列变异位点分析, 推测193、229、383位点的突变会影响CHS的功能, 进一步利用黄酮高/低含量组的主流氨基酸序列类型aa-20、aa-45、aa-11进行结合位点预测分析, 发现黄酮高含量组aa-20的383位点和aa-45的229位点均与底物结合有关, 而黄酮低含量组aa-11的229位点和383位点均不在位点结合域内, 与底物结合无关。因此证明除229位点的突变会对CHS功能产生较大影响之外, 383位点变异同样会影响CHS的功能。本研究为解析甘草CHS基因的功能奠定了基础, 也为其他药用植物功能基因多态性研究提供了思路。
作者贡献: 刘颖和肖瑶设计并指导了本文全部实验及论文写作; 田少凯撰写了本论文并与侯嘉铭一起完成实验; 杨林和张智新参与了实验数据分析。
利益冲突: 本文作者均无利益冲突。
| [1] |
Chinese Pharmacopoeia Commission.Pharmacopoeia of the People's Republic of China. Part 1(中华人民共和国药典一部)[S]. Beijing: China Medical Science Press, 2015: 87.
|
| [2] |
Yu XM, Bao YR, Meng XS, et al. Multi-pathway integrated adjustment mechanism of licorice flavonoids presenting anti-inflammatory activity[J]. Oncol Lett, 2019, 18: 4956-4963. |
| [3] |
Funakoshi-Tago M, Tanabe S, Tago K, et al. Licochalcone A potently inhibits tumor necrosis factor α-induced nuclear factor-κB activation through the direct inhibition of IκB kinase complex activation[J]. Mol Pharmacol, 2009, 76: 745-753. DOI:10.1124/mol.109.057448 |
| [4] |
Frattaruolo L, Carullo G, Brindisi M, et al. Antioxidant and anti-inflammatory activities of flavanones from Glycyrrhiza glabra L. (licorice) leaf phytocomplexes: identification of licoflavanone as a modulator of NF-κB/MAPK pathway[J]. Antioxidants, 2019, 8: 186.
|
| [5] |
Fu Y, Chen J, Li YJ, et al. Antioxidant and anti-inflammatory activities of six flavonoids separated from licorice[J]. Food Chem, 2013, 141: 1063-1071. DOI:10.1016/j.foodchem.2013.03.089 |
| [6] |
Gosch C, Halbwirth H, Stich K. Phloridzin. Biosynthesis, distribution and physiological relevance in plants[J]. Phytochemistry, 2010, 71: 838-843. DOI:10.1016/j.phytochem.2010.03.003 |
| [7] |
Reimold U, Kröger M, Kreuzaler F, et al. Coding and 3' non-coding nucleotide sequence of chalcone synthase mRNA and assignment of amino acid sequence of the enzyme[J]. EMBO J, 1983, 2: 1801-1805. DOI:10.1002/j.1460-2075.1983.tb01661.x |
| [8] |
Deng YX, Li CL, Li HQ, et al. Identification and characterization of flavonoid biosynthetic enzyme genes in Salvia miltiorrhiza (Lamiaceae)[J]. Molecules, 2018, 23: 1467. DOI:10.3390/molecules23061467 |
| [9] |
Wang Y, Dou Y, Wang R, et al. Molecular characterization and functional analysis of chalcone synthase from Syringa oblata Lindl. in the flavonoid biosynthetic pathway[J]. Gene, 2017, 635: 16-23.
|
| [10] |
Wang H, Wang W, Zhan J, et al. The accumulation and localization of chalcone synthase in grapevine (Vitis vinifera L.)[J]. Plant Physiol Biochem, 2016, 106: 165-176.
|
| [11] |
Lan X, Quan H, Xia X, et al. Molecular cloning and transgenic characterization of the genes encoding chalcone synthase and chalcone isomerase from the Tibetan herbal plant Mirabilis himalaicaI[J]. Biotechnol Appl Biochem, 2016, 63: 419-426. DOI:10.1002/bab.1376 |
| [12] |
Hu L, He H, Zhu C, et al. Genome-wide identification and phylogenetic analysis of the chalcone synthase gene family in rice[J]. J Plant Res, 2017, 130: 95-105. DOI:10.1007/s10265-016-0871-7 |
| [13] |
Du F, Fan J, Wang T, et al. Identification of differentially expressed genes in flower, leaf and bulb scale of Lilium oriental hybrid 'Sorbonne' and putative control network for scent genes[J]. BMC Genomics, 2017, 18: 899. DOI:10.1186/s12864-017-4303-4 |
| [14] |
Chen LJ, Guo HM, Yi L, et al. Chalcone synthase EaCHS1 from Eupatorium adenophorum functions in salt stress tolerance in tobacco[J]. Plant Cell Rep, 2015, 34: 885-894. DOI:10.1007/s00299-015-1751-7 |
| [15] |
Dilshad E, Zafar S, Ismail H, et al. Effect of rol genes on polyphenols biosynthesis in Artemisia annua and their effect on antioxidant and cytotoxic potential of the plant[J]. Appl Biochem Biotechnol, 2016, 179: 1456-1468. DOI:10.1007/s12010-016-2077-9 |
| [16] |
Hu T, Liu ZZ, Tian SK, et al. Polymorphism of β-amyrin synthase gene (β-AS) influence the accumulation of triterpenes in licorice[J]. S Afr J Bot, 2019, 125: 310-320. DOI:10.1016/j.sajb.2019.06.036 |
| [17] |
Liu Y, Zhang N, Wang XY, et al. Researches on influence of squalene synthase gene polymorphism on catalytic efficiencyof its encode enzyme in Glycyrrhiza uralensis[J]. China J Chin Mater Med (中国中药杂志), 2012, 37: 3777-3783. |
| [18] |
Liu Y, Xu QX, Wang XY, et al. Analysis on correlation between 3-hydroxy-3-methylglutary-coenzyme A reductase gene polymorphism of Glycyrrhiza uralensis and content of glycyrrhizic acid[J]. China J Chin Mater Med (中国中药杂志), 2012, 37: 3789-3792. |
| [19] |
Jia C, Li A. Advances in studies on radiating mutation breeding of medicinal plants in China[J]. Chin Tradit Herb Drugs (中草药), 2007, 38: 633-636. |
| [20] |
Gao WY, Li KF, Yan S, et al. Effects of space flight on DNA mutation and secondary metabolites of licorice (Glycyrrhiza uralensis Fisch[J]. Sci China C Life Sci, 2009, 52: 977-981. DOI:10.1007/s11427-009-0120-6 |
| [21] |
Hu T, Gao ZQ, Ma YS, et al. Effect of X-ray irradiation treatment on contents of triterpenoids and flavonoids in Glycyrrhizae Radix et Rhizoma[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2017, 23: 17-21. |
| [22] |
Wang X, Zhang H, Chen L, et al. Liquorice, a unique "guide drug" of traditional Chinese medicine:a review of its role in drug interactions[J]. J Ethnopharmacol, 2013, 150: 781-790. DOI:10.1016/j.jep.2013.09.055 |
| [23] |
Anguraj VAK, Krysiak K, Tian G, et al. Genome-wide identification and localization of chalcone synthase family in soybean (Glycine max[L] Merr)[J]. BMC Plant Biol, 2018, 18: 325-325.
|
| [24] |
Wang CH, Zhi S, Liu CY, et al. Isolation and characterization of a novel chalcone synthase gene family from mulberry[J]. Plant Physiol Biochem, 2017, 115: 107-118. DOI:10.1016/j.plaphy.2017.03.014 |
| [25] |
Han YH, Ding T, Su B, et al. Genome-wide identification, characterization and expression analysis of the chalcone synthase family in maize[J]. Int J Mol Sci, 2016, 17: 161. DOI:10.3390/ijms17020161 |
| [26] |
Sun W, Meng XY, Liang LJ, et al. Molecular and biochemical analysis of chalcone synthase from freesia hybrid in flavonoid biosynthetic pathway[J]. PLoS One, 2015, 10. |
| [27] |
Pettinga DJ, Ou J, Patterson EL, et al. Increased chalcone synthase (CHS) expression is associated with dicamba resistance in Kochia scoparia[J]. Pest Manag Sci, 2018, 74: 2306-2315. DOI:10.1002/ps.4778 |
| [28] |
Hossain MZ, Ishiga Y, Yamanaka N, et al. Soybean leaves transcriptomic data dissects the phenylpropanoid pathway genes as a defence response against Phakopsora pachyrhizi[J]. Plant Physiol Biochem, 2018, 132: 424-433. DOI:10.1016/j.plaphy.2018.09.020 |
| [29] |
Yin YC. Research of Over-expression CHS and CHI in Hairy Roots of Licorice (基于毛状根培养体系的甘草CHS及CHI基因功能研究)[D]. Beijing: Beijing University of Chinese Medicine, 2019.
|
| [30] |
Ghosh S, Mandi SS. SNP in chalcone synthase gene is associated with variation of 6-gingerol content in contrasting landraces of Zingiber officinale Roscoe[J]. Gene, 2015, 566: 184-188. DOI:10.1016/j.gene.2015.04.042 |
| [31] |
Zhang XD, Zhou S, Yin YC, et al. Analysis on the correlation between chalcone synthase gene polymorphism and content of liquiritin in licorice[J]. Acta Pharm Sin (药学学报), 2018, 53: 646-658. |
 2020, Vol. 55
2020, Vol. 55


