2. 中国科学院上海药物研究所, 上海 201203;
3. 上海交通大学医学院附属仁济医院, 上海 200127
2. Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China;
3. Renji Hospital, Shanghai Jiaotong University School of Medicine, Shanghai 200127, China
作为外源性物质的药物进入人体后, 在代谢酶特别是肠和肝脏中代谢酶的作用下, 会发生生物转化而形成代谢产物[1-3]。有些代谢产物会随体循环分布到各组织中, 产生药效或/和不良反应。因此在创新药物进入临床开发过程中, 人们希望除原形药物外能尽早地获得人体血浆中代谢物的相关数据, 以评价创新药物的有效性和安全性[4, 5]。但是采用目前常用的液相色谱-串联质谱(LC-MS/MS)法同时测定原形药物和代谢产物时, 仍面临着一些挑战:原形和代谢产物的极性往往存在较大差异, 比如卡培他滨亲脂性强, 而它的活性代谢物5-氟尿嘧啶(5-FU)极性较大, 多通过优化色谱柱和梯度洗脱条件实现在较短的色谱分析时间的同时测定[6]。其次, 代谢物与原形药物可能会呈现出不同的稳定性, 比如氯吡格雷及其非活性代谢产物氯吡格雷酸在生物基质中是稳定的, 但其具有活性的硫醇代谢物非常不稳定, 全血采集后要立即衍生化以保护活泼的巯基[7]。另外, 原形药物和代谢产物由于稳定性的原因, 在样品储存、预处理或质谱分析过程中存在一方向另一方转化或相互转化的问题, 如N-氧化物代谢物[8]、葡萄糖醛酸结合物等[9]。
倍赛诺他[10] (bisthianostat, 图 1), 是由中国科学院上海药物研究所科研人员基于海洋天然产物Largazole[11-13]结构中噻唑-噻唑啉关键结构单元, 经系统的结构优化, 开发获得的一类新型双噻唑类组蛋白去乙酰化酶[14] (histone deacetylase, HDAC)抑制剂。临床前药效学研究显示, 口服倍赛诺他对两种人骨髓瘤的移植瘤小鼠均显示出良好的治疗效果, 抑制活性优于首个获准上市的HDAC抑制剂伏立诺他。倍赛诺他目前正处在临床Ⅰ/Ⅱ期开发阶段。
倍赛诺他的临床前及早期临床代谢研究结果均显示N-羟基酰胺水解代谢物M351是小鼠、比格犬及人血浆中主要代谢产物。因此, 本文首次开发并建立了灵敏、准确的LC-MS/MS法同时测定人血浆中倍赛诺他和代谢物M351, 并用于倍赛诺他人体药动学研究, 为后续的临床治疗剂量和给药频率选择提供依据。
材料与方法对照品 倍赛诺他(批号: WS2017037;纯度: 99.94%)、代谢物M351 (批号: 20180227;纯度: 99.59%)、d4-倍赛诺他(批号: 20180409;纯度: 95.81%)、d5-M351 (批号: 20180416;纯度: 99.10%)均由国家新药筛选中心提供。甲醇和乙腈(德国Merck公司)、甲酸(日本TCI公司)、醋酸铵(美国ROE公司)均为色谱纯; 去离子水由法国Millipore超纯水仪制得。
仪器 Triple Quad 5500型三重四极杆串联质谱仪, 配备电喷雾电离源(ESI源), 美国AB Sciex公司; 液相色谱系统包括DGU-20A5R脱气机, LC-30AD液相色谱泵, SIL-30AC MP自动进样器, CTO-20A柱温箱, 日本Shimadzu公司; Analyst 1.6.3定量处理软件, 美国AB Sciex公司。
色谱条件 色谱柱: Waters ACQUITY UPLC® BEH C18柱(2.1 mm×50 mm, 1.7 μm), 美国Waters公司。流动相: A相为含0.2%甲酸的5 mmol·L-1醋酸铵水溶液, B相为乙腈。采用线性梯度洗脱程序如下: 0~0.3 min, 25% B; 0.3~0.8 min, 25%~40% B; 0.8~1.3 min, 40%~90% B; 1.3~1.6 min, 90% B; 1.6~1.7 min, 90%~25% B; 1.7~2.4 min, 25% B。流速为0.55 mL·min-1, 柱温为40 ℃, 进样量为2.0 μL。
质谱条件 离子源为电喷雾电离源(ESI源), 正离子扫描模式检测; 源喷射电压为5 500 V; 源温度为550 ℃; 离子源气体1 (N2)压力为50 psi (1 psi ≈ 6.9 kPa); 离子源气体2 (N2) 60 psi; 气帘气体(N2)压力为40 psi, 扫描方式为多反应检测(multiple reaction monitoring, MRM), 碰撞气压力为9 psi; 扫描时间为70 ms。用于MRM检测的定量离子反应为: m/z 367.1→235.0 (倍赛诺他)、m/z 371.1→235.0 (d4-倍赛诺他)、m/z 352.1→207.0 (代谢物M351)和m/z 357.1→208.0 (d5-M351)。
标准系列样品和质控样品的配制 精密称取倍赛诺他和代谢物M351对照品各两份, 用甲醇溶解并稀释至刻度, 摇匀, 分别获得质量浓度约为1.00 mg·mL-1的倍赛诺他和代谢物M351的储备液, 用于配制标准系列溶液和质控溶液。精密量取倍赛诺他和代谢物M351的储备液, 用乙腈-水(50:50, v/v)稀释, 获得倍赛诺他和代谢物M351的质量浓度分别为0.040 0/0.080 0、0.080 0/0.160、0.200/0.400、0.600/1.20、2.00/4.00、6.00/12.0、20.0/40.0和40.0/80.0 μg·mL-1的标准系列混合工作溶液。以人空白血浆稀释工作溶液, 获得血浆浓度分别为2.00/4.00、4.00/8.00、10.0/20.0、30.0/60.0、100/200、300/600、1 000/2 000、2 000/4 000 ng·mL-1的标准系列样品。以质控储备液如上配制定量下限、低、中、高浓度和稀释质控样品, 血浆浓度分别为2.00/4.00、6.00/12.0、500/1 000、1 600/3 200和16 000/32 000 ng·mL-1。精密称取d4-倍赛诺他和d5-M351对照品各一份, 用甲醇溶解并稀释, 分别获得质量浓度约为1.00 mg·mL-1的内标储备液。然后用乙腈-水(50:50, v/v)稀释, 获得d4-倍赛诺他和d5-M351的质量浓度为50.0/50.0 ng·mL-1的内标混合工作溶液。
血浆样品预处理 取血浆样品50.0 μL, 加入内标溶液(d4-倍赛诺他/d5-M351, 质量浓度为50.0/50.0 ng·mL-1) 50.0 μL, 加入乙腈300 μL, 涡流1 min, 离心5 min (14 000 r·min-1, 4 ℃)。取上清液2.0 μL进行LC-MS/MS分析。
方法验证 参照中国药典(2015年版)指导原则[15]和美国FDA相关指导原则[16], 从方法的选择性、标准曲线和定量下限、精密度和准确度、基质效应、回收率和稳定性等方面对建立的LC-MS/MS方法进行了完整的方法学验证。
选择性 取6个不同来源的人空白血浆以及相应人空白血浆配制的LLOQ样品进行LC-MS/MS分析, 考察不同来源的空白血浆中内源性物质是否对待测物和内标测定有干扰。
标准曲线 取标准系列样品按照“血浆样品预处理”项下操作, 以每个待测物浓度为横坐标, 待测物与内标物的峰面积比值为纵坐标, 用加权(W = 1/x2)最小二乘法进行回归运算, 获得标准曲线的相关系数(r2)应大于0.99。
定量下限 取LLOQ血浆样品, 进行6样本分析, 连续测定3天, 并根据当日标准曲线计算每一样本的测得浓度, 计算该浓度的日内和日间精密度和准确度。精密度不得大于20%, 准确度在标示值的±20%之内。
精密度和准确度 取低、中、高浓度QC样品, 按“血浆样品预处理”项下操作, 每个浓度进行6样本分析, 连续测定3个分析批, 根据每一分析批结果求算待测物的日内、日间精密度和准确度。每个浓度QC样品测定值的精密度不得大于15%, 平均准确度在标示值的±15%之内。
基质效应 分别取6个不同来源的空白人血浆, 除不加内标溶液外, 按“血浆样品预处理”项下操作, 取上清液加入相应浓度的对照质控溶液和内标溶液, 涡流混匀, 进行LC-MS/MS分析。同时另取去离子水代替空白血浆, 按上述处理, 分别获得相应的待测物和内标的峰面积。以两种处理方法的峰面积比值计算基质效应。
分别取一份溶血血浆和高脂血浆, 分别配制低、高两浓度的质控样品, 按“血浆样品预处理”项下操作, 每一浓度进行6样本分析。根据当日标准曲线计算溶血样品和高脂样品的精密度、准确度, 评价溶血和高脂血浆样品的基质效应。
回收率 采用人空白血浆配制低、中、高3个浓度质控样品, 按“血浆样品预处理”项下操作, 每一浓度进行6样本分析(A)。同时另取人空白血浆, 除不加内标溶液外, 按“血浆样品预处理”项下操作, 取上清液加入相应浓度的对照质控溶液和内标溶液, 涡流混匀, 每一浓度进行6样本分析(B)。以每一浓度两种处理方法的峰面积比值计算回收率, 计算公式为A/B×100 %。
稳定性 考察人全血样品室温放置4 h、血浆样品室温放置24 h、经沉淀蛋白处理后自动进样器(4 ℃)放置25 h、血浆样品经历5次冷冻-解冻循环以及-20 ℃、-70 ℃长期放置112天后倍赛诺他和M351稳定性。
稀释效应 考察超出标准曲线定量上限的血浆样品, 经空白血浆稀释10倍后测定的准确度。
人体药动学研究和数据分析 临床试验经上海交通大学医学院附属仁济医院伦理委员会批准, 并在该医院进行。3例女性难治性或复发性多发性骨髓瘤患者自愿签署书面知情同意书。在给药前30 min内和口服倍赛诺他片100 mg后15 min、30 min、1、1.5、2、3、5、7、10、24、48、72 h分别从前臂肘静脉使用留置针采集全血2.5 mL至EDTA-K2抗凝的试管中。分离血浆于-70 ℃以下保存。采用Phoenix WinNonlin6.3 (美国Pharsight公司)软件以非房室模型对测得的药动学数据进行处理和统计分析。
结果 1 质谱分析在建立的LC-MS/MS条件下, 倍赛诺他、d4-倍赛诺他、代谢物M351和d5-M351在ESI电离源下主要产生[M+H]+离子, 质荷比分别为m/z 367.1、m/z 371.1、m/z 352.1、m/z 357.1。选择性对[M+H]+峰进行产物离子扫描, 倍赛诺他和d4-倍赛诺他的主要碎片离子均为m/z 235.0, 将其作为定量分析时监测的产物离子。代谢物M351和d5-M351的主要碎片离子分别为m/z 235.0、m/z 207.0和m/z 236.0、m/z 208.0, 因信号响应和血浆浓度均高于原形, 为防止信号饱和, 选择响应较低的碎片离子m/z 207.0和208.0作为M351和d5-M351定量检测的产物离子。待测物和内标的产物离子扫描质谱图以及主要碎片离子的断裂模式见图 1。
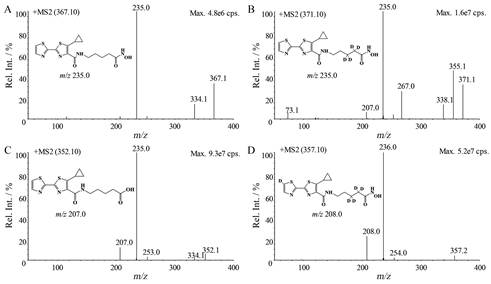
|
Figure 1 The chemical structures, product ion mass spectra, and proposal fragmentation patterns of bisthianostat (A), d4-bisthianostat (B), M351 (C) and d5-M351(D) |
空白血浆样品在倍赛诺他、M351和相应内标保留时间处的峰面积均小于定量下限样品待测物峰面积的20%和内标峰面积的5%。结果表明, 空白人血浆中的内源性物质不干扰待测物倍赛诺他、代谢物M351及内标d4-倍赛诺他、d5-M351的测定, 典型色谱图见图 2A。同位素内标也不影响待测物倍赛诺他和M351测定, 典型色谱图见图 2B。
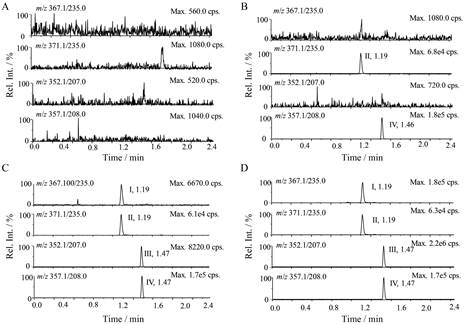
|
Figure 2 Typical MRM chromatograms of bisthianostat (Ⅰ), d4-bisthianostat (Ⅱ), M351 (Ⅲ), d5-M351(Ⅳ) in human plasma. A: Blank plasma; B: Blank plasma spiked only with 50.0 ng·mL-1 d4-bisthianostat and 50.0 ng·mL-1 d5-M351; C: Blank plasma containing 2.00 ng·mL-1 bisthianostat, 4.00 ng·mL-1 M351, 50.0 ng·mL-1 d4-isthianostat and 50.0 ng·mL-1 d5-M351; D: Plasma sample collected 6 h after an oral administration of 100 mg bisthianostat to a patient with multiple myeloma |
测定人血浆中倍赛诺他和代谢物M351的线性范围分别为2.00~2 000 ng·mL-1和4.00~4 000 ng·mL-1。典型标准曲线回归方程为: y = 4.59×10-2 x + 1.09×10-2 (r = 0.999 2, 倍赛诺他); y = 1.07×10-2 x + 2.91×10-3 (r = 0.999 6, M351)。
2.3 定量下限测得定量下限样品中倍赛诺他的日内精密度为5.2%, 日间精密度为6.2%, 准确度为-1.1%;代谢物M351的日内精密度为6.8%, 日间精密度为5.9%, 准确度为-0.5%。结果表明LC-MS/MS法同时测定人血浆中倍赛诺他和代谢物M351的定量下限分别可达到2.00和4.00 ng·mL-1。
2.4 精密度和准确度每一浓度水平倍赛诺他的QC样品的日内精密度(RSD)均不大于3.3%, 日间精密度(RSD)均不大于3.3%, 准确度(RE)在1.0%~4.3%之间; 每一浓度水平代谢物M351的QC样品日内精密度(RSD)均不大于3.6%, 日间精密度(RSD)均不大于3.6%, 准确度(RE)在0.0%~4.9%之间。质控样品的日内和日间的精密度和准确度均符合生物样品测定相关要求。
2.5 基质效应倍赛诺他在低、中、高浓度经内标校正的基质效应分别为95.1%、96.7%和98.4%, 不同来源的内标归一化基质因子变异系数均不大于4.0%;代谢物M351在低、中、高浓度经内标校正的基质效应分别为100.9%、100.3%和99.2%, 不同来源的内标归一化基质因子变异系数均不大于1.8%。结果表明, 待测物和内标在本实验选择的色谱和质谱条件下, 可忽略基质效应的影响。
溶血血浆配制的每一浓度水平的倍赛诺他的质控样品的精密度(RSD)均不大于4.2%, 准确度(RE)在-2.7%~0.4%之间; 代谢物M351的质控样品的精密度(RSD)均不大于2.6%, 准确度(RE)在0.4%~3.0%之间。高脂血浆配制的每一浓度水平的倍赛诺他的质控样品的精密度(RSD)均不大于3.6%, 准确度(RE)在-2.7%~0.8%之间; 代谢物M351的质控样品的精密度(RSD)均不大于3.7%, 准确度(RE)均在0.3%~4.3%之间。结果表明, 待测物在本实验选择的色谱和质谱条件下, 可忽略溶血和高脂基质效应的影响。
2.6 样品处理回收率倍赛诺他在低、中、高浓度的回收率分别为92.7%、91.1%和91.7%, 回收率精密度在0.8%~2.4%之间; 代谢物M351在低、中、高浓度的回收率分别为84.3%、83.4%和86.6%, 回收率精密度在1.0%~3.0%之间。结果表明, 本实验选择的预处理方法重现性良好。
2.7 稳定性倍赛诺他/M351血浆样品在各种稳定性考察条件下准确度均在-6.5%~2.7%之间, 表明倍赛诺他/M351血浆样品在本文测试的不同储存条件下均稳定, 能够满足本实验中样品测定的要求。另外, 与新鲜配制的全血样品结果相比, 全血样品在室温下放置4 h后测得的相对偏差在-6.3%~3.3%之间, 表明全血在室温下放置4 h稳定。
2.8 稀释效应取倍赛诺他/代谢物M351人血浆稀释质控样品(浓度为16 000/32 000 ng·mL-1), 用人空白血浆稀释10倍后, 按“血浆样品预处理”项下操作, 进行6样本分析。测得稀释10倍后, 质控样品中倍赛诺他的精密度和准确度分别为1.3%和0.4%、M351的精密度和准确度分别为2.4%和1.0%。结果表明, 人血浆样品经空白血浆稀释10倍后不影响测定结果的准确性。
3 药动学研究采用经过完整方法学验证的LC-MS/MS方法测定3名肿瘤患者口服100 mg倍赛诺他后的血浆样品, 获得倍赛诺他和M351平均血浆药物浓度-时间曲线如图 3。相应的药动学参数见表 1。口服给药后倍赛诺他血浆浓度达峰迅速, tmax为0.67 h时, 代谢物M351血浆达峰时间(4.00 h)明显滞后于原形药物, 且代谢物有更长的血浆清除半衰期。血浆中代谢物M351的达峰浓度和血浆暴露量分别约为原形药物的1.7倍和11倍。
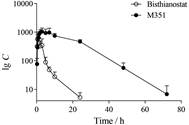
|
Figure 3 The plasma concentration-time curve of bisthianostat and M351 following an oral administration of 100 mg bisthianostat to patients with multiple myeloma (n =3, |
|
Table 1 The pharmacokinetic parameters of bisthianostat and M351 after an oral administration of 100 mg bisthianostat (n = 3, |
倍赛诺他和N-羟基酰胺水解物M351极性相差较大, 油水分配系数lg D值分别为0.77和-0.84, 液-液萃取和固相萃取法很难保证同一条件下二者血浆样品回收率的一致性和重现性。因此, 本实验采用蛋白沉淀法进行预处理, 二者的提取回收率分别为91.8%和84.8%。实验发现倍赛诺他的酰胺键在大气压化学电离源(APCI源)下易发生源内裂解, 降低了检测灵敏度, 最终选择ESI源。在色谱分离上, 考虑到倍赛诺他分子结构含有羟胺基团, 优先选用了碱性或中性流动相, 以提高色谱保留, 但在此pH条件下倍赛诺他色谱保留过强, 且峰形拖尾严重。以含0.2%甲酸的5 mmol·L-1醋酸铵溶液(pH 2.9)作为流动相水相时, 可以降低色谱保留, 且极大地改善色谱峰形。为保证倍赛诺他和代谢物均能有较好的色谱保留, 且缩短分析时间, 本文选用了梯度洗脱方式。在色谱柱的选择方面, 比较了3款不同粒径的色谱柱: Phenomenex Gemini C18 (2.0 mm×50 mm, 5 μm)、Agilent Eclipse Plus C18 (2.1 mm×100 mm, 3.5 μm)和Waters BEH C18柱(2.1 mm×50 mm, 1.7 μm), 结果发现粒径为1.7 μm的超高压液相色谱柱具有更优的柱效和峰形对称性。
本文首次建立了快速、灵敏、准确的LC-MS/MS法同时测定人血浆中倍赛诺他和代谢物M351, 已成功应用于倍赛诺他药动学实验。测定倍赛诺他和M351的定量下限分别为2.00和4.00 ng·mL-1, 可充分评价倍赛诺他及代谢物在临床Ⅰ期人体药动学实验各剂量组的药动学特征。代谢物M351血浆暴露量约为原形药物的11倍, 提示在临床研究中应关注代谢物安全性和有效性。
作者贡献: 于松达负责整篇论文的写作和修改; 陈笑艳提供优质的质谱平台, 并指导和修改论文; 侯翔宇、王彦、闫超为论文修改提出宝贵意见; 南发俊、张仰明负责氘代内标化合物的设计与合成; 黄洪晖、沈莉菁负责临床试验的开展与血浆样品采集。
利益冲突: 无任何利益冲突。
| [1] |
Croom E. Metabolism of xenobiotics of human environments[J]. Prog Mol Biol Transl, 2012, 112: 31-88. DOI:10.1016/B978-0-12-415813-9.00003-9 |
| [2] |
Testa B, Pedretti A, Vistoli G. Reactions and enzymes in the metabolism of drugs and other xenobiotics[J]. Drug Discov Today, 2012, 17: 549-560. DOI:10.1016/j.drudis.2012.01.017 |
| [3] |
Baillie TA, Rettie AE. Role of biotransformation in drug-induced toxicity:influence of intra-and inter-species differences in drug metabolism[J]. Drug Metab Pharmacokinet, 2011, 26: 15-29. DOI:10.2133/dmpk.DMPK-10-RV-089 |
| [4] |
Robison TW, Jacobs A. Metabolites in safety testing[J]. Bioanalysis, 2009, 1: 1193-1200. DOI:10.4155/bio.09.98 |
| [5] |
Laine R. Metabolic stability:main enzymes involved and best tools to assess it[J]. Curr Drug Metab, 2008, 9: 921-927. DOI:10.2174/138920008786485146 |
| [6] |
Deng P, Cheng J, Dai XJ, et al. Simultaneous determination of capecitabine and its three nucleoside metabolites in human plasma by high performance liquid chromatography-tandem mass spectrometry[J]. J Chromatogr B, 2015, 989: 71-79. DOI:10.1016/j.jchromb.2015.03.002 |
| [7] |
Lyngby JG, Court MH, Lee PM. Validation of a method for quantitation of the clopidogrel active metabolite, clopidogrel, clopidogrel carboxylic acid, and 2-oxo-clopidogrel in feline plasma[J]. J Vet Cardiol, 2017, 19: 384-395. DOI:10.1016/j.jvc.2017.03.004 |
| [8] |
Majumdar TK. Regulated Bioassay of N-Oxide Metabolites Using LC-MS:Dealing with Potential Instability Issues[M]. .
|
| [9] |
Gao RN, Zhong DF, Liu K, et al. Simultaneous determination of morinidazole, its N-oxide, sulfate, and diastereoisomeric N+-glucuronides in human plasma by liquid chromatography-tandem mass spectrometry[J]. J Chromatogr B, 2012, 908: 52-58. DOI:10.1016/j.jchromb.2012.09.017 |
| [10] |
Chen F, Chai H, Su MB, et al. Potent and orally efficacious bisthiazole-based histone deacetylase inhibitors[J]. ACS Med Chem Lett, 2014, 5: 628-633. DOI:10.1021/ml400470s |
| [11] |
Gronbaek K, Treppendahl M, Asmar F, et al. Epigenetic changes in cancer as potential targets for prophylaxis and maintenance therapy[J]. J Basic Clin Physiol Pharmacol, 2008, 103: 389-396. DOI:10.1111/j.1742-7843.2008.00325.x |
| [12] |
Taori K, Paul VJ, Luesch H. Structure and activity of largazole, a potent antiproliferative agent from the Floridian marine cyanobacterium Symploca sp[J]. J Am Chem Soc, 2008, 130: 1806-1807. DOI:10.1021/ja7110064 |
| [13] |
Liu Y, Salvador LA, Byeon S, et al. Anticolon cancer activity of largazole, a marine-derived tunable histone deacetylase inhibitor[J]. J Pharmacol Exp Ther, 2010, 335: 351-361. DOI:10.1124/jpet.110.172387 |
| [14] |
Poli G, Di Fabio R, Ferrante L, et al. Largazole analogues as histone deacetylase inhibitors and anticancer agents:an overview of structure-activity relationships[J]. ChemMedChem, 2017, 12: 1917-1926. DOI:10.1002/cmdc.201700563 |
| [15] |
Chinese Pharmacopoeia Commission. Guidance for bioanalytical method validation[S]//Pharmacopoeia of the People's Republic of China (中华人民共和国药典). 2015 ed. Vol 4. Beijing: China Medical Science Press, 2015: 363-368.
|
| [16] |
U. S. Department of Health and Human Services, Food and Drug Administration (FDA). Guidance for Industry: Bioanalytical Method Validation[S/OL]. 2018[2020-03].https://www.fda.gov/downloads/drugs/guidances/ucm070107.pdf.
|
 2020, Vol. 55
2020, Vol. 55


