2. 内蒙古科技大学包头医学院蒙中药活性物质与功能研究所, 内蒙古 包头 014060
2. Institute of Bioactive Substance and Function of Mongolian Medicine and Chinese Materia Medica, Baotou Medical College of Inner Mongolia University of Science and Technology, Baotou 014060, China
肾纤维化(renal fibrosis)几乎是所有肾脏疾病进展到终末期肾功能衰竭的共同通路, 是各种慢性肾病主要的病理学表现之一[1]。其特征是细胞外基质的大量产生和堆积, 同时肾纤维化引起的肾实质细胞的损害[2, 3]、炎性细胞的浸润、小管上皮细胞丧失再生能力[4]和间质毛细血管的完整性受损, 都将导致组织局部缺氧, 进而加重肾损伤和肾纤维化, 最终演变为肾衰竭[5], 严重影响人们的生活质量和身体健康。因此早期防治和延缓肾纤维化对防治肾病发展具有较深远的社会学价值和重要的经济学意义。
蒙古扁桃(Amygdalus mongolica), 蒙名为乌兰-布衣勒斯[6], 属蔷薇科扁桃属多年旱生落叶灌木, 为蒙古高原特有的古老残遗植物之一[7], 富含总黄酮[8]、苦杏仁苷[9]、蛋白质[10]、脂肪酸[11]、有机酸[12]、多糖[13]、维生素E[14]等多种营养和药用成分。蒙古扁桃作为一味传统中药材以种仁入药, 可代“郁李仁”[15], 性平, 味苦, 主治大便燥结、水肿、脚气等症, 具有润肠通便、利尿之功效[16]。课题组前期研究表明[17-23], 蒙古扁桃提取物具有降血脂和抵抗高血脂症引起的大鼠脂质过氧化的作用, 且石油醚和正丁醇部位是其发挥作用的有效部位, 可通过减少大鼠肝脏内脂质过氧化的蓄积和减少肝脏组织氧化应激反应来保护肝脏; 其中蒙古扁桃油也具有调血脂、提高肝脏抗氧化功能和保肝的作用。同时课题组开展了蒙古扁桃药材提取物抗器官纤维化的研究: Wu等[24]和Jia等[25]研究发现蒙古扁桃石油醚和正丁醇提取物具有良好的抗肝、肾纤维化作用; Chang等[26]进一步利用血清代谢组学技术阐明了蒙古扁桃石油醚和正丁醇提取物抗大鼠肾纤维化的作用机制。基于以上研究, 目前课题组前期已初步证实蒙古扁桃提取物具有较好防治肝、肾纤维化的作用, 但由于中药总提物的全成分特点更符合整体效应, 其多成分多靶点在抗肾纤维化方面更具优势, 因此本研究进一步展开了蒙古扁桃总提物对单侧输尿管结扎所致的大鼠肾纤维化作用机制的研究。
代谢组学主要应用高通量筛选技术结合化学计量学的方法定量和定性分析生物体内的内源性代谢物, 并以筛选敏感的生物标志物来阐明药物的作用机制[27]。因其在方法学上具有集融整性、动态、综合、分析于一体的特点, 因此在疾病诊断和中药现代化研究中具有广泛的应用。将代谢组学应用于中药物质基础及作用机制研究符合中药及其复方多组分、多层次、多靶点、多代谢途径的特点[28], 为此本研究采用代谢组学技术并结合药效学, 评价蒙古扁桃总提物抗肾纤维化的作用, 并从代谢物角度阐述蒙古扁桃抗肾纤维化的作用机制及代谢通路, 为抗肾纤维化药物的挖掘以及对蒙古扁桃药材资源开发和合理利用提供一定的理论与科学依据。
材料与方法药物 蒙古扁桃(Amygdalus mongolica), 采于内蒙古阿拉善盟巴彦诺日公, 由包头医学院石松利教授鉴定为蔷薇科, 扁桃属, 蒙古扁桃药材干燥成熟种子; 蒙古扁桃总提物, 取蒙古扁桃种仁, 去除外壳后研碎置于索氏提取装置中回流煎煮(料液比=1:10), 用95%乙醇90 ℃提取2次, 70%乙醇90 ℃提取1次, 每次2 h, 合并3次提取液后用旋转蒸发仪回收溶剂并浓缩为稠浸膏, 即蒙古扁桃种仁总提物, 出膏率为16.67%。盐酸贝那普利片(规格:每片10 mg, 批号: X2633)购自北京诺华制药有限公司。
动物 雄性SD大鼠60只, SPF级, 体质量170~190 g, 购自北京大学医学部实验动物科学部[许可证号: SCXK (京) 2017-0005]。饲养条件:室温22~27 ℃, 相对湿度(50 ± 5) %。
试剂与仪器 注射用青霉素钠(规格: 160万单位/瓶, 批号: F8117305)购自华北制药股份有限公司; 羧甲基纤维素钠(分析纯, 批号: 20160912)购自天津市凯通化学试剂有限公司; MDA试剂盒(批号: 20180504)、SOD试剂盒(批号: 20180503)、HYP试剂盒(批号: 20180429)、总蛋白定量测定试剂盒(批号: 20180502)均购自南京建成生物工程研究所。
DZW-8-8型水浴锅(北京市永光明医疗仪器厂); RE-52A型旋转蒸发仪和SHZ-D (Ⅲ)循环水真空泵(上海亚荣生化仪器厂); BSY-200T研磨机(永康市铂欧五金制品有限公司); TGL-16M型高速台式冷冻离心机(湖南湘仪实验室仪器开发有限公司); MH-250型电热套(北京科伟永兴仪器有限公司); K4896-B快速混匀器(姜堰市新康医疗器械有限公司); ACQUITY UPLC T3色谱柱(英国Waters公司)、Triple TOF 5600 plus高分辨串联质谱计(英国SCIEX公司); CX31显微镜(日本奥林巴斯公司)。
动物分组及给药 60只雄性SD大鼠, 根据体重随机分为6组:假手术组、模型组、盐酸贝那普利组(1.5 mg·kg-1)[25]、蒙古扁桃种仁总提物低(0.75 g·kg-1)、中(1.5 g·kg-1)、高(3.0 g·kg-1)剂量组, 用0.5%羧甲基纤维素钠溶液配制, 每组10只, 分别用苦味酸标号, 于造模后第二天给药。本实验给药剂量设定是根据蒙古扁桃药材成人每天最大用药量9.0 g生药量计算, 人的给药剂量为0.128 6 g·kg-1。考虑到中药药效可能是不同成分相互拮抗或协同后联合起效, 故将给药剂量加大2倍后换算成大鼠的给药剂量为1.5 g·kg-1, 以此为基础上下各增设一组, 故给药量设定为0.75、1.5和3.0 g·kg-1。模型组和假手术组均按照4 mL·kg-1大鼠体重灌胃给予生理盐水, 每天一次, 自由饮食并观察大鼠基本状况及死亡情况, 给药21天后处死。所有灌胃药液均置于4 ℃冰箱中保存。动物实验已获得内蒙古科技大学包头医学院医学伦理委员会批准(批准号: 20190314)。
动物模型建立 本实验采用的单侧输尿管结扎术制备大鼠肾纤维化模型, 是研究大鼠肾纤维化较理想的模型[29]。大鼠购回适应性饲养一周后, 根据0.035 g·kg-1大鼠体重给予3%戊巴比妥钠腹腔注射进行麻醉, 将大鼠仰卧位固定于鼠板上, 手术区域备皮, 用碘酒消毒, 沿大鼠左肋骨边缘下方1.5 cm处向外横切口2 cm, 剪开外皮后分离腹膜, 暴露左肾, 分离出左侧输尿管后用手术缝合线进行结扎, 结扎后逐层缝合大鼠皮毛组织, 最后将青霉素钠溶液涂于伤口防止感染。除假手术组仅游离左侧输尿管, 不结扎, 其余5组均结扎左侧输尿管。
样本采集 大鼠造模21天后, 禁食不禁水, 于末次给药24 h后, 眼眶静脉丛采血, 血样用液氮速冻后置于-80 ℃冰箱保存备用, 测定血清肌酐(serum creatinine, Scr)、尿素氮(blood urea nitrogen, BUN)和白蛋白(albumin, ALB)。按照造模的方法将大鼠进行麻醉、固定, 打开腹腔, 取腹主动脉血后摘取双侧肾脏, 于生理盐水中清洗两遍, 置于滤纸上吸干多余水分, 从结扎侧肾脏纵切一半组织固定于4%甲醛固定液中备用(用做HE和Masson染色); 另一半用液氮速冻后置于-80 ℃冰箱保存备用, 测定组织匀浆超氧化物歧化酶(superoxide dismutase, SOD)、丙二醛(malondialdehyde, MDA)和羟脯氨酸(hydroxyproline, HYP); 所采腹主动脉血液以3 000 r·min-1离心10 min, 吸取上层血清于EP管中, 液氮速冻后置于-80 ℃冰箱保存备用(检测血清SOD和MDA以及血清代谢组学研究)。
血清代谢组学研究液相参数条件 ACQUITY UPLC T3色谱柱(100 mm×2.1 mm, 1.8 μm)。流动相A (水, 0.1%甲酸)和B (乙腈, 0.1%甲酸), 柱温35 ℃, 流速0.4 mL·min-1。洗脱梯度: 5% B, 0~0.5 min; 5%~100% B, 0.5~7 min; 100% B, 7~8 min; 100% B, 8~8.1 min; 5% B, 8.1~10 min。
质谱参数条件 采用高分辨串联质谱计Triple TOF 5600 plus检测柱上洗脱的代谢产物。离子源Gas1和离子源Gas2均为60 psi, 界面加热温度为650 ℃, 正离子模式下的离子喷雾电压为500 V, 负离子模式下的离子喷雾电压浮动为-4 500 V。操作过程中采用IDA模式采集质谱数据, TOF质量扫描范围是60~1 200 Da。调查扫描在150 ms内完成, 总循环时间设置在0.56 s。通过对40 GHz四阳极/通道检测的多路TDC探测器的监测, 在脉冲频率为11 kHz的情况下, 将每次扫描的4个时间箱进行相加。
多元数据分析 对原始数据进行统计分析, 利用MSConvert软件转换成可读数据mzXML, 再利用XCMS软件进行了多变量数据矩阵分析。分别使用质谱一级信息进行鉴定和质谱二级信息与内部标准品数据库进行匹配。对各组大鼠血清代谢轮廓进行分析。
对各组血清样本采用主成分分析法(principal component analysis, PCA)和正交偏最小二乘-判别分析法(orthogonal partial least squares-discriminant analysis, OPLS-DA)进行差异物质的筛选; 本实验筛选VIP (variable importance in the projection, VIP) > 1的代谢产物作为蒙古扁桃抗肾纤维化作用的候选差异物。利用MetaboAnalyst software 4.0进行代谢通路Met PA (http://metpa.metabolomics.ca)分析, 筛选出代谢通路影响值(impact value) > 0.02, 代谢通路显著性水平(-lg P) > 2的通路作为影响肾纤维化的关键代谢通路。根据这些关键代谢通路中所涉及的差异代谢物, 筛选出肾纤维化关键生物标志物。利用GraphPad Prism 5对所筛选的关键生物标志物的含量水平做柱状图, 分析其在相同条件下不同组别之间的水平变化, 并作经蒙古扁桃干预后的KEGG (http://www.kegg.jp)结果对关键代谢产物所参与肾纤维化的关键通路网络图, 从而阐明蒙古扁桃药材抗大鼠肾纤维化的作用机制。
统计学分析 实验结果以SPSS 19.0进行统计分析, 数据均以
生化指标检测结果见图 1。与假手术组相比, 模型组SOD活力显著降低, 其余各指标含量均显著增高; 与模型组相比, 蒙古扁桃低剂量组的血清Scr、BUN、ALB、血清MDA和组织HYP含量均显著降低, SOD活力显著升高; 盐酸贝那普利组和蒙古扁桃中剂量组的SOD活力显著升高, 其余各指标含量均显著降低; 蒙古扁桃高剂量组的Scr、ALB、血清MDA和组织HYP含量均显著降低, 组织SOD活力显著升高。
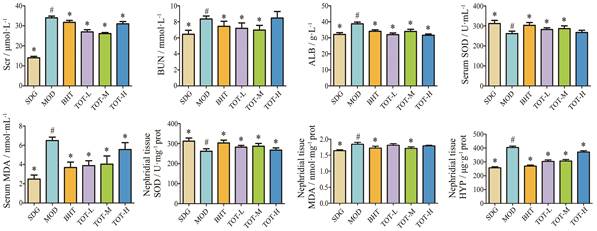
|
Figure 1 Test results of biochemical indicators (n = 10, |
HE和Masson染色结果见图 2A、B, 根据染色结果进行半定量评分, 结果显示蒙古扁桃总提物低、中、高剂量组纤维化程度分值较模型组显著降低, 以中剂量效果较为明显(图 2C)。HE染色结果表明, 与假手术组相比, 模型组肾小管出现明显萎缩且小管上皮细胞大部分坏死、脱落, 间质变宽, 大量炎症细胞浸润, 肾小球萎缩且数目减少。与模型组相比, 盐酸贝那普利组肾脏组织病变较轻, 间质出现少量炎性细胞。蒙古扁桃总提物不同剂量组与模型组相比, 高剂量组肾小球数量明显减少, 肾小管扩张, 物镜下可观察到空腔, 炎性细胞浸润明显; 中剂量组病变较模型组缓解, 肾小球结构比较正常, 形状饱满, 间质间的炎性细胞浸润减少, 少量肾小管出现萎缩, 较少间质增厚; 低剂量组与模型组相比, 肾小管结构较清晰, 髓质区肾小管排列紧密。Masson染色结果可见纤维组织被染成蓝色, 模型组较假手术组的肾小管上皮细胞出现空泡状变化, 细胞外基质大量沉积, 蒙古扁桃总提物给药组较模型组均有所改善, 与HE染色结果一致, 表明蒙古扁桃总提物对大鼠肾纤维化具有一定的保护作用。
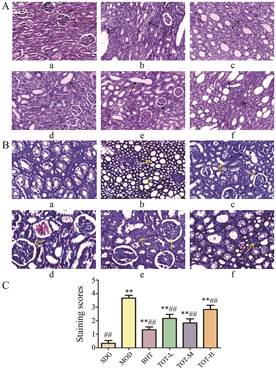
|
Figure 2 Effect of Amygdalus mongolica administration group on renal histopathology of renal fibrosis rat. Arrows indicate severe tubular atrophy and dilatation, interstitial inflammation and tubulointerstitial fibrosis. A: HE staining, ×200; B: Masson staining, ×200, C: Staining scores. a: SDG, b: MOD, c: BHT, d: TOT-L, e: TOT-M, f: TOT-H. **P < 0.01 vs SDG; ##P < 0.01 vs MOD |
各组大鼠血清代谢轮廓PCA结果见图 3A、D, 结果显示正、负离子模式下的假手术组与模型组之间显著分离, 代谢产物分离聚类良好, 表明本实验成功建立了反映肾纤维化疾病的模型, 且蒙古扁桃总提物低、中、高剂量组与模型组相比分离度良好, 均向假手术组回调, 表明蒙古扁桃总提物对肾纤维化大鼠的内源性代谢物产生正性调节作用。PLS-DA结果见图 3B和E, 结果显示假手术组与模型组代谢物具有明显差异, 随后通过置换检验进行了模型验证, 其中正离子模型截距R2=0.79, Q2=-0.41 (图 3C), 负离子模型截距R2=0.63, Q2=-0.42 (图 3F), 提示该模型具有良好的拟合度和预测能力。

|
Figure 3 PCA score plot (A: Positive; D: Negative) of the serum samples from the SDG, MOD, TOT-L, TOT-M and TOT-H, OPLS-DA score plot (B: Positive; E: Negative), corresponding validation plot (C: Positive; F: Negative) from SDG and MOD |
课题组前期研究对假手术组和模型组进行了PLS-DA分析, 根据VIP > 1和P < 0.05共筛选鉴定得到74个差异代谢物[26], 本次实验对各组血清样本代谢产物差异丰度进行聚类热图分析, 结果见图 4, 74个代谢物能够显著区分模型组、蒙古扁桃总提物低、中、高剂量给药组。此外, 实验比较了所有组中这74个差异代谢物的浓度, 显示蒙古扁桃低、中、高剂量组相比于模型组可分别回调67、69和70个差异代谢物, 其中可共同回调的差异代谢物有62个。

|
Figure 4 Heat map of the differential abundance of metabolites in the SDG, MOD, TOT-L, TOT-M and TOT-H. Rows, samples; Columns, metabolites. The degree of color saturation indicates the metabolite expression value with blue representing the lowest expression and red representing the highest expression |
课题组前期对74个差异代谢物进行Met PA分析, 根据代谢通路影响值> 0.02, 代谢通路显著性水平 > 2共筛选出6条关键差异代谢通路, 包括精氨酸和脯氨酸代谢、组氨酸代谢、烟酸和烟酰胺代谢、戊糖和葡萄糖合成、抗坏血酸和醛糖代谢和氨基糖和核酸糖代谢, 该些通路中共有8个差异代谢物参与, 以此筛选出影响肾纤维化的关键生物标志物[26]。这些生物标志物鉴定及参与通路信息结果见表 1。本实验考查蒙古扁桃对关键生物标志物的影响, 经蒙古扁桃给药后的含量变化见图 5。结果显示, 与假手术组相比, 模型组显著下调的N-乙酰-D-氨基葡萄糖-6-磷酸, 经蒙古扁桃总提物给药后显示各给药组均无回调作用; 模型组显著上调的S-腺苷甲硫氨酸、烟酸-D-核糖核苷酸、鸟氨酸和二酮古龙酸, 经蒙古扁桃总提物给药后, 结果显示低、中、高剂量组的以上关键生物标志物水平均向假手术组显著回调; 模型组显著下调的D-葡萄糖醛酸1-磷酸, 经蒙古扁桃给药后, 高剂量组的D-葡萄糖醛酸1-磷酸含量向假手术组显著回调, 低、中剂量组则无明显调节作用; 模型组显著上调的吲哚葡萄糖醛酸酯, 给予蒙古扁桃不同剂量后, 高剂量组的吲哚葡萄糖醛酸酯含量向假手术组显著回调, 低、中剂量组对其无调节作用; 模型组显著下调的4-咪唑酮-5-丙酸, 经蒙古扁桃给药后, 低、中、高剂量组的4-咪唑酮-5-丙酸水平均向假手术组显著回调。
| Table 1 The results of identified key potential biomarker |
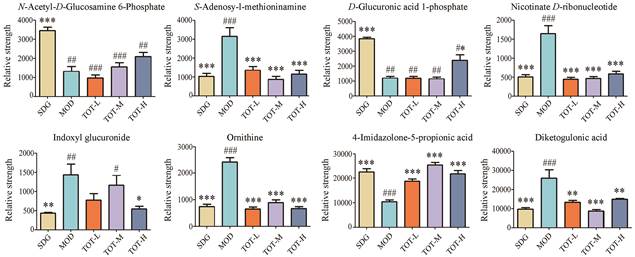
|
Figure 5 Changes in the crucial metabolites among the SDG, MOD, TOT-L, TOT-M and TOT-H. #P < 0.05, ##P < 0.01, ###P < 0.001 vs SDG; *P < 0.05, **P < 0.01, ***P < 0.001 vs MOD |
根据Met PA分析筛选出的与肾纤维化相关的8个关键生物标志物主要参与精氨酸和脯氨酸代谢、组氨酸代谢、烟酸和烟酰胺代谢、戊糖和葡萄糖合成、抗坏血酸和醛糖代谢、氨基糖和核酸糖代谢6条代谢途径, 见表 1。给药后通过生物标志物和所参与的代谢通路构建了蒙古扁桃抗肾纤维化潜在作用靶点及代谢通路网络图, 见图 6。由图可知6条代谢通路与8个生物标志物之间相互关联, 证明了肾纤维化发病机制的复杂性以及蒙古扁桃总提物整体性调节的特点。

|
Figure 6 Network of the identified key biomarkers and pathways according to the KEGG pathway database. The blue-gray oval represents the metabolic pathway; Yellow quadrilaterals represent potential biomarker targets; Gray rectangles represent different experimental groups; KEGG number represents each potentially different metabolite, C00077: Ornithine; C01137: S-Adenosy-L-methioninamine; C03680: 4-Imidazolone-5-propionic acid; C05841: Nicotinate D-ribonucleotide; C05385: D-Glucuronic acid 1-phosphate; C04575: Diketogulonic acid; C00357: N-Acetyl-D-Glucosamine 6-Phosphate; C03033: Indoxyl glucuronide |
本实验采用UPLC-Q-TOF/MS分析手段, 结合生化指标和组织病理学分析, 进行了蒙古扁桃总提物干预下的肾纤维化大鼠血清代谢组学研究, 并对血样中相关生物标志物和代谢通路进行了分析。结果显示, 蒙古扁桃总提物低剂量组可显著降低Scr、BUN、ALB、血清MDA、组织HYP含量, 显著提升SOD活力; 蒙古扁桃总提物中剂量组可显著提升SOD活力, 显著降低其余各指标含量; 蒙古扁桃高剂量组可显著降低Scr、ALB、血清MDA、组织HYP含量, 显著提升组织SOD活力, 提示蒙古扁桃总提物对大鼠肾纤维化具有一定的治疗作用。同时蒙古扁桃总提物可以通过干预7个与肾纤维化相关的关键生物标志物: S-腺苷甲硫氨酸、D-葡萄糖醛酸1-磷酸、烟酸-D-核糖核苷酸、吲哚葡萄糖醛酸酯、鸟氨酸、4-咪唑酮-5-丙酸和二酮古龙酸, 进而参与精氨酸和脯氨酸代谢、组氨酸代谢、烟酸和烟酰胺代谢、戊糖和葡萄糖合成和抗坏血酸和醛糖代谢5条代谢通路, 发挥其抗肾纤维化的作用。
精氨酸在体内主要参与机体代谢和调节免疫功能, 有抗肿瘤和抗肥胖的作用[30]。其在体内通过精氨酸酶分解为鸟氨酸和尿素, 其中鸟氨酸是调节细胞生长的一类重要物质, 可促进细胞增殖, 也是合成多胺类物质的前体。本实验筛选出的生物标志物鸟氨酸、S-腺苷甲硫氨酸均参与了精氨酸代谢途径, 经蒙古扁桃总提物给药后与模型组相比二者水平均显著降低, 由此推测蒙古扁桃可通过抑制精氨酸在体内代谢生成鸟氨酸, 进而抑制纤维细胞的增殖而发挥了抗纤维化作用。组氨酸是一种儿童和尿毒症患者所必需的氨基酸, 其参与了蛋白质的合成, 在调节神经系统和维护机体健康等方面具有重要作用。组氨酸转氨酶是组氨酸代谢的一种限速酶[31], 主要在肝脏中, 通常与丙酮酸相连, 生成丙酮酸和咪唑丙酮酸[32]。本实验筛选出的4-咪唑酮-5-丙酸也是组氨酸降解途径中的一种产物, 其在假手术组和各给药组中的水平较模型组显著增高, 并经蒙古扁桃总提物给药后向假手术组显著回调, 由此推测蒙古扁桃药材可能通过加快组氨酸代谢速度来维持机体的正常功能。本研究筛选出与肾纤维化相关的关键生物标志物D-葡萄糖醛酸1-磷酸、二酮古龙酸和吲哚葡萄糖醛酸酯均参与了戊糖和葡萄糖醛酸结合通路。吲哚葡萄糖醛酸酯和硫酸吲哚酚是一种能与蛋白质结合的毒素, 会在慢性肾脏病患者的血液和组织中积累[33], 除此之外硫酸吲哚酚还参与了慢性肾功能衰竭的过程。研究表明[34]血清中高浓度的硫酸吲哚酚在慢性肾病进展过程中会加剧吲哚葡萄糖醛酸酯的合成。本研究中, 与模型组相比, 蒙古扁桃高剂量组给药后的吲哚葡萄糖醛酸酯水平显著降低。D-葡萄糖醛酸1-磷酸是糖原在磷酸化酶的作用下生成的[35], 经蒙古扁桃总提物高剂量给药后与模型组相比其水平显著升高, 提示蒙古扁桃总提物高剂量组可能通过调节D-葡萄糖醛酸1-磷酸的水平从而改善糖代谢, 恢复机体稳态。抗坏血酸又称维生素C, 是人体所必需的维生素, 具有抗氧化、清除血浆中自由基、保护细胞免遭活性氧损害以及抗癌等功效[36]。本实验筛选出的关键生物标志物二酮古龙酸也参与了抗坏血酸代谢, 结果显示模型组二酮古龙酸水平显著升高, 经蒙古扁桃给药后其水平显著降低, 并向假手术组回调。由此可推测蒙古扁桃药材可通过抑制维生素C的氧化脱氢, 达到抗肾纤维化并维持机体正常代谢功能的作用。
其他关键生物标志物如烟酸-D-核糖核苷酸和N-乙酰-D-氨基葡萄糖-6-磷酸分别参与了烟酸和烟酰胺代谢与氨基糖和核酸糖代谢, 同样都与肾纤维化相关。其中经蒙古扁桃总提物给药后, 不同剂量组的烟酸-D-核糖核苷酸水平均向假手术组显著回调, 但N-乙酰-D-氨基葡萄糖-6-磷酸的水平经给药后则无明显变化。
综上所述, 相对于模型组, 蒙古扁桃药材总提物给药组可以回调的与肾纤维化相关的生物标记物有7个: S-腺苷甲硫氨酸、D-葡萄糖醛酸1-磷酸、烟酸-D-核糖核苷酸、吲哚葡萄糖醛酸酯、鸟氨酸、4-咪唑酮-5-丙酸和二酮古龙酸。初步从代谢物角度阐明了蒙古扁桃总提物抗大鼠肾纤维化的作用机制, 为抗肾纤维化药物的研发提供理论与实验依据, 同时对蒙古扁桃药材资源开发利用具有深远意义。
作者贡献: 郝海梅、贾小叶是本研究的实验设计和实验研究的执行人, 完成数据分析和论文初稿的写作; 周红兵、白万富参与实验设计和实验结果分析; 石松利、常虹是项目的构思者及负责人, 指导实验设计、数据分析、论文写作与修改。全体作者均阅读并同意最终的文本。
利益冲突: 本研究不受企业、公司等第三方资助, 不存在潜在利益冲突。
| [1] |
Qin M, Zheng M, Zhong WN. Progress of experimental study on treatment of renal fibrosis with UUO by traditional Chinese medicine[J]. Heilongjiang J Tradit Chin Med (黑龙江中医药), 2016, 45: 63-65. |
| [2] |
Eddy AA, López-Guisa JM, Okamura DM, et al. Investigating mechanisms of chronic kidney disease in mouse models[J]. Pediatr Nephrol, 2012, 27: 1233-1247. DOI:10.1007/s00467-011-1938-2 |
| [3] |
Farris AB, Colvin RB. Renal interstitial fibrosis:mechanisms and evaluation[J]. Curr Opin Nephrol Hypertens, 2012, 21: 289-300. DOI:10.1097/MNH.0b013e3283521cfa |
| [4] |
Eddy AA. Overview of the cellular and molecular basis of kidney fibrosis[J]. Kidney Int Suppl, 2014, 4: 2-8. DOI:10.1038/kisup.2014.2 |
| [5] |
Wang QW, Dai XX, Xiang X, et al. Advances in the molecular mechanism of salvianolic acid and tanshinone for intervention of diabetic kidney disease[J]. Acta Pharm Sin (药学学报), 2019, 54: 1356-1363. |
| [6] |
Siqinbateer. Prunus mongolica Maxim[J]. Bull Biol (生物学通报), 2003, 38: 23-24. |
| [7] |
Siqinbateer, Xiu M. Hydrological characteristic of the desert plant Prunus mongolica on the mongolian plateau of China[J]. Chin J Plant Ecol (植物生态学报), 2007, 31: 484-489. DOI:10.17521/cjpe.2007.0060 |
| [8] |
Shi SL, Bai YC, Cheng XH, et al. Extraction and determination of total flavonoids in Amygdalus mongolica[J]. J Baotou Med Coll (包头医学院学报), 2012, 28: 12-13. |
| [9] |
Bai WF, Shi SL, Zhou HB, et al. Comparison of contents of amygdalin in Amygdalus mongolica seed from different producing area[J]. Chin J Health Lab Technol (中国卫生检验杂志), 2015, 25: 315-317. |
| [10] |
Niu SF, Wang J, Shi SL, et al. Determination and comparison of contents of protein in the kernels of Prunus mongolica in different origins[J]. Nei Mong J Tradit Chin Med (内蒙古中医药), 2015, 34: 134-135. |
| [11] |
Liu HJ, Liu GX, Liu GH, et al. Physicochemical properties and fatty acid composition of Prunus mongolica Maxim. kernel oil[J]. China Oils Fats (中国油脂), 2016, 41: 98-101. |
| [12] |
Zheng DH, Shi SL, Su K. Determination of content of organic acids in Prunus mongolica[J]. Lishizhen Med Mater Med Res (时珍国医国药), 2013, 24: 515-516. |
| [13] |
Shi SL, Bai YC, Zhou HB, et al. Extraction and determination of content of polysaccharides in Amygdalus mongolica[J]. Lishizhen Med Mater Med Res (时珍国医国药), 2013, 24: 257-258. |
| [14] |
Sechenbaater, Zhang XQ. Determination of the content of vitamin E in seed oil of Prunus mongolica Maxim[J]. Cereals Oils (粮食与油脂), 2017, 30: 93-96. |
| [15] |
Zhao YZ. Study on floristic geographical distribution of Amygdalus mongolica[J]. J Inner Mong Univ (Nat Sci Ed) (内蒙古大学学报自然科学版), 1995, 26: 713-715. |
| [16] |
Fang HT, Li JL, Wang LY. Research advance of endangered plant Prunus mongolica[J]. Yinshan Acad J (Nat Sci Ed) (阴山学刊自然科学版), 2004, 18: 16-18. |
| [17] |
Zheng QN, Su K, Shi SL, et al. Components analysis, dose-effect relationship and antioxidation of the petroleum ether extracted from Amygdalus mongolica[J]. China J Tradit Chin Med Pharm (中华中医药杂志), 2018, 33: 287-290. |
| [18] |
Zheng QN, Shi SL, Zhou HB, et al. Effects of petroleum ether extracts of Amygdalus mongolica on lipid levels, liver function and lipid peroxidation in hyperlipidemia rats[J]. Pharmacol Clin Chin Mater Med (中药药理与临床), 2016, 32: 67-70. |
| [19] |
Zheng QN, Feng CM, Wu T, et al. Effect of Amygdalus mongolica oil on the liver and mechanisms in hyperlipidemic rats[J]. Sci Technol Food Ind (食品工业科技), 2018, 39: 286-292. |
| [20] |
Zheng QN, Wang J, Zhou HB, et al. Effectiveness of Amygdalus mongolica oil in hyperlipidemic rats and underlying antioxidant processes[J]. J Toxicol Environ Health A, 2017, 80: 1193-1198. DOI:10.1080/15287394.2017.1367124 |
| [21] |
Wu PS, Shi SL, Cheng XH, et al. Protective effects of different extracts of Amygdalus mongolica on liver of hyperlipidemia rats[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2017, 35: 295-298, 514. |
| [22] |
Wu PS, Shi SL, Zhou HB, et al. Effect of Different extracts of Amygdalus mongolica on blood lipid, lipid peroxidation and liver function of hyperlipidemia rats[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2015, 21: 113-117. |
| [23] |
Zhao YS, Wu PS, Zhang HW, et al. Studies on dose-effect relationship of n-butanol extracts of Amygdalus mongolica on reducing blood lipid and its chemical constituents[J]. Sci Technol Food Ind (食品工业科技), 2017, 38: 348-352. |
| [24] |
Wu T, Chang H, Shi SL, et al. Effect of petroleum ether extracts of Amygdalus mongolica on liver fibrosis rat models induced by carbon tetrachloride[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2017, 35: 595-598. |
| [25] |
Jia XY, Gao C, Liu Q, et al. Screening of effective parts of Amygdalus mongolica medicinal materials against rat renal fibrosis[J]. Sci Technol Food Ind (食品工业科技), 2020, 41: 297-302, 308. DOI:10.1016/j.jep.2020.112858 |
| [26] |
Chang H, Liu Q, Bai WF, et al. Protective effects of Amygdalus mongolica on rats with renal fibrosis based on serum metabolomics[J]. J Ethnopharmacol, 2020, 257: 112858. DOI:10.1016/j.jep.2020.112858 |
| [27] |
Buriani A, Garcia-Bermejo ML, Bosisio E, et al. Omic techniques in systems biology approaches to traditional Chinese medicine research:present and future[J]. J Ethnopharmacol, 2012, 140: 535. DOI:10.1016/j.jep.2012.01.055 |
| [28] |
Zhu C, Hu P, Liang QL, et al. Integration of metabonomics technology and its application in modernization of traditional Chinese medicine[J]. Acta Pharm Sin (药学学报), 2008, 43: 683-689. |
| [29] |
Sato M, Muragaki Y, Saika S, et al. Targeted disruption of TGF-β1/Smad3 signaling protects against renal tubulointerstitial fibrosis induced by unilateral ureteral obstruction[J]. J Clin Investig, 2003, 112: 1486-1494. DOI:10.1172/JCI200319270 |
| [30] |
Lei XQ, Wu WZ, Fang LY, et al. Advance in the nutrition and physiological function of arginine[J]. Chin J Anim Sci (中国畜牧杂志), 2009, 45: 46-49. |
| [31] |
Brand LM, Harper AE. Histidine ammonia-lyase from rat liver. Purification, properties, and inhibition by substrate analogs[J]. Biochemistry, 1976, 15: 1814-1821.
|
| [32] |
Hu M, Wu SG, Wang J, et al. Physiological function and application of histidine in animal production[J]. China Feed (中国饲料), 2018(07): 38-45. |
| [33] |
Gondouin B, Cerini C, Dou L, et al. Indolic uremic solutes increase tissue factor production in endothelial cells by the aryl hydrocarbon receptor pathway[J]. Kidney Int, 2013, 84: 733-744. DOI:10.1038/ki.2013.133 |
| [34] |
Niwa T, Miyazaki T, Tsukushi S, et al. Accumulation of indoxyl-beta-D-glucuronide in uremic serum:suppression of its production by oral sorbent and efficient removal by hemodialysis[J]. Nephron, 1996, 74: 72-78. DOI:10.1159/000189284 |
| [35] |
Touster O, Reynolds VH. The synthesis and properties of beta-D-glucuronic acid-1-phosphate[J]. J Biol Chem, 1952, 197: 863-868. DOI:10.1515/bchm2.1952.289.5-6.309 |
| [36] |
Pohanka M, Pejchal J, Snopkova S, et al. Ascorbic acid:an old player with a broad impact on body physiology including oxidative stress suppression and immunomodulation:a review[J]. Mini Rev Med Chem, 2012, 12: 35-43. DOI:10.2174/138955712798868986 |
 2020, Vol. 55
2020, Vol. 55


