淫羊藿(Epimedium brevicornu Maxim.)首载于《神农本草经》, 为多年生草本植物, 又名仙灵脾、千两金、放杖草等, 普遍分布于我国贵州、四川、江西、湖南等地[1, 2]。其味辛, 性温, 归肝、肾经, 有补肾壮阳、祛风除湿、强筋健骨之功效, 主要用于治疗腰膝酸软、风湿痹痛、四肢麻木不仁等病证, 淫羊藿为常用的补肾壮阳药物, 具有极高的药用价值[3, 4]。近年来研究发现, 淫羊藿在生殖系统、抑制肿瘤转移、免疫系统、改善记忆和抗衰老方面均有作用, 临床运用广泛[5-7]。有研究表明, 淫羊藿的主要有效成分是一类以异戊烯基、糖基、羟基、烃氧基及甲氧基等为取代基的2-苯基色原酮衍生物[8, 9]。虽然对该类化学成分的研究己经较为深入, 但迄今研究重点和热点主要集中在黄酮醇类成分, 而黄酮的化学和药理学文献报道则较少。对于淫羊藿类黄酮生物合成途径, 至今尚无系统报道, 关于淫羊藿黄酮次级代谢酶与结构基因的报道尤为鲜见, 仅Yamamoto等[10]对二甲烯丙基转移酶进行了生物化学研究。本研究通过剖析整理淫羊藿化学成分结构信息, 在总结黄酮醇类成分代谢规律基础上, 初步构建起了以箭叶淫羊藿素为主要产物的特征次生代谢途径, 推导出22个新成分结构, 结合高分辨质谱法分析鉴定出了1个新成分及8个新化合物, 该研究结果不仅验证了淫羊藿类黄酮次生代谢规律的正确性, 也为后续的次生代谢调控奠定了科学基础。
材料与方法仪器 LC-30A型超高效液相色谱仪(日本岛津公司):二元高压泵、自动进样器、柱温箱; Triple TOFTM 4600型四极杆串联飞行时间高分辨质谱仪(美国AB公司); JY92-ⅡD型超声波细胞粉碎机(中国宁波新艺超声设备有限公司); BJ-100型超高速中药粉碎机(中国德清拜杰电器有限公司); VGT-2013QT型超声清洗机(中国固特超声公司); BSA224S-CW型万分之一分析天平(德国赛多利斯公司)。
试药 对照品芹菜素(批号: 111901-201603), 购于中国食品药品检定研究院; 淫羊藿苷、朝藿定A、朝藿定B、朝藿定C对照品为自制, 经高效液相色谱(HPLC)归一化法测定, 纯度 > 98%;乙腈(色谱级, 德国Merck公司)、甲酸(色谱级, 美国ACS公司), 其余试剂为分析纯; 水为娃哈哈纯净水(杭州娃哈哈集团有限公司)。不同品种淫羊藿样品均采自于重庆、四川、湖北、湖南等地, 经重庆市中药研究院生药研究所刘翔副研究员鉴定为小檗科多年生草本植物淫羊藿的地上部分。54批样品信息见表 1。
| Table 1 Epimedium sample collection information table |
色谱条件 色谱柱为ACE Excel 3 SuperC18柱(10 mm×2.1 mm, 3.0 µm), 广州菲罗门科学仪器有限公司; 柱温40 ℃; 流动相为乙腈-0.1%甲酸水溶液, 体积流量0.25 mL·min-1; 梯度洗脱: 0~1.2 min, 12%乙腈; 1.2~7.5 min, 12%~65%乙腈; 7.5~11.5 min, 65%~85%乙腈; 11.5~12.0 min, 85%乙腈; 12.0~12.1 min, 85%~12%乙腈; 12.1~15.0 min, 12%乙腈; 进样量2 µL。
质谱条件 电喷雾离子源(ESI), 正离子模式采集数据, 喷雾电压(IS): +5 500 V; 雾化气压力(GS1): 0.39 MPa; 气帘气压力(CUR): 0.15 MPa; 辅助气压力(GS2): 0.39 MPa; 离子源温度(TEMP): 600 ℃; 簇裂解电压(DP): 65 V; 碰撞能量(CE): 40 V; 碰撞能量滚动区间(CES): 15 V; 检测模式为IDA (信息关联采集模式), 多重质量亏损(MMDF)和动态背景扣除(DBS)为触发二级的条件, 满足该条件优先进行二级扫描。
供试品溶液的制备 取淫羊藿样品粉末约0.1 g, 精密称定, 置5 mL试管中, 精密加入50%乙醇水溶液2 mL, 密塞, 称定质量, 超声波细胞破碎处理(功率: 600 W) 30 min, 放冷, 再次称定质量, 用50%乙醇溶液补足减失质量, 涡旋混匀, 过滤, 精密量取续滤液1 mL提取液于10 mL量瓶中, 加色谱甲醇定容至刻度, 摇匀, 用0.22 µm微孔滤膜滤过于进样瓶中, 即得。
数据分析处理 查阅淫羊藿化学相关文献, 总结淫羊藿黄酮类成分的次生代谢规律, 根据其特有的生物合成途径推导可能存在的代谢产物, 并将产物信息代入PeakView软件, 构建新化合物筛查数据库; 提取分析Q-TOF采集的15个品种54批次样品数据, 将满足质量误差小于5 ppm、同位素分布正确且含有二级碎片的离子作为目标化合物, 结合软件Formula Finder和Mass Calculators等功能、在线数据库(ChemSpider、Metlin、HMDB等)及二级碎片裂解规律, 鉴定验证新化合物的化学结构。
结果与讨论 1 化合物结构推导本研究根据淫羊藿类黄酮次生代谢规律, 构建了以箭叶淫羊藿素A、箭叶淫羊藿素B、箭叶淫羊藿素C、箭叶淫羊藿素D、箭叶淫羊藿素E为主要产物的生源合成途径, 由代谢网络图可以看出(图 1), 整个途径包括28个化合物, 其中已知成分有6个, 将推导化合物结果采用“数据分析处理”项下方法进行分析, 共鉴定出了1个新成分和6个新化合物(表 2、图 2)。由箭叶淫羊藿素A、B等已知成分化学结构可以看出, 黄酮母核C5、C7、C4′位发生氧化后各引入了1个羟基, 而C3′位既有键合异戊烯基的化合物(箭叶淫羊藿素D)也有键合羟基的化合物(箭叶淫羊藿素E), C5′位同样可以键合异戊烯基(箭叶淫羊藿素B), 且该基团上的双键还可以和C4′位羟基发生加成反应形成环状结构(箭叶淫羊藿素A、C、E)。笔者通过整理淫羊藿化学成分结构信息, 发现黄酮醇类成分的C7位羟基只能进行单葡萄糖苷化(epimedoside C、icariside I和淫羊藿苷等)和双葡萄糖苷化(粗藿苷、二叶淫羊藿苷C、acuminatoside等)反应; 由于黄酮与黄酮醇结构近似, 且都为同种植物的次生代谢产物, 故推测该途径中黄酮母核C7位羟基会在酶的催化下发生葡萄糖基转移反应; 同理黄酮母核的C4′位羟基可能发生甲基化反应, 而C5位羟基则不具反应活性。但与淫羊藿黄酮醇成分结构不同的是, 在此途径中异戊烯基的结合位点由C8位变为了C3′、C5′位, 同时母核的C3′位还可以发生单加氧反应, 根据文献[11]报道, 在类黄酮的次生代谢途径中存在F3′H酶, 可以在C3′位上引入羟基, 推测在此途径中也可能存在该种氧化反应类型。由构建的特征黄酮代谢途径可知, 芹菜素的C3′位键合异戊烯基生成箭叶淫羊藿素D, 箭叶淫羊藿素D的C5′位再键合异戊烯基生成X1, 同时X1的C3′位异戊烯基上双键还可以与水发生加成反应生成X5, 而X5的C3′位异戊烯基脱氢后生成箭叶淫羊藿素B, 箭叶淫羊藿素B的C5′位异戊烯基双键与C4′位羟基发生加成反应可生成箭叶淫羊藿素A; 同样芹菜素的C5′位键合异戊烯基生成X13, 而X13的C5′位异戊烯基双键与C4′羟基发生加成反应生成箭叶淫羊藿素C, 箭叶淫羊藿素C的C3′位发生羟基化反应生成箭叶淫羊藿素E; 在上述生化反应之后即是各种C4′位羟基的甲基化产物和C6位的葡萄糖苷化产物。

|
Figure 1 Derived map of Epimedium flavone secondary metabolism network |
| Table 2 Epimedium flavonoids identification table |

|
Figure 2 TIC diagram of the sample from Epimedium |
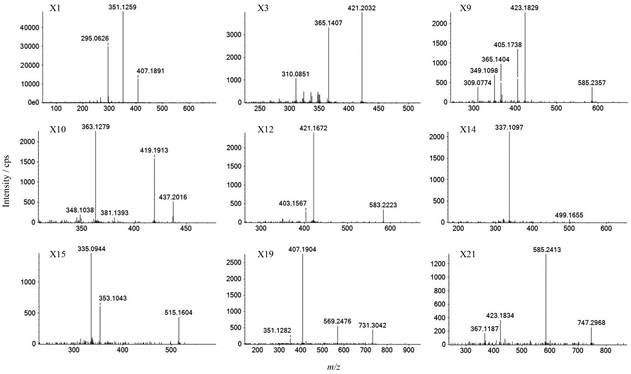
化合物X1的分子式为C25H26O5, [M+H]+的理论值与实测值偏差为4.9 ppm, 由二级质谱碎片图(图 3-X1)可知, m/z为407.189 1 [M+H]+的母离子, 连续脱去56.063 2、56.063 3基团生成m/z 351.125 9和m/z 295.062 6的碎片离子; 采用PeakView软件的Mass Calculators功能计算出C4H8的准确质量为56.062 05, 脱去碎片差值均小于0.01;该化合物可能含有连续脱掉异戊烯基的结构, 这与代谢途径推导结果一致; 将化合物信息代入ChemSpider、Metlin、HMDB在线数据库进行检索, 发现Honyucitrin与X1的化学结构完全匹配, 推测其为淫羊藿的新成分。
|
Figure 3 Fragment ions (MS/MS) mass spectrum of X1, X3, X9, X10, X12, X14, X15, X19, X21 |
化合物X3的分子式为C26H28O5, [M+H]+的理论值与实测值偏差为0.5 ppm, 由二级质谱碎片图(图 3-X3)可知, m/z为421.203 2 [M+H]+的母离子, 连续脱去56.062 5、55.055 6基团生成m/z 365.140 7和m/z 310.085 1的碎片离子; 采用PeakView软件的Mass Calculators功能计算出C4H8、C4H7的准确质量分别为56.062 05、55.054 23, 脱去碎片差值均小于0.01;该化合物可能含有连续脱掉异戊烯基的结构, 这与代谢途径推导结果一致; 将化合物信息代入ChemSpider、Metlin、HMDB在线数据库进行检索, 未找到与X3相匹配的化学结构, 推测其为淫羊藿的新化合物。
化合物X9的分子式为C31H36O11, [M+H]+的理论值与实测值偏差为4.8 ppm, 由二级质谱碎片图(图 3-X9)可知, m/z为585.235 7 [M+H]+的母离子, 连续脱去162.052 8、18.009 1、56.064 0基团生成m/z 423.182 9、m/z 405.173 8、m/z 349.109 8的碎片离子, 再由m/z为423.182 9子离子连续脱去58.042 5、56.063 0基团生成m/z 365.140 4和m/z 309.077 4的碎片离子; 采用PeakView软件的Mass Calculators功能计算出C6H10O5、H2O、C4H8、C3H6O的准确质量分别为162.052 28、18.010 02、56.062 05、58.041 32, 脱去碎片差值均小于0.01;该化合物可能含有连续脱掉葡萄糖苷、水、异戊烯基等结构, 这与代谢途径推导结果一致; 将化合物信息代入ChemSpider、Metlin、HMDB在线数据库进行检索, 未找到与X9相匹配的化学结构, 推测其为淫羊藿的新化合物。
化合物X10的分子式为C26H28O6, [M+H]+的理论值与实测值偏差为0.3 ppm, 由二级质谱碎片图(图 3-X10)可知, m/z为437.201 6 [M+H]+的母离子, 分别脱去18.010 3、56.062 3基团生成m/z 419.191 3和m/z 381.139 3的碎片离子, 再由m/z为419.191 3子离子连续脱去56.063 4、15.024 1基团生成m/z 363.127 9和m/z 348.103 8的碎片离子; 采用PeakView软件的Mass Calculators功能计算出H2O、C4H8、CH3的准确质量分别为18.010 02、56.062 05、15.022 93, 脱去碎片差值均小于0.01;该化合物可能含有连续脱掉水、异戊烯基和甲基的结构, 这与代谢途径推导结果一致; 将化合物信息代入ChemSpider、Metlin、HMDB在线数据库进行检索, 未找到与X10相匹配的化学结构, 推测其为淫羊藿的新化合物。
化合物X12的分子式为C31H34O11, [M+H]+的理论值与实测值偏差为4.6 ppm, 由二级质谱碎片图(图 3-X12)可知, m/z为583.222 3 [M+H]+的母离子, 连续脱去162.055 1、18.010 5基团生成m/z 421.167 2和m/z 403.156 7的碎片离子; 采用PeakView软件的Mass Calculators功能计算出C6H10O5、H2O的准确质量分别为162.052 28、18.010 02, 脱去碎片差值均小于0.01;该化合物可能含有连续脱掉葡萄糖苷和水的结构, 这与代谢途径推导结果一致; 将化合物信息代入ChemSpider、Metlin、HMDB在线数据库进行检索, 未找到与X12相匹配的化学结构, 推测其为淫羊藿的新化合物。
化合物X14的分子式为C26H26O10, [M+H]+的理论值与实测值偏差为0.6 ppm, 由二级质谱碎片图(图 3-X14)可知, m/z为499.165 5 [M+H]+的母离子, 脱去162.055 8基团生成m/z 337.109 7的碎片离子; 采用PeakView软件的Mass Calculators功能计算出C6H10O5的准确质量为162.052 28, 脱去碎片差值小于0.01;该化合物可能含有脱掉葡萄糖苷的结构, 这与代谢途径推导结果一致; 将化合物信息代入ChemSpider、Metlin、HMDB在线数据库进行检索, 未找到与X14相匹配的化学结构, 推测其为淫羊藿的新化合物。
化合物X15的分子式为C26H26O11, [M+H]+的理论值与实测值偏差为3.5 ppm, 由二级质谱碎片图(图 3-X15)可知, m/z为515.160 4 [M+H]+的母离子, 连续脱去162.056 1、18.009 9基团生成m/z 353.104 3和m/z 335.094 4的碎片离子; 采用PeakView软件的Mass Calculators功能计算出C6H10O5、H2O的准确质量分别为162.052 28、18.010 02, 脱去碎片差值均小于0.01;该化合物可能含有连续脱掉葡萄糖苷和水的结构, 这与代谢途径推导结果一致; 将化合物信息代入ChemSpider、Metlin、HMDB在线数据库进行检索, 未找到与X15相匹配的化学结构, 推测其为淫羊藿的新化合物。
化合物X19的分子式为C37H46O15, [M+H]+的理论值与实测值偏差为1.4 ppm, 由二级质谱碎片图(图 3-X19)可知, m/z为731.304 2 [M+H]+的母离子, 连续脱去162.056 6、162.057 2、56.062 2基团生成m/z 569.247 6、m/z 407.190 4、m/z 351.128 2的碎片离子; 采用PeakView软件的Mass Calculators功能计算出C6H10O5、C4H8的准确质量分别为162.052 28、56.062 05, 脱去碎片差值均小于0.01;该化合物可能含有连续脱掉葡萄糖苷和异戊烯基的结构, 这与代谢途径推导结果一致; 将化合物信息代入ChemSpider、Metlin、HMDB在线数据库进行检索, 未找到与X19相匹配的化学结构, 推测其为淫羊藿的新化合物。
化合物X21的分子式为C37H46O16, [M+H]+的理论值与实测值偏差为2.4 ppm, 由二级质谱碎片图(图 3-X21)可知, m/z为747.296 8 [M+H]+的母离子, 连续脱去162.055 5、162.057 9、56.064 7基团生成m/z 585.241 3、m/z 423.183 4、m/z 367.118 7的碎片离子; 采用PeakView软件的Mass Calculators功能计算出C6H10O5、C4H8的准确质量分别为162.052 28、56.062 05, 脱去碎片差值均小于0.01;该化合物可能含有连续脱掉葡萄糖苷和异戊烯基的结构, 这与代谢途径推导结果一致; 将化合物信息代入ChemSpider、Metlin、HMDB在线数据库进行检索, 未找到与X21相匹配的化学结构, 推测其为淫羊藿的新化合物。
3 小结本研究优化考察了样品提取方法、提取溶剂、溶剂比例及提取时间, 最终确定以50%的乙醇水超声细胞破碎提取30 min为最佳的提取方案。根据TIC峰响应值及峰形优化考察了流动相组成和色谱柱类型; 同时采用针泵以10 µL·min-1流速注射对照品, 在TOF MS模式下, 逐个微调雾化气、辅助加热气、气帘气、喷雾电压、离子源温度及喷雾针位置等离子源参数, 以使总离子流的响应值达到最佳。
据作者统计已报道的淫羊藿黄酮醇类成分有70余种(代表性成分如:淫羊藿苷、朝藿定、淫羊藿次苷等), 是研究的热点和重点, 而黄酮成分则报道较少, 仅有20余种, 其次生代谢途径亦尚不明确。通过前期研究[12, 13]发现, 淫羊藿黄酮醇的生化反应类型主要为C7位的葡萄糖苷化、C3位的鼠李糖苷化以及C4′位的甲基化; 箭叶淫羊藿素与黄酮醇类成分的母核(去甲淫羊藿素)化学结构类似, 差别仅在于C3位羟基和异戊烯基的个数及结合位点, 据此推测在同一种植物中、在相同酶的催化作用下可能会发生相同或相似的生化反应。本研究以箭叶淫羊藿素A、箭叶淫羊藿素B、箭叶淫羊藿素C、箭叶淫羊藿素D及箭叶淫羊藿素E的化学结构作为参考, 结合黄酮醇类成分的代谢规律, 构建了特征黄酮的次生代谢途径, 并采用高分辨质谱法对推导结果进行分析验证, 从该途径中共推导出28个化合物, 在15个品种54批次淫羊藿样品中鉴定出了1个新成分和8个新化合物, 补充完善了淫羊藿药效黄酮的物质基础; 通过总结分析裂解规律发现, 上述化合物脱去碎片多为葡萄糖苷和异戊烯基。该实验结果为从基因层面、分子层面去深入调控淫羊藿类黄酮次生代谢提供科学依据。本研究将次生代谢和高分辨质谱相结合, 精简了长时间、繁琐的植化分离步骤, 节约了实验成本, 为具有药效活性次生代谢产物分析鉴定提供了一种新的思路和方法。
作者贡献:秦伟瀚负责数据分析及文章撰写; 阳勇负责构建淫羊藿黄酮代谢产物数据库; 郭延垒负责高分辨质谱样品前处理和进样; 李卿负责淫羊藿药材样品处理; 张小梅负责研究设计; 刘翔负责淫羊藿药材采集鉴定、指导论文撰写。
利益冲突:本文研究内容无任何利益冲突。
| [1] |
Qin WH, Liu X, Zhang J, et al. Quality evaluation of fifteen varieties of Epimedii Folium from different growing areas[J]. Chin Tradit Pat Med (中成药), 2017, 39: 1889-1895. |
| [2] |
Han S, Xie YY, Wang YM, et al. Comparative study on chemical quality of main species of Epimedium[J]. Acta Pharm Sin (药学学报), 2012, 47: 502-507. |
| [3] |
Feng J. Research progress of Epimedium[J]. Hubei J Tradit Chin Med (湖北中医杂志), 2012, 34: 74-75. |
| [4] |
Zhang JL, Ding H, Song XB. Research progress on anti-aging effect of total flavonoids of Herba Epimedii[J]. Nat Prod Res Dev (天然产物研究与开发), 2018, 30: 339-343. |
| [5] |
Wang HZ, Cai YH, Chen YZ, et al. Epimedium chemical composition and pharmacological activity research progress[J]. Asia-Pac Tradit Med (亚太传统医药), 2016, 12: 63-65. |
| [6] |
Fang LY. Research progress on pharmacological effects and clinical application of Epimedium[J]. Smart Healthcare (智慧健康), 2017, 3: 25-27. |
| [7] |
Zhao WJ, Wang L, Wang ZL, et al. Research progress on pharmacological effects and clinical application of Epimedium[J]. Inf Tradit Chin Med (中医药信息), 2016, 33: 105-108. |
| [8] |
Wang XY, Xie RM, Sun WJ. Research progress of flavonoids in Epimedium[J]. Pharmacol Clin Chin Mater Med (中药药理与临床), 2010, 26: 171-175. |
| [9] |
Lu L, Xu Y, Cai H. Research progress of total flavonoids in Epimedium[J]. J Shandong Univ Tradit Chin Med (山东中医药大学学报), 2013, 37: 167-170. |
| [10] |
Yamamoto H, Kimata J, Senda M, et al. Dimethylallyl diphosphate:kaempferol 8-dimethylallyl transferase in Epimedium diphyllum cell suspension cultures[J]. Phytochemistry, 1997, 44: 23-28. |
| [11] |
Xia T, Gao LP. Advances in biosynthesis pathways and regulation of flavonoids and catechins[J]. Sci Agric Sin (中国农业科学), 2009, 42: 2899-2908. |
| [12] |
Li Y, Zhang XL, Yang J, et al. Chemical constituents of Epimedium brevicornu[J]. Chin Tradit Herb Drugs (中草药), 2015, 46: 2057-2061. |
| [13] |
Liu XL, Zhang YW, Guan YQ. Advances in studies on flavonoid constituents from Epimedium[J]. Tianjin Chem Ind (天津化工), 2010, 24: 10-13. |
 2020, Vol. 55
2020, Vol. 55


