2. 丽珠集团新北江制药股份有限公司, 广东 清远 511515
2. Livzon New River Pharmaceutical Co., Ltd., Qingyuan 511515, China
胰高血糖素样多肽1 (glucagon-like peptide 1, GLP-1)是一种由回肠内分泌细胞分泌的肽类激素[1], GLP-1在体内可与G蛋白偶联受体结合, 激活腺苷酸环化酶使细胞内环磷酸腺苷(cyclic adenosine monophosphate, cAMP)水平升高, 正反馈调节胞内Ca2+水平, 刺激胰岛β细胞分泌胰岛素[2], 并且GLP-1与胰高血糖素结构相似, 可竞争性抑制胰高血糖素释放而降低血糖[3]。GLP-1类似物已成为2型糖尿病的新型治疗药物, 目前美国食品药品监督管理局已批准上市的GLP-1类似物包括艾塞那肽、利拉鲁肽、度拉糖肽及索马鲁肽等。其中利拉鲁肽具有降低体重、平稳降低血糖和保护胰岛β细胞的功能, 且因具有较长半衰期等优势而在临床中广泛应用[4]。为了开发更多安全及有效的GLP-1类似物, 有必要建立简便可靠、体系稳定的活性评价模型和宿主杂质含量检测方法。
目前GLP-1类似物的体外活性主要通过检测大鼠胰岛β细胞瘤细胞RIN-m5F及小鼠胰岛β细胞MIN6等天然胰岛β细胞增殖率[5]、胰岛素分泌水平[6]、细胞内cAMP分泌水平[7]等指标进行分析。由于胰岛细胞培养具有条件苛刻、细胞活性低、成本高等问题, 并不适用于高通量药物筛选, 因此建立稳定可靠、操作简便且适用于高通量筛选的细胞模型成为GLP-1类似物体外活性评价的新策略。本课题组前期将GLP-1受体基因克隆至真核表达载体中构建重组质粒, 转染进宿主细胞HEK293A中获得GLP-1R-GFP (GLP-1 receptor-green fluorescent protein)-HEK293A稳转细胞株, 可用于检测细胞内cAMP含量[8]。对于细胞内cAMP含量可通过放射免疫分析法[9]、酶联免疫法[10]、荧光报告基因信号分析[11]、均相时间分辨荧光法(homogeneous time-resolved fluorescence, HTRF)等方法进行检测[12]。HTRF基于时间分辨荧光和荧光共振能量转移两大技术, 将时间分辨荧光的低背景特点与荧光共振能量转移的均相实验方式融合在一起, 与酶联免疫吸附实验(enzyme linked immunosorbent assay, ELISA)相比不需要洗涤过程, 使该方法具有更高的灵敏度和更大的通量, 保证检测结果的准确性[13]。目前HTRF作为高通量药物筛选的重要方法已广泛应用于G蛋白偶联受体研究、激酶活性检测、抗体检测、蛋白相互作用分析等领域[14]。因此本研究以利拉鲁肽为代表, 采用GLP-1R-GFP-HEK293A细胞模型, 通过HTRF方法检测cAMP含量, 建立适用于GLP-1类似物的体外药理活性检测新方法。
GLP-1类似物是一类既可通过化学合成, 也可通过基因工程重组技术以大肠杆菌或酵母细胞为宿主表达而得到的重组多肽类药物[15], 在后者生产过程中会引入残留宿主细胞蛋白(host cell protein, HCP)等杂质, HCP会诱发机体产生HCP抗体, 引发机体过敏反应, 并且使机体对蛋白多肽类药物产生抗体而影响治疗效果[16]。除了HCP所造成的影响, 从细胞或微生物内提取的生物制品中含有的宿主细胞残留DNA会整合入人体基因组引起突变, 并且可通过激活原癌基因或失活抑癌基因等方式而诱发潜在致癌和DNA传染等风险[17]。《中国药典》规定大肠杆菌宿主菌体蛋白残留量不得高于蛋白总量的0.10%, 并且外源性DNA残留量应低于每剂量10 ng[18]。为了控制GLP-1类似物的药物质量及保证其安全性, 本实验利用ELISA测定GLP-1类似物的HCP含量, 同时利用Taqman探针原理, 将磁珠提取DNA前处理方法与定量实时聚合酶链式反应法(quantitative real time polymerase chain reaction, Q-PCR)相结合, 测定GLP-1类似物的宿主DNA残留量, 为GLP-1类似物的杂质检测提供参考。
材料和方法药品及试剂 利拉鲁肽原研制剂(丹麦Novo Nordisk公司); 不同批次利拉鲁肽类似物C1、C2和C3 (丽珠制药江北集团提供); GLP-1R-GFP-HEK293A稳转细胞株(中山大学新药筛选中心构建[8]); 磷酸盐缓冲液(phosphate buffer saline, PBS, 美国Hyclone公司); 牛血清蛋白(bovine serum albumin, BSA, 中国翔博生物公司); IBMX (3-isobutyl-1-methylxanthine, 美国MP Biomedicals公司); 384白色浅孔板(美国Corning公司); 透明封板膜(美国Axygen公司); 0.2 mL qPCR八连管(台湾GUNSTER公司); cAMP检测试剂盒(美国Cisbio公司); 宿主细胞残留DNA样本前处理试剂盒以及大肠杆菌残留DNA检测试剂盒(中国湖州申科公司); 大肠杆菌宿主蛋白检测试剂盒(美国Cygnus Technologies公司)。
仪器 FlexStation 3多功能酶标仪工作站(美国Molecular Devices公司); PRISM 7500实时荧光定量PCR仪(美国ABI公司)。
溶液配制 向PBS中加入终浓度为0.5 mmol·L-1 IBMX和0.1% BSA配制成反应缓冲液。用反应缓冲液将1.6 μmol·L-1利拉鲁肽原研制剂稀释至100 nmol·L-1, 将利拉鲁肽类似物C1、C2和C3干粉原料精密称量, 用Tris-HCl缓冲液溶解后稀释至100 nmol·L-1。按照梯度稀释的方法, 使用反应缓冲液将利拉鲁肽等样品浓度从高到低依次定量稀释成1.0×10-5.5~1.0×10-12 mol·L-1范围的14个浓度值, 用于cAMP含量测定。
HTRF检测条件优化 光照条件会影响多肽类药物的结构稳定性, 从而降低药物原有的生物活性[19]。为了达到最佳的检测信号, 本实验采用避光孵育方法, 同时对细胞活性和细胞密度等条件进行优化。按照cAMP检测试剂盒要求, 在100 nmol·L-1利拉鲁肽原研制剂刺激下, 检测野生型HEK293A与GLP-1R-GFP-HEK293A细胞株cAMP含量, 通过验证细胞活性、细胞密度以及是否避光孵育等条件下的信号窗口来确定HTRF的最佳检测条件。
cAMP含量测定 用适量反应缓冲液将生长状况良好的GLP-1R-GFP-HEK293A细胞重悬并稀释, 细胞密度按1 500个/孔加入384白色浅孔板中, 根据cAMP检测试剂盒要求将配制好的不同浓度各待测样本溶液按每孔5 µL加入384白色浅孔板中, 透明封板膜密封, 置于37 ℃、5% CO2培养箱中孵育30 min。孵育完成后将5 µL cAMP-d2工作溶液加入到384白色浅孔板的相应孔中, 于室温下避光孵育1 h, 放入多功能酶标仪工作站中记录读数, 计算665 nm处与620 nm处的吸光度比值(A665/A620)。
宿主残留蛋白含量测定 用样品稀释液将HCP标准品配制成20 ng·mL-1作为质控品。用样品稀释液将各利拉鲁肽样品配制成20 ng·mL-1。HCP标准品、样品、质控品以每孔25 µL加入酶标板中, 各浓度设置2个复孔, 室温下摇床孵育90 min。加入洗涤液清洗4次, 加入底物四甲基联苯胺, 避光静置30 min, 加入终止剂后于10 min内放入酶标仪, 选择450 nm及650 nm波长处测定吸光度值。
宿主细胞残留DNA样本前处理及含量测定 用样品稀释液将大肠杆菌DNA标准品稀释成0.03~3 000 pg·µL-1的梯度浓度。将30 pg DNA标准品加入100 µL各利拉鲁肽样品中混匀, 作为样本质控品。取100 µL DNA稀释液作为阴性质控品。样本质控品、阴性质控品和待测样品进行磁珠法前处理, 按照试剂盒要求操作, 获得样本质控品、阴性质控品和待测样品纯化液用于大肠杆菌宿主残留DNA含量测定。将Q-PCR扩增预混和溶液与样品纯化液加入八连管中, 反应体积为每孔30 µL, 95 ℃预变性10 min, 95 ℃、15 s, 60 ℃、1 min, 40个循环。根据扩增曲线计算各样品大肠杆菌宿主残留DNA含量。
数据及统计学处理 ① cAMP含量测定:由FlexStation 3多功能酶标仪工作站测定出cAMP标准品在665 nm与620 nm处的A665/A620, 并根据公式Ratio = (A665/A620)×104、Rationeg = (Aneg665/Aneg620)×104和Delta F% = [(standard or sample ratio-rationeg)/rationeg]×100计算出标准品在各浓度下的Delta F%值。以cAMP标准品浓度为横坐标, Delta F%为纵坐标, 采用GraphPad Prism 7软件绘制标准曲线。利用标准曲线计算各样品cAMP变化并绘制cAMP浓度曲线, 计算其半数有效剂量值(concentration for 50% of maximal effect, EC50)。采用GraphPad Prism 7软件对实验数据进行Bonferroni-Dunn法多重t检验, 实验数据以
根据计算公式, Delta F%表示样品在665 nm与620 nm处的A665/A620, cAMP含量与Delta F%之间成反比, 可用Delta F%表示cAMP含量变化情况。结果表明, 与野生型HEK293A相比, GLP-1R-GFP-HEK293A细胞可显著增加cAMP含量(P < 0.001, 图 1A), 当细胞个数为1 500个/孔时, Delta F%与本底相比可明显增加cAMP含量(P < 0.001, 图 1B), 并且在避光下孵育更能提高检测体系对cAMP的灵敏度(P < 0.001, 图 1C)。因此, 本实验采用GLP-1R-GFP-HEK293A细胞的细胞密度为1 500个/孔和避光孵育等优化条件对GLP-1类似物进行HTRF活性检测。
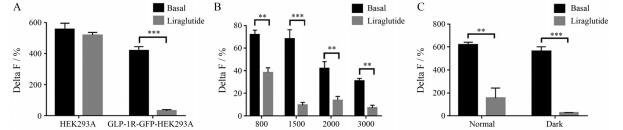
|
Figure 1 Optimization of homogeneous time-resolved fluorescence (HTRF) detection conditions. A: Activity comparison of the GLP-1R (glucagon-like peptide-1 receptor)-GFP (green fluorescent protein)-HEK293A stable cell line using 1 500 cells per well; B: Cell density optimization for cyclic adenosine monophosphate (cAMP) measurement treated with 100 nmol·L-1 of liraglutide; C: The optimization of detection system under the condition of normal light incubate and avoid light incubation treated with 100 nmol·L-1 of liraglutide. n = 3, |
根据检测数据绘制cAMP标准曲线(图 2A)。由标准曲线方程计算出各GLP-1类似物样品在梯度浓度下刺激GLP-1R-GFP-HEK293A细胞释放的cAMP含量(图 2B~E)。各样品的EC50值为:利拉鲁肽原研制剂为5.087 nmol·L-1; 利拉鲁肽类似物C1为5.191 nmol·L-1; 类似物C2为5.469 nmol·L-1; 类似物C3为6.028 nmol·L-1。各EC50值与文献报道范围一致[20], 并且各GLP-1类似物在该检测模型下拟合曲线良好, 各组数据组间与组内差异较小, 具有良好的稳定性和可靠性, 结果表明采用GLP-1R-GFP-HEK293A细胞模型所建立的HTRF方法适用于GLP-1类似物的体外药理活性评价。
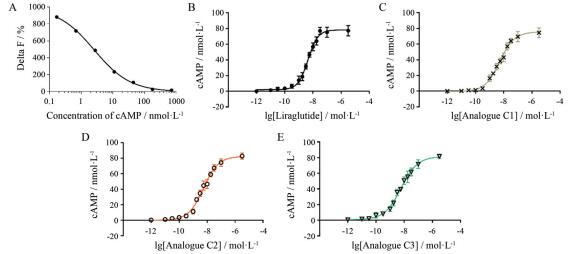
|
Figure 2 Liraglutide original product and its analogues promoted cAMP release in GLP-1R-GFP-HEK293A cells. A: The standard curve of cAMP was drawn with the mean value of Delta F% as Y (n = 3) and cAMP concentration as X, the equation of the standard curve was Y = (993.4×X-0.760 5)/(X-0.760 5 + 0.490 1) - 1.589. The r value of the standard curve is 0.999 4; B-E: The concentration for 50% of maximal effect (EC50) values of different batches of GLP-1 analogues were determined by HTRF assay at 1 500 cells per well, cAMP-d2 working solution incubation in dark for 1 h in GLP-1R-GFP-HEK293A cells. n = 3, |
以吸光度平均值Y (n = 3)为纵坐标, HCP标准品浓度X为横坐标绘制标准曲线, 标准曲线符合四参数回归且r值为1.000 (图 3)。由标准曲线方程计算出利拉鲁肽原研制剂HCP浓度为1.933 ng·mL-1; 利拉鲁肽类似物C1为1.800 ng·mL-1; 类似物C2为1.731 ng·mL-1; 类似物C3为1.664 ng·mL-1。根据样品粉末称取量及母液稀释倍数可知利拉鲁肽原研制剂HCP含量为0.039 9%;类似物C1为0.036 0%;类似物C2为0.034 6%;类似物C3为0.033 3%。各样品大肠杆菌宿主残留蛋白均低于蛋白总量的0.10%, 符合《中国药典》规定。利拉鲁肽与3个利拉鲁肽类似物之间的变异系数为6.45%。结果表明采用的方法测定结果准确可靠, 适用于GLP-1类似物HCP含量测定。
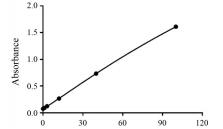
|
Figure 3 Detection of the E.coli host residual protein (E.coli P) of GLP-1 analogues. The standard curve of host cell protein (HCP) was drawn with the mean value of absorbance as Y and HCP standard concentration as X, the equation of the standard curve was Y = (6.921×X1.090)/(2.716 + X1.090) + 0.077 40. The r value of the standard curve is 1.000. n = 3, |
采用大肠杆菌宿主DNA标准品进行系统试验性实验, 根据标准曲线可知DNA标准品与循环阈值(cycle threshold, CT)间线性关系良好, 标准曲线的r值为0.999 2 (图 4)。标准曲线检测范围在30 fg·µL-1~3 ng·µL-1之间, 且最低检测限为30 fg·µL-1。各样品经磁珠提取纯化后, 根据标准曲线方程以及样品CT均值, 计算出利拉鲁肽原研制剂宿主DNA残留量为1.802 ng·µg-1, 回收率为86.5%;类似物C1为1.923 ng·µg-1, 回收率为79.1%;类似物C2为1.515 ng·µg-1, 回收率为92.3%;类似物C3为1.868 ng·µg-1, 回收率为102.0%。各样品宿主DNA残留/剂量 < 10 ng, 符合国家食品药品监督管理局标准。结果表明, 采用磁珠提取纯化与Q-PCR相结合的方式可将检测限达到fg水平, 并且样本回收率均在70%~120%内, 该方法能够提高检测灵敏度, 适用于GLP-1类似物宿主残留DNA的测定。
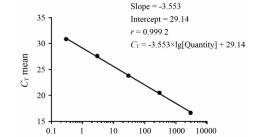
|
Figure 4 Detection of the E.coli host residual DNA of GLP-1 analogues. Regression curve of real-time fluorescence PCR of positive DNA standard substance is shown. n = 3, |
GLP-1类似物在促进胰岛素分泌和降低血糖与血脂的同时, 还具有改善内皮细胞功能、降低动脉粥样硬化风险、缓解糖尿病肾病的发生发展和改善认知功能等作用[21]。良好的降糖效果及控制糖尿病并发症等优势使GLP-1类似物在临床应用上具有巨大前景。
尽管传统的动物模型能够更加准确地评估GLP-1类似物在体内的活性, 但常规采用的db/db鼠模型由于给药周期长、价格昂贵和受造模影响较大等因素使之并不适合作为GLP-1类似物活性检测的常规手段[22]。细胞模型主要包括以肝细胞和外周组织为主的胰岛素抵抗模型以及以原代胰岛细胞和胰岛细胞系为主的胰岛细胞模型[23]。这类细胞模型主要针对如甘精胰岛素、地特胰岛素等胰岛素类药物, 对GLP-1类似物的专属性不及GLP-1R表达的细胞。本研究基于GLP-1R-GFP-HEK293A稳转细胞株, 利用HTRF技术检测细胞内cAMP含量, 进而直观反映GLP-1类似物的降糖效果。实验结果表明GLP-1类似物样品在较低浓度下均能促进GLP释放cAMP的生物活性, 其中利拉鲁肽原研制剂EC50为5.087 nmol·L-1, 各样品EC50值变异系数在4.36%~7.62%之间。本研究所采用的HTRF检测方法为高通量筛选GLP-1类似物以及GLP-1类似物的体外活性评价提供了稳定可靠的新途径。
在质量控制方面, 聚丙烯酰胺凝胶电泳早期用于检测生物制品中是否含有HCP污染, 但该方法检测灵敏度较低, 主要用于限量分析而达不到质控要求。目前ELISA、毛细管电泳、高效液相色谱和傅立叶转化红外光谱等技术对HCP的检测已逐渐成熟[24]。针对特定表达宿主的商品化HCP检测试剂盒在经过产品性能评估和优化后也不断问世, 检测试剂盒以高灵敏度、高专属性、高通量和结果稳定可靠等优势被广泛应用。本研究采用大肠杆菌HCP检测试剂盒对大肠杆菌宿主残留蛋白进行测定, 该试剂盒利用ELISA原理将待测的GLP-1类似物样品作为抗原包被于2个抗体之间, 经表达宿主作为内部标准品进行标定后计算出HCP含量。该检测方法特异性高, 操作简便, 通量高, 抗原无需事先纯化, 结果稳定可靠, 为GLP-1类似物的HCP检测提供了参考。
《中国药典》采用探针杂交法对生物制品中外源性DNA残留量进行检测[18], 但该方法在种属特异性、实验周期和样品需求等方面还存在不足。对于生物制品中残留的微量DNA, 需要开发一种操作简便、灵敏度高、种属特异性强的检测方法以确保其质量及安全性。本研究将DNA前处理技术与PCR绝对定量方法相结合用于宿主残留DNA的定量检测, 使最低检测限达到fg水平, 提高了GLP-1类似物外源性DNA检测的灵敏度。
综上所述, 本研究以利拉鲁肽作为GLP-1类似物的代表, 系统性地建立了GLP-1类似物的体外生物活性检测方法, 并且对大肠杆菌宿主残留蛋白和残留DNA建立了含量检测方法, 为GLP-1受体激动剂或GLP-1类似物的研发奠定了基础。
作者贡献: 郑志华作为该实验的直接参与人, 负责该实验的设计、实施、数据分析和文章撰写等工作; 陈倩倩和顾倩倩对本实验提供技术支持, 审阅原稿并对文章的知识性内容作批评性审阅; 刘培庆和李民作为基金项目的主要负责人对本实验提供指导意见与支持性贡献。所有作者均阅读并批准了最后的手稿。
利益冲突: 本文章不存在任何的利益冲突。
| [1] |
Zheng YC. Preparation and the biological effect of fusion protein GLP-1-exendin-4/IgG4(Fc) fusion protein as long acting GLP-1 receptor agonist[J]. Acta Pharm Sin (药学学报), 2015, 50: 1668-1672. |
| [2] |
Graaf Cd, Donnelly D, Wootten D, et al. Glucagon-like peptide-1 and its class B G protein-coupled receptors:a long march to therapeutic successes[J]. Pharmacol Rev, 2016, 68: 954-1013. DOI:10.1124/pr.115.011395 |
| [3] |
Ahrén B. Glucagon-like peptide-1 receptor agonists for type 2 diabetes:a rational drug development[J]. J Diabetes Investig, 2019, 10: 196-201. DOI:10.1111/jdi.12911 |
| [4] |
Guo ZR. Research and development of the blood glucose control drugs liraglutide and exenatide[J]. Acta Pharm Sin (药学学报), 2019, 54: 1706-1710. |
| [5] |
Kornelius E, Li HH, Peng CH, et al. Liraglutide protects against glucolipotoxicity-induced RIN-m5F β-cell apoptosis through restoration of PDX1 expression[J]. J Cell Mol Med, 2019, 23: 619-629. DOI:10.1111/jcmm.13967 |
| [6] |
Green AD, Vasu S, Moffett RC, et al. Co-culture of clonal beta cells with GLP-1 and glucagon-secreting cell line impacts on beta cell insulin secretion, proliferation and susceptibility to cytotoxins[J]. Biochimie, 2016, 125: 119-125. DOI:10.1016/j.biochi.2016.03.007 |
| [7] |
Geng Y, Ren YL, Xu ZH, et al. An improved method to measure bioactivity of the fusion protein GGH based on the intracellular cAMP level[J]. China Biotechnol (中国生物工程杂志), 2013, 33: 63-67. |
| [8] |
Li ST, Zheng XP, Yang XM, et al. Development and evaluation of a cell model targeted on GLP-1 receptor[J]. Chin Pharmacol Bull (中国药理学通报), 2017, 33: 285-289. |
| [9] |
Brown JT, Kant A, Mailman RB. Rapid, semi-automated, and inexpensive radioimmunoassay of cAMP:application in GPCR-mediated adenylate cyclase assays[J]. J Neurosci Methods, 2009, 177: 261-266. DOI:10.1016/j.jneumeth.2008.10.016 |
| [10] |
Li SY, Li J, Cao GL, et al. Effect of glucagon on insulin secretion through cAMP signaling pathway in MIN6 cells[J]. Int J Clin Exp Pathol, 2015, 8: 5974-5980. |
| [11] |
Chen J, Bai G, Yang Y, et al. Identifying glucagon-like peptide-1 mimetics using a novel functional reporter gene high-throughput screening assay[J]. Peptides, 2007, 28: 928-934. DOI:10.1016/j.peptides.2006.12.012 |
| [12] |
Li J, Xie X. High-throughput screening assays for G-protein-coupled receptors-targeted drug discovery[J]. J Int Pharm Res (国际药学研究杂志), 2012, 39: 353-357. |
| [13] |
Heuninck J, Hounsou C, Dupuis E, et al. Time-resolved FRET-based assays to characterize G protein-coupled receptor hetero-oligomer pharmacology[J]. Methods Mol Biol, 2019, 1947: 151-168. |
| [14] |
Ji JZ, Lao KJ, Hu J, et al. Discovery of novel aromatase inhibitors using a homogeneous time-resolved fluorescence assay[J]. Acta Pharmacol Sin, 2014, 35: 1082-1092. DOI:10.1038/aps.2014.53 |
| [15] |
Yang D, de Graaf C, Yang L, et al. Structural determinants of binding the seven-transmembrane domain of the glucagon-like peptide-1 receptor (GLP-1R)[J]. J Biol Chem, 2016, 291: 12991-13004. DOI:10.1074/jbc.M116.721977 |
| [16] |
Cui XL, Zhu T, Ying WT. Research progress on host cell proteins of genetically engineered pharmaceuticals[J]. Chin J Pharm Anal (药物分析杂志), 2019, 39: 1533-1541. |
| [17] |
André M, Reghin S, Boussard E, et al. Universal real-time PCR assay for quantitation and size evaluation of residual cell DNA in human viral vaccines[J]. Biologicals, 2016, 44: 139-149. DOI:10.1016/j.biologicals.2016.03.002 |
| [18] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China中华人民共和国药典:三部)[M]. Beijing: China Medical Science Press, 2015: General 2-3.
|
| [19] |
Deller MC, Kong L, Rupp B. Protein stability:a crystallographer's perspective[J]. Acta Crystallogr F Struct Biol Commun, 2016, 72: 72-95. DOI:10.1107/S2053230X15024619 |
| [20] |
Gault VA, Kerr BD, Harriott P, et al. Administration of an acylated GLP-1 and GIP preparation provides added beneficial glucose-lowering and insulinotropic actions over single incretins in mice with type 2 diabetes and obesity[J]. Clin Sci (Lond), 2011, 121: 107-117. DOI:10.1042/CS20110006 |
| [21] |
Zhao X, Liu G, Shen H, et al. Liraglutide inhibits autophagy and apoptosis induced by high glucose through GLP-1R in renal tubular epithelial cells[J]. Int J Mol Med, 2015, 35: 684-692. DOI:10.3892/ijmm.2014.2052 |
| [22] |
Wang Y, Dilidaxi D, Wu Y, et al. Composite probiotics alleviate type 2 diabetes by regulating intestinal microbiota and inducing GLP-1 secretion in db/db mice[J]. Biomed Pharmacother, 2020, 125: 109914. DOI:10.1016/j.biopha.2020.109914 |
| [23] |
Damania A, Jain E, Kumar A. Advancements in in vitro hepatic models:application for drug screening and therapeutics[J]. Hepatol Int, 2014, 8: 23-38. DOI:10.1007/s12072-013-9490-8 |
| [24] |
Capito F, Skudas R, Kolmar H, et al. Host cell protein quantification by Fourier transform mid infrared spectroscopy (FT-MIR)[J]. Biotechnol Bioeng, 2013, 110: 252-259. DOI:10.1002/bit.24611 |
 2020, Vol. 55
2020, Vol. 55


