2. 广东药科大学, 中药学院, 广东 广州 510006;
3. 广州市香雪制药股份有限公司, 广东 广州 510663
2. Department of Traditional Chinese Medicine, Guangdong Pharmaceutical University, Guangzhou 510006, China;
3. Guangzhou Xiangxue Pharmaceutical Co., Ltd., Guangzhou 510663, China
呼吸系统疾病是一种常见病、多发病, 其主要包括感冒、哮喘病、气管炎、支气管炎、慢性阻塞性肺疾病及肺心病等。不可忽视的是, 随着社会人口老龄化、大气环境污染恶化及各种新型微生物、细菌、病毒的出现, 这类疾病的发病率与死亡率呈上升趋势。
我国传统中医根据呼吸系统疾病的临床表现将其归为“咳嗽”和“喘证”[1]。肺失宣降, 肺气上逆导致咳, 气机失常表现喘; 而脾为肺之母, 久病不愈, 子盗母气, 脾虚生痰, 痰饮在内, 阻滞气机; 咳、喘、痰三证交杂, 致内本不固, 正气不足之脾肺两虚, 又让外邪更易入侵, 最终形成“咳嗽”和“喘证”。中药方剂是目前中医临床治疗呼吸系统疾病的首选方式, 如何科学地阐明临床有效经典方剂其可能的药效物质基础、作用机制及配伍规律, 始终是中药复方研究的瓶颈。网络药理学作为目前药理学研究领域的新方法, 通过运用各大数据库进行药物与疾病相关靶点信息的搜集、预测与筛选, 进行分子对接, 构建药物-靶点-疾病相互作用网络, 进行靶标基因富集分析, 可从分子机制方面揭示复方组分在疾病预防或治疗方面发挥效用的途径, 阐明中药复方多成分、多靶点、多途径的治疗特点[2], 是研究中药复杂体系行之有效的方法。
古代医家讲究理气以化痰, 痰化则咳止喘平, 而中成药橘红痰咳液的用药配伍基本符合这一治则。橘红痰咳液以宋代经方《太平惠民和剂局方》中“二陈汤”为基础, 重用南药“化橘红”为君药, 行气除满、燥湿化痰、健脾和中, 气顺痰消则咳喘平; 制半夏可治湿痰咳喘, 白前长于降气化痰, 二者辅为臣; 佐以茯苓健脾祛湿, 蜜百部润肺止咳, 苦杏仁止咳定喘, 五味子敛肺气, 止咳喘; 甘草既可止咳化痰, 又能补脾养肺, 调和诸药。8味中药精制而成的橘红痰咳液是温化寒痰的代表方剂, 其理气化痰、润肺止咳之效可适用于各种具有咳、喘、痰症状的呼吸系统疾病的治疗, 包括急性气管支气管炎、慢性支气管炎和咽喉炎等[3, 4]。
橘红痰咳液作为临床常用方剂, 其在止咳、平喘、化痰等方面的功效已十分明确[3], 但对于该方发挥治疗作用可能的药效物质基础、分子机制及配伍规律仍不明确。故本研究通过搜集组方中药物目标化学成分的潜在靶点, 与相应病症靶点进行映射, 结合传统功效将全方分为止咳、平喘和化痰3个组分, 运用网络药理学的方法对其药效物质基础与作用分子机制进行分析, 探究其配伍作用规律。
材料与方法数据库与分析软件 TCMSP (Traditional Chinese Medicine Systems Pharmacology Database and Analysis Platform)数据库(http://tcmspw.com/tcmsp.php)、TCMID (Traditional Chinese Medicines Integrated Database)数据库(http://119.3.41.228:8000/tcmid/search/ )、TTD (Therapeutic Target Database)数据库(http://db.idrblab.net/ttd/ )、DrugBank数据库(https://www.drugbank.ca/ )、DisGeNET数据库(http://www.disgenet.org/ )、UniProt数据库(http://www.uniprot.org/ )、PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/ )、SwissTargetPrediction数据库(http://www.swisstargetprediction.ch/ )、DAVID (David Functional Annotation Bioinformatics Microarray Analysis)数据库(https://david.ncifcrf.gov/ )、CNKI数据库(https://www.cnki.net/ )、Web of Science数据库(http://apps.webofknowledge.com/ )、RCSB数据库(http://www.rcsb.org/ )、Open Babel软件、SYBYL-X 2.0软件、Cytoscape 3.2.1软件。
目标化合物的选取 结合TCMSP、TCMID两大中药化学成分数据库收录的橘红痰咳液中8味药的化学成分, 并参考以下条件: ①该中药在《中华人民共和国药典》 (2015年版)中规定的质量标志物; ②通过CNKI文献数据库与Web of Science文献数据库搜索得到的该味药中目前已被研究发现具有明确药理活性或在药物中含量较高的有效成分, 共选取出24个目标化合物, 其中包括化橘红中的4个成分(野漆树苷、芹菜素、柚皮苷和水合橙皮内酯); 白前中的3个成分(海粟苷元A、白前苷元C和β-谷甾醇); 茯苓中的2个成分(茯苓酸和去氢土莫酸); 苦杏仁中的3个成分(苦杏仁苷、亚油酸和亚麻酸); 五味子中的3个成分(五味子甲素、五味子丙素和五味子醇甲); 制百部中的3个成分(新对叶百部碱、新斯替宁碱和对叶百部碱H); 制半夏中的3个成分(L-麻黄碱、琥珀酸和鸟苷); 甘草中的3个成分(甘草酸、甘草次酸和甘草素)。
目标化合物与对应病症靶点的搜集 将橘红痰咳液中8味药的24个目标化合物输入PubChem数据库, 以“active”和“human”作为搜索条件搜集其作用于人体的已知基因靶点; 再将化合物结构导入SwissTargetPrediction数据库中进行潜在作用靶点的预测, 选取前15个具有结合可能性(probability)的靶点, 整合得到该化合物的作用靶点集合。
将咳嗽病症搜索关键词“cough”、“chronic cough”与哮喘病症搜索关键词“asthma”、“bronchial asthma”等相应病症检索条件输入TTD、DrugBank以及DisGeNET三大疾病数据库进行相关疾病靶点的搜集, 得到“咳”证靶点与“喘”证靶点。
因为西医范畴中无“痰”疾病, 故无法在TTD与DisGeNET等数据库中查找到相应的靶点。所以本文首先通过DrugBank数据库搜集临床广泛使用的西药祛痰药, 选取在该数据库中收录有靶点的全部祛痰药[愈创木酚甘油醚、安息香酊、乙酰半胱氨酸、N-乙酰半胱氨酸、羧甲司坦、胆碱水杨酸酯、切诺(桉柠蒎肠溶软胶囊)和磺啶新林胶囊], 搜集其作用靶点; 同时通过CNKI数据库与Web of Science数据库查阅文献发现“痰”与“气道黏液高分泌”存在着极为紧密的联系, 在文献中对其发病机制靶点进行搜集, 首次整合得到“痰”证靶点, 作为本文的疾病相关靶点。
搜集得到中药目标化合物靶点集合与病症靶点集合之后, 将二者进行映射, 得到每味药中各化合物与相应病症映射的自由度; 参考靶点映射后每味药的总度值大小, 以其传统药效为基础, 对中药进行功效分组。
目标化合物作用生物过程与生物通路分析 将各分组中所有药物的靶点集合与该组对应治疗病症的靶点集合进行映射, 得到该功效组的“组映射靶点”。将“组映射靶点”导入DAVID 6.8数据库(https://david.ncifcrf.gov/), 进行基因本体(GO)分析, 探讨药物作用的生物学过程; 进行京都基因与基因组百科全书(KEGG)分析, 探讨药物作用的生物通路。最后以P < 0.05为具有显著性进行数据筛选, 通过对数据库分析并结合文献查找等手段, 筛选出中药的主要有效成分及药物作用于疾病的潜在靶点与通路; 将分析结果导入Cytoscape 3.2.1软件绘制各功效组治疗对应病症的机制网络图[5]。
分子对接验证 各组根据拓扑参数分析结果, 在关键靶点中挑选2种不同类型的靶点, 选择该靶点在方中所对应的化合物及临床广泛使用的西药化合物进行计算机模拟分子对接。利用RCSB数据库搜索靶点蛋白结构模型并保存为“PDB”格式文件, 同时在PubChem数据库中搜索下载对应的中药与西药小分子化合物3D结构, 将结构模型保存为“PDB”格式, 并使用Open Babel软件转格式为“mol2”文件; 将蛋白结构与小分子化合物结构一同导入SYBYL-X 2.0软件中进行分子对接分析, 整理分析所得的Score评分, 用以评价小分子化合物与蛋白靶点之间的结合活性。
结果 1 目标化合物潜在作用靶点与疾病靶点搜集情况通过搜索PubChem数据库得到24个目标化合物的PubChem-Compound CID (表 1)。通过对PubChem、DrugBank及SwissTargetPrediction三大数据库进行搜集与筛选, 化橘红中的4种成分共获得143个潜在作用靶点, 制半夏中的3种成分共得到119个潜在作用靶点, 白前中的3种成分共得到62个潜在作用靶点, 苦杏仁中的3种成分共得到103个潜在作用靶点, 五味子中的3种成分共得到97个潜在作用靶点, 制百部中的3种成分共得到54个潜在作用靶点, 茯苓中的2种成分共得到47个潜在作用靶点, 甘草中的3种成分共得到93个潜在作用靶点。另外, 通过对TTD、DrugBank以及DisGeNet等数据库进行疾病靶点搜索, 共得到130个与“咳嗽”相关的靶点信息, 131个与“哮喘”相关的靶点信息, 以及31个与“痰症”相关的靶点信息。
| Table 1 PubChem-Compound CID of 24 compounds in 8 Chinese herbs. HJH: Huajuhong; ZBX: Zhibanxia; BQ: Baiqian; KXR: Kuxingren; WWZ: Wuweizi; ZBB: Zhibaibu; FL: Fuling; GC: Gancao |
8味中药的目标化合物与病症靶点映射后, 将中药与病症靶点映射的总自由度称为该药的“功效自由度” (图 1), 结合每味中药的功效自由度值作为参考, 以其传统药效为基础, 将8味中药进行功效分组, 分别得到:止咳组(化橘红、制半夏、白前、五味子、苦杏仁、制百部、甘草), 平喘组(化橘红、制半夏、白前、五味子、苦杏仁), 化痰组(化橘红、制半夏、白前、茯苓、甘草)。
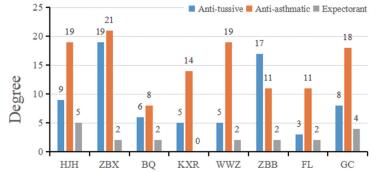
|
Figure 1 Degrees of freedom of Chinese herb in Ju-Hong Tan-Ke liquid in different functions |
止咳组七味药(化橘红、半夏、白前、五味子、苦杏仁、制百部、甘草)中21个目标化合物的潜在作用靶点与“咳嗽”的130个病症靶点映射对接后, 共得到包括表皮生长因子受体(EGFR)、μ阿片受体基因(OPRM1)、乙酰胆碱酯酶(ACHE)及毒蕈碱型胆碱受体M2 (CHRM2)等33个“止咳组映射靶点”。
自由度(degree of freedom)是指在分子网络中每个单元与其他单元连接数量的大小, 度值越大, 表明该单元与网络中越多的单元具有连接关系, 在该网络中越重要。通过拓扑参数分析筛选, 得到在止咳作用中自由度前五的关键靶点为毒蕈碱型胆碱受体M1 (CHRM1)、CHRM2、毒蕈碱型胆碱受体M3 (CHRM3)、ACHE和β2肾上腺素能受体(ADRB2)。KEGG分析可以对蛋白靶点交互(互动)网络在各种细胞活动中起的作用做出预测, 找出关键蛋白靶点及其所在的作用通路。KEGG通路富集分析得到神经活性配体-受体相互作用(neuroactive ligand-receptor interaction)、胆碱能突触(cholinergic synapse)及钙离子信号通路(calcium signaling pathway)等6条重要信号通路, 通路显著性富集情况如图 2。GO分析可通过富集得到蛋白靶点作用的生物学过程(BP)。GO分析提示止咳功效组的BP显著富集在与神经信号传导和炎症反应等方面相关的97个生物过程中。止咳组治疗咳嗽的作用机制网络如图 3。
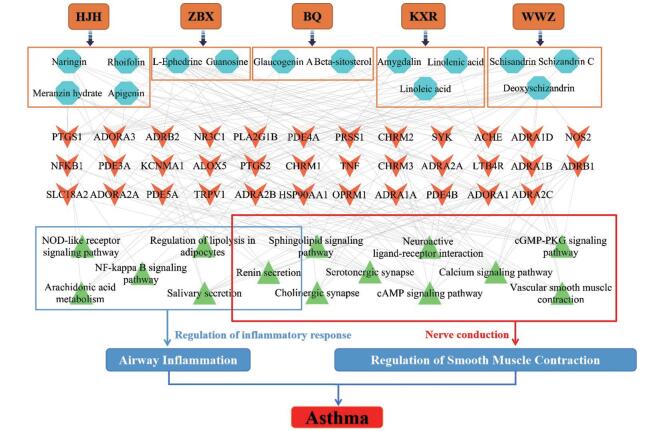
4 平喘组作用机制分析平喘组五味药(化橘红、制半夏、白前、五味子、苦杏仁)中16个目标化合物的潜在作用靶点与“哮喘”的131个病症靶点进行映射对接后, 得到了包括钙激活钾通道亚基α-1 (KCNMA1)、ADRB2、CHRM1以及前列腺素内过氧化物合酶2 (PTGS2)等在内的43个“平喘组映射靶点”。
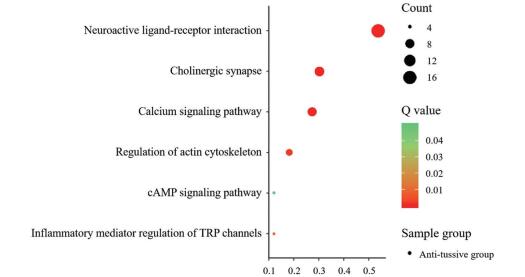
|
Figure 2 KEGG pathway enrichment of predicted targets of anti-tussive group in relieving cough |
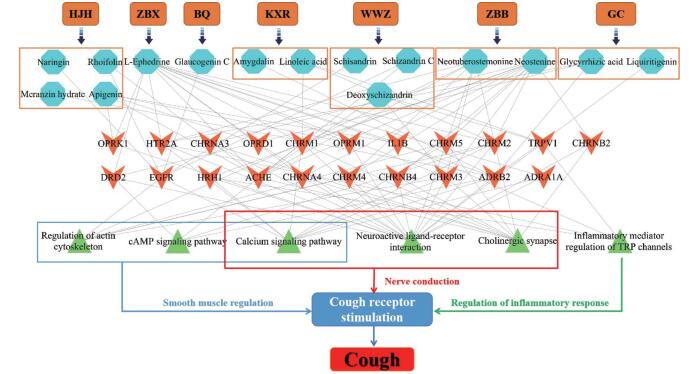
|
Figure 3 Action mechanism network of compounds in anti-tussive group. Orange rectangle represent TCM, ultramarine nodes represent compounds, orange nodes represent targets, green nodes represent pathways, arrows represent modes of regulation, blue rectangle represents responses regulation, and red rectangle represents disease |
拓扑参数分析得到自由度排名前五的关键靶点为PTGS2、前列腺素内过氧化物合酶1 (PTGS1)、腺苷受体A1 (ADORA1)、ADRB2和β1肾上腺素能受体(ADRB1)。KEGG通路富集分析得到环磷酸鸟苷-蛋白激酶G信号通路(cGMP-PKG signaling pathway)、唾液分泌(salivary secretion)、脂肪细胞脂解的调节(regulation of lipolysis in adipocytes)及花生四烯酸代谢(arachidonic acid metabolism)等14条重要的生物信号通路, 生物通路显著性富集情况见图 4。GO分析提示平喘组通过作用于神经信号传导、平滑肌收缩调节及炎症反应调控等78个生物过程来调控哮喘反应。平喘组的作用机制网络如图 5。
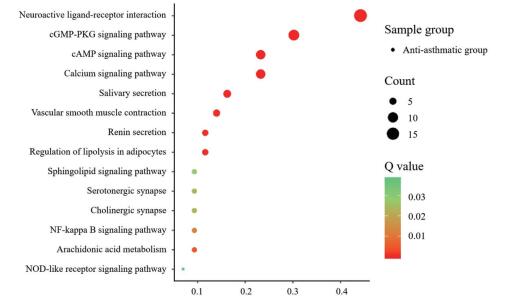
|
Figure 4 KEGG pathway enrichment of predicted targets of anti-asthmatic group in relieving asthma |
|
Figure 5 Action mechanism network of compounds in anti-asthmatic group. Orange rectangles represent TCM, ultramarine nodes represent compounds, orange nodes represent targets, green nodes represent pathways, arrows represent modes of regulation, blue rectangles represent responses regulation, and red rectangle represents disease |
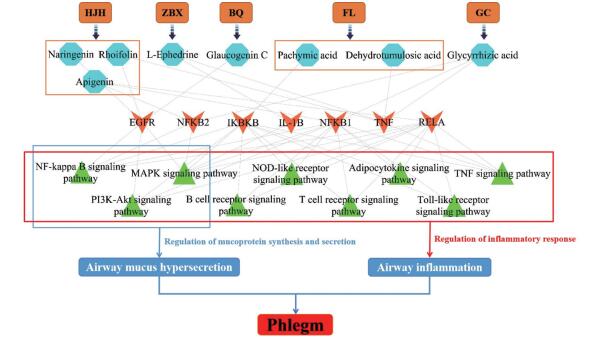
化痰组五味药(化橘红、制半夏、白前、茯苓、甘草)中15个目标化合物的潜在作用靶点与“痰”的31个病症靶点进行映射对接, 共得到包括肝脏羧酸酯酶1 (CES1)、核转录因子P105 (NFKB1)、转录因子P65 (RELA)、ACHE及核转录因子激酶亚单位抑制剂(IKBKB)在内的10个“化痰组映射靶点”。
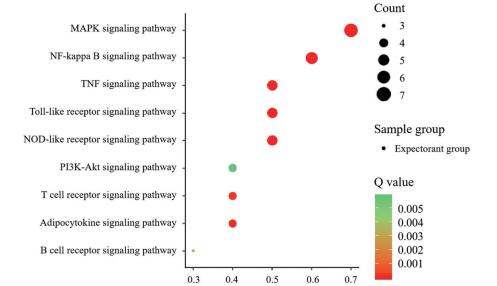
拓扑参数分析得出EGFR、肿瘤细胞坏死因子(TNF)为化痰组中的关键靶点。KEGG分析发现化痰组主要作用于核转录因子-κB信号通路(NF-kappa B signaling pathway)、丝裂原活化蛋白激酶信号通路(MAPK signaling pathway)、磷酸化磷酯酰肌醇3激酶-丝/苏氨酸激酶信号转导通路(PI3K-Akt signaling pathway)等9条与炎症反应密切相关的生物信号通路, 生物通路显著性富集情况见图 6。GO分析显示化痰组靶点在包括炎症表达和RNA转录在内的24条生物过程中起作用。基于KEGG分析与GO分析并结合文献查阅[6-8]得到的化痰组作用机制网络如图 7。
|
Figure 6 KEGG pathway enrichment of predicted targets of expectoran group in eliminating phlegm |
|
Figure 7 Action mechanism network of compounds in expectoran group. Orange rectangles represent TCM, ultramarine nodes represent compounds, orange nodes represent targets, green nodes represent pathways, arrows represent modes of regulation, blue rectangles represent responses regulation, and red rectangle represents disease |
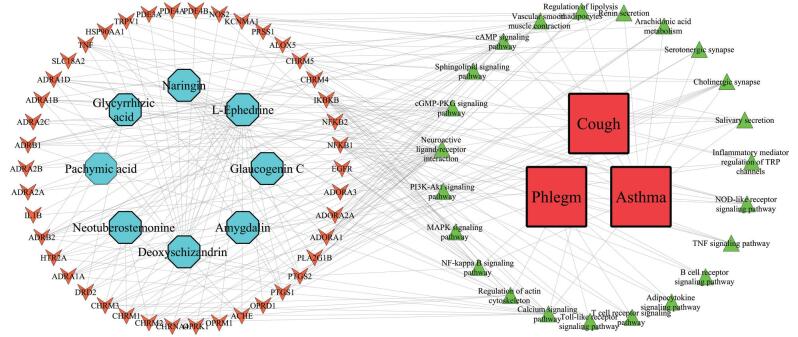
通过文献查阅, 筛选橘红痰咳液8味药中已被大量实验证明药理作用较强的活性成分, 或是《中国药典》中收录的中药指标性成分, 结合网络药理学手段的佐证分析, 得到8个最主要活性成分(柚皮苷、L-麻黄碱、白前苷元C、苦杏仁苷、五味子甲素、新对叶百部碱、茯苓酸和甘草酸)。其中化橘红中的柚皮苷、苦杏仁中的苦杏仁苷、甘草中的甘草酸及制百部中的新对叶百部碱, 通过文献总结发现其在对应的主治功效方面具有较强的药理作用, 是药物中发挥药效的主要活性成分, 且前三者为药典规定的指标性成分, 具有代表性意义; 制半夏中的L-麻黄碱与五味子中的五味子甲素通过网络药理学研究均发现其对应靶点数量最多, 总自由度最大, 推测应当为该中药内同类型化合物总提物中的主要起效成分; 目前国内外对于白前的研究较少, 通过拓扑分析发现白前苷元C在止咳、平喘、化痰3个功效上都有映射靶点, 推测其可能为主要活性物质; 茯苓酸为茯苓中主要化学成分三萜类化合物的指标性物质, 且在3个功效尤其是化痰功效上具有映射靶点, 能够体现茯苓利水渗湿的药理作用, 推测其为主要活性物质。这8个主要活性成分通过调控42个关键蛋白靶点, 作用于24条信号通路, 在组方通过止咳、平喘、化痰功效治疗呼吸系统疾病时发挥主要作用(图 8)。
|
Figure 8 Function characteristics of essential active components in JHTK liquid. Ultramarine nodes represent compounds, orange nodes represent targets, green nodes represent pathways, and red nodes represent diseases |
在每个功效分组前五位关键靶点中挑选两个不同类型的靶点, 平喘组与化痰组选择一个炎症靶点与一个非炎症靶点, 止咳组选择一个毒蕈碱型胆碱受体(CHRM)家族的靶点与一个非该家族的靶点, 与其在方中对应的化学成分进行分子对接, 并在DrugBank数据库中查找目前临床广泛使用的西药作为比较分析, 分析结果见表 2。总分数(total score)值代表靶点蛋白与小分子化合物的结合活性, 当分值≥4.25, 说明分子与靶点具有一定的结合活性; 得分>5.0, 说明有较好的结合活性。从对接结果可以看出, 方中大部分的化合物与其对应靶点蛋白都具有一定的结合活性, 但普遍分值与阳性药分值相比仍存在一定的差距。由此可以推断, 与西药单一靶点发挥作用不同的是, 橘红痰咳液复方主要通过不同中药化合物作用于多个靶点, 从不同的途径协同交叉发挥治疗作用, 这也正为中药复杂体系发挥其药效的作用特点。
| Table 2 Docking results of partial pivotal targets with active compounds and positive drugs |
呼吸系统疾病是中老年群体中的高发性疾病, 发病表现多为咳、喘、痰三证交杂, 临床上使用中药方剂进行辨证治疗取得了良好的效果。橘红痰咳液是经方“二陈汤”的衍生方, 现代药理研究及临床治疗均已被证明适用于多种临床表现出咳嗽、喘息、痰多等症状的疾病治疗中, 且疗效显著。通过网络药理学研究发现, 橘红痰咳液发挥止咳、平喘、化痰功效可能的药效物质基础及其分子机制, 剖析了全方的配伍作用规律, 并探讨了该方进一步二次开发的潜在可能性。
通过运用网络药理学的方法, 本研究对橘红痰咳液的主要药效物质基础进行了研究。柚皮苷(naringin)是化橘红起止咳化痰作用的主要活性成分, 其代谢产物为其苷元柚皮素(naringenin), 具有抗炎、抗氧化、抗肿瘤和抑制增殖等特性。据文献[9, 10]报道, 柚皮素可通过调控氧化应激及炎症反应等途径来抑制支气管上皮(NHBE)受损所引起的呼吸系统疾病。Yang等[6, 11]发现柚皮素可通过抑制活性氧(ROS)的生成与EGFR的表达来影响下游靶标MAPK与PI3K-Akt的表达, 抑制下游效应器NF-κB转录合成MUC5AC黏蛋白, 减轻气道黏液高分泌症状, 发挥化痰作用。L-麻黄碱(L-ephedrine)是制半夏总生物碱中的代表性成分; Du等[7, 8]将其用于治疗具有黏液高分泌与气道炎症的慢性阻塞性肺病(chronic obstructive pulmonary disease, COPD)患者时, 发现患者肺泡灌洗液中TNF、IL-1β和IL-18等炎性因子水平明显下降, 表明此成分可通过抗炎作用对呼吸系统疾病有较好的辅助治疗效果。白前长于降气, 在止嗽散等诸多经典名方中皆为要药, 白前苷元C (glaucogenin C)被发现为芫花白前皂苷元中的主要成分, 且网络药理学分析得到其在止咳、平喘、化痰病症中皆有对应靶点, 推测其可能为白前中主要起效的活性成分[12]。苦杏仁苷(amygdalin)是止咳平喘药苦杏仁中的主要成分; 郑晓辉等[13]通过筛选发现苦杏仁苷可以通过结合β2-肾上腺素受体发挥止咳平喘功效。五味子具有敛肺止咳的功效; 刘杰等[14]发现五味子中的五味子甲素(deoxyschizandrin)等木脂素类成分可以通过发挥抗炎和抗氧化等功效对呼吸道起到保护作用。百部中含有的生物碱是其发挥润肺止咳功效的物质基础; Chung等[15]进行的豚鼠咳嗽模型实验证明, 新对叶百部碱(neotuberostemonine)单体的镇咳作用最强。茯苓可健脾渗湿, 其中的茯苓酸(pachymic acid)有助于利水消肿, 祛湿化痰, 减轻气道黏液分泌量[16]。甘草调和诸药, 被称为“国老”, 而其本身也具有止咳化痰的功效; Zhao等[17]发现甘草酸(glycyrrhizic acid)能抑制ALI大鼠体内的炎症、氧化和凋亡反应, 对疾病状态下的呼吸系统起到保护作用。
目前橘红痰咳液在《中国药典》中规定的质量检测标准仅以化橘红中的柚皮苷为质量标志物, 单一成分的检测并不能起到控制复方质量的作用。本研究分析得出以上8种目标化合物可能为该方主要活性成分, 可与柚皮苷一起作为橘红痰咳液的质量标志物, 进而有效地提升该复方的质量控制标准, 更好地为产品质量把关。
在人体咽喉部与气管等位置分布着大量高敏感性的咳嗽感受器, 当呼吸道黏膜受到异物或呼吸道内分泌物刺激时, 就会通过一系列神经反射产生咳嗽反应, 意图排出呼吸道内分泌物。有害气体的吸入、病原微生物的入侵、气道炎症产生的炎性因子及气道平滑肌收缩等一系列机械或化学刺激皆可作为诱因, 使感受器在机体受到刺激后将信号传导到咳嗽中枢, 诱发咳嗽反射[18, 19]。通过网络药理学分析发现, 橘红痰咳液中止咳组药物可通过作用于咳嗽反应相关通路上的关键靶点发挥作用。CHRM简称M型受体, 其许多基因靶点广泛存在于神经活性配体-受体相互作用信号通路、钙离子信号通路等止咳组发挥作用的重要信号通路上。止咳组药物(制半夏、苦杏仁以及制百部)可通过调控神经活性配体-受体相互作用信号通路来抑制气道神经神经节上CHRM1对咳嗽反射信号的传导, 达到止咳的效果[20]。同时, 止咳组中药(制半夏、白前、苦杏仁、五味子与制百部)可通过钙离子信号通路抑制分布在人支气管平滑肌上CHRM2和CHRM3的活化, 并调控气道平滑肌上的Ca2+浓度, 抑制平滑肌收缩, 减轻该反应对咳嗽感受器的刺激, 发挥止咳作用[21, 22]。另外, 钙离子信号通路中的Ca2+能够直接与离子通道结合并调节其活性, 作为第二信使参与其他与咳喘反应有关的信号通路作用过程, 充分体现了各通路之间交互协同作用的特点。ACHE是一种存在于胆碱能突触间的生物神经传导过程中的关键酶, 止咳组药物(化橘红、制半夏、白前、五味子、制百部)可通过激活位于胆碱能突触通路上的ACHE靶点来抑制M受体兴奋, 减轻支气管平滑肌收缩引发的咳喘反应[23, 24]。
呼吸道疾病的“喘”症以支气管哮喘为典型, 其发生主要与过敏性气道炎症和气道神经反应有关[25]。过敏原免疫球蛋白E (IgE)存在于人体呼吸道组织黏膜中, 一定数量的尘螨、病毒、污染物等过敏原暴露后, 会刺激IgE抗体产生, 促发Ⅰ型变态反应; 而IgE高亲和力受体“FcεRI”表达于多种免疫细胞(肥大细胞、B细胞、嗜酸性粒细胞等)的表面, 大量分泌的IgE可通过激活炎症细胞促发过敏性炎症级联反应, 导致气道平滑肌收缩与黏液分泌。同时, 气道平滑肌的运动又受到肾上腺素能神经、胆碱能神经等的共同支配, 当胆碱能神经活性增强, M受体兴奋而ADRB2功能减弱时, 都会引起支气管平滑肌强收缩与黏膜腺体的分泌, 从而引发哮喘。通过网络药理学分析发现, 平喘组药物可与哮喘反应相关通路上的关键靶点结合发挥作用。Chan等[26]通过研究发现, PTGS2的基因多态性与哮喘这一类过敏性反应的炎症产生有着密切的联系, PTGS2基因编码的环氧合酶(COX)可以介导花生四烯酸代谢途径产生各种前列腺素类物质; 同时, PTGS2基因在肥胖人群中的表达明显升高[27], 肥胖型哮喘患者的代谢性炎症标志物显著增加[28], 这些变化与哮喘过程中的气道重塑反应息息相关; 而平喘组中的全部5味中药均可通过分解脂肪细胞与调控花生四烯酸代谢途径达到减轻哮喘反应的效果。ADRB2基因靶点存在于cGMP-PKG信号通路、唾液分泌等多条平喘组发挥作用的重要通路上, 苦杏仁苷等活性成分能够激活β2-肾上腺素能受体, 扩张支气管从而发挥治疗哮喘的作用[13, 29]。在人肺与平滑肌上存在着cGMP的主要蛋白激酶G (PKG), 平喘组药物(化橘红、制半夏、五味子与苦杏仁)可能通过cGMP-PKG信号通路调节气道壁血管平滑肌的收缩与舒张, 扩张气道, 减轻哮喘症状[30]。唾液中富含的免疫细胞与IgE等因子在病理状态下会加剧过敏性炎症反应, 平喘组中药(化橘红、制半夏、五味子以及苦杏仁)可通过调控哮喘患者的唾液分泌过程来减轻过敏反应, 减少呼吸道黏膜损伤, 起到平喘的作用[31]。
“痰”在中国传统中医范畴中分为“有形之痰”与“无形之痰”, 若气机失调, 痰饮则生。现代医学中的痰多偏向于有形之痰, 与呼吸系统疾病中的气道黏液有着极为相似之处。气道黏液高分泌(airway mucus hypersecretion)是一些慢性炎症类气道疾病的主要表现, 当人体出现感染或炎症的时候, 过多的中性粒细胞在病灶处聚集并释放中性粒细胞弹性蛋白酶(NE), 它不仅可以导致杯状细胞增生, 还可以促进黏蛋白MUC5AC的分泌[32, 33]。黏液分泌本是机体应对疾病的一种保护机制, 但不受控的高分泌最终会阻塞呼吸道, 加重疾病的情况。由此可以看出, 气道黏液与“痰”都十分符合其同时作为病理产物与致病因素的双重性质。通过网络药理学分析与文献查阅发现, 橘红痰咳液中的柚皮苷、白前苷元C和L-麻黄碱等活性成分可以通过作用于EGFR和TNF等关键靶点, 影响MAPK的ERK1/2级联反应与PI3K-Akt信号通路, 抑制下游NF-κB途径, 通过降低细胞中MUC5AC启动子的转录活性来抑制MUC5AC mRNA的表达, 减少黏液分泌; 同时, 化痰组中的芹菜素、茯苓酸以及甘草酸等有效成分也都通过作用于B细胞受体信号通路、NOD样受体信号通路等一系列炎症反应途径, 协同改善气道黏液分泌的情况, 消炎化痰[6, 8, 33]。
此外, 本研究还对橘红痰咳液的配伍规律进行了分析研究。结合网络药理学的分析结果可知, 化橘红化痰方面功效的总自由度在8味药中为最大, 又映射作用于调控痰黏液分泌最关键的靶点(EGFR、TNF)与通路(MAPK信号通路、NF-κB信号通路)上, 同时在止咳与平喘功效中的总自由度值排名靠前, 实为方中之“君”药; 制半夏与白前在止咳、平喘方面功效显著, 同时为化橘红补充了CHRM2和CHRM3等作用靶点, 增强了调控平滑肌收缩反应的作用, 辅以为“臣”药; “佐、使”药则可能通过作用于Ca2+信号通路和脂肪细胞的脂解等途径, 调控气道神经中的信号传导, 抑制炎症反应, 协同增效, 辅助主药发挥止咳、平喘、化痰的作用。橘红痰咳液3个功效分组分别对各自相应病症发挥作用, 同时各组分之间又通过相关联的通路群交互发挥着协同作用, 如止咳组与平喘组发挥作用都离不开胆碱能突触等通路来维持气道神经中的信号传导; 平喘组可通过作用于血管平滑肌收缩等方式来调控气道扩张反应, 通过介导花生四烯酸代谢等途径抑制炎性因子的产生, 减少了机械因素与化学因素对咳嗽感受器的刺激, 辅助止咳组减少咳嗽反应, 又通过抑制炎性细胞大量分泌黏蛋白协同化痰组减少痰液的产生; 化痰组可通过下调NF-κB信号通路的表达, 抑制黏蛋白的转录合成从而减少气道黏液分泌, 在减少分泌物刺激咳嗽感受器的同时, 也避免了其对呼吸道产生堵塞作用, 有利于止咳、平喘功效的发挥。由不同药物组成的3个分组能够分别产生不同的功效, 而不同分组的各个通路之间又交互协同发挥着作用, 这种作用方式真正体现了中药方剂在治疗疾病的过程中多成分、多靶点、多途径的作用特点。
中成药橘红痰咳液因其疗效好、品质佳而被广泛应用于急/慢性呼吸系统疾病。本次全国暴发的新型冠状病毒肺炎疫情是继“非典”之后的又一次冠状病毒大范围传染, 感染“新冠”的患者多表现为咳嗽、气喘、怕冷、乏力、有白痰, 中医将其辨证为伤寒病, 即其具有“寒症”的特点[34]。橘红痰咳液中的化橘红、制半夏、苦杏仁与蜜百部皆具有辛温之性, 其他药物也性微温或平, 辛可行气化湿, 温可助阳驱寒。本课题从分子机制方面研究发现, 橘红痰咳液对于呼吸系统炎症有着较强的抑制作用, 推断此温化寒痰之方, 亦存在着治疗此次新冠肺炎, 或是其他在冬春季节多发的病毒性流感的可能性。
综上所述, 本研究运用网络药理学的方法初步分析了橘红痰咳液治疗痰、咳、喘的主要活性成分, 明确了其治疗呼吸系统疾病可能的分子机制, 阐明了该组方配伍的科学内涵, 为该复方质量标志物的确定奠定了研究基础, 同时也为其临床更好的应用提供了参考依据。
作者贡献: 钟仁兴、丁子禾和杨燕妮共同讨论并设计了文章的整体构架, 钟仁兴、夏天乙和王武静完成了文献搜集与整理; 钟仁兴完成了文章网络药理学与分子对接等部分的工作以及初稿与终稿的撰写; 王毅、丁子禾和王艳慧分析并整理了实验数据; 舒尊鹏提供了论文主题中心思想并完成了论文初稿与终稿的修改。
利益冲突: 所有作者均声明没有利益冲突。
| [1] |
Qin GC. Current status of research on respiratory diseases in Chinese medicine and future clinical research ideas[J]. China Foreign Med Treat (中外医疗), 2019, 38: 192-194. |
| [2] |
Li BT, Zhai XY, Li J, et al. Network pharmacology-based study on mechanisms of antipyretic action of Pueraria radix[J]. Acta Pharm Sin (药学学报), 2019, 54: 1409-1416. |
| [3] |
Wang Y, Huang J, Jiang X, et al. Pharmacodynamics research on antitussive, expectorant, antiasthmatic and antiinflammatory effect of Ju-Hong Tan-Ke liquid[J]. World Sci Technol Mod Tradit Chin Med Mat Med (世界科学技术-中医药现代化), 2017, 19: 1375-1380. |
| [4] |
Yang Y, Cheng L. Clinical analysis of Citri Grandis Exocarpium and component of Ju-Hong Tan-Ke liquid[J]. J China Prescript Drug (中国处方药), 2019, 17: 26-27. |
| [5] |
Zhuang L, Zhai YY, Yao WF, et al. The mechanism study of protecting kidney of Erzhi Pill based on network pharmacology[J]. Acta Pharm Sin (药学学报), 2019, 54: 877-885. |
| [6] |
Yang J, Li Q, Zhou XD, et al. Naringenin attenuates mucous hypersecretion by modulating reactive oxygen species production and inhibiting NF-kappaB activity via EGFR-PI3K-Akt/ERK MAPKinase signaling in human airway epithelial cells[J]. Mol Cell Biochem, 2011, 351: 29-40. DOI:10.1007/s11010-010-0708-y |
| [7] |
Du W, Su J, Ye D, et al. Pinellia ternata attenuates mucus secretion and airway inflammation after inhaled corticosteroid withdrawal in COPD rats[J]. Am J Chin Med, 2016, 44: 1027-1041. DOI:10.1142/S0192415X16500579 |
| [8] |
Wu W, Zhu C, Luo C. Research on the protective effect of alkaloids Pinelliaf Rhizoma on inflammatory injury of lung epithelial cells[J]. J Inner Mongolia Agricult Univ (Nat Sci Ed) (内蒙古农业大学学报(自然科学版)), 2018, 39: 1-8. |
| [9] |
Zhao M, Li C, Shen F, et al. Naringenin ameliorates LPS-induced acute lung injury through its anti-oxidative and anti-inflammatory activity and by inhibition of the PI3K/AKT pathway[J]. Exp Ther Med, 2017, 14: 2228-2234. DOI:10.3892/etm.2017.4772 |
| [10] |
Yu DH, Ma CH, Yue ZQ, et al. Protective effect of naringenin against lipopolysaccharide-induced injury in normal human bronchial epithelium via suppression of MAPK signaling[J]. Inflammation, 2015, 38: 195-204. DOI:10.1007/s10753-014-0022-z |
| [11] |
Mendelsohn J, Baselga J. Status of epidermal growth factor receptor antagonists in the biology and treatment of cancer[J]. J Clin Oncol, 2003, 21: 2787-2799. DOI:10.1200/JCO.2003.01.504 |
| [12] |
Hu S, Kong Z, Pan Y. Identification and reasonable application of Cynanchistauntonii Rhizoma Et Radix, Radix Cynanchi, Radix Cynanchi Paniculati and Hemerocallis Radix[J]. Hebei J Tradit Chin Med (河北中医), 2007, 29: 745-747. |
| [13] |
Zheng XH, Zhao X, Yang R, et al. β2-Adrenoceptor affinity chromatography and its application in screening active components of bitter almond[J]. Chin Sci Bull (科学通报), 2007, 52: 2111-2115. DOI:10.1360/csb2007-52-18-2111 |
| [14] |
Liu J, Xu J, Guo JT. Review of active constituents and pharmacological activities of Schisandrae Chinensis Fructus[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2019, 25: 206-215. |
| [15] |
Chung HS, Hon PM, Lin G, et al. Antitussive activity of Stemona alkaloids from Stemona tuberosa[J]. Planta Med, 2003, 69: 914-920. DOI:10.1055/s-2003-45100 |
| [16] |
Ma L, Yin L, Wang B, et al. Research progress of Poria ocos[J]. Asia Pacific Tradit Med (亚太传统医药), 2015, 11: 55-59. |
| [17] |
Zhao H, Zhao M, Wang Y, et al. Glycyrrhizic acid prevents sepsis-induced acute lung injury and mortality in rats[J]. J Histochem Cytochem, 2015, 64: 125-137. |
| [18] |
Nong GM. Ongoing research in cough pathogenesis[J]. Chin J Pract Pediat (中国实用儿科杂志), 2016, 31: 165-168. |
| [19] |
Zhu TJ, Cui LY. Study progress of chronic cough[J]. J Inner Mongolia Med Univ (内蒙古医科大学学报), 2006, 28: 43-46. |
| [20] |
Lauss M, Kriegner A, Vierlinger K, et al. Characterization of the drugged human genome[J]. Pharmacogenomics, 2007, 8: 1063-1073. DOI:10.2217/14622416.8.8.1063 |
| [21] |
Szczepankiewicz A, Bręborowicz A, Sobkowiak P, et al. Association of A/T polymorphism of the CHRM2 gene with bronchodilator response to ipratropium bromide in asthmatic children[J]. Pneumonol Alergol Pol, 2009, 77: 5-10. |
| [22] |
Townsend EA, Thompson MA, Pabelick CM, et al. Rapid effects of estrogen on intracellular Ca2+ regulation in human airway smooth muscle[J]. Am J Physiol Lung Cell Mol Physiol, 2010, 298: L521-L530. DOI:10.1152/ajplung.00287.2009 |
| [23] |
Aas P, Walday P, Tans R. The effect of acetylcholinesterase-inhibition on the tonus of guinea-pig bronchial smooth muscle[J]. Biochem Pharmacol, 1988, 37: 4211-4216. DOI:10.1016/0006-2952(88)90118-9 |
| [24] |
Rajasekaran A, He D, Yue A, et al. Cholinergic synapse pathway gene polymorphisms associated with allergen-induced late asthmatic responses[J]. ERJ Open Res, 2019, 5: 00107-2019. |
| [25] |
Jiang BA, Qu B, Zheng H, et al. Research advance on pathogenesis and drug treatment of bronchial asthma[J]. China Mod Med (中国当代医药), 2015, 22: 35-37, 41. |
| [26] |
Chan IH, Tang NL, Leung TF, et al. Association of prostaglandin-endoperoxide synthase 2 gene polymorphisms with asthma and atopy in Chinese children[J]. Allergy, 2007, 62: 802-809. DOI:10.1111/j.1398-9995.2007.01400.x |
| [27] |
Zhao H, Wang J, Fang D, et al. Adiposity results in metabolic and inflammation differences in premenopausal and postmenopausal women consistent with the difference in breast cancer risk[J]. Horm Cancer, 2018, 9: 229-239. DOI:10.1007/s12672-018-0329-6 |
| [28] |
Sideleva O, Suratt BT, Black KE, et al. Obesity and asthma:an inflammatory disease of adipose tissue not the airway[J]. Am J Respir Crit Care Med, 2012, 186: 598-605. DOI:10.1164/rccm.201203-0573OC |
| [29] |
Szczepankiewicz A, Brêborowicz A, Sobkowiak P, et al. Role of ADRB2 gene polymorphism in asthma and response to β2-agonists in Polish children[J]. J Appl Genet, 2009, 50: 275-281. DOI:10.1007/BF03195683 |
| [30] |
Wang XH, Tong M, Dou D, et al. Role of cGMP-dependent protein kinase in the cardiovascular system[J]. Prog Physiol Sci (生理科学进展), 2005, 36: 299-303. |
| [31] |
Chellaih P, Sivadas G, Chintu S, et al. Effect of anti-asthmatic drugs on dental health:a comparative study[J]. J Pharm Bioallied Sci, 2016, 8: S77-S80. DOI:10.4103/0975-7406.171732 |
| [32] |
Liang X, Zhang Y, Yan J. Neutrophils:a double-edged sword in the inflammatory response[J]. Chin J Nat (自然杂志), 2019, 41: 370-375. |
| [33] |
Song JS, Cho KS, Yoon HK, et al. Neutrophil elastase causes MUC5AC mucin synthesis via EGF receptor, ERK and NF-κB pathways in A549 cells[J]. Korean J Int Med, 2005, 20: 275-283. DOI:10.3904/kjim.2005.20.4.275 |
| [34] |
Wang FX, Zhang Y, Liu KC. Prevention and control strategies of NCP based on theory of principle, method and prescription of Treatise on febrile diseases [J]. Shandong Sci (山东科学), 2020. DOI:http://kns.cnki.net/kcms/detail/37.1188.N.20200220.1205.002.html.
|
 2020, Vol. 55
2020, Vol. 55


