2. 青岛市中医医院干部保健科, 山东 青岛 266033;
3. 重庆医科大学基础医学院, 重庆 400016
2. Qingdao Hospital of Traditional Chinese Medicine, Qingdao 266033, China;
3. School of Basic Medicine, Chongqing Medical University, Chongqing 400016, China
卵巢癌是女性常见恶性肿瘤, 其发病率逐年升高, 晚期复发率高, 化疗易耐药且化疗药物易引起不良反应, 因此, 寻找可抑制卵巢癌恶性程度发展的药物以增强临床疗效的研究成为热点。二氢杨梅素(dihydromyricetin, DHM; 3, 5, 7, 3', 4', 5'-六羟基-2, 3-二氢黄酮醇)是从民间用药藤茶和枳椇子等中提取的植物性黄酮类化合物[1], 有抗肿瘤[2, 3]和提高免疫力[4]等功效, 具有毒副作用小和靶向作用效果明显等特点, 但其抗卵巢癌的作用机制还有待研究。课题组前期已证实DHM处理可诱导卵巢癌SKOV3和A2780细胞的凋亡, 并可降低癌细胞的迁移和侵袭[5]。另有研究发现, DHM (又名蛇葡萄素)可通过内质网应激(endoplasmic reticulum stress, ERS)通路诱导乳腺癌细胞凋亡[6]。而DHM诱导卵巢癌细胞凋亡作用是否由ERS通路介导尚不清楚。本文通过体内、外实验研究, 深入探讨了DHM诱导卵巢癌细胞凋亡的机制及其抑制体内肿瘤生长的作用与ERS通路的相关性。
材料与方法试剂 DHM (编号Bellancom-A1046, 纯度99.51%, 北京寰宇公司), 溶于二甲基亚砜(dimethyl sulfoxide, DMSO)配成50 mmol·L-1储存液备用; Annexin V-FITC (fluorescein isothiocyanate)凋亡检测试剂盒(美国BD公司); 葡萄糖调节蛋白78 (glucose-regulated protein 78, GRP78, 78 kDa)、C/EBP同源蛋白(C/EBP-homologous protein, CHOP, 27 kDa)及活化的半胱氨酸天冬氨酸蛋白酶-3 (cleaved cysteinyl aspartate specific proteinase-3, cleaved-caspase-3, 17 kDa)一抗、辣根过氧化物酶标记的山羊抗小鼠及山羊抗兔IgG (美国Cell Signaling Technology公司); 半胱氨酸天冬氨酸特异性蛋白酶-12 (cysteinyl aspartate specific proteinase-12, caspase-12, 38 kDa)一抗(美国Abcam公司); CCK-8 (cell counting kit-8)试剂盒、二喹啉甲酸(bicinchoninic acid, BCA)蛋白定量试剂盒和β-actin抗体(中国碧云天生物技术公司); ERS抑制剂4-苯基丁酸(4-phenylbutyric acid, 4-PBA, 大连美仑生物技术有限公司)。
细胞培养及分组处理 人卵巢癌A2780细胞购自上海中国科学院细胞库。采用含10%胎牛血清及1%青/链霉素的改良Eagle培养基(Dulbecco's modification of Eagle's medium, DMEM)进行细胞培养。分组: ①不同浓度DHM (0、40和80 μmol·L-1)处理A2780细胞48 h后, 检测ERS相关蛋白的表达; ② 4-PBA (10 mmol·L-1)预处理A2780细胞1 h后, 再用DHM (80 μmol·L-1)处理细胞48 h, 检测细胞活力及凋亡情况。
CCK-8法检测细胞活力 A2780细胞接种于96孔板中培养, 按实验分组进行处理后, 每孔加入含CCK-8液的完全培养基100 μL, 继续孵育1~2 h, 置于酶标仪中, 测量各孔450 nm波长的吸光度值(A450), 计算细胞活力抑制率。
流式细胞术(flow cytometry, FCM)检测细胞凋亡率 将细胞进行分组处理后, 按照试剂盒说明书进行操作并上机检测。结果显示为:左下象限(Annexin V-/PI-), 正常细胞; 右下象限(Annexin V+/PI-), 早期凋亡细胞; 右上象限(Annexin V+/PI+), 处于晚期凋亡或坏死细胞; 左上象限(Annexin V-/PI+), 可能是细胞收集过程中出现的损伤细胞[7]。用FlowJo V10软件进行分析, 通过计算处于早期凋亡和晚期凋亡的细胞所占总细胞数的比例为细胞凋亡率(apoptosis rate, AR)。
Western blot法检测细胞中GRP78、CHOP及caspase-12)的表达 提取各组细胞内总蛋白, 用BCA法测定蛋白浓度并进行SDS-PAGE凝胶电泳分离蛋白。将蛋白转移至聚偏二氟乙烯膜(polyvinylidene fluoride, PVDF)上, 用10%脱脂牛奶封闭非特异性抗原后, 于室温孵育2 h, 加入一抗(均为1:1 000), 并于4 ℃孵育过夜。经Tris缓冲盐溶液(Tris buffered saline Tween, TBST)洗膜后, 加入辣根过氧化物酶标记的二抗(1:4 000), 于室温继续孵育3 h, 再经TBST洗膜后, 用电化学发光(electro-chemi-luminescence, ECL)法显色并曝光成像。应用凝胶成像分析软件扫描, 以β-actin作为内参对照, 分析目的蛋白的相对表达水平。
裸鼠体内模型建立及DHM干预 BALB/c-nu雌性裸小鼠, 28~42日龄, 体重18~20 g, 购自北京华阜康生物科技股份有限公司, 分为对照组(control, Con)和DHM处理组(DHM, 200 mg·kg-1·d-1), 每组6只, 饲养于重庆医科大学实验动物中心无特定病原体(specific pathogen free, SPF)级环境。动物实验遵循重庆医科大学动物伦理委员会的规定。
制备A2780单细胞悬液, 进行裸鼠皮下种植, 每只注射0.2 mL细胞悬液(约5×106个细胞), 共接种12只。当接种7~10天后, 可于接种部位皮下触及小米粒大小硬结, 表明造模成功。待肿瘤达到约100 mm3体积时, 开始给药处理。DHM组采用DHM混悬液(200 mg·kg-1·d-1)进行腹腔注射, Con组注射等量生理盐水。按实验方案连续给药21天, 每隔2天测量1次裸鼠体重及肿瘤长、短径。实验结束处死裸鼠, 完整分离肿瘤组织用于检测。肿瘤体积计算公式为:肿瘤体积(mm3) =短径(mm)2×长径(mm)/2。
苏木素-伊红(haematoxylin-eosin, HE)染色法观察皮下瘤组织的形态学改变 将裸鼠瘤组织经固定(10%多聚甲醛)、脱水、浸蜡、包埋和切片, 行常规HE染色后, 中性树脂封片并观察组织的形态结构特点。
透射电镜(transmission electron microscope, TEM)法观察裸鼠瘤组织细胞内质网等细胞器结构 取裸鼠瘤组织做电镜样本时, 尽量取靠近肿瘤边缘的非坏死区。将组织修剪为1 mm3大小的样本块, 浸于2.5%的电镜专用戊二醛溶液中固定。组织样本依次采用1%锇酸固定2 h, 50%、70%、80%、90%及95%梯度酒精脱水各5 min, 无水乙醇及丙酮浸泡3次、各5 min, 丙酮包埋过夜, 固化、切片, 再行醋酸双氧铀和柠檬酸铅双重染色后, 于透射电镜下观察。
裸鼠瘤组织内GRP78、CHOP和cleaved-caspase-3蛋白表达的检测 提取瘤组织的总蛋白, 进行蛋白浓度测定后, 取等量蛋白进行Western blot检测分析, 检测方法及各抗体稀释比例均同前。
统计学处理 采用SPSS 20.0软件进行统计分析, 两组间比较用独立样本t检验, 多组间比较采用单因素方差分析, 以P < 0.05为具有统计学差异, 采用GraphPad Prism 5软件绘制统计图。
结果 1 DHM处理A2780细胞可激活ERS为研究DHM诱导A2780细胞凋亡是否与ERS信号通路有关, 检测了DHM处理后A2780细胞中ERS相关蛋白GRP78及凋亡蛋白CHOP和caspase-12的表达水平。
作者前期实验结果显示, 不同浓度DHM干预A2780细胞24及48 h后, 采用CCK-8方法检测细胞活力, 计算获得半数抑制浓度(50% inhibitory concentration, IC50)分别为157.2和98.2 μmol·L-1 [5]。本实验中采用40和80 μmol·L-1的DHM处理A2780细胞48 h后检测ERS相关蛋白的表达水平(图 1)。结果显示, 与对照组(DMSO)相比, DHM (80 μmol·L-1)处理48 h可引起GRP78表达水平明显增加(P < 0.01), 且凋亡蛋白CHOP和caspase-12水平升高(P < 0.01), 表明DHM的处理激活了A2780细胞内的ERS并引起细胞凋亡。
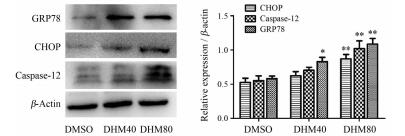
|
Figure 1 Dihydromyricetin (DHM) activated endoplasmic reticulum stress (ERS). The protein expression levels of CHOP, GRP78, and caspase-12 were tested by Western blot after treatment with 40 and 80 μmol·L-1 DHM, and with DMSO as the control for 48 h, respectively. The experiment was repeated three times and the statistical results are presented as |
为进一步探讨ERS在DHM诱导的细胞凋亡中的作用, 采用ERS抑制剂(4-PBA, 10 mmol·L-1)预处理A2780细胞1 h, 再用DHM干预48 h后, 检测各组细胞活力及凋亡率。细胞分组包括: Con组; DHM (80 μmol·L-1)组; 4-PBA (10 mmol·L-1)组; DHM (80 μmol·L-1) + 4-PBA (10 mmol·L-1)组。
应用CCK-8法检测各组细胞活力结果显示:与Con组相比, DHM单独处理组细胞活力呈显著性降低(P < 0.01, 图 2A), 而4-PBA单独处理组细胞活力无变化, 提示4-PBA不影响细胞活力; 与DHM单独处理组相比, 4-PBA预处理联合DHM组细胞活力降低(P < 0.05, 图 2A)。
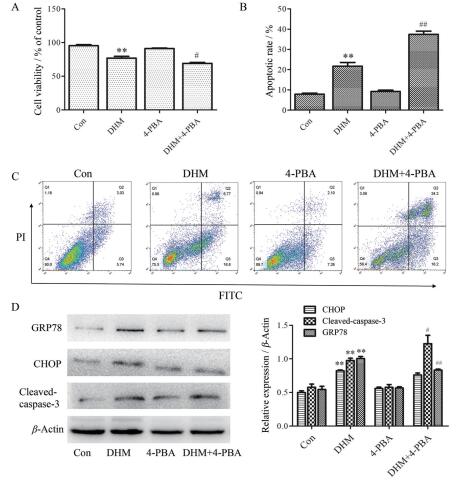
|
Figure 2 Inhibition of ERS enhanced DHM-induced apoptosis in A2780 cells. A: Cell viability was tested by CCK-8 assay; B and C: Apoptotic rate was detected by FCM (C) and the statistical analysis was shown (B); D: Protein expression was detected by Western blot. The experiment was repeated three times and the representative results of one experiment are shown. The statistical results are presented as |
应用FCM法检测各组细胞凋亡率, 统计分析处于早期凋亡和晚期凋亡的细胞占总细胞的比例为各组细胞的凋亡率。结果显示:与Con组相比, DHM处理组细胞凋亡率明显增加(P < 0.01, 图 2B、C), 而4-PBA单独处理组细胞凋亡率无变化, 提示4-PBA不影响细胞凋亡; 与DHM单独处理组相比, 4-PBA预处理联合DHM组的细胞凋亡率明显增加(P < 0.01, 图 2B、C)。细胞活力检测及凋亡率分析结果表明, 抑制ERS联合DHM处理可降低细胞活力并促进细胞凋亡。
应用Western blot法检测促凋亡蛋白cleaved-caspase-3和ERS相关蛋白GRP78和CHOP的表达。结果显示:与DHM单独处理组相比, 4-PBA预处理联合DHM组的促凋亡蛋白cleaved-caspase-3的表达增加(P < 0.05), GRP78表达降低(P < 0.01), 而CHOP蛋白水平无明显变化, 表明ERS抑制剂联合DHM处理增加了A2780细胞凋亡的水平, 与FCM检测结果一致(图 2D)。
3 DHM具有抑制裸鼠卵巢癌移植瘤的作用 3.1 DHM对裸鼠移植瘤生长的影响将A2780细胞皮下接种于裸鼠, 接种后第8天进行DHM (200 mg·kg-1·d-1)腹腔注射干预。共干预21天, 干预结束时, 检测各组裸鼠肿瘤体积。结果显示第21天时, 对照组(Con)平均肿瘤体积为(1 669.22 ± 213.66) mm3, DHM组平均肿瘤体积为(1 119.02 ± 109.29) mm3, 二者差异显著(P < 0.01, 图 3A)。肿瘤生长曲线结果显示(图 3B), DHM处理明显抑制了肿瘤的生长(P < 0.01)。
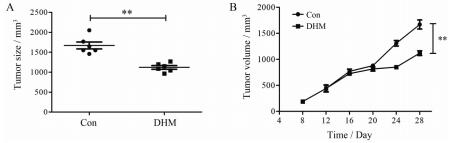
|
Figure 3 Effect of DHM on the transplanted tumor in nude mice. A2780-bearing mice were randomly divided into two groups. One group received saline solution as control and the other group received DHM (200 mg·kg-1·d-1) daily for 21 days. A: The tumor size difference in two groups; B: Growth curves of transplanted tumor in two groups.n = 6, |
实验结束后, 完整分离各裸鼠的肿瘤组织。由于各裸鼠对药物敏感性有差异, 因而DHM组内肿瘤大小显示有差异, 但肉眼观察两组裸鼠的瘤组织形态无显著差别, 肿瘤质地均较软、呈单个肿块、形状椭圆形, 与皮肤无粘连、活动度好、被膜完整、表面光滑、血管丰富, 基底部与肌肉、脂肪组织等无粘连, 切面呈灰白或灰红色、鱼肉样(图 4A)。
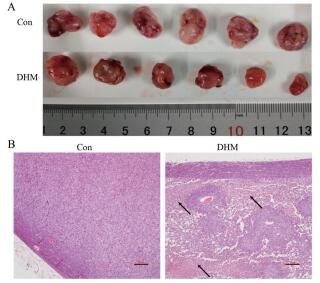
|
Figure 4 Morphological features of transplanted tumor in two groups. A: Implanted tumors gained from nude mice after 21 days (n = 6/group); B: The representative morphological features of tumor tissues analyzed by haematoxylin-eosin (HE) staining (scale bar, 100 μm) |
经HE染色后在光镜下观察皮下瘤组织的形态特点, 结果显示, 对照组瘤细胞均较密集、有腺样结构形成, 间质内可见丰富的血管, 纤维性被膜清晰, 坏死较少(图 4B)。DHM处理组瘤细胞密度降低、瘤组织内坏死多见, 间质内大量炎细胞浸润, 可见纤维增生(图 4B), 表明DHM处理可引起瘤组织内出现明显细胞坏死。
3.3 透射电镜观察细胞超微结构改变通过透射电镜观察组织细胞内的内质网等细胞器的结构特点, 结果如图 5所示。对照组细胞内的细胞核(nucleus, N)、内质网(endoplasmic reticulum, ER)、高尔基体(Golgi apparatus, GA)和线粒体(mitochondria, M)等细胞器结构正常, 而DHM处理组细胞内可见明显ER肿胀和破碎。

|
Figure 5 Ultrastructural features of tumor tissues of nude mice were observed by transmission electron microscope (TEM). A2780-bearing mice were randomly divided into two groups. One group received saline solution as control and the other group received DHM (200 mg·kg-1·d-1) daily for 21 days. Scale bar: 1 μm. N: Nucleus; ER: Endoplasmic reticulum; GA: Golgi apparatus; M: Mitochondria |
通过Western blot法检测DHM干预21天后裸鼠瘤组织内GRP78、CHOP及cleaved-caspase-3蛋白的表达水平, 结果如图 6所示。与对照组(Con)相比, DHM处理组内ERS相关蛋白GRP78、CHOP和促凋亡蛋白cleaved-caspase-3的表达水平均增加, 表明DHM的处理激活了ERS并促使细胞凋亡。

|
Figure 6 Protein expression levels of GRP78, CHOP, and cleaved-caspase-3 in tumor tissues were analyzed by Western blot. Nude mice bearing A2780 tumors were randomized and treated with DHM (200 mg·kg-1·d-1) once daily continuously for 21 days. The statistical data of relative expression are presented as |
DHM是一种存在于植物性食物中的黄酮类化合物, 在藤茶(广泛分布于湖北、广西和湖南等地)的嫩茎叶中含量最高[8]。已报道DHM具有抑菌抗炎、抗氧化和抗癌等多种药理活性, 具有潜在的多靶点作用, 而且在不同肿瘤细胞中的作用机制也不尽相同[9]。作者前期研究发现DHM可促进卵巢癌细胞凋亡, 其机制可能与通过线粒体途径而诱发高尔基体碎裂有关[5]。有研究报道同为食源性黄酮类化合物的珍珠梅黄酮可能通过ERS途径诱导肝癌移植瘤细胞凋亡[10], 芹菜素能诱导肝癌细胞自噬及凋亡[11], 均表明食源性黄酮类化合物可能通过诱导细胞凋亡而抑制肿瘤生长。目前亦有报道DHM可通过p53通路诱导卵巢癌细胞凋亡及逆转多药耐药[12], 然而DHM作用靶点多样化、作用机制复杂, 其能否通过ERS通路诱导卵巢癌细胞凋亡还未见报道。
细胞凋亡途径包括死亡受体(death receptor, DR)介导的外源性凋亡、线粒体依赖的内源性凋亡和ERS通路介导的凋亡[13]。研究已证实CHOP和caspase-12在ERS诱导的细胞凋亡中发挥重要作用[14]。ERS通路激活后可通过下游促凋亡因子CHOP来诱发caspase级联反应[15, 16], 其中caspase-12位于ER膜, caspase-12活化可进一步激活caspase-3, 再通过后续级联反应执行细胞凋亡程序[17]。GRP78是ER上的伴侣蛋白, 可重新折叠ER中的“错误折叠蛋白”来保护细胞免受损伤, ERS激活后其表达水平增加[18], 因而GRP78成为ERS标志性蛋白之一。有研究发现白花地胆草(Elephantopus mollis H.B.K.)单体分子EM-12可通过激活ERS介导的细胞凋亡通路来诱导卵巢癌A2780细胞凋亡[19], 这与本研究结果一致, 本研究发现DHM处理A2780细胞可引起GRP78、CHOP的蛋白表达增加, 及caspase-12的水平增加, 表明DHM处理激活了ERS通路引起细胞凋亡。
为深入探讨, 本研究又采用ERS抑制剂4-PBA预处理A2780细胞1 h, 再用DHM干预48 h, 结果发现抑制ERS后, A2780细胞的凋亡率明显增加, 说明ERS在DHM诱导细胞凋亡过程中可能起细胞保护作用, 而且DHM联合ERS抑制剂处理可促进癌细胞的凋亡, 进而提高其临床疗效。体内实验亦发现DHM腹腔注射抑制了裸鼠体内肿瘤的生长, 同时在瘤组织内可见ER水肿、破碎等ERS性改变, 且瘤组织内ERS相关的蛋白及凋亡蛋白的表达均增加, 因此体内实验结果表明DHM干预可抑制体内卵巢癌的生长, 与激活ERS通路促进肿瘤细胞凋亡有关。
综上所述, 本研究发现DHM可通过激活ERS通路促进卵巢癌细胞凋亡, 但其调控ERS并诱导细胞凋亡的具体分子机制还有待深入研究。本研究可为藤茶、枳椇子等药食两用植物的研发及应用提供理论依据。
作者贡献: 王凤杰负责课题实施及撰写初稿; 王海静负责数据整理及统计分析; 陈显兵负责课题设计及指导; 易永芬负责课题指导及终稿审查; 谢雅负责细胞学实验; 张桃负责动物体内实验。
利益冲突: 所有作者均不存在利益冲突。
| [1] |
Liu C, Wu JL, Zhao N, et al. Correlation analysis between quality and habitat phenotype of Hovenia acerba[J]. China J Chin Mater Med (中国中药杂志), 2017, 42: 4769-4774. |
| [2] |
Zhou DZ, Sun HY, Yue JQ, et al. Dihydromyricetin induces apoptosis and cytoprotective autophagy through ROS-NF-κB signalling in human melanoma cells[J]. Free Radic Res, 2017, 51: 517-528. DOI:10.1080/10715762.2017.1328552 |
| [3] |
Qi SM, Jiang Q, Li Q, et al. Ampelopsin inhibited apoptosis and migration of SMMC-7721 cells through MAPKs signaling pathway[J]. Acta Pharm Sin (药学学报), 2019, 54: 1431-1438. |
| [4] |
Wu B, Lin J, Luo J, et al. Dihydromyricetin protects against diabetic cardiomyopathy in streptozotocin-induced diabetic mice[J]. Biomed Res Int, 2017, 2017: 3764370. |
| [5] |
Wang F, Chen X, Yuan D, et al. Golgi reassembly and stacking protein 65 downregulation is required for the anti-cancer effect of dihydromyricetin on human ovarian cancer cells[J]. PLoS One, 2019, 14: e0225450. DOI:10.1371/journal.pone.0225450 |
| [6] |
Zhou Y, Shu F, Liang X, et al. Ampelopsin induces cell growth inhibition and apoptosis in breast cancer cells through ROS generation and endoplasmic reticulum stress pathway[J]. PLoS One, 2014, 9: e89021. DOI:10.1371/journal.pone.0089021 |
| [7] |
Azuma K, Ishihara T, Nakamoto H, et al. Effects of oral administration of fucoidan extracted from Cladosiphon okamuranus on tumor growth and survival time in a tumor-bearing mouse model[J]. Mar Drugs, 2012, 10: 2337-2348. DOI:10.3390/md10102337 |
| [8] |
Zhou TD, Zhou XX. Isolation, structure determination and pharmacological activity of flavanonol from Ampelopsis grossedentata[J]. Chin Pharm J (中国药学杂志), 1996, 31: 458-461. |
| [9] |
Chen YL, Yin YF, Li Y, et al. Advances in pharmacological study of dihydromyricetin[J]. Chin J New Drugs (中国新药杂志), 2019, 28: 173-178. |
| [10] |
Liu RR, Zhang X, Xiao B, et al. Mechanism of TTF1-NP induced implanted hepatoma tumor apoptosis in nude mice by endoplasmic reticulum stress pathway[J]. Acta Pharm Sin (药学学报), 2016, 51: 403-407. |
| [11] |
Yang J, Pi C, Wang G, et al. Inhibition of PI3K/Akt/mTOR pathway by apigenin induces apoptosis and autophagy in hepatocellular carcinoma cells[J]. Biomed Pharmacother, 2018, 103: 699-707. DOI:10.1016/j.biopha.2018.04.072 |
| [12] |
Xu Y, Wang S, Chan HF, et al. Dihydromyricetin induces apoptosis and reverses drug resistance in ovarian cancer cells by p53-mediated downregulation of survivin[J]. Sci Rep, 2017, 7: 46060. DOI:10.1038/srep46060 |
| [13] |
Wang M, Kaufman RJ. Protein misfolding in the endoplasmic reticulum as a conduit to human disease[J]. Nature, 2016, 529: 326-335. DOI:10.1038/nature17041 |
| [14] |
Badiola N, Penas C, Mi ano-Molina A, et al. Induction of ER stress in response to oxygen-glucose deprivation of cortical cultures involves the activation of the PERK and IRE-1 pathways and of caspase-12[J]. Cell Death Dis, 2011, 2: e149. DOI:10.1038/cddis.2011.31 |
| [15] |
Li Y, Guo Y, Tang J, et al. New insights into the roles of CHOP-induced apoptosis in ER stress[J]. Acta Biochim Biophys Sin (Shanghai), 2015, 47: 146-147. DOI:10.1093/abbs/gmu128 |
| [16] |
Zhou W, Fang H, Wu Q, et al. Ilamycin E, a natural product of marine actinomycete, inhibits triple-negative breast cancer partially through ER stress-CHOP-Bcl-2[J]. Int J Biol Sci, 2019, 15: 1723-1732. DOI:10.7150/ijbs.35284 |
| [17] |
Song J, Zhang Q, Wang S, et al. Cleavage of caspase-12 at Asp94, mediated by endoplasmic reticulum stress (ERS), contributes to stretch-induced apoptosis of myoblasts[J]. J Cell Physiol, 2018, 233: 9473-9487. DOI:10.1002/jcp.26840 |
| [18] |
Ibrahim IM, Abdelmalek DH, Elfiky AA. GRP78:a cell's response to stress[J]. Life Sci, 2019, 226: 156-163. DOI:10.1016/j.lfs.2019.04.022 |
| [19] |
Huang X. EM-12, An Elephantopus mollis H.B.K. Monomer, Induces Apoptosis by Activating the Intrinsic Apoptotic Signaling Pathway in Response Endoplasmic Reticulum Stress in Ovarian Cancer Cells (白花地胆草单体EM-12通过激活内质网应激介导的内源性凋亡通路诱导卵巢癌细胞凋亡) [D]. Guangzhou: Jinan University, 2018.
|
 2020, Vol. 55
2020, Vol. 55


