2. 浙江大学医学院附属妇产科医院, 药剂科, 浙江 杭州 310006
2. Department of Pharmacy, Women's Hospital, School of Medicine, Zhejiang University, Hangzhou 310006, China
肿瘤化学治疗的目的在于抑制癌细胞增殖、浸润和转移, 直至消灭肿瘤组织。目前临床上的治疗药物主要通过直接或间接地促进细胞凋亡来杀死癌细胞[1]。但是由于长时间暴露于凋亡诱导剂, 癌细胞能通过变异增强抗凋亡信号或丧失凋亡机制以减少凋亡诱导剂导致的损伤, 从而使癌细胞对多种诱导细胞凋亡的药物产生抵抗[2, 3]。免疫治疗在过去10年发展为一种有前景的癌症治疗方法[4-7]。然而, 免疫检验点抑制剂由于抗癌谱窄的特性及自身免疫引起的潜在毒性阻碍了其在临床上广泛应用[4, 6]。此外, 由于实体肿瘤中存在药物传递障碍, 免疫疗法对实体瘤的治疗效果不及预期[5, 7]。因此, 研究新的肿瘤治疗方法是十分有意义的。
2012年“铁死亡(ferroptosis)”概念被提出, 国内外许多研究者均证明诱导肿瘤细胞铁死亡将会是一种有前景的治疗策略。铁死亡是一种不同于细胞凋亡、自噬、坏死和焦亡的调节性细胞死亡方式, 是因铁依赖性活性氧(reactive oxygen species, ROS)异常堆积而导致氧化还原平稳失调的细胞死亡方式[8, 9]。铁死亡的主要过程为:细胞内铁依赖的芬顿反应(Fenton reaction)产生ROS; 细胞膜脂中的多聚不饱和脂肪酸(poly unsaturated fatty acid, PUFA-LPs-OH)可被ROS和脂氧合酶等氧化, 形成脂质过氧化物(lipid peroxidation, PUFA-LPs-OOH)[10]; PUFA-LPs-OOH转变成有毒的脂质自由基[11], 导致细胞膜破碎, 进而引发细胞死亡[10]。与肿瘤细胞凋亡需要多级信号传导相比, 铁死亡模式作用强而迅速[12]。在正常细胞中, 依赖于谷胱甘肽(glutathione, GSH)的脂质修复酶-谷胱甘肽过氧化物酶4 (glutathione peroxidase 4, GPx4), 可以将有毒的PUFA-LPs-OOH还原为无毒的PUFA-LPs-OH[11], 从而减少脂质自由基的积累来阻止铁死亡的发生与发展。作为重要的抗氧化物, GSH在细胞内的合成需要胱氨酸(cystine, Cys)/谷氨酸(glutamic acid, Glu)反向转运体系(Xc-转运体系, 包含SLC3A2和SLC7A11两个膜转运蛋白)向细胞内转入Cys[13]。根据铁死亡的发生机制, 增强肿瘤细胞内芬顿反应与抑制GPx4酶活性是诱导肿瘤细胞铁死亡最有效的两种策略[10, 14]。
许多小分子药物具有显著的铁死亡诱导作用, 如双氢青蒿素, 能够在Fe2+催化下发生芬顿反应而增加肿瘤细胞内的ROS[15, 16]; 索拉非尼能够竞争性抑制Xc-转运体而减少细胞内GSH的合成, 进而抑制GPx4的活性[17]。然而, 这些药物水溶性差, 体内分布无特异性, 容易造成毒副作用。体内清除快, 靶区分布不足, 无法发挥很强的铁死亡诱导作用。纳米医学的长足进步解决了许多抗癌药物的递送问题。纳米递药体系在肿瘤治疗方面具有特殊的优势, 能够克服抗癌药物低溶解度、膜通透性差等不足以实现靶向递送[18, 19]。更重要的是, 纳米科技能够赋予纳米载体一些特异性功能, 如生成ROS和消耗GSH等, 能够与药物协同发挥更加强大的铁死亡诱导作用。本文根据铁死亡发生与发展的机制, 从加速肿瘤细胞内芬顿反应、抑制GPx4酶活性、脂质过氧化物的外源递送及联合疗法(包括联合传统疗法和体外能量), 多角度介绍诱导铁死亡纳米药物的构建及其抗肿瘤的研究进展(图 1)。

|
Figure 1 Schematic representation of emerging ferroptosis-inducing nanotherapeutics for efficient cancer therapy. GPx4: Glutathione peroxidase 4; GSH: Glutathione; ROS: Reactive oxygen species |
芬顿反应是过氧化氢(hydrogen peroxide, H2O2)与Fe2+/3+的混合溶液将很多有机化合物如羧酸、醇、酯类氧化为无机态的反应。该反应迅速而强烈, 具有高效去除难降解有机污染物的能力, 在印染废水、含油废水等废水处理以及有机废物降解中有很广泛的应用。肿瘤细胞内同样存在芬顿反应。即线粒体释放的H2O2在内源性Fe2+/3+的催化下生成羟基自由基(hydroxyl radical, ·OH, ROS的一种形式), 导致细胞内的脂质过氧化物异常蓄积, 促进肿瘤细胞铁死亡的发生与发展[20]。基于以上机制, 向肿瘤细胞内递送芬顿反应催化剂或(和)反应物能够加速肿瘤细胞铁死亡的发生与发展。
1.1 芬顿催化剂递送目前, 研究者们已经开发出多种纳米催化剂以诱导肿瘤局部芬顿反应, 进行抗肿瘤治疗[21-23]。施剑林课题组[23]开发了一种高性能纳米催化系统用于诱导肿瘤细胞铁死亡。通过将铁单质分散到氮掺杂的碳纳米材料中, 然后将纳米粒聚乙二醇(polyethylene glycol, PEG)化, 以构建PEG修饰的含单质铁的纳米催化剂(PSAF NCs) (图 2)。依据质子介导的均裂机制, H2O2容易被非晶态原子铁吸收和解离。在肿瘤酸性的微环境下, PSAF NCs可以有效引发原位芬顿反应并产生有毒的·OH。肿瘤细胞内特异性产生的·OH可导致脂质过氧化物的快速蓄积, 同时诱导细胞铁死亡和凋亡。体内结果显示, PSAF NCs静脉或瘤内注射15天后, 荷4T1肿瘤模型动物的抑瘤率分别为40.01%和63.49%。更重要的是, 单质铁纳米催化剂表现出良好的生物降解性和生物相容性, 未显示明显的系统毒性。

|
Figure 2 Schematic diagram of PEGylated single-atom Fe-containing nanocatalysts (PSAF NCs) for cancer therapy (Adapted from Ref. 23 with permission. Copyright © 2019 American Chemical Society). TME: Tumor microenviroment |
肿瘤细胞内H2O2水平(5×10-5~5×10-4 mol·L-1)无法产生足够的ROS以实现高效的铁死亡诱导作用[24, 25]。通过增加肿瘤细胞内H2O2浓度, 能够加速芬顿反应。葡萄糖氧化酶(glucose oxidase, GOD)是一类以β-D-葡萄糖为底物的氧化还原酶, 能够以O2为电子受体, 专一且高效地催化β-D-葡萄糖形成葡萄糖酸和H2O2[26]。肿瘤的生长高度依赖于葡萄糖的持续供应, 其主要通过糖酵解形式获得大量能量(adenosine triphosphate, ATP)以维持其快速增殖。GOD能够在肿瘤微环境中消耗大量的葡萄糖, 切断肿瘤营养物质供应, 阻碍肿瘤血管生长, 因此常应用于肿瘤的“饥饿”疗法[27, 28]。有意思的是, GOD高效催化葡萄糖形成H2O2的特性能够促进肿瘤细胞铁死亡的发生。如图 3所示, Li等[29]报道了一种负载GOD的聚合物胶束(theraNR)。肿瘤酸性微环境能特异性增加胶束的通透性, 葡萄糖、O2与GOD接触后被催化生成H2O2。生成的H2O2将在细胞内源性铁作用下转化为ROS, 进而将PUFA-LPs-OH氧化成脂PUFA-LPs-OOH。同时, 高水平的H2O2会诱导纳米胶束解聚, 进而释放出醌甲基化物(quinone methide, QM)。所释放的QM能够消耗细胞内的GSH从而发挥很强的肿瘤抑制作用。药效学结果显示, 该纳米药物能够有效地抑制人肺上皮细胞肿瘤A549的生长(空白对照组肿瘤大小是纳米药物组的12倍, 游离GOD组肿瘤大小是纳米药物组的10倍), 治疗27天后甚至能完全消融肿瘤。

|
Figure 3 Schematic illustration of self-assembly of PEG-b-P(PBEM-co-PEM) to form GOD-loaded NRs (theraNR) (A) and the functioning mechanism of theraNR at tumor site including tumor pH-activation, H2O2 production, and QM release for synergistically killing cancer cells (B) (Adapted from Ref. 29 with permission. Copyright © 2017 Wiley). GOD: Glucose oxidase; QM: Quinone methide |
结合以上两种治疗策略, 直接向肿瘤细胞内递送纳米芬顿反应器或将成为更高效的ROS供应策略。近期, 陈小元课题组[30]从纳米粒自供给H2O2的角度出发, 巧妙地利用金属过氧化物富含过氧根的特点, 率先报道了过氧化铜纳米点(copper peroxide nanodots, CP)。CP经内吞进入肿瘤细胞后, 结构中的铜-氧键(Cu-O)在酸性的溶酶体环境中发生断裂, 纳米粒降解的同时释放出芬顿反应物H2O2及催化剂Cu2+。研究者们采用荷人恶性胶质瘤U87MG模型裸鼠进行药效学评价, 结果发现, 给药18天后CP给药组的肿瘤抑制率可达84.85%, 展现出优越的肿瘤抑制作用。另外, 步文博课题组[31]巧妙地构建了转铁蛋白(transferrin, Tf)修饰的过氧化镁(magnesium peroxide, MgO2)纳米片(TMNSs)。当TMNSs被细胞内吞后, Tf能将内源性铁转运至肿瘤部位[32], 而MgO2会在肿瘤酸性环境中发生降解, 从而快速释放大量H2O2。H2O2能在铁的催化下生成·OH而发挥抗肿瘤作用。
2 抑制GPx4酶活性加速芬顿反应能够瞬时产生大量的ROS而发挥强大的抗肿瘤作用。然而, 细胞内依赖于GSH的脂质修复酶GPx4, 可以将有毒的PUFA-LPs-OOH还原为无毒的PUFA-LPs-OH[11, 33, 34], 从而减少脂质自由基的积累来阻止铁死亡的发生与发展。作为重要的抗氧化物, GSH在细胞内的合成需要Xc-转运体系向细胞内转入GSH合成的原料[13]。基于以上机制, 抑制Xc-转运系统功能、降低细胞内GSH含量均能抑制GPx4的活性而发挥铁死亡诱导作用。
2.1 抑制Xc-转运体功能Li等[35]通过乳化法构建了一种erastin-雷帕霉素共价纳米药物(NFER)。NFER中的erastin通过抑制Xc-转运体的功能而抑制GSH的合成, 因此抑制了GPx4的活性, 从而发挥强大的铁死亡诱导作用。雷帕霉素所发挥的自噬诱导作用进一步加强了纳米药物的抗肿瘤作用。研究者们考察了NFER对小鼠成纤维细胞L929和乳腺癌细胞4T1的细胞毒性。研究发现, 与0.7 mg·mL-1 NFER共孵育24 h后L929细胞的存活率保持在80%以上, 而4T1细胞的存活率不足20%, 说明NFER能选择性杀死肿瘤细胞。在药效学研究中, erastin和雷帕霉素等比例混合溶液在荷4T1肿瘤切除模型动物中的肿瘤抑制率约为16.67%, 而NFER纳米药物的肿瘤抑制率高达68.75%, 说明纳米药物对肿瘤复发有更好的控制作用。
2.2 GSH清除凌代舜课题组[36]报道了一种精氨酸修饰的锰掺杂硅纳米粒(AMSNs)以消耗细胞内GSH (图 4)。静脉给药后, AMSNs外表面的精氨酸(arginine, Arg)配体可实现肿瘤归巢。AMSNs中掺杂的锰-氧键(-Mn-O-)为氧化/还原的化学键, 在富含GSH (2~20 mmol·L-1)的肿瘤细胞环境中被切割, 1分子-Mn-O-的断裂将消耗2分子GSH。因此, AMSNs拥有高效的GSH清除能力, 进而发挥较理想的铁死亡诱导作用。体内药效学实验采用人肝癌细胞Huh7肿瘤模型裸鼠进行。研究结果表明, 游离多柔比星(doxorubicin, DOX)和AMSN在给药14天后的肿瘤抑制率分别约为19.51%和45.12%, 而AMSN/DOX给药组的肿瘤抑制率约为73.17%。表明其具有优越的肿瘤抑制作用。-Mn-O-的降解会游离出Mn2+, 可以实现肿瘤核磁共振成像(magnetic resonance imaging, MRI)。另外, 本课题组发现, 多机制GSH清除策略能够发挥更加迅速且强大的铁死亡诱导作用[37]。

|
Figure 4 Schematic illustration of the designed synthesis of the arginine-rich manganese silicate nanobubbles as well as the in vivo tumor homing after blood circulation (Adapted from Ref. 36 with permission. Copyright © 2018 American Chemical Society). Arg: Arginine; DOX: Doxorubicin; GSSG: Glutathiol; MRI: Magnetic resonance imaging; ASS: Argininosuccinate synthetase |
脂质过氧化物主要来自氧化刺激下膜磷脂中PUFA-LPs-OH。因此, 除了诱导芬顿反应和抑制GPx4以外, 通过向癌细胞中补充额外的PUFA-LPs-OH或脂质过氧化物也可以增强基于铁死亡的癌症治疗效果。陈小元课题组[38]报道了一种脂质过氧化物的外源递送纳米体系(IO-LAHP NPs), 如图 5所示, 磷酸基团通过疏水性亚油酸过氧化物(linoleic acid hydroperoxide, LAHP)和亲水性低聚乙二醇被修饰在氧化铁纳米粒(iron oxide nanoparticles, IO NPs)的表面。其中IO NPs采用亚稳态的FeO和Fe3O4作为二价铁源, 能够催化单线态氧(singlet oxygen, 1O2)的生成。在肿瘤酸性环境中, H+能穿透聚合物并使氧化铁纳米粒降解释放出Fe2+, 随后LAHP在Fe2+的催化下通过Russell机制分解成自由基和1O2。实验证明, IO-LAHP NPs可以通过肿瘤部位特异性ROS的产生, 以及随后ROS介导的肿瘤铁死亡和细胞凋亡而诱导肿瘤细胞死亡。药效学结果显示, U87MG皮下瘤裸鼠模型静脉给药18天后, Au-LAHP和IO-LA组的肿瘤抑制率约为36.23%, 而IO-LAHP NPs给药组的肿瘤抑制率高达93.62%。说明将脂质过氧化物递送进入肿瘤细胞的策略能够发挥强的肿瘤抑制作用。

|
Figure 5 Activatable singlet oxygen (1O2) generation through a biochemical reaction between LAHP and catalytic Fe2+ ions by the Russell mechanism. IO-LAHP NPs were fabricated by tethering phosphate group terminated hydrophobic (p1) and hydrophilic (p2) polymer brushes on surface of iron oxide nanoparticles. After internalization with cancer cells, the release of Fe2+ ions under acidic environment generates 1O2 species which exert cancer cell death through reactive oxygen species mediated mechanism (Adapted from Ref. 38 with permission. Copyright © 2017 Wiley) |
迄今为止, 化疗仍然是肿瘤治疗中最重要的非手术疗法之一[39-41]。临床用的化疗药物大部分为凋亡诱导药物, 如DOX、顺铂和紫杉醇等。由于长时间的使用, 耐药、转移、复发及不良反应等问题不断涌现[39-42]。近年来, 将这些药物与其他治疗方式结合已经成为临床癌症治疗的趋势。
许多研究[22, 43-46]报道, 将凋亡诱导药物与诱导铁死亡的纳米递药系统结合已经成为一种具有广阔前景的治疗策略。Bao等[43]构建了一种共同装载DOX和铁离子的多重响应纳米递药系统。如图 6所示, 氧化淀粉基凝胶在Fe3+的存在下发生交联形成纳米粒, 同时包封上转换纳米粒(up-conversion NPs, UCNP)与DOX, 随后表面修饰聚乙烯亚胺(polyethylenimine, PEI)和2, 3-二甲基马来酸酐(2, 3-dimethylmaleic anhydride, DMMA)。纳米药物经静脉注射进入肿瘤部位后, DMMA在弱酸性微环境下脱落, 纳米粒发生电位反转。在近红外光的照射下, UCNP将近红外光转换成紫外光的同时可以促进Fe3+还原成Fe2+, 凝胶网络也随之瓦解, 从而释放出Fe2+和DOX。Fe2+作为芬顿反应催化剂能诱导肿瘤细胞铁死亡, 而DOX则将诱导肿瘤细胞凋亡。药效学结果显示, 在荷乳腺癌4T1小鼠模型中, 游离DOX的肿瘤抑制率约为53.85%。而所构建的纳米药物在近红外光的照射下肿瘤抑制率约为92.31%。表明Fe2+触发的铁死亡和DOX诱导的凋亡能发挥较好的铁死亡-凋亡协同作用。
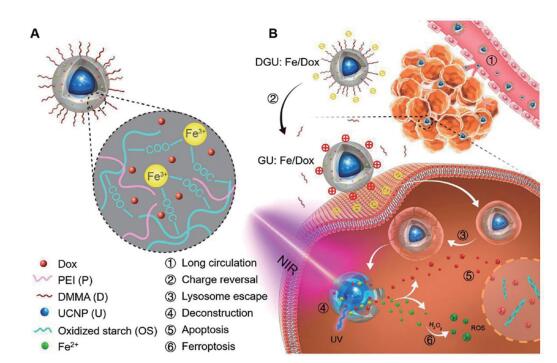
|
Figure 6 Schematic illustration of nanolongan with multiple conversions and the corresponding anticancer mechanism. A: The Fe3+ cross-linked structure of nanolongan carrier containing up-conversion NPs (UCNP) as the core and doxorubicin (Dox) absorbed in the polymer shell. The nanolongan was formed by coordination of carboxyl groups on oxidized starch polymers with Fe3+ and further decorated with polyethylenimine (PEI) and 2, 3-dimethylmaleic anhydride (DMMA); B: Corresponding anticancer mechanism for nanolongan (Adapted from Ref. 43 with permission. Copyright © 2019 American Chemical Society). UV: Ultraviolet |
免疫疗法已成为一种有前途的癌症治疗方法, FDA已经批准了几种检验点抑制剂(如nivolumab、PD-1抗体)用于临床[5, 6, 47]。尽管前景广阔, 但免疫疗法仍然存在一些不可忽视的问题, 如在临床中仅有部分患者能进行免疫治疗, 并存在严重的不良反应[5, 6]。对于实体瘤而言, 免疫疗法的功效通常不如化疗或放疗等[5, 6], 而联合其他疗法能够克服免疫治疗的局限[48]。
近年来, 已发现铁死亡与免疫调节密切相关[49, 50]。免疫治疗中活化的细胞毒性T细胞(CD8+ T细胞)可以显著促进肿瘤细胞中与铁死亡相关的脂质过氧化, 而促进的铁死亡又有助于提高免疫疗法的疗效[49]。具体机制如下: CD8+ T细胞可通过释放干扰素γ来下调SLC3A2和SLC7A11的表达, 从而降低肿瘤细胞对胱氨酸的摄取并抑制FUPA-LPs-OOH的还原[49]。上述发现为铁死亡联合免疫疗法协同治疗肿瘤奠定了理论基础[49]。基于此, Zhang等[49]构建了一种仿生的磁小体(Pa-M/Ti-NC), 以促进癌症治疗中的铁死亡/免疫调节协同作用。如图 7所示, 研究者用白细胞膜包被Fe3O4磁性纳米粒, 并将TGF-β抑制剂(TGF-β inhibitor, Ti)包裹在膜内, 最后通过点击化学将PD-1抗体(PD-1 antibody, Pa)锚定在纳米粒的外表面。静脉注射给药后, Fe3O4磁性纳米粒可实现MRI诊断与纳米药物示踪。在肿瘤部位, Ti和Pa可以协同产生免疫原性微环境并提高H2O2水平。H2O2在Fe2+/3+的催化下产生有毒的·OH并引发肿瘤细胞铁死亡, 而死细胞释放的肿瘤抗原反过来又促进了微环境的免疫原性。实验采用小鼠黑色素瘤细胞B16F10肿瘤模型进行药效学评价。研究结果显示, 与磷酸盐缓冲液(PBS)组相比, Ti和Pa单独静脉给药并不能防止肿瘤复发, 而肿瘤切除后经Pa-M/Ti-NC联合治疗, 其体积几乎没有增大。最终, 铁死亡和免疫调节相互促进, 取得了理想的联合抗肿瘤作用。
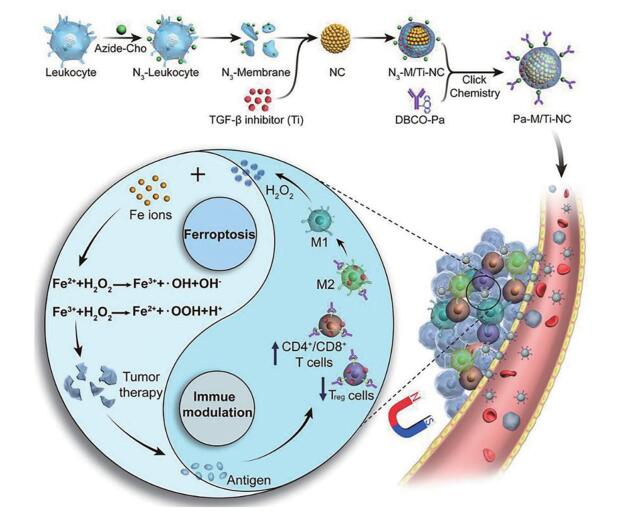
|
Figure 7 Schematic illustration of a biomimetic magnetosome for ferroptosis/ immunomodulation synergism in cancer (Adapted from Ref. 49 with permission. Copyright © 2019 American Chemical Society). NC: Fe3O4 magnetic nanocluster; Pa: PD-1 antibody; Treg cells: Regulatory T cells |
最近研究表明, p53基因除了能够调节细胞周期、凋亡和衰老之外, 还可以通过抑制SLC7A11的表达来抑制胱氨酸的摄取并诱导细胞铁死亡[51]。Zheng等[52]将p53质粒封装到金属有机框架中(MON-p53), 并利用p53基因诱导的铁死亡与细胞凋亡双重作用治疗肿瘤。研究者们将单宁酸(一种从绿茶中提取的FDA批准的食品添加剂)与Fe3+结合, 在PEI/p53质粒复合物(PEI/p53)的表面形成金属有机框架(MON), 从而获得MON-p53。如图 8所示, 一旦MON-p53被细胞内吞, Fe3+就可以诱导芬顿反应产生ROS, 而细胞内ROS浓度高将导致生物膜PUFA-LPs-OOH的堆积。同时, 表达的p53蛋白进一步抑制脂质过氧化物的消除。MON-p53处理后, 人纤肉瘤HT1080细胞的形态变化表明, 肿瘤细胞发生铁死亡。纳米药物静脉给药以后, MON-p53能够显著抑制HT1080肿瘤的生长, 中位生存时间从44.5天(PBS处理的小鼠)显著延长至75天(MON-p53处理的小鼠)。此外, acyl-CoA synthetase long-chain family member 4 (ACSL4)[53]、p62[54]、CDGSH iron sulfur domain 1 (CISD1)[55]和heat shock protein beta-1 (HSPB1)[56]等基因也被报道是肿瘤细胞铁死亡的调控因子。通过RNA干扰技术, 在癌细胞中调节上述基因, 可能会协同诱导铁死亡纳米药物发挥更强的抗肿瘤效果。
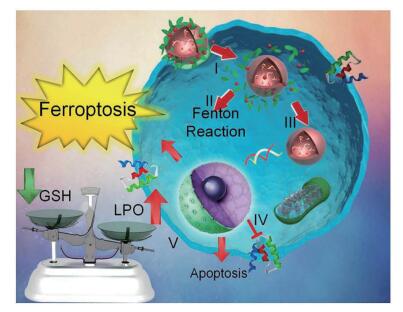
|
Figure 8 Schematic illustration for metal organic network (MON) encapsulated with p53 plasmid (MON-p53) mediated anti-cancer therapy. (Ⅰ) Endocytosis of MON-p53. (Ⅱ) Fenton reaction induced by MON. (Ⅲ) Transfection and expression of p53 protein. (Ⅳ) Inhibition of transmembrane SLC7A11 protein mediated by p53 protein. (Ⅴ) Fenton reaction regulated lipid peroxidation (LPO) accumulation and SLC7A11 inhibition induced glutathione (GSH) depletion caused ferroptosis; p53 protein regulated apoptosis pathway and cause apoptosis (Adapted from Ref. 52 with permission. Copyright © 2017 American Chemical Society) |
近年来, 超声(ultrasonic, US)从诊断扩展到治疗性应用, 如高强度聚焦超声用于消融肿瘤, 声动力学疗法用于治疗阿尔茨海默病, 打开生物屏障, 超声响应药物释放和增强细胞内药物传递等[57]。其中, 超声的空化作用是由液体中的微气核空化泡在声波的作用下快速膨胀和剧烈崩塌所导致。空化效应不但能释放微泡中携带的药物, 而且能够导致高温并引起水热解离, 从而产生ROS[58]。基于超声的以上特点, Li等[59]用双乳法构建了H2O2为内核, 外壳载有Fe3O4纳米粒的PLGA囊泡(H2O2/Fe3O4-PLGA) (图 9)。在超声辐射下, H2O2分解成O2而产生空化效应, 导致有机物囊泡的破裂。因囊泡破裂而释放的Fe3O4纳米粒与H2O2通过芬顿反应生成有毒的•OH, 从而发挥高效的铁死亡诱导作用。同时, 超声空化作用会引起水热解离和细胞氧化应激, 进一步增加ROS。该研究采用荷人宫颈癌细胞HeLa裸鼠模型进行药效学考察。研究结果显示, 磁靶向协同H2O2/Fe3O4-PLGA处理组的肿瘤抑制率约为73.15%, 而超声和磁靶向协同H2O2/Fe3O4-PLGA处理组肿瘤几乎完全消失, 说明超声能促使纳米药物表现出优越的肿瘤抑制作用。此外, 超声空化效应所产生的O2和释放的Fe3O4能够实现US/MRI双模态成像。

|
Figure 9 Schematic diagram of ferroptosis inducing cancer therapy by H2O2/Fe3O4-PLGA polymersomes (Adapted from Ref. 59 with permission. Copyright © 2016 American Chemical Society). PLGA: Poly(lactic-co-glycolic acid); US: Ultrasonic; MR: Magnetic resonance; •OH: Hydroxyl radical |
光动力治疗(photodynamic therapy, PDT)是一种非侵入性癌症治疗方法, 通过将光激发光敏剂的能量转移到氧气中以产生高毒性的ROS来诱导肿瘤细胞死亡[60]。因此光动力治疗本身具有很强的铁死亡诱导作用。然而, 肿瘤细胞高水平的GSH不仅具有化学、放射和光动力治疗抗性, 而且还可以作为抗氧化剂清除细胞内ROS[61, 62]。这对体内PDT的应用是一个巨大的挑战。因此, 迫切需要一个能够同时实现有效光动力疗法介导ROS生成和细胞内GSH消除的智能递药系统, 以实现高效铁死亡诱导作用。Wan等[63]通过Mn (Ⅲ)和光敏剂卟啉(porphyrin, TCPP)之间通过配位键, 采用一锅法设计合成的Mn (Ⅲ)封印的金属有机骨架(metal-organic framework, MOF)纳米体系(图 10)。在正常生理环境中, Mn (Ⅲ)作为封印剂, 淬灭了TCPP的荧光, 而且抑制了ROS的生成, 这使MOF成为“惰性”的纳米粒。当其被肿瘤细胞内吞后, 由于Mn (Ⅲ)与GSH之间的氧化还原反应, MOF被肿瘤细胞中的细胞内GSH分解成Mn (Ⅱ)和游离TCPP。这种分解为光动力疗法创造了GSH缺乏的环境, TCPP的释放可以在辐照下实现可控的ROS生成。该研究考察了MOF对小鼠成纤维细胞3T3细胞和乳腺癌细胞4T1细胞的作用。结果发现, 当给药剂量为[Mn] = 5.6 μg·mL-1时, 4T1细胞的生存率约为50%, 而3T3细胞的生存率约为80%。说明MOF因具有肿瘤GSH响应降解的特征, 因此对3T3细胞的毒性较小。研究者们进一步评价了4T1荷瘤小鼠的治疗效果。研究结果显示, MOFs给药组肿瘤抑制率约为61.48%。当与660 nm激光联合作用时抑瘤作用增强, 给药14天后, 联合治疗组的肿瘤抑制率高达67.22%。此外, 这种GSH调节的TCPP释放可以在辐照下实现可控的ROS生成, 从而避免了不良反应(炎症和正常组织的损伤)。
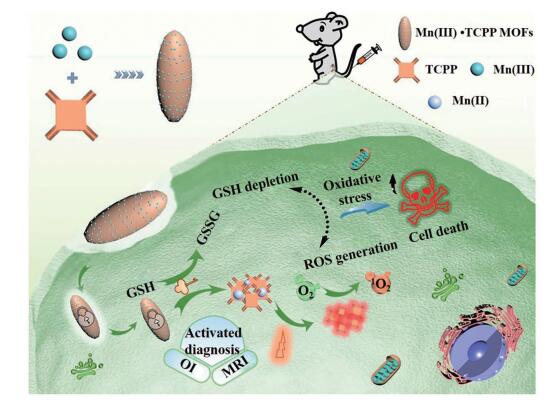
|
Figure 10 Schematic illustration of an endocytosis Mn (Ⅲ)-sealed metal-organic framework (MOFs) nanosystem for magnetic resonance imaging (MRI)- and optical imaging (OI)-guided photodynamic therapy by controlled reactive oxygen species (ROS) generation and glutathione (GSH) depletion after being unlocked by overexpressed GSH in tumor cells (Adapted from Ref. 63 with permission. Copyright © 2019 American Chemical Society). TCPP: Porphyrin; GSSG: Glutathiol; 1O2: Singlet oxygen |
本文综述了铁死亡诱导纳米制剂的研发思路以及基于铁死亡的联合疗法。鉴于肿瘤细胞能够通过代谢补偿, 适应不断变化的微环境, 仅仅提高肿瘤细胞内ROS浓度或抑制GPx4酶活性的铁死亡诱导剂并不能取得强大而持久的抑瘤作用。多角度协同诱导肿瘤细胞铁死亡将成为更有效的肿瘤治疗趋势。在铁死亡纳米制剂中, 功能性纳米材料发挥着举足轻重的作用, 如清除GSH、供应与募集芬顿反应催化剂, 以及生成H2O2等。超声治疗、光动力治疗中ROS的生成能够辅助诱导铁死亡纳米药物发挥更强的肿瘤抑制作用。尽管基于铁死亡的抗肿瘤纳米疗法发展迅速, 但其潜在的临床应用价值仍有待进一步考察。第一, 应明确铁死亡治疗的临床有效性。铁死亡治疗还处在初始探究阶段, 几乎所有研究数据都来源于实验动物, 因此还需要持续而广泛的研究支撑其有效性。另外, 应该深入研究基于铁死亡的肿瘤联合治疗方式, 以克服现有治疗方式客观存在的问题。第二, 应全面表征肿瘤铁死亡治疗的毒副作用。诱导铁死亡纳米药物作用强而迅速, 与细胞凋亡或免疫治疗相比, 不需要多级信号传导。因此此类药物也存在着较大的毒副作用, 应该确保芬顿反应的肿瘤特异性触发, 以规避其脱靶毒性。第三, 应明确不同肿瘤类型对铁死亡治疗的敏感性。不同肿瘤细胞对ROS的耐受情况不同, 对铁死亡治疗的敏感程度也不一样。处于氧化磷酸化应激状态的肿瘤细胞, 对ROS的耐受性也会增强。应该深入剖析不同肿瘤细胞对ROS耐受情况, 并选择敏感性肿瘤采取铁死亡治疗策略。第四, 关注铁死亡耐受及其机制。肿瘤细胞能够通过基因改变等不断适应变化的微环境, 应该明确其对ROS的耐受机制, 从而延缓耐药的发生。第五, 多样化的铁死亡联合纳米治疗药物可能会产生协同效应, 但是要避免其结构过于复杂, 影响工业可行性。总的来说, 虽然铁死亡诱导型纳米药物能够取得理想的抑瘤作用, 但是肿瘤的铁死亡治疗正处于起步阶段, 许多问题需要被阐明, 基础研究工作任重道远。
作者贡献:李超群负责文章的撰写和修改; 汤红霞和张悦负责查阅部分文献并整理; 宋倩倩和陈凤英负责稿件的修改和校验; 费伟东负责文章的选题、设计, 把握文章方向, 同时负责文章的撰写、绘图和修改。
利益冲突:全体作者声明无任何利益冲突。
| [1] |
Lu Y, Wang Y, Miao L, et al. Exploiting in situ antigen generation and immune modulation to enhance chemotherapy response in advanced melanoma:a combination nanomedicine approach[J]. Cancer Lett, 2016, 379: 32-38. DOI:10.1016/j.canlet.2016.05.025 |
| [2] |
Ashkenazi A, Fairbrother WJ, Leverson JD, et al. From basic apoptosis discoveries to advanced selective BCL-2 family inhibitors[J]. Nat Rev Drug Discov, 2017, 16: 273-284. DOI:10.1038/nrd.2016.253 |
| [3] |
Johnstone RW, Ruefli AA, Lowe SW. Apoptosis:a link between cancer genetics and chemotherapy[J]. Cell, 2002, 108: 153-164. DOI:10.1016/S0092-8674(02)00625-6 |
| [4] |
Teng F, Meng X, Kong L, et al. Progress and challenges of predictive biomarkers of anti PD-1/PD-L1 immunotherapy:a systematic review[J]. Cancer Lett, 2018, 414: 166-173. DOI:10.1016/j.canlet.2017.11.014 |
| [5] |
Pham T, Roth S, Kong J, et al. An update on immunotherapy for solid tumors:a review[J]. Ann Sur Oncol, 2018, 25: 3404-3412. DOI:10.1245/s10434-018-6658-4 |
| [6] |
Adams S, Gatti-Mays ME, Kalinsky K, et al. Current landscape of immunotherapy in breast cancer:a review[J]. JAMA Oncol, 2019, 5: 1205-1214. DOI:10.1001/jamaoncol.2018.7147 |
| [7] |
Chu DK, Wood RA, French S. Oral immunotherapy for peanut allergy (PACE):a systematic review and meta-analysis of efficacy and safety[J]. Lancet, 2019, 393: 1936. DOI:10.1016/S0140-6736(19)31010-4 |
| [8] |
Yagoda N, von Rechenberg M, Zaganjor E, et al. RAS-RAF-MEK-dependent oxidative cell death involving voltage-dependent anion channels[J]. Nature, 2007, 447: 864-868. DOI:10.1038/nature05859 |
| [9] |
Yang CY, Wang WD, Deng HL., et al. Tryptanthrin derivative CY-1-4 nanoparticle induces ferroptosis in B16-F10 cells[J]. Acta Pharm Sin, 2019, 54: 1288-1296. |
| [10] |
Cheng ZY, Li YZ. What is responsible for the initiating chemistry of iron-mediated lipid peroxidation:an update[J]. Chem Rev, 2007, 107: 748-766. DOI:10.1021/cr040077w |
| [11] |
Seiler A, Schneider M, Foerster H, et al. Glutathione peroxidase 4 senses and translates oxidative stress into 12/15-lipoxygenase dependent-and AIF-mediated cell death[J]. Cell Metabol, 2008, 8: 237-248. DOI:10.1016/j.cmet.2008.07.005 |
| [12] |
Mahalakshmi B, Huang HL, Lee SD, et al. Functional role of ferroptosis on cancers, activation and deactivation by various therapeutic candidates-an update[J]. Chem Biol Interact, 2019, 317: 108930. DOI:10.1016/j.cbi.2019.108930 |
| [13] |
Dixon S, Lemberg K, Lamprecht M, et al. Ferroptosis:an iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149: 1060-1072. DOI:10.1016/j.cell.2012.03.042 |
| [14] |
Dolma S, Lessnick SL, Hahn WC, et al. Identification of genotype-selective antitumor agents using synthetic lethal chemical screening in engineered human tumor cells[J]. Cancer Cell, 2003, 3: 285-296. DOI:10.1016/S1535-6108(03)00050-3 |
| [15] |
Haynes RK, Chan WC, Lung CM, et al. The Fe2+-mediated decomposition, PfATP6 binding, and antimalarial activities of artemisone and other artemisinins:the unlikelihood of C-centered radicals as bioactive intermediates[J]. ChemMedChem, 2007, 2: 1480-1497. DOI:10.1002/cmdc.200700108 |
| [16] |
Dong L, Wang C, Zhen W, et al. Biodegradable iron-coordinated hollow polydopamine nanospheres for dihydroartemisinin delivery and selectively enhanced therapy in tumor cells[J]. J Mater Chem B, 2019, 7: 6172-6180. DOI:10.1039/C9TB01397K |
| [17] |
Shen Z, Song J, Yung BC, et al. Emerging strategies of cancer therapy based on ferroptosis[J]. Adv Mater, 2018, 30: 1704007. DOI:10.1002/adma.201704007 |
| [18] |
Matos AI, Carreira B, Peres C, et al. Nanotechnology is an important strategy for combinational innovative chemo-immunotherapies against colorectal cancer[J]. J Control Release, 2019, 307: 108-138. DOI:10.1016/j.jconrel.2019.06.017 |
| [19] |
Chen Q, Liu G, Liu S, et al. Remodeling the tumor microenvironment with emerging nanotherapeutics[J]. Trends Pharmacol Sci, 2018, 39: 59-74. DOI:10.1016/j.tips.2017.10.009 |
| [20] |
Qian X, Zhang J, Gu Z, et al. Nanocatalysts-augmented Fenton chemical reaction for nanocatalytic tumor therapy[J]. Biomaterials, 2019, 211: 1-13. DOI:10.1016/j.biomaterials.2019.04.023 |
| [21] |
Zhang C, Bu W, Ni D, et al. Synthesis of iron nanometallic glasses and their application in cancer therapy by a localized fenton reaction[J]. Angew Chem Int Ed Engl, 2016, 55: 2101-2106. DOI:10.1002/anie.201510031 |
| [22] |
Yue L, Dai Z, Chen X, et al. Development of a novel FePt-based multifunctional ferroptosis agent for high-efficiency anticancer therapy[J]. Nanoscale, 2018, 10: 17858-17864. DOI:10.1039/C8NR05150J |
| [23] |
Huo M, Wang L, Wang Y, et al. Nanocatalytic tumor therapy by single-atom catalysts[J]. ACS Nano, 2019, 13: 2643-2653. |
| [24] |
Fan JX, Peng MY, Wang H, et al. Engineered bacterial bioreactor for tumor therapy via Fenton-like reaction with localized H2O2 generation[J]. Adv Mater, 2019, 31:e1808278. |
| [25] |
Gao S, Lin H, Zhang H, et al. Nanocatalytic tumor therapy by biomimetic dual inorganic nanozyme-catalyzed cascade reaction[J]. Adv Sci, 2019, 6: 1801733. DOI:10.1002/advs.201801733 |
| [26] |
Wang CM, Wang KH, Chen XD. Glucose oxidase:natural occurrence, function, properties and industrial applications[J]. Appl Microbiol Biotechnol, 2008, 78: 927-938. DOI:10.1007/s00253-008-1407-4 |
| [27] |
Zhang C, Ni DL, Liu YY, et al. Magnesium silicide nanoparticles as a deoxygenation agent for cancer starvation therapy[J]. Nat Nanotechnol, 2017, 12: 378-386. DOI:10.1038/nnano.2016.280 |
| [28] |
Heiden MGV, Cantley LC, Thompson CB. Understanding the warburg effect:the metabolic requirements of cell proliferation[J]. Science, 2009, 324: 1029-1033. DOI:10.1126/science.1160809 |
| [29] |
Li J, Dirisala A, Ge Z, et al. Therapeutic vesicular nanoreactors with tumor-specific activation and self-destruction for synergistic tumor ablation[J]. Angew Chem Int Ed Engl, 2017, 56: 14025-14030. DOI:10.1002/anie.201706964 |
| [30] |
Lin LS, Huang T, Song J, et al. Synthesis of copper peroxide nanodots for H2O2 self-supplying chemodynamic therapy[J]. J Am Chem Soc, 2019, 141: 9937-9945. DOI:10.1021/jacs.9b03457 |
| [31] |
Tang ZM, Liu YY, Ni DL, et al. Biodegradable nanoprodrugs:"delivering" ROS to cancer cells for molecular dynamic therapy[J]. Adv Mater, 2019, 15: 1904011. DOI:10.1002/adma.201904011 |
| [32] |
Xia Q, Yang XW, Yang XD, et al. Drug delivery via the transferrin receptor-mediated endocytosis pathway[J]. J Chin Pharm Sci, 2008, 18: 7-13. DOI:10.1124/pr.54.4.561 |
| [33] |
Yang WS, SriRamaratnam R, Welsch ME, et al. Regulation of ferroptotic cancer cell death by GPX4[J]. Cell, 2014, 156: 317-331. DOI:10.1016/j.cell.2013.12.010 |
| [34] |
Stockwell BR, Friedmann Angeli JP, Bayir H, et al. Ferroptosis:a regulated cell death Nexus linking metabolism, redox biology, and disease[J]. Cell, 2017, 171: 273-285. DOI:10.1016/j.cell.2017.09.021 |
| [35] |
Li YQ, Wang XY, Yan JJ, et al. Nanoparticle ferritin-bound erastin and rapamycin:a nanodrug combining autophagy and ferroptosis for anticancer therapy[J]. Biomater Sci, 2019, 7: 3779-3787. DOI:10.1039/C9BM00653B |
| [36] |
Wang S, Li F, Qiao R, et al. Arginine-rich manganese silicate nanobubbles as a ferroptosis-inducing agent for tumor-targeted theranostics[J]. ACS Nano, 2018, 12: 12380-12392. DOI:10.1021/acsnano.8b06399 |
| [37] |
Tang H, Chen D, Li C, et al. Dual GSH-exhausting sorafenib loaded manganese-silica nanodrugs for inducing the ferroptosis of hepatocellular carcinoma cells[J]. Int J Pharm, 2019, 572: 118782. DOI:10.1016/j.ijpharm.2019.118782 |
| [38] |
Zhou Z, Song J, Tian R, et al. Activatable singlet oxygen generation from lipid hydroperoxide nanoparticles for cancer therapy[J]. Angew Chem Int Ed Engl, 2017, 56: 6492-6496. DOI:10.1002/anie.201701181 |
| [39] |
Gustavsson B, Carlsson G, Machover D, et al. A review of the evolution of systemic chemotherapy in the management of colorectal cancer[J]. Clin Colorect Cancer, 2015, 14: 1-10. DOI:10.1016/j.clcc.2014.11.002 |
| [40] |
Romero D. Breast cancer metronomic chemotherapy for elderly and/or frail patients[J]. Nat Rev Clin Oncol, 2018, 15: 266. |
| [41] |
Desai A, Yan Y, Gerson SL. Concise reviews:cancer stem cell targeted therapies:toward clinical success[J]. Stem Cells Translat Med, 2019, 8: 75-81. DOI:10.1002/sctm.18-0123 |
| [42] |
Luo C, Sun J, Sun B, et al. Prodrug-based nanoparticulate drug delivery strategies for cancer therapy[J]. Trends Pharmacol Sci, 2014, 35: 12-22. DOI:10.1016/j.tips.2013.11.001 |
| [43] |
Bao W, Liu X, Lv Y, et al. Nanolongan with multiple on-demand conversions for ferroptosis-apoptosis combined anticancer therapy[J]. ACS Nano, 2019, 13: 260-273. DOI:10.1021/acsnano.8b05602 |
| [44] |
Ma PA, Xiao H, Yu C, et al. Enhanced cisplatin chemotherapy by iron oxide nanocarrier-mediated generation of highly toxic reactive oxygen species[J]. Nano Lett, 2017, 17: 928-937. DOI:10.1021/acs.nanolett.6b04269 |
| [45] |
Shen Z, Liu T, Li Y, et al. Fenton-reaction-acceleratable magnetic nanoparticles for ferroptosis therapy of orthotopic brain tumors[J]. ACS Nano, 2018, 12: 11355-11365. DOI:10.1021/acsnano.8b06201 |
| [46] |
Zheng DW, Lei Q, Zhu JY, et al. Switching apoptosis to ferroptosis:metal-organic network for high-efficiency anticancer therapy[J]. Nano Lett, 2017, 17: 284-291. DOI:10.1021/acs.nanolett.6b04060 |
| [47] |
Gong J, Chehrazi-Raffle A, Reddi S, et al. Development of PD-1 and PD-L1 inhibitors as a form of cancer immunotherapy:a comprehensive review of registration trials and future considerations[J]. J Immunother Cancer, 2018, 6: 8. DOI:10.1186/s40425-018-0316-z |
| [48] |
George S, Rini BI, Hammers HJ. Emerging role of combination immunotherapy in the first-line treatment of advanced renal cell carcinoma a review[J]. JAMA Oncol, 2019, 5: 411-421. DOI:10.1001/jamaoncol.2018.4604 |
| [49] |
Zhang F, Li F, Lu GH, et al. Engineering magnetosomes for ferroptosis/immunomodulation synergism in cancer[J]. ACS Nano, 2019, 13: 5662-5673. DOI:10.1021/acsnano.9b00892 |
| [50] |
Wang WM, Green M, Choi JE, et al. CD8(+) T cells regulate tumour ferroptosis during cancer immunotherapy[J]. Nature, 2019, 569: 270-274. DOI:10.1038/s41586-019-1170-y |
| [51] |
Jiang L, Kon N, Li TY, et al. Ferroptosis as a p53-mediated activity during tumour suppression[J]. Nature, 2015, 520: 57-62. DOI:10.1038/nature14344 |
| [52] |
Zheng DW, Lei Q, Zhu JY, et al. Switching apoptosis to ferroptosis:metal-organic network for high-efficiency anticancer therapy[J]. Nano Lett, 2017, 17: 284-291. DOI:10.1021/acs.nanolett.6b04060 |
| [53] |
Doll S, Proneth B, Tyurina YY, et al. ACSL4 dictates ferroptosis sensitivity by shaping cellular lipid composition[J]. Nat Chem Biol, 2017, 13: 91-98. DOI:10.1038/nchembio.2239 |
| [54] |
Sun X, Ou Z, Chen R, et al. Activation of the p62-Keap1-NRF2 pathway protects against ferroptosis in hepatocellular carcinoma cells[J]. Hepatology, 2016, 63: 173-184. DOI:10.1002/hep.28251 |
| [55] |
Yuan H, Li X, Zhang X, et al. CISD1 inhibits ferroptosis by protection against mitochondrial lipid peroxidation[J]. Biochem Biophys Res Commun, 2016, 478: 838-844. DOI:10.1016/j.bbrc.2016.08.034 |
| [56] |
Sun X, Ou Z, Xie M, et al. HSPB1 as a novel regulator of ferroptotic cancer cell death[J]. Oncogene, 2015, 34: 5617-5625. DOI:10.1038/onc.2015.32 |
| [57] |
Zhou Y, Han X, Jing X, et al. Construction of silica-based micro/nanoplatforms for ultrasound theranostic biomedicine[J]. Adv Healthc Mater, 2017, 6: 1700646. DOI:10.1002/adhm.201700646 |
| [58] |
Rosenthal I, Sostaric JZ, Riesz P. Sonodynamic therapy-a review of the synergistic effects of drugs and ultrasound[J]. Ultra Sonochem, 2004, 11: 349-363. |
| [59] |
Li WP, Su CH, Chang YC, et al. Ultrasound-induced reactive oxygen species mediated therapy and imaging using a fenton reaction activable polymersome[J]. ACS Nano, 2016, 10: 2017-2027. DOI:10.1021/acsnano.5b06175 |
| [60] |
Dolmans D, Fukumura D, Jain RK. Photodynamic therapy for cancer[J]. Nat Rev Cancer, 2003, 3: 380-387. DOI:10.1038/nrc1071 |
| [61] |
Lim CK, Heo J, Shin S, et al. Nanophotosensitizers toward advanced photodynamic therapy of cancer[J]. Cancer Lett, 2013, 334: 176-187. DOI:10.1016/j.canlet.2012.09.012 |
| [62] |
Diehn M, Cho RW, Lobo NA, et al. Association of reactive oxygen species levels and radioresistance in cancer stem cells[J]. Nature, 2009, 458: 780-783. DOI:10.1038/nature07733 |
| [63] |
Wan SS, Cheng Q, Zeng X, et al. A Mn(Ⅲ)-sealed metal-organic framework nanosystem for redox-unlocked tumor theranostics[J]. ACS Nano, 2019, 13: 6561-6571. DOI:10.1021/acsnano.9b00300 |
 2020, Vol. 55
2020, Vol. 55


