2. 抗体药物与靶向治疗国家重点实验室, 国家药品监督管理局治疗类单抗质量控制重点实验室, 上海 201203
2. State Key Laboratory of Antibody Medicine and Targeted Therapy, NMPA Key Laboratory for Quality Control of Therapeutic Monoclonal Antibodies, Shanghai 201203, China
近年来, 治疗类抗体药物发展迅速, 已成为现代生物制药的主力军。治疗类抗体药物可以特异性地与靶抗原结合, 发挥疾病治疗作用, 具有选择性高、不良反应少等优势, 其分子量巨大、结构复杂, 包括有单抗、抗体融合蛋白、抗体片段、抗体偶联药物、多功能抗体等。它们一般由细胞重组表达, 不同的理化因素会使其在生产过程中发生诸如糖基化、氧化、糖化、脱酰胺、异构化及端基环化等修饰, 形成翻译后修饰(post-translation modification, PTMs)变异体, 导致产品在糖型、电荷、半胱氨酸、相关氧化物、大小、微量突变等方面存在差异[1]。这些变异体作为产品质量相关属性(product quality attribute, PQA)的一部分, 可能对产品的功能产生影响。
为了更好地对关键质量属性(critical quality attribute, CQA)甚至PQA进行控制, 进而保障治疗类抗体药物的质量, 目前常用的QC方法包括:毛细管电泳法、离子交换色谱法、亲水色谱法、反相高效液相色谱法、体积排阻色谱法或疏水相互作用色谱法等[2]。这些方法通常分别用于分析不同的PQA, 如:还原SDS毛细管电泳用于分析剪切变异体, 离子交换色谱用于分析电荷变异体, 亲水色谱用于分析寡糖分布。近年来, 质谱(mass spectrometry, MS)技术已经广泛用于治疗类抗体药物PQA及潜在CQA的表征, 以评估工艺变更后的产品差异及对产品质量安全性及有效性的影响、鉴别假药、研究药物药效学/药代动力学、确认早期药物研发中的CQA等[3-6]。
随着MS分辨率、质量精度等检测性能的提升以及半自动化数据处理软件的开发, 目前出现了基于MS的多属性分析方法(multi-attribute method, MAM)。该方法通过MS分析治疗类抗体药物的肽段, 可以对包括糖基化、氧化、脱酰胺、异构化、C末端赖氨酸缺失在内的诸多PQA进行定量分析, 反映PQA在变异体、多批次稳定性样品、工艺开发与变更样品中的变化。MAM还具有杂质分析功能, 为药品的质控提供更加快速和全面的分析, 有望在未来替代还原SDS毛细管电泳、亲水色谱、离子交换色谱等多种传统方法。作为一种新方法, MAM用于治疗类抗体药物质量控制(quality control, QC)正处于快速发展阶段[7]。为了使该方法更好地应用于QC, 本文将介绍MAM的基本流程、在生物制药领域的应用特别在QC中的应用、FDA对于该方法在QC中应用的考量以及面临的机遇与挑战, 以期为MAM在我国治疗类抗体药物中的应用提供思路, 并为其在QC中更好地开发、使用、替代传统方法奠定基础。
1 MAM基本流程及其在研发及QC中的应用 1.1 MAM基本流程典型的基于LC-MS (liquid chromatography-mass spectrometry, LC-MS)肽图的MAM工作流程是, 治疗类抗体药物经过变性、还原、烷基化处理后, 酶解为含有PQA信息的多肽, 是一个自下而上(bottom up)的检测策略。基于对治疗类抗体的PQA以及其中CQA的全面了解, 采用LC-MS结合数据库搜索软件对多肽进行鉴定, 进一步基于不同m/z信息通过自动化的软件进行定量, 获得氨基酸序列、PTM、化学修饰以及剪切体等信息(图 1)[8]。MAM一般可分为两个层次:一是通过与参考品的比较来实现PQA相对含量的监控, 这时可只采用LC串联一级MS分析; 二是对PQA定量以及对杂质、潜在的PTM变化所产生的新峰检测(new peak detection, NPD), 需采用LC-MS/MS分析。PQA的定量结果要符合一定的可接受范围, 而NPD起到了杂质鉴定的作用, 是MAM关键的组成部分[9]。MAM具有高灵敏度、高特异性、高精度, 并能同时监测及定量分析多种PQA。对于结构及PTM复杂的大分子蛋白药物而言, 在充分理解产品特性和工艺过程的基础上, 可以更为精确地对CQA甚至PQA进行控制。
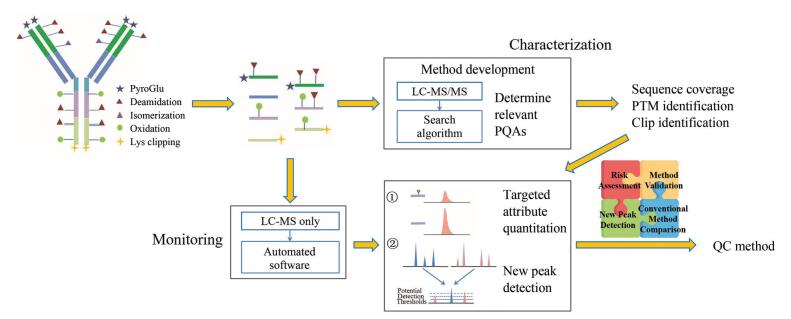
|
Figure 1 Peptide-based multi-attribute method (MAM) workflow used as a quality control (QC) test (bottom-up) |
与传统方法(如: SDS-毛细管电泳、亲水色谱、离子交换色谱、反相色谱)相比, MAM有3个主要的优势。一是MAM可通过一次分析获得更多的PQA信息。例如, SDS-毛细管电泳获得的片段信息, 亲水色谱检测的寡糖分布以及反相色谱鉴别互补决定区序列信息均能够通过一次MAM测定获得, 可以减少一些检测较少质量属性的传统分析方法。二是MAM提供了针对众多PQA的直接定量监测, 增强了对PTM和化学修饰的整体理解和趋势分析。而传统方法则是以完整分子的形式进行测定, 如离子交换色谱检测由多种PQA综合形成的酸峰、主峰和碱峰含量, 可能遗漏一些关键信息。三是MAM通过一次采样获得多种PQA的一套完整的数据集。当在之后对产品有额外的理解或发现了新的杂质时, 之前的数据集都可以重新分析从而获得特定PQA的完整数据。而大多数传统方法缺乏特异性, 通常不具有这一特性。此外, MAM由于具有对PQA直接测定以及产出信息更加全面的特点, 与结构功能研究相结合, 可帮助从PQA中筛选出CQA, 也可分辨一个或多个属性与产品质量之间的关系。MAM的鉴别及定量能力有利于工艺中更好地控制CQA, 还可以简化产品全生命周期的管理[8]。
1.2 MAM在研发与QC中的应用MAM可以通过较少的检测次数获得更全的属性分析。因此, 使用MAM可以在药品研发阶段减少检测量, 进而有效降低成本。更重要的是, MAM可以直接监测与生物学功能相关的PQA指标, 分析质量属性的变化, 并推测对产品活性及有效性的影响。此外, MAM还可以直接在工艺开发和人体应用中监测CQA指标, 从而辅助CQA的风险评估[9]。MAM还可以应用到工艺开发与表征中, 建立关键过程参数与药品的有效安全性信息之间的联系, 从而支持质量源于设计理念。有研究者[10-12]采用MAM对工艺开发中的微量样品进行检测, 揭示了关键过程参数与糖基化和糖化水平的相关性, 从而实现了生产工艺的实时调整。此外, MAM也被用于监测特定的可能影响产品有效性的修饰, 如:糖基化、脱酰胺、氧化, 以及片段, 并为产品的稳定性、有效期的制定提供依据[13, 14]。综合来讲, 在治疗类抗体药物研发的所有阶段, 包括:候选药物筛选、工艺开发、稳定性与可比性评估、QC、甚至药物体内监测等均可以应用MAM方法。最近发现, 治疗类抗体药物在体内产生的修饰可能对其疗效及免疫原性有潜在的关联, FDA也建议通过使用监测PTM的方法来监控生物药的体内代谢状况[15]。因此, 使用MAM还可以分析体内给药后一段时间内体内药物特定位点上的修饰比例变化, 并用于建立评估不同PQA对治疗潜在影响的模型, 帮助预测工艺或者产品属性变化可能带来的影响[15, 16]。
对于QC而言, MAM包括两个主要功能:目标属性的定量和NPD。在前期的工作中, 使用MS/MS和数据库搜索对酶解产品进行深入的表征, 从PQA筛选出一些CQA用于控制。一旦确定一组CQA, 就要在随后的检测中监测这些含有选定CQA的修饰及非修饰肽段的质荷比(m/z)。根据修饰肽峰面积与总肽峰面积之比计算每个CQA的相对丰度(式1)。
| $ \begin{array}{l} \rm PQA/COA\left( {\% Relative\, \, abundance} \right) = \\ \, \, \, \, \, \, \, \, \, \, \, \, \, \, \, \, \, \, \, \, \, \, \rm \frac{{Area\, {\mathop{\rm modified\, peak}\nolimits} }}{{Area\, unmodified\, peak + Area\, modified\, peak}} \times 100 \end{array} $ | (1) |
为了发挥NPD功能, 使用基本峰对齐算法对测试样品的LC-MS色谱图和参考品的LC-MS色谱图进行比较分析, 评估产品质量变化[8]。
MAM在治疗类抗体QC检测中的应用已有一些研究[6, 8, 17-19]。快速可靠的酶解方法, 可以有效地减少人为因素对方法的干扰, 为MAM在QC中的应用奠定基础[17]。与传统方法的结果相比, MAM也展现了对治疗类抗体药物PQA定量的优势[18]。Biogen尝试用MAM来预测药物的等电点和寡糖比例, 从而在商业化产品放行中替代传统方法, 已获得了欧洲药品管理局的认可[8]。Zhang等[6]开发了一种使用低分辨率四极杆质谱仪的MAM, 可实现PQA监测。但也有研究对MAM的耐用性和可转移性表示关注和担忧[19]。
总体而言, 基于MS的MAM在QC中有很好的应用前景, 但由于与传统方法的差异、方法验证较困难等问题, 该方法还有待更深入的评估。为此, 监管部门如FDA对MAM应用于QC开展了研究与探讨。
2 FDA对MAM在QC中应用的考量FDA对MAM在QC中的分析能力与重要作用予以了充分肯定, 为其在QC中的开发与应用提供了指导与理念支持[20]。为了更好地在QC中实施MAM, 提出以下四点考量: ①风险评估; ②方法验证; ③ NPD的能力及特异性; ④与传统方法的比较。
2.1 风险评估将MAM替代传统方法用于QC检测需要基于方法及产品特性, 要在候选蛋白产品的CQA和整体控制策略的背景下对MAM的能力和性能进行具体的评估。
是否采用MAM作为QC方法, 需要对产品和其作用机制的背景进行考虑。风险评估中要了解MAM和传统方法产生信息的差异。典型的MAM是基于肽图的方法, 反映每个肽段上修饰的变化。与基于完整分子或亚基整体评估的传统方法相比, 不足在于MAM分析会丢失一些分子结构以及降解片段信息。但为了发挥MAM在QC中的作用, MAM产生的综合数据应可以在一定程度上控制产品的整体信息(如等电点)。另外还应对MAM方法与其他传统方法反映出的与产品质量、安全性和有效性相关信息的差异予以考虑。MAM作为QC检测用于产品研发阶段时, 也要进行风险评估, 从而提升对CQA的鉴定与认知。
MAM正交于传统方法, 在放行和稳定性检测中可与传统方法的结果相互印证, 以加深产品开发者对产品的认识。随着产品的开发及工艺的变更, 多个批次和不同稳定条件下产品积累的MAM数据可以帮助产品开发者对PQA有更加深入的理解, 这有利于上市产品控制策略的建立以及将MAM纳入到质量控制策略中。
2.2 方法验证由于MS的高灵敏度以及前处理、数据采集及分析方法的变异性, MAM方法验证较传统方法更为困难。参考一系列指导原则, 包括ICH Q2(R1)、ICH Q6B、FDA色谱方法验证指导原则以及FDA药品和生物制品分析步骤与方法验证指导原则。定量分析方法的验证参数主要包括专属性、线性、准确度、精密度、范围、定量限、检测限、耐用性和系统适用性。精密度、定量限、检测限和系统适用性是充分验证MAM用于QC检测的关键参数。精密度是评估方法可行性的重要参数, 要与被替代的传统方法的精密度进行比较以确保MAM的适用性。成功的方法验证应确保MAM既有能力区分产品固有的变异, 也可以从QC的角度鉴别批间差异。
快速发展的MS技术对方法验证也是一个挑战。随着新仪器的出现和发展, 方法的转移需要额外的实验和数据支持。软件平台的改变和更新也需要进行彻底的评估。QC需要制订详细的桥接计划来确保将方法转移到新的仪器和软件上。
2.3 NPD的能力与特异性MAM NPD的能力分为两个方面, 一是通过m/z提取来实现非特异性峰的检测, 二是检测谱图中的任何变化。应对实验细节进行评估以决定NPD的优化参数。选择合适的检测阈值是NPD成功的关键。
NPD的优势在于, 能够通过对额外产品降解产物或变异体等的检测, 实现监测产品CQA的目的, 在产品的稳定性研究中显得尤为重要。采用恰当的NPD设置和验证, MAM可用于分析在不同储存条件下可预期以及不可预期的变化来全面地确认产品质量。NPD在批次放行中也具有优势, 可在产品生命周期中检测新的、非预期的变化。
2.4 与传统方法的性能比较MAM可提供大量特定PQA相对含量的信息, 许多机构和组织推荐采用MAM作为QC检测方法, 代替多个传统的放行和稳定性检测方法。表 1比较了MAM和传统方法在分析目标上的差异。可以看出, 与传统方法相比, MAM可获得对产品PQA更直接、更详细的信息。然而, 要证明MAM可在QC中替代传统方法, 该方法应当可比或优于传统方法。为此, 要在PQA充分表征以及风险评估的基础上, 对MAM和被建议替代的分析方法进行适当的比较研究。
| Table 1 Attributes and targets of MAM and conventional methods |
亲水色谱法测定游离寡糖含量, 而典型MAM测定糖肽的相对丰度。由于测定的对象较为一致, 寡糖的分布结果未显著改变。已有的数据也表明两个方法之间有很好的相关性[14]。另外, MAM可以在一次试验中确定特定的糖基化位点。当蛋白具有多个糖基化位点时, MAM还可以检测位点特异性糖基化分布。
然而, 有时MAM与传统方法可能反映不同的属性。这时, 比较不同分析方法的结果可能会出现困难, 而且可能不直接相关。如阳离子交换色谱检测是基于分子的净表面电荷。而MAM则鉴定位点特异性修饰, 允许对变异体进行单独控制。因此阳离子交换色谱与MAM的结果不直接相关。另外, 使用MAM替代SDS-毛细管电泳时也需要注意, MAM可能无法检测到特定的剪切体。这些情况在风险评估中应当予以考虑, 还应注意MAM与传统方法产出数据的差异性。
3 MAM面临的机遇与挑战随着生物制药的迅速发展, 尤其是大量治疗类抗体药物的上市, 人们对于大分子药物的理解愈加深入, 对于药物QC的要求也在不断提高。开发更快、更准、更全(快、准、全)的质量控制技术不仅是企业提高药品质量、降低生产成本的需求, 也符合监管机构高效全面监察的需求。MAM作为一种新的技术出现, 也契合了治疗类抗体质控“快、准、全”技术平台和全过程/生命周期质控的理念, 通过新技术、新理念为QC提供支撑, 最终进一步促进治疗类单抗为代表的生物药物的质量可控性(图 2A)。
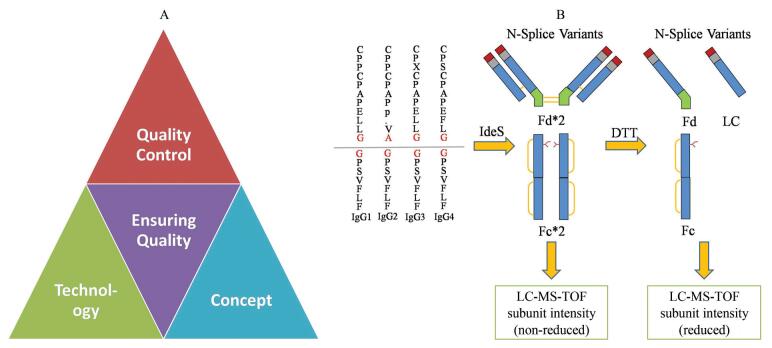
|
Figure 2 Product life cycle management concept and broad-spectrum, rapid, and accurate platform (A), and subunit-based MAM workflow (top-down/middle-down, B) |
基于肽图的MAM本身也有一些亟待解决的问题。比如, 其开发过程较为复杂、损失一定的蛋白完整信息且验证较为繁琐。实验步骤多且需要考量多种条件或者参数。此外, 仪器与仪器之间的差异性, 以及软件的合规性和自动化不足也影响了其在GMP环境中的应用[21]。因此基于LC-MS亚基/完整蛋白的MAM有望成为另一个发展趋势[22-26]。基于LC-MS亚基/完整蛋白的MAM方法作为自上而下(top-down/middle-down)的检测策略, 通过较为简单的样品处理, 以及自动化的软件方法可以让几乎没有质谱经验的分析人员完成法规要求的分析工作(图 2B), 同时在一定程度上平衡蛋白的完整和局部信息, 还可以用于分析降解产物和相关杂质。基于“快、准、全”的质控平台及理念, 该方法可以更好地在法规要求的条件下, 开展快速鉴定、常规监测的相关检测。
在技术领域中, MAM最常见的关注点包括关键试剂、仪器间稳健性、方法可转移性和数据分析全自动化软件的稳健性。这些技术问题也一直存在一些争议, 其中MS硬件稳健性和用于NPD的软件是MAM在QC中实施相对关键及较为困难的环节, 受到大家的普遍关注。监管及合规方面的主要问题包括有:数据量大、方法验证难度高、存在潜在的不合规结果、是否采用并行测试(传统分析加MAM)。此外, 由于MAM是一种新的技术, QC实验室人员可能缺乏对于MAM恰当的技术理解和如何达到监管验收要求的认识。因此, 为了可以在符合GMP环境中使用MAM替代传统的检测方法, 要充分参考上述的风险评估以及与传统方法的比较原则, 证明MAM与传统纯度/杂质分析的结果之间具有较好的相关性。在此基础上还可以进一步尝试用MAM代替传统方法作为治疗类抗体的放行检测。目前, 由于对MAM技术的了解及经验不足, 在GMP环境中使用MAM替代传统的放行和稳定性方法还在起步阶段。但基于目前MAM的发展和接受度, 业界已经开始尝试将此技术作为CQA控制策略的一部分。而且, 随着监管机构对MAM愈加熟悉, 目前也在尝试推进并行测试, 在产品放行和稳定性检测中同时开展MAM和常规分析, 但最终目标还是希望能让MAM在一段时间后逐步取代分辨率较低的传统方法。
目前, 许多对MAM的研究和方法开发为来自技术和合规性的挑战提供了解决方案, 以此来扩大行业和监管机构对MAM的接受度。对于关键试剂, 多家酶供应商正在优化其试剂质量和平台, 以加快样品酶切等样品前处理过程。自动化技术的进步也提供了一种提高MAM样品制备重现性的方法, 还可以节省资源, 减少样品制备的变异性。关于MS硬件, 仪器供应商优化了对系统间性能至关重要的硬件参数设置, 可允许用户对多台MS专业参数进行一样的设置, 从而保证系统硬件性能一致, 将有助于改善GMP实验室中用于MAM分析的MS性能。软件的稳健性和用于MAM数据收集和分析的能力也在提高[19]。多家供应商提供法规兼容包, 用于整个MAM数据分析工作流程, 从而保证结果的稳定性。在数据处理软件中增加NPD功能, 大大提高了MAM检测能力。通过硬件和软件的进一步提升促进MAM在不同实验室的成功转移和验证。对于监管及合规性相关问题, 可以通过设置通用的参考品以及在开发和规范设置的早期阶段增加研究, 来提高合规性, 避免出现不规范结果。
4 结语MAM是一种高灵敏度、高分辨率、低人为干扰的检测技术, 能够同时开展多个CQA/PQA的直接检测。MAM提供了一类实现“快、准、全”技术平台及理念的方法, 有助于提高治疗类抗体药物为代表的生物制品的有效性和安全性。通过MAM的应用, 不仅可以引导工业界开发更优的质控策略, 提高产品的质量可控性, 同时也能更好地将药物质量属性与临床表现联系在一起, 促进药物开发与上市。未来, 希望通过业界和监管机构的共同努力, MAM能够在QC中更好地被开发、应用, 替代多种传统方法以提升产品研发、质控放行效率。
致谢: 上海市食品药品检验所方欣欣、胡川梅、孙珍、严翠霞参与资料收集与整理。
作者贡献:汪泓负责资料整理、全文撰写与修改; 徐进负责文献翻译和段落撰写; 尹红锐、徐明明和凌今负责文献翻译; 郭怀祖负责段落撰写与修改; 邵泓负责资料的整理; 陈钢负责参与人员协调与整体把控。
利益冲突:无任何利益冲突。
| [1] |
Zhao CX, Hu ZW, Cui B. Recent advances in monoclonal antibody-based therapeutics[J]. Acta Pharm Sin (药学学报), 2017, 52: 837-847. DOI:10.16438/j.0513-4870.2017-0398 |
| [2] |
Rathore D, Faustino A, Schiel JE, et al. The role of mass spectrometry in the characterization of biologic protein products[J]. Expert Rev Proteomics, 2018, 15: 431-449. DOI:10.1080/14789450.2018.1469982 |
| [3] |
Li Y, Fu T, Liu T, et al. Characterization of alanine to valine sequence variants in the Fc region of nivolumab biosimilar produced in Chinese hamster ovary cells[J]. MAbs, 2016, 8: 951-960. DOI:10.1080/19420862.2016.1172150 |
| [4] |
Gao YX, Zhong DF. Advances in bioanalysis of antibody drugs by LC-MS[J]. Acta Pharm Sin (药学学报), 2020, 55: 453-462. DOI:10.1016/j.jpba.2007.02.006 |
| [5] |
Peng X, Liu B, Li Y, et al. Development and validation of LC-MS/MS method for the quantitation of infliximab in human serum[J]. Chromatographia, 2015, 78: 521-531. DOI:10.1007/s10337-015-2866-2 |
| [6] |
Zhang J, Qin T, Xu L, et al. Development and validation of a peptide mapping method for the characterization of adalimumab with QDa detector[J]. Chromatographia, 2016, 79: 395-403. DOI:10.1007/s10337-016-3046-8 |
| [7] |
Bern M, Kil YJ, Becker C. Byonic:advanced peptide and protein identification software[J]. Curr Protoc Bioinform, 2012, 13: 1-17. |
| [8] |
Rogers RS, Abernathy M, Richardson DD, et al. A view on the importance of "multi-attribute method" for measuring purity of biopharmaceuticals and improving overall control strategy[J]. AAPS J, 2017, 20: 7. |
| [9] |
Xu X. In vivo characterization of therapeutic monoclonal antibodies[J]. J Appl Bioanal, 2016, 2: 10-15. DOI:10.17145/jab.16.003 |
| [10] |
Dong J, Migliore N, Mehrman SJ, et al. High-throughput, automated protein A purification platform with multiattribute LC-MS analysis for advanced cell culture process monitoring[J]. Anal Chem, 2016, 88: 8673-8679. DOI:10.1021/acs.analchem.6b01956 |
| [11] |
Tharmalingam T, Wu CH, Callahan S, et al. A framework for real-time glycosylation monitoring (RT-GM) in mammalian cell culture[J]. Biotechnol Bioeng, 2015, 112: 1146-1154. DOI:10.1002/bit.25520 |
| [12] |
Zupke C, Brady LJ, Slade PG, et al. Real-time product attribute control to manufacture antibodies with defined N-linked glycan levels[J]. Biotechnol Prog, 2015, 31: 1433-1441. DOI:10.1002/btpr.2136 |
| [13] |
Rogers RS, Nightlinger NS, Livingston B, et al. Multi-attribute method for characterization, quality control testing and disposition of biologics[J]. MAbs, 2015, 7: 881-890. DOI:10.1080/19420862.2015.1069454 |
| [14] |
Wang T, Chu L, Li WZ, et al. Application of a quantitative LC-MS multi-attribute method for monitoring site-specific glycan heterogeneity on a monoclonal antibody containing two N-linked glycosylation sites[J]. Anal Chem, 2017, 89: 3562-3567. DOI:10.1021/acs.analchem.6b04856 |
| [15] |
U. S. Department of Health and Human Services & Food and Drug Administration. Guidance for Industry, Immunogenicity Assessment for Therapeutic Protein Products[EB/OL]. 2014[2020-3-31]. https://www.fda.gov/media/85017/download.
|
| [16] |
Goetze AM, Schenauer MR, Flynn GC, et al. Assessing monoclonal antibody product quality attribute criticality through clinical studies[J]. MAbs, 2010, 2: 500-507. DOI:10.4161/mabs.2.5.12897 |
| [17] |
Wang Y, Li XJ, Liu YH. Simultaneous monitoring of oxidation, deamidation, isomerization, and glycosylation of monoclonal antibodies by liquid chromatographymass spectrometry method with ultrafast tryptic digestion[J]. MAbs, 2016, 8: 1477-1486. DOI:10.1080/19420862.2016.1226715 |
| [18] |
Xu XB, Qiu HB, Li N, et al. LC-MS multi-attribute method for characterization of biologics[J]. J Appl Bioanal, 2017, 3: 21-25. DOI:10.17145/jab.17.003 |
| [19] |
Zhang Y, Guo J. Characterization and QC of biopharmaceuticals by MS-based 'multi-attribute method':advantages and challenges[J]. Bioanalysis, 2017, 9: 499-502. DOI:10.4155/bio-2017-0004 |
| [20] |
Rogstad S, Yan HH, Wang XS, et al. Multi-attribute method for quality control of therapeutic proteins[J]. Anal Chem, 2019, 91: 14170-14177. DOI:10.1021/acs.analchem.9b03808 |
| [21] |
Zhang ZQ, Shah B, Guan XY. Reliable LC-MS multiattribute method for biotherapeutics by run-time response calibration[J]. Anal Chem, 2019, 91: 5252-5260. DOI:10.1021/acs.analchem.9b00027 |
| [22] |
Sokolowska I, Mo J, Rahimi Pirkolachahi F, et al. Implementation of a high-resolution liquid chromatography-mass spectrometry method in quality control laboratories for release and stability testing of a commercial antibody product[J]. Anal Chem, 2020, 92: 2369-2373. DOI:10.1021/acs.analchem.9b05036 |
| [23] |
Liu T, Guo HZ, Zhu L, et al. Fast characterization of Fc-containing proteins by middle-down mass spectrometry following IdeS digestion[J]. Chromatographia, 2016, 79: 1491-1505. DOI:10.1007/s10337-016-3173-2 |
| [24] |
Zhang B, Jeong J, Burgess B, et al. Development of a rapid RP-UHPLC-MS method for analysis of modifications in therapeutic monoclonal antibodies[J]. Chromatogr B, 2016, 1032: 172-181. DOI:10.1016/j.jchromb.2016.05.017 |
| [25] |
Haberger M, Bonnington L, Bomans K, et al. Application of electrospray ionization mass spectrometry in a quality control lab[J]. Am Pharm Rev, 2016, 19: 1-6. |
| [26] |
Kellie JF, Thomson AS, Chen SG, et al. Biotherapeutic antibody subunit LC-MS and peptide mapping LC-MS measurements to study possible biotransformation and critical quality attributes in vivo[J]. J Pharm Sci, 2019, 108: 1415-1422. DOI:10.1016/j.xphs.2018.11.019 |
 2020, Vol. 55
2020, Vol. 55


