2. 国家药品监督管理局食品药品审核查验中心, 北京 100044;
3. 四川大学华西第二医院, 四川 成都 610041;
4. 香港浸会大学中医药表型组学研究中心, 香港;
5. 天津药物研究院释药技术与药代动力学国家重点实验室, 天津 300193;
6. 四川大学华西药学院, 四川 成都 610041
2. Center for Food and Drug Inspection of National Medical Products Administration, Beijing 100044, China;
3. West China Second University Hospital, Sichuan University, Chengdu 610041, China;
4. Hong Kong Traditional Chinese Medicine Phenome Research Centre, Hong Kong Baptist University, Hong Kong, China;
5. State Key Laboratory of Drug Delivery Technology and Pharmacokinetics, Tianjin Institute of Pharmaceutical Research, Tianjin 300193, China;
6. West China School of Pharmacy, Sichuan University, Chengdu 610041, China
C24胆汁酸是胆固醇在哺乳动物体内的代谢终产物之一, 具有独特的甾体骨架结构和重要的生物活性。目前已有若干胆汁酸或其衍生物作为药物上市, 其中熊去氧胆酸(ursodeoxycholic acid, UDCA)是一种用于胆汁淤积性肝病治疗的重要药物, 也是熊胆的关键有效成分。熊胆作为中药, 最早载于《神农本草经》, 功能主治为清热、平肝、明目。作为化学药物, UDCA自1902年在北极熊胆汁中被发现以来, 1957年首次在日本上市, 20世纪70年代首先在日本开始用于治疗胆结石, 80年代首先在欧洲开始用于治疗胆汁淤积性肝病, 至今已有60余年的临床应用史[1]。UDCA不仅可以促使胆固醇结石溶解, 更重要的是可以替换人体胆汁酸池中具有细胞损伤作用的疏水性胆汁酸, 从而发挥保护胆管上皮细胞、抑制肝细胞凋亡、调节肝细胞免疫、刺激胆汁分泌等药理作用。目前, UDCA全球获批的主要适应症为胆固醇性胆囊结石、胆汁郁积性肝病和胆汁反流性胃炎, 尤其是治疗原发性胆汁性肝硬化(primary biliary cirrhosis, PBC)的首选药物, PBC最近已更名为原发性胆汁性胆管炎(primary biliary cholangitis)[2]。
人体的内源性UDCA是肠道菌群的7-羟基类固醇脱氢酶(7-HSDH)将鹅去氧胆酸(chenodeoxycholic acid, CDCA)的7α-羟基异构为7β-羟基形成的一种次级胆汁酸。UDCA通常在人体胆汁酸池中仅占很少部分, 主要以熊去氧胆酰甘氨酸(GUDCA)和熊去氧胆酰牛磺酸(TUDCA)的形式存在, 并被宿主及肠道菌群的转运和代谢系统通过肠肝循环蓄积在肝-胆-肠构成的胆汁酸池中, 每餐后进行约二、三次循环, 每天约进行4~12次循环。因此, UDCA具有独特的分布特征和很长的体内滞留时间, 其体内药代动力学(pharmacokinetics, PK)过程难以用经典药代动力学模型描述[3, 4]。
虽然UDCA在肝病治疗领域具有重要地位, 但是它作为内源性药物的代表在人体具有非常复杂的代谢处置过程, 仿制药研发具有极高的技术挑战。这些技术挑战不仅有来源于分子两亲性质和大规格等生物药剂学和药剂学问题, 更有来源于内源性、长半衰期、高变异、准确测定多个代谢物的药代动力学问题。基于此, 本文系统整理了UDCA人体内代谢相关的文献资料, 文献资料不仅来源于学术论文, 也参考了FDA的审评报告等工业界公开的文献[5-7]资料。在此基础上, 本文结合人类胆汁酸代谢研究的进展, 总结了UDCA生物等效性(bioequivalence, BE)研究的现状, 剖析了现有BE技术指南、研究现状和关键技术挑战, 并提出了相应的解决思路, 期望为UDCA仿制药研发BE试验的技术攻关提供有价值的参考。
1 UDCA的化学结构、理化性质和剂型规格UDCA的化学名为3α, 7β-二羟基-5β-胆甾烷-24-酸(图 1A), 与CDCA的结构差异仅在于7-羟基的立体构型。UDCA和CDCA均为弱酸性化合物, 未解离时lg P分别为3.0和3.3, 几乎不溶于水, 解离后由于具有两亲性质而表现出独特的溶解性。日本医疗用医药品品质情报集数据显示[8], UDCA的pKa为4.63, 在pH 1.2和4.0 (< pKa)介质中的溶解度仅为7 µmol·L-1 (2.7 mg·L-1)和9 µmol·L-1 (3.6 mg·L-1), 在pH 6.8和7.0 (> pKa)介质中的溶解度增加到566 µmol·L-1 (222 mg·L-1)和800 µmol·L-1 (314 mg·L-1), 该数据显然不符合描述溶液pH、化合物pKa值及溶解度关系的Henderson-Hasselbalch方程。这是由于胆汁酸分子具有独特的两亲性质, 随pH升高羧酸侧链逐渐解离, 解离后的分子具备羧酸侧链极性头及甾体骨架亲水面和疏水面的结构特征, 可以自组装为多聚体, 达到临界胶束浓度(CMC)时形成胶束, 从而在环境pH达到临界胶束pH (CM-pH)时溶解度急剧增加。根据FDA批准UDCA治疗PBC的审评报告[5], UDCA和CDCA在水中的溶解度分别为9和27 µmol·L-1, 在0.15 mol·L-1 NaCl溶液中的CMC分别为7和3 mmol·L-1, CM-pH分别约为8.0和6.7, 两者在CH-pH以上溶液中的溶解度均可超过100 mmol·L-1。与UDCA相比, GUDCA和TUDCA的溶解性远高于UDCA, GUDCA的pKa和CM-pH分别为3.9和6.0; TUDCA的pKa < 2.0, CM-pH则更低。
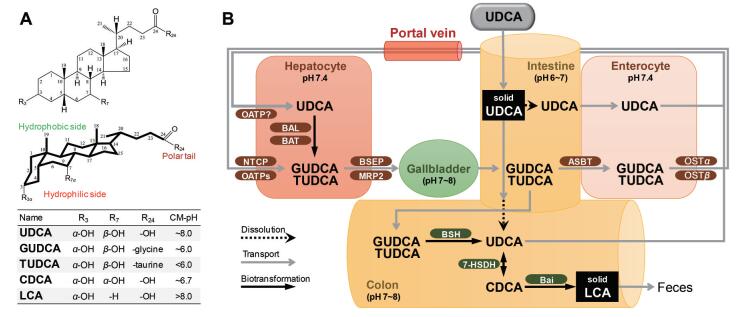
|
Figure 1 Chemical structures (A), host-gut microbial co-metabolism and hepato-billilary-intestinal circulation of ursodeoxycholic acid (UDCA, B). Transporters: Apical sodium-dependent bile salt transporter (ASBT), organic solute transporter subunit (OSTα/β), organic anion transport peptides (OATPs), sodium taurocholate cotransporting polypeptide (NTCP), bile salt export pump (BSEP), multi-drug resistance protein 2 (MRP2). Host enzymes: Bile acid-CoA ligase (BAL), bile acid-CoA:amino acid N-acyltransferase (BAT). Gut microbial enzymes: Bile salt hydrolase (BSH), 7-hydroxysteroid dehydrogenase (7-HSDH), bile acid inducible genes (Bai genes) |
全球首次上市的UDCA制剂为日本Mitsubishi Tanabe公司的URSO片剂(50和100 mg)[1], 50 mg片剂也是我国批准上市的国产UDCA仿制药的主要剂型。UDCA用于治疗胆结石的每日常用剂量为8~10 mg·kg-1, 代表制剂产品为美国Allergan公司的Actigall胶囊剂(300 mg)[3]; UDCA用于治疗胆汁淤积性肝病的每日常用剂量为3~15 mg·kg-1, 代表制剂产品为德国Dr. Falk Pharm公司的Ursofalk胶囊剂(250 mg)[1]、美国Allergan公司的URSO 250片剂(250 mg)及URSO FORTE片剂(500 mg)[4]。
2 UDCA的人体药代动力学作为一种内源性胆汁酸, UDCA具有非常独特的ADME特征[9]。如图 1B所示, 具体表现为往复的肝-胆-肠循环处置过程及其中广泛的宿主-肠道菌群共代谢, 由此导致其主要蓄积在肝-胆-肠构成的胆汁酸池中, 随饮食节律往复循环而缺乏典型的消除相, 最终主要由肠道菌群代谢为不溶于水的石胆酸(lithocholic acid, LCA)通过粪便排泄。UDCA、CDCA与其他内源性胆汁酸均通过肠肝循环被蓄积在肝-胆-肠构成的胆汁酸池中, 体循环中的胆汁酸仅是胆汁酸池溢出的表现, 这与绝大部分化学药物的代谢处置特征完全不同。由于生物利用度是指药物吸收进体循环的速度与程度, 曾有学者提出体循环暴露量一定程度上不适用于UDCA等胆汁酸药物的生物利用度评价, 其BE评价应关注UDCA的肠道吸收及其在胆汁中的富集程度, 但是该策略方法用于仿制药研发时临床试验可操作性很差, 成本也极高。
2.1 吸收UDCA在胃内酸性环境基本不能溶出, 在小肠pH 6.8及以上的环境可以溶出, 溶解的UDCA分子无论解离与否均具有良好的脂溶性, 可以通过被动转运吸收, 这一点已被大量研究证实。由于UDCA没有多晶型, UDCA溶出后可在近端小肠被迅速吸收, 因此原料药粒径是影响其在近端小肠吸收的关键药剂学因素之一, 最近的一篇药剂学文献已对此进行了充分的讨论和总结[10]。
然而, 大于250 mg规格的UDCA制剂在小肠pH 6.8环境下难以完全溶出, 此时吸收也不完全。一项研究报道了健康受试者空腹口服放射性标记UDCA的药代动力学数据[11]。该研究的一组试验在空肠处放置气囊人造肠梗阻, 采集了给药250~750 mg后气囊上方肠腔的样品; 试验结果显示血浆UDCA浓度在40~90 min左右达到峰值, 肠腔样品中已溶解的UDCA水平与血浆UDCA浓度呈正比, 但在肠腔样品中回收到21%~50%给药剂量的固体UDCA。该研究的另一组试验将球囊上方采集的肠腔样品再注入下段肠道, 此时在口服较高剂量UDCA的个体检测到第二个更高的血浆UDCA峰值, 说明空肠内未溶解的UDCA在下段肠道发生了进一步的溶解和吸收。另一项研究报道了UDCA在回肠切除造瘘患者体内的吸收特征[12], 8例患者在早餐前口服给予UDCA 500 mg, 给药后24 h内在回肠瘘管中回收到给药剂量的59% (标准误±8%), 给药后2~8 h瘘出物中的UDCA水平达到峰值, 瘘出物的pH范围在6.1~7.5之间。
上述研究证实, 如图 1B所示, 由于小肠pH环境未达到UDCA的CH-pH, 临床常用剂量的UDCA在小肠中只能部分溶出吸收, 表现为药时曲线的第一个峰浓度; 未溶解的UDCA逐渐进入结肠pH 7~8的环境, 此时UDCA可进一步溶出吸收, 表现为药时曲线的第二个峰浓度。因此, 肠道蠕动在一定程度上可以影响UDCA的吸收速度与程度, 口服UDCA的多峰现象与其在不同肠段pH环境下的溶出度有关。饮食尤其是高脂餐不仅导致胃排空延迟、影响肠道蠕动, 而且会促使胆汁排泄导致内源性胆汁酸与UDCA形成混合胶束, 理论上会对UDCA的吸收速度与程度造成影响, 但是文献资料中均并未提供该方面的可靠数据与信息。目前, FDA、Tsrlinc和BDDCS均合理地将UDCA归为BCS 2类, 溶出是其吸收的限速环节。
2.2 分布、代谢与排泄表观分布容积常用于描述全身系统作用药物的体内分布, 但不适用于具有特殊的肝-胆-肠分布的UDCA等胆汁酸药物, 胆汁酸代谢领域常用胆汁酸池和胆汁酸周转率来评估其分布特征。有研究[13]报道了肝功正常患者口服14C标记UDCA的分布数据, 7例健康受试者每天口服1 000 mg连续14天后, 胆汁中UDCA占总胆汁酸的比例从2% ± 2%增加到56% ± 7%, 估算UDCA的表观分布容积、胆汁酸池容量和每日吸收增加量分别约为750 L、938 ± 458 mg和900 ± 438 mg。
UDCA独特的肝-胆-肠分布特征来源于高度专属的胆汁酸转运与代谢机制。肠道吸收的UDCA经门静脉被快速摄取进入肝细胞, 首过肝提取率达到50%~75%[14], 肝细胞摄取可能有钠离子-牛磺胆酸共转运蛋白(sodium taurocholate cotransporting polypeptide, NTCP)和有机阴离子转运多肽(organic anion transport peptides, OATPs)的参与[15, 16]。未被肝脏摄取的UDCA主要与白蛋白与脂蛋白结合, 血浆蛋白结合率约为70%。UDCA摄取进入肝细胞后, 很快在胆汁酸-辅酶A连接酶(bile acid-CoA ligase, BAL)和胆汁酸辅酶A:氨基酸N-酰基转移酶(bile acid-CoA:amino acid N-acyltransferase, BAT)的催化下与甘氨酸或牛磺酸结合成GUDCA和TUDCA, 成年人以GUDCA为主。UDCA与氨基酸结合后, 被专属性胆汁酸转运体识别限制性地蓄积在胆汁酸池, 仅有很少一部分溢出到体循环。如图 1所示, 这些胆汁酸转运体包括:肝细胞窦状侧的NTCP和OATPs, 肝细胞胆管侧的胆盐外排泵(bile salt export pump, BSEP)和多药耐药蛋白2 (multi-drug resistance protein 2, MRP2), 小肠上皮细胞肠腔侧的顶端钠依赖性胆盐转运体(apical sodium-dependent bile salt transporter, ASBT)和基底侧的有机溶质转运体(organic solute transporter subunit, OSTα/β)[17, 18]。在上述转运系统的驱动下, GUDCA和TUDCA随胆汁排泄往复地发生肠肝循环, 表现出典型的与饮食节律相关的多峰药时曲线。
UDCA具有广泛的肠道菌群代谢, 这是其代谢处置的另一项特征[19, 20]。口服UDCA后, 未吸收的部分进入结肠; 同样, 随胆汁排泄的GUDCA和TUDCA也会在胆盐水解酶(bile salt hydrolase, BSH)的作用下水解为UDCA, 然后进入结肠。结肠内有丰富的胆汁酸代谢菌群, 这里也是内源性UDCA合成的主要场所。在结肠内, 如图 2所示, UDCA可被细菌7-HSDH异构代谢为CDCA, 或者被细菌3-HSDH异构代谢为异熊去氧胆酸(isoursodeoxycholic acid, isoUDCA); 更多的UDCA在细菌胆汁酸诱导基因(bile acid inducible genes, Bai genes)编码代谢酶的催化下, 经过一系列反应脱去7β-羟基形成LCA。LCA溶解性很差, 大部分经粪便排泄, 这是UDCA的主要排泄途径。也有一小部分LCA会重吸收, 然后与甘氨酸或牛磺酸结合形成GLCA和TLCA, 也可在CYP3A的催化下发生6α-羟化形成猪去氧胆酸(hyodeoxycholic acid, HDCA)、GHDCA和THDCA[21, 22]。

|
Figure 2 Host-gut microbial co-metabolism pathways of ursodeoxycholic acid in human. Metabolites: Isoursodeoxycholic acid (isoUDCA), ursodeoxycholic acid (UDCA), chenodeoxycholic acid (CDCA), lithocholic acid (LCA), hyodeoxycholic acid (HDCA). Host enzymes: BAL, BAT, cytochrome P450 3A (CYP3A), UDP-glucuronosyltransferases (UGTs), sulfotransferases (SULTs). Gut microbial enzymes: BSH, 7-HSDH, Bai genes |
综上, UDCA具有胆汁酸特有的宿主-肠道菌群共代谢和肝-胆-肠循环处置特征, 通过肠肝循环局限地分布于肝-胆-肠系统, 主要经肠道菌群代谢后通过粪便排泄, 尿液排泄量通常小于给药剂量的1%, 严重胆汁淤积时除外。UDCA及其代谢产物的消除相受到胆汁排泄及饮食节律的剧烈扰动, 无法准确测量其末端消除半衰期, 总体表观半衰期长达3.5~5.8天[3, 4]。因此, UDCA药代动力学的影响因素繁杂, 即有经典的肝脏代谢因素, 还有来源于肠道菌群代谢的因素, 更受到饮食节律相关胆汁排泄和肠肝循环转运因素的显著影响, 其体内药代动力学参数具有高度的个体变异。
3 人体胆汁酸代谢及内源性UDCA代谢通路胆汁酸具有复杂的宿主-肠道菌群共代谢网络, 人体内的胆汁酸从生物转化通路上可分为初级胆汁酸[23]、次级胆汁酸[20]和三级胆汁酸[24, 25], 从化学结构上可分为游离型胆汁酸和结合型胆汁酸[19]。初级胆汁酸是肝细胞以胆固醇为原料从头合成的胆汁酸, 主要包括胆酸(cholic acid, CA)、CDCA及其6α-氧化产物猪胆酸(hyocholic acid, HCA)。次级胆汁酸是初级胆汁酸被肠道菌群代谢处置而成的胆汁酸, 主要包括① CDCA和CA的7-脱氧产物: LCA和去氧胆酸(deoxycholic acid, DCA); ② CDCA的异构产物: UDCA和异熊去氧胆酸(isoursodeoxycholic acid, isoUDCA); ③ CA的异构产物熊胆酸(ursocholic acid, UCA)、异熊胆酸(isoursocholic acid, isoUCA)和12-表胆酸(12-epicholic acid, 12-epiCA); ④ DCA的异构产物:异去氧胆酸(isodeoxycholic acid, isoDCA)和12-表去氧胆酸(12-epideoxycholic acid, 12-epiDCA)。三级胆汁酸是次级胆汁酸重吸收回到肝脏后再被CYP3A氧化生成的胆汁酸, 主要包括① LCA的6α-氧化产物猪去氧胆酸(hyodeoxycholic acid, HDCA); ② DCA的若干氧化产物, 如DCA-1β-ol、DCA-6α-ol和DCA-5β-ol。初级、次级和三级胆汁酸即可在BAL和BAT催化下与甘氨酸或牛磺酸结合, 也可以在葡萄糖醛酸转移酶(UGTs)和硫酸基转移酶(SULTs)催化下与葡萄糖醛酸或硫酸结合, 总共构成了成员超过数百种的胆汁酸池, 其中与UDCA有关的宿主-肠道菌群共代谢通路如图 2所示。
内源性UDCA是CDCA被肠道菌群7-HSDH异构而成的一种次级胆汁酸, 通常在人体胆汁酸池中仅占很少一部分, 且个体差异很大。有研究显示[13], 7例健康受试者每天口服14C-CDCA 1 000 mg连续14天后, 胆汁中UDCA占总胆汁酸的比例从2% ± 2%增加到8% ± 3%。最近一篇胆汁酸组学研究采用LC-MS定量检测了10名健康成人的血清样品[26], 结果显示血清UDCA、GUDCA和TUDCA水平的均值和浓度范围分别为34 (4.7~264)、120.9 (18.0~1 138)和4.3 (1.3~15.2) ng·mL-1, 不同个体的最低与最高浓度相差近百倍。作者[27]最近开展的13例健康成人高脂餐后血清胆汁酸组学研究也得到了相似的结果。该研究不仅测定了餐后0~2 h的血清游离UDCA浓度, 还使用酶解法处理样品测定了包括GUDCA、TUDCA和UDCA在内的UDCA总浓度。如图 3所示, 无论是游离UDCA浓度还是UDCA总浓度的个体间变异系数均在100%左右(图 3A), 其中游离UDCA约占游离胆汁酸总量的4%, 总UDCA约占胆汁酸总量的7% (图 3B)。与CDCA、CA和DCA相比, 高脂餐后游离UDCA和总UDCA水平未见显著变化, 提示餐后内源性UDCA随胆汁排泄及重吸收的波动对UDCA药代动力学研究的影响有限。
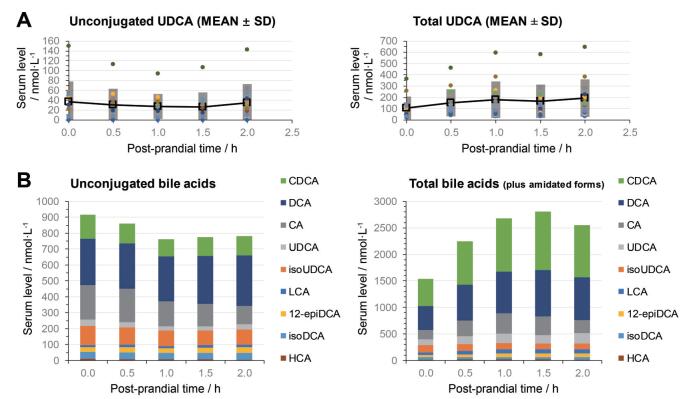
|
Figure 3 Post-prandial serum unconjugated and total levels of ursodeoxycholic acid (A) and the related major bile acid metabolites (B) [27]. Metabolites: CDCA, deoxycholic acid (DCA), cholic acid (CA), UDCA, isoUDCA, LCA, 12-epideoxycholic acid (12-epiDCA), isodeoxycholic acid (isoDCA), hyocholic acid (HCA) |
FDA已推荐了UDCA片剂(250 mg)[28]和胶囊剂(300 mg)[29]的仿制药BE试验指南草案, 片剂推荐的给药剂量为500 mg, 胶囊剂推荐的给药剂量为600 mg, 除此之外两份指南的内容无差异。指南中的技术指引主要有以下几点: ①应分别进行空腹试验和餐后试验; ②对于餐后试验, 在-48、-24、和0 h 3个基线期采样点前30 min应给予受试者标准高脂餐; ③应检测生物样品中的游离UDCA和总UDCA; ④应测定受试者的背景基线水平, 推荐基线采样时间点为-48、-42、-36、-30、-24、-18、-12、-6和0 h, 若有数据证明48 h内基线稳定, 可以将基线采样时间缩短到-24~0 h; ⑤ BE评价指标应包括游离UDCA、总UDCA、基线校正后的游离UDCA、基线校正后的总UDCA的PK参数, 应以基线期平均浓度进行校正, 校正后的浓度若为负值则计为零; ⑥上述4项指标的PK参数(Cmax和AUC0-t)全部合格时才能判定生物等效。
从理论分析, FDA指南草案较严谨地考虑了UDCA的临床药理与代谢处置特征。其一, 由于UDCA的吸收受饮食节律及胃肠道运用的显著影响, 要求开展空腹和餐后试验符合国际通行的BE技术指导原则。其二, UDCA在体内的主要存在的活性形式是GUDCA和TUDCA, 因此应测定样品中游离UDCA和总UDCA的水平, 以游离UDCA与总UDCA为BE评价指标符合国际通行的BE技术指导原则。其三, 由于内源性UDCA的合成和代谢清除速率受肠道菌群和宿主的代谢水平以及饮食的综合影响, 存在随饮食节律波动的基线背景, 因此应分别使用基线校正前和校正后的PK参数来评估生物等效性。其四, UDCA表观半衰期长达3~6天, 两周期间的清洗期通常要求3周以上, 所以应在每周期给药前测定受试者基线水平, 以便准确计算基线校正PK参数。其五, 由于高基线背景受试者潜在Cmax不足基线浓度10倍的风险, 因此给予受试者500 mg及以上的剂量有利于降低PK参数计算误差。其六, 餐后试验前连续测定3次标准高脂餐后30 min时的基线水平, 有利于评估受试者内源性UDCA在饮食干预后肝肠循环的稳定性。FDA在指南草案发布前批准了3个胶囊剂仿制药上市, 由此可推断该指南的起草应参考了仿制药申报的BE试验数据, 具备有效的技术指引作用和可操作性。
FDA指南草案也存在某些不合理之处。其一, 并未考虑基线采样时间点的可操作性及其与给药后采样点对应昼夜节律的一致性。按BE试验常规操作(早晨8点给药), 指南推荐的-30、-6 h基线采样点对应凌晨2点, 那么也应当在给药后设置相应的采样点(例如18和42 h), 以保证扣除基线背景的前后一致性。该技术指引显然对受试者带来了不必要的睡眠干预, 不仅缺乏合理的伦理考量, 也没有充分的科学依据。其二, UDCA基线水平对基线校正PK参数计算准确性有重要影响, 理论上基线水平过高或者基线波动程度较大个体的PK参数存在更高的偏倚, 达到一定程度时应考虑不纳入BE统计分析, 但是指南草案并未对此进行界定。
5 UDCA制剂生物等效性研究的现状、技术挑战及解决思路根据上述分析, UDCA生物等效性研究的技术挑战主要来源于生物样品检测与试验方案两个方面。
5.1 来源于生物样品检测方面的技术挑战和解决思路在胆汁酸代谢研究领域, 准确检测人体内各种胆汁酸一直是重大的技术挑战。上个世纪主要采用衍生化GC-MS方法检测胆汁酸, 通常将GUDCA与TUDCA水解或酶解为UDCA来间接检测它们的总量, 由此引入了游离UDCA和总UDCA的概念, 该概念也被FDA指南草案沿用。本世纪以来主要采用LC-MS法直接检测胆汁酸, 可以实现UDCA、GUDCA和TUDCA的分别检测, 但是大部分LC-MS方法存在对人类胆汁酸组复杂程度认识不足所致的专属性问题。FDA在批准UDCA治疗PBC的审评报告中也明确指出了这一点[5]:申报资料中采用的分析方法并未确证其检测UDCA及其代谢产物的专属性, 某些资料提供的数据是UDCA与其同分异构体的总浓度。
生物样品中UDCA、GUDCA和TUDCA检测的技术挑战首先来源于内源性同分异构体干扰所致的专属性风险。UDCA是二羟基胆甾烷-24-酸, 其同分异构体包括3-deoxyCA、DCA、CDCA、isoDCA、12-epiDCA、HDCA、UDCA、isoHDCA、isoUDCA、MDCA等一系列二羟基胆汁酸, 理论上GUDCA和TUDCA也存在相似的同分异构体。对于游离型胆汁酸, 由于其甾体骨架非常稳定, 没有可用于质谱多反应监测(MRM)的特征裂解碎片离子, 含12-羟基的胆汁酸除外; 对于结合型胆汁酸, 可用于MRM的特征裂解碎片离子也来源于各同分异构体共有的侧链酰胺键裂解[30, 31]。因此, MRM技术无法实现胆汁酸同分异构体的有效区分, 方法专属性高度依赖于方法的色谱分离效能, 需要使用高效能的色谱柱、足够长的洗脱时间和精细的梯度洗脱程序。如图 4所示, 近年来笔者发展的LC-MS方法可实现50种以上内源性胆汁酸的检测[27, 32], 尽管该方法已对通量进行了优化, 但20 min/样品的通量用于BE试验大量样品检测时仍显不足。在此基础上发展更高通量的LC-MS检测技术, 并保证UDCA、GUDCA和TUDCA与主要同分异构体的有效分离, 有望成为BE试验技术攻关的突破口。

|
Figure 4 Representative ion chromatograms of a series of dihydroxy-cholan-24-oic acids that present in human biological fluids[31]. Unconjugated bile acids: murideoxycholic acid (MDCA), isoUDCA, isohyodeoxycholic acid (isoHDCA), UDCA, HDCA, 12-epiDCA, isoDCA, CDCA, DCA, 3-deoxycholic acid (3-deoxyCA); Glycine-conjugated bile acids: glycohyodeoxycholic acid (GHDCA), glycoursodeoxycholic acid (GUDCA), glycochenodeoxycholic acid (GCDCA), glycodeoxycholic acid (GDCA); Taurine-conjugated bile acids: taurohyodeoxycholic acid (THDCA), tauroursodeoxycholic acid (TUDCA), taurochenodeoxycholic acid (TCDCA), taurodeoxycholic acid (TDCA) |
由于存在内源性干扰, 如何选择配制校正标样的空白基质是一个进退两难的问题。首先, 目前尚无选择性去除血浆/血清中UDCA或者胆汁酸的技术, 因此无法制备真正的“空白”生物基质。目前, 胆汁酸组学分析技术通常采用活性炭去除基质中的胆汁酸[27, 33], 但该法也会无选择性地吸附去除所有内源性代谢物、多肽和蛋白。也有研究选择低UDCA背景基质来制备校正标样, 但这些研究并未检测GUDCA, 其浓度通常在UDCA的几倍以上。其次, 选择替代基质(例如水、缓冲液、代血浆等)可以制成真正的空白“生物基质”, 但是由于LC-MS的基质效应来源于色谱同流出物质在离子源接口对待测物离子化程度的直接或间接干扰作用, 使用替代基质时潜在高度的基质效应风险。基质效应风险的降低一方面依赖于色谱分离效能, 另一方面依赖于使用稳定性同位素标记的UDCA、GUDCA和TUDCA作为内标。在此基础上, 还需要设计严密的验证试验来评估替代基质的潜在基质效应, 及其对方法准确度和精密度的影响程度。根据FDA审评报告[6, 7], UDCA仿制药注册BE试验使用了水作为替代基质来制备校正标样。
5.2 来源于试验方案设计方面的技术挑战和解决思路在试验方案方面, FDA指南草案已提供了良好的技术指引, 但迄今为止公开发表的BE试验均未完全按照FDA指南要求完成。如表 1所示, 检索到文献资料主要包括FDA公开的三份审评报告[5-7]和发表于2000~2013年间的学术论文[34-41]。总体而言, 学术界近年来对UDCA仿制药BE试验关键技术的关注不足, 来源于学术论文的资料不仅方案和方法信息披露不完整, 对UDCA的药代动力学性质的分析不够充分, 试验方法和数据质量较差。相比而言, FDA审评报告的披露信息的完整性与可靠性更佳。
| Table 1 Summary of the bioequivalence study protocols in literatures. |
文献资料采用的试验方案与FDA指南的主要差异在于两方面。首先, 除一项速释UDCA制剂的探索性BE研究之外, 其他BE研究均为空腹试验, 目前尚无可靠数据呈现高脂餐对UDCA口服吸收的影响程度。笔者认为, 高脂餐一方面可以影响胃排空和肠道蠕动可能导致吸收达峰延迟, 但另一方面有利于UDCA与胆汁排泄的内源性胆汁酸形成混合胶束, 促进UDCA溶出, 从而弱化制剂关键质量属性所致的吸收速度与程度差异, 餐后试验理论上比空腹试验更容易等效。其次, 除FDA仿制药注册BE试验外, 其他文献均未采用基线校正的试验设计和统计方法, BE试验结论的可靠性存疑。此外, 由于GUDCA和TUDCA的肝肠循环导致很长的体内滞留时间, 学术论文的BE方案均采用1~2周的清洗期, 无法消除周期间残留效应, 显然这些研究由于仅检测游离UDCA未关注到这一点。
更重要的是, 只有在生物样品检测的可靠性得到充分保证后, BE试验结果才能准确地反映出受试制剂和参比制剂关键质量属性的差异。如图 4所示, 人体内存在多种作为UDCA同分异构体的二羟基胆甾烷-24-酸, 其中isoUDCA及HDCA和UDCA的极性和保留时间最为相近, 它们也是UDCA的下游代谢产物, 这是导致方法专属性问题的关键风险之一, 但即便最近报道的LC-MS方法也未关注此问题[42]。考虑对照品的可及性问题, 作者认为, 用于BE试验的LC-MS方法至少应保证HDCA-UDCA、GHDCA-GUDCA、THDCA-TUDCA 3对代谢物的有效区分, 否则即便BE方案采用大受试者例数来对冲专属性缺陷所致个体差异失真的影响, 试验结果也不能如实反映受试制剂和参比制剂的关键质量属性的差异。综上, 在生物样品检测的专属性、基质效应等关键属性未得到充分验证时, BE试验结论将不可靠。
6 结语综上所述, 本文旨在抛砖引玉, 根据UDCA独特的结构、理化性质、生物药剂学和药代动力学性质, 在学术界和工业界文献资料的基础上剖析了UDCA仿制药研发及其BE研究的关键技术挑战, 并提出了相应的解决方案, 期望为我国高质量UDCA仿制药研发的技术攻关提供参考, 助力于UDCA这种高难度仿制药的“一致性评价”。此外, 胆汁酸作为哺乳动物保守的功能性代谢物, 不仅有关键的促进脂类物质吸收的生理功能, 而且有重要的糖脂代谢和免疫调控活性[43, 44]。本世纪蓬勃发展的宏基因组学及相关生物医学研究已提示, 很多慢性代谢性疾病和自身免疫性疾病与胆汁酸宿主-肠道菌群共代谢紊乱有关[45, 46]。因此, 针对UDCA这种已成药胆汁酸的代谢机制和作用机制的深入研究, 也将有利于胆汁酸类创新药物的研发, 助力于我国达成“健康中国2030规划”。
作者贡献:兰轲构思并修改审定终稿, 丁劲松和王安娜调查文献并撰写初稿, 黄亮绘制图稿并提供基金资助, 贾伟和刘昌孝修改文章, 所有作者均批准了最终出版版本。
利益冲突:作者声明不存在任何利益冲突。
| [1] |
Makino I, Tanaka H. From a choleretic to an immunomodulator:historical review of ursodeoxycholic acid as a medicament[J]. J Gastroenterol Hepatol, 1998, 13: 659-664. DOI:10.1111/j.1440-1746.1998.tb00707.x |
| [2] |
Beuers U, Gershwin ME, Gish RG, et al. Changing nomenclature for PBC:from 'cirrhosis' to 'cholangitis'[J]. Hepatology, 2015, 62: 1620-1622. DOI:10.1002/hep.28140 |
| [3] |
Food and Drug Administration. Approved Label for NDA 01594[EB/OL]. 2002-08-14[2020-03-31]. Silver Spring, MD, U.S. Food and Drug Administration. https://www.accessdata.fda.gov/drugsatfda_docs/label/2018/019594s21lbl.pdf.
|
| [4] |
Food and Drug Administration. Approved Label for NDA 020675[EB/OL]. 2013-06-14[2020-03-31]. Silver Spring, MD, U.S. Food and Drug Administration. https://www.accessdata.fda.gov/drugsatfda_docs/label/2013/020675s022lbl.pdf.
|
| [5] |
Food and Drug Administration. Approval Review for NDA 020675[EB/OL]. 1997-12-10[2020-03-31]. Silver Spring, MD, U.S. Food and Drug Administration. https://www.accessdata.fda.gov/drugsatfda_docs/nda/97/20675a.cfm.
|
| [6] |
Food and Drug Administration. Approval Review for ANDA 075592[EB/OL]. 2000-05-25[2020-03-31].Silver Spring, MD, U.S. Food and Drug Administration. https://www.accessdata.fda.gov/drugsatfda_docs/nda/2000/75-592_Ursodiol.pdf.
|
| [7] |
Food and Drug Administration. Approval Review for ANDA 75517[EB/OL]. 2000-03-14[2020-03-31]. Silver Spring, MD, U.S. Food and Drug Administration. https://www.accessdata.fda.gov/drugsatfda_docs/nda/2000/75517_Ursodiol.pdf.
|
| [8] |
Center of Drug Evaluation, National Medical Product Administration of China. Drug in vitro dissolution test information base/Japan medical pharmaceutical quality information set: ursodeoxycholic acid[EB/OL]. 2010-01-27[2020-03-31]. Center of Drug Evaluation, National Medical Product Administration of China. http://www.cde.org.cn/recommend.do?method=view&id=156.
|
| [9] |
Crosignani A, Setchell KDR, Invernizzi P, et al. Clinical pharmacokinetics of therapeutic bile acids[J]. Clin Pharmacokinet, 1996, 30: 333-358. DOI:10.2165/00003088-199630050-00002 |
| [10] |
Horkovics-Kovats S, Ulč I, Vít L, et al. Physicochemical pharmacokinetics as an optimization tool for generic development:a case study[J]. Eur J Pharm Sci, 2018, 111: 349-357. DOI:10.1016/j.ejps.2017.10.018 |
| [11] |
Parquet M, Metman EH, Raizman A, et al. Bioavailability, gastrointestinal transit, solubilization and faecal excretion of ursodeoxycholic acid in man[J]. Eur J Clin Invest, 1985, 15: 171-178. DOI:10.1111/j.1365-2362.1985.tb00164.x |
| [12] |
Stiehl A, Raedsch R, Rudolph G. Ileal excretion of bile acids:comparison with biliary bile composition and effect of ursodeoxycholic acid treatment[J]. Gastroenterology, 1988, 94: 1201-1206. DOI:10.1016/0016-5085(88)90013-3 |
| [13] |
Fedorowski T, Salen G, Colallilo A, et al. Metabolism of ursodeoxycholic acid in man[J]. Gastroenterology, 1977, 73: 1131-1137. DOI:10.1016/S0016-5085(19)31871-2 |
| [14] |
Bachrach WH, Hofmann AF. Ursodeoxycholic acid in the treatment of cholesterol cholelithiasis.Part Ⅱ[J]. Digest Dis Sci, 1982, 27: 737-761. DOI:10.1007/BF01393771 |
| [15] |
K nig J, Klatt S, Dilger K, et al. Characterization of ursodeoxycholic and norursodeoxycholic acid as substrates of the hepatic uptake transporters OATP 1B1, OATP 1B3, OATP 2B1 and NTCP[J]. Basic Clin Pharmacol, 2012, 111: 81-86. DOI:10.1111/j.1742-7843.2012.00865.x |
| [16] |
Zhou D, Kong L, Jiang Y, et al. UGT-dependent regioselective glucuronidation of ursodeoxycholic acid and obeticholic acid and selective transport of the consequent acyl glucuronides by OATP1B1 and 1B3[J]. Chem Biol Interact, 2019, 310: 108745. DOI:10.1016/j.cbi.2019.108745 |
| [17] |
Dawson PA, Lan T, Rao A. Bile acid transporters[J]. J Lipid Res, 2009, 50: 2340-2357. DOI:10.1194/jlr.R900012-JLR200 |
| [18] |
Halilbasic E, Claudel T, Trauner M. Bile acid transporters and regulatory nuclear receptors in the liver and beyond[J]. J Hepatol, 2013, 58: 155-168. DOI:10.1016/j.jhep.2012.08.002 |
| [19] |
Hofmann AF, Hagey LR. Key discoveries in bile acid chemistry and biology and their clinical applications:history of the last eight decades[J]. J Lipid Res, 2014, 55: 1553-1595. DOI:10.1194/jlr.R049437 |
| [20] |
Ridlon JM, Harris SC, Bhowmik S, et al. Consequences of bile salt biotransformations by intestinal bacteria[J]. Gut Microbes, 2016, 7: 22-39. DOI:10.1080/19490976.2015.1127483 |
| [21] |
Araya Z, Wikvall K. 6α-Hydroxylation of taurochenodeoxycholic acid and lithocholic acid by CYP3A4 in human liver microsomes[J]. Biochim Biophys Acta, 1999, 1438: 47-54. DOI:10.1016/S1388-1981(99)00031-1 |
| [22] |
Xie W, Radominska-Pandya A, Shi Y, et al. An essential role for nuclear receptors SXR/PXR in detoxification of cholestatic bile acids[J]. Proc Natl Acad Sci U S A, 2001, 98: 3375-3380. DOI:10.1073/pnas.051014398 |
| [23] |
Russell DW. The enzymes, regulation, and genetics of bile acid synthesis[J]. Annu Rev Biochem, 2003, 72: 137-174. DOI:10.1146/annurev.biochem.72.121801.161712 |
| [24] |
Zhang J, Gao LZ, Chen YJ, et al. Continuum of host-gut microbial co-metabolism:host CYP3A4/3A7 are responsible for tertiary oxidations of deoxycholate species[J]. Drug Metab Dispos, 2019, 47: 283-294. DOI:10.1124/dmd.118.085670 |
| [25] |
Lan K. Potential roles of cytochrome P4503A in host-gut microbial co-metabolism of bile acids[J]. Chin J Clin Pharmacol (中国临床药理学杂志), 2019, 35: 2923-2929. |
| [26] |
J ntti SE, Kivilompolo M, Ohrnberg L, et al. Quantitative profiling of bile acids in blood, adipose tissue, intestine, and gall bladder samples using ultra high performance liquid chromatography-tandem mass spectrometry[J]. Anal Bioanal Chem, 2014, 406: 7799-7815. DOI:10.1007/s00216-014-8230-9 |
| [27] |
Zhu P, Zhang J, Chen Y, et al. Analysis of human C24 bile acids metabolome in serum and urine based on enzyme digestion of conjugated bile acids and LC-MS determination of unconjugated bile acids[J]. Anal Bioanal Chem, 2018, 410: 5287-5300. DOI:10.1007/s00216-018-1183-7 |
| [28] |
Food and Drug Administration. Draft Guidance on Ursodiol (Tablets)[EB/OL]. Silver Spring, MD, U.S. Food and Drug Administration, 2008-07. https://www.accessdata.fda.gov/drugsatfda_docs/psg/Ursodiol_tab_20675_RC7-08.pdf.
|
| [29] |
Food and Drug Administration. Draft Guidance on Ursodiol (Capsules)[EB/OL]. Silver Spring, MD, U.S. Food and Drug Administration, 2010-02. https://www.accessdata.fda.gov/drugsatfda_docs/psg/Ursodiol_cap_19594_RC2-10.pdf.
|
| [30] |
Maekawa M, Shimada M, Iida T, et al. Tandem mass spectrometric characterization of bile acids and steroid conjugates based on low-energy collision-induced dissociation[J]. Steroids, 2014, 80: 80-91. DOI:10.1016/j.steroids.2013.11.016 |
| [31] |
Lan K, Su M, Xie G, et al. Key role for the 12-hydroxy group in the negative ion fragmentation of unconjugated C24 bile acids[J]. Anal Chem, 2016, 88: 7041-7048. DOI:10.1021/acs.analchem.6b00573 |
| [32] |
Yin S, Su M, Xie G, et al. Factors affecting separation and detection of bile acids by liquid chromatography coupled with mass spectrometry in negative mode[J]. Anal Bioanal Chem, 2017, 409: 5533-5545. DOI:10.1007/s00216-017-0489-1 |
| [33] |
Sarafian MH, Lewis MR, Pechlivanis A, et al. Bile acid profiling and quantification in biofluids using ultra-performance liquid chromatography tandem mass spectrometry[J]. Anal Chem, 2015, 87: 9662-9670. DOI:10.1021/acs.analchem.5b01556 |
| [34] |
Williams CN, Al-Knawy B, Blanchard W. Bioavailability of four ursodeoxycholic acid preparations[J]. Aliment Pharmacol Ther, 2000, 14: 1133-1139. DOI:10.1046/j.1365-2036.2000.00817.x |
| [35] |
Scalia S, Scagliarini R, Pazzi P. Evaluation of ursodeoxycholic acid bioavailability from immediate-and sustained-release preparations using gas chromatography-mass spectrometry and high-performance liquid chromatography[J]. Arzneimittelforschung, 2000, 50: 129-134. |
| [36] |
Sundd Singh S, Shah H, Gupta S, et al. Validation of LC/MS electrospray ionisation method for the estimation of ursodiol in human plasma and its application in bioequivalence study[J]. Ann Chim, 2004, 94: 951-959. DOI:10.1002/adic.200490117 |
| [37] |
Setchell KD, Galzigna L, O'Connell N, et al. Bioequivalence of a new liquid formulation of ursodeoxycholic acid (Ursofalk suspension) and Ursofalk capsules measured by plasma pharmacokinetics and biliary enrichment[J]. Aliment Pharmacol Ther, 2005, 21: 709-721. DOI:10.1111/j.1365-2036.2005.02385.x |
| [38] |
Zhang ZC, Jia JY, Wang W, et al. Pharmacokinetics and bioequivalence of ursodeoxycholic acid tablets[J]. Chin J Pharm (中国医药工业杂志), 2007, 38: 573-576. DOI:10.1631/jzus.2007.B0566 |
| [39] |
Yan YD, Yang ZM, Huang XJ, et al. Study on bioequivalence of ursodeoxycholic acid capsules[J]. Chin Pharm J (中国药学杂志), 2008, 43: 213-217. |
| [40] |
Yu JY, Bian Y, He L, et al. Bioequivalence of domestic and imported ursodeoxycholic acid capsules in healthy volunteers[J]. Chin J Clin Pharmacol (中国临床药理学杂志), 2010, 26: 37-41. |
| [41] |
Mukherjee J, Choudhurya H, Karmakara S, et al. Comparative pharmacokinetic and relative bioavailability study of ursodeoxycholic acid tablets in healthy Indian volunteers[J]. Int J Pharm Sci Rev Res, 2013, 22: 69-72. |
| [42] |
Pinto MC, Berton DC, de Oliveira AC, et al. Method development and validation of ursodiol and its major metabolites in human plasma by HPLC-tandem mass spectrometry[J]. Clin Pharmacol, 2019, 11: 1-13. DOI:10.2147/CPAA.S187519 |
| [43] |
Wahlstr m A, Sayin SI, Marschall HU, et al. Intestinal crosstalk between bile acids and microbiota and its impact on host metabolism[J]. Cell Metab, 2016, 24: 41-50. DOI:10.1016/j.cmet.2016.05.005 |
| [44] |
Jia W, Xie G, Jia W. Bile acid-microbiota crosstalk in gastrointestinal inflammation and carcinogenesis[J]. Nat Rev Gastroenterol Hepatol, 2018, 15: 111. DOI:10.1038/nrgastro.2017.119 |
| [45] |
Nicholson JK, Holmes E, Kinross J, et al. Host-gut microbiota metabolic interactions[J]. Science, 2012, 336: 1262-1267. DOI:10.1126/science.1223813 |
| [46] |
Soderholm AT, Pedicord VA. Intestinal epithelial cells:at the interface of the microbiota and mucosal immunity[J]. Immunology, 2019, 158: 267-280. DOI:10.1111/imm.13117 |
 2020, Vol. 55
2020, Vol. 55


