2. 中国药科大学药学院, 江苏省药物分子设计与成药性优化重点实验室, 江苏 南京 211198
2. College of Pharmacy, China Pharmaceutical University, Jiangsu Provincial Key Laboratory of Drug Molecular Design and Drug Formation Optimization, Nanjing 211198, China
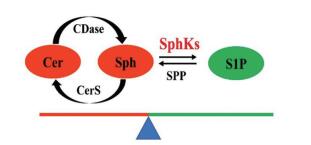
随着脂质组学的发展, 哺乳动物体内的鞘脂信号通路的重要功能逐渐被发掘, 靶向鞘脂信号通路成为治疗肿瘤的新策略[1, 2]。神经酰胺(ceramide, Cer)、鞘氨醇(sphingosine, Sph)与鞘氨醇-1-磷酸(sphingosine-1-phosphate, S1P)为主要的鞘脂类信号分子, 参与调节细胞生长、分化、衰老和死亡等信号转导过程。研究表明, Cer/Sph促进细胞凋亡, 而S1P促进细胞存活[3]。Cer经从头合成途径而来, 也可由鞘磷脂酶水解鞘磷脂产生, 生成的Cer可被神经酰胺酶水解生成Sph。鞘氨醇激酶(sphingosine kinase, SphK)催化Sph磷酸化生成S1P, 是维持Cer、Sph和S1P之间平衡的关键限速酶。鞘脂学研究用“鞘脂-变阻器” (sphingolipid-rheostat)来描述三者之间的平衡与转化(图 1)[4], 从而引起促凋亡的Cer/Sph升高和促存活的S1P降低。因此, 近年来SphKs作为抗肿瘤的新靶标越来越受到重视。
|
Figure 1 Transformation between ceramide, sphingosine and sphingosine-1-phosphate. CDase: Ceramidase; CerS: Ceramide synthase; SphKs: Sphingosine kinase; SPP: Sphingosine-1-phosphate |
SphKs具有两个亚型, 其中SphK1参与肿瘤发生的作用已被大量报道, 而SphK2在癌症中的作用尚未得到全面认识。但越来越多的研究表明SphK2是治疗肿瘤的一个潜在靶标。在此, 本研究检索并统计了Oncomine数据库中SphK2在多种癌症中的表达情况, 同时综述了目前SphK2在肿瘤发生发展过程中的生物学研究、SphK2抑制剂的开发现状及抑制剂抗肿瘤的相关研究进展。
1 鞘氨醇激酶在肿瘤中的表达与分布由于SphK2在细胞核、内质网、线粒体等位置均有分布, 早期生物学研究显示其功能十分复杂, 特别是对细胞存活与凋亡的作用存在较大争论[5-7], 导致相关病理学研究及药物开发严重受阻。但SphK2促进肿瘤发生的重要作用在近几年得到研究人员的一致认可, 特别是其选择性抑制剂ABC294640目前进入了临床Ⅱ期开发, 有力推动了SphK2的相关机制研究。
1.1 SphK2的亚细胞定位近期研究初步显示SphK2对肿瘤的影响取决于该酶的亚细胞定位, 而其定位主要受表达情况影响。在人工诱导SphK2高度过表达(> 30倍)时, 其分布于细胞核[8, 9]。但在患者癌变组织中SphK2均显示出较低的上调程度(< 5倍), SphK2则主要分布于细胞膜, 诱导细胞外S1P显著升高, 促进癌症发生[10, 11]。细胞质动力蛋白DYNC1I1可以抑制SphK2在细胞膜分布, 在人恶性胶质瘤中DYNC1I1下调, 导致更多的SphK2分布于细胞膜中, 而恢复小鼠体内DYNC1I1的表达后, 细胞膜的SphK2和胞外的S1P水平降低, 抑制了肿瘤生长和血管生成[12]。
1.2 SphK2在患者体内的表达研究Wang等[11]研究发现SphK2在多种患者癌组织中均有一定幅度上调, 最高约为正常组织的2.5倍。在非小细胞肺癌患者组织中, SphK2低表达患者5年无病生存率(DFS)和5年总生存率(OS)分别为44.4%和 > 50%, 而SphK2高表达患者5年DFS和OS分别为28.2%和35.36%。在胆管癌患者中, Noxa基因高表达与更好的总体生存率有关, 而研究发现SphK2 mRNA表达与Noxa mRNA表达呈负相关[13]。
本文应用Oncomine数据库统计了正常组织和患病组织中的SphK2 mRNA水平表达差异并进行箱式图比较分析, 发现在膀胱癌、乳腺癌、食管癌、宫颈癌、结直肠癌、胃癌、淋巴瘤等患者中均有不同程度的高表达(P > 0.05), 其中在食管癌、黑色素瘤、膀胱癌和骨髓瘤患者中最为明显(图 2)。

|
Figure 2 Expression of SphK2 mRNA in different cancers in Oncomine database |
SphK2高效高选择性抑制剂非常缺乏, 研究主要采用基因手段对SphK2进行调控, 并发现干扰或沉默该酶可显著抑制肿瘤细胞生长。Xu等[14]发现SphK2过表达会促进骨肉瘤细胞生长, 沉默SphK2则会抑制这些细胞生长。Liang等[15]通过小干扰RNA (siRNA)下调SphK2, 抑制了正常肝细胞的癌变和侵袭。体内实验也证明SphK2的siRNA可有效抑制肿瘤生长。此外, 微小RNA (miRNA)表达水平的改变可通过调节目的基因的转录, 影响靶蛋白表达水平, 并最终影响肿瘤细胞对药物的敏感性[16]。研究表明miR-338-3p、miR-363-3p、miR-613等均可以抑制肿瘤细胞中的SphK2并导致肿瘤的生长抑制[17-19]。
3 Sphk2参与肿瘤的主要机制目前SphK2参与肿瘤发生发展的具体机制还未明确, 甚至部分学说存在争论。Sarah Spiegel最早报道了SphK2与Bcl-xL结合会阻断Bcl-xL的促存活作用, 起到肿瘤抑制作用。但在Neubauer等[8]的一项研究中, 采用多种方法均没有发现SphK2与Bcl-xL之间的相互作用。直至近期, 越来越多的研究表明SphK2确实参与了肿瘤的发生, 可能存在以下几种途径:
3.1 细胞外途径如前所述, 在患者癌变组织中SphK2均显示出较低的上调程度, SphK2则更多地分布于细胞膜, 诱导细胞外S1P显著升高[10, 11]。胞外升高的S1P与其G蛋白偶联受体结合(S1PR1~5), 产生典型的S1P样作用, 如促进癌细胞存活、增殖、迁移、侵袭、肿瘤组织血管和淋巴管生成等[2, 20]。细胞质动力蛋白DYNC1I1参与SphK2的定位, 其下调导致更多的SphK2分布于细胞膜, 促进了以上过程[12]。
3.2 Mcl-1途径Bcl-2蛋白家族是细胞凋亡的主要调控因子, 该家族成员Noxa可降解抗凋亡的Bcl-2蛋白Mcl-1。Ding等[13]发现SphK2抑制剂ABC294640促进Mcl-1进行蛋白酶体降解, Noxa的敲除抑制了ABC294640诱导的Mcl-1降解和细胞凋亡。胆管癌细胞常过表达Mcl-1以抑制凋亡促进细胞存活, 而ABC294640通过上调促凋亡蛋白Noxa的mRNA和蛋白水平抑制癌细胞生长。Venkata等[21]发现ABC294640处理使Noxa蛋白表达水平提高了50%, 使Noxa/Mcl-1细胞凋亡组织器趋向于促进细胞凋亡。
3.3 细胞核途径SphK2在细胞核中具有分布, 可催化细胞核内的Sph生成S1P。核内S1P直接与组蛋白去乙酰化酶HDAC1和HDAC2结合并抑制其活性[5], 但最终对肿瘤生长所起的作用还未被阐明。细胞核内S1P还会作用于端粒酶反转录酶(TERT), 阻止其被泛素化降解, 进而抑制端粒的损伤和降解。抑制SphK2会导致TERT被持续降解, 诱导端粒的损伤和衰老, 导致细胞生长抑制[22]。
Myc在肿瘤的发生和维持中起重要作用。三阴乳腺癌细胞MDA-MB-231分泌含有microRNA-105的外泌体到达肿瘤基质细胞, 激活Myc, 为周围肿瘤细胞的生长提供能量[23], 而抑制SphK2可降低血液恶性肿瘤中c-Myc的表达[24]。Schrecengost等[25]发现ABC294640处理会显著抑制对雄激素阻断疗法敏感的前列腺癌细胞生长、增殖和周期进程, 并伴随AKT、雄激素受体(AR)和Myc信号通路失活。特别地, Myc和AR表达水平以及随后的转录活性均显著降低。通过增强Myc表达, Sphk2也被证明在急性淋巴细胞白血病中具有致癌作用[26]。ABC294640上调Noxa表达并促进Mcl-1和c-Myc的蛋白酶体降解, 显著下调pS6、Mcl-1和c-Myc的表达水平, 并诱导多发性骨髓瘤细胞凋亡[21]。Zhang等[27]发现SphK2敲除导致转染了特定siRNA的大肠癌LoVo细胞中Myc蛋白表达明显降低, 下调LoVo细胞系中SphK2表达可抑制癌细胞增殖。
3.4 其他途径除上述机制外, SphK2还可通过促进致癌性外排体形成[28], 参与表皮生长因子(EGF)诱导的膜突蛋白(ERM)的磷酸化和细胞侵袭[29]等过程促进癌症的发生发展。此外, SphK2以细胞特异性方式在细胞迁移中发挥作用。在乳腺癌细胞系MDA-MB-453中, 观察到细胞向EGF迁移, 并且该迁移被SphK2特异性siRNA消除, 而在HEK293细胞中SphK2的下调对迁移没有影响[30]。
4 SphK2抑制剂的研究现状目前已报道的高效高选择性SphK2抑制剂很少, 但在研究中发现靶向SphK2要表现出更优于靶向SphK1的抗肿瘤活性[7, 31]。基于对SphKs两个亚型的选择性, 将已报道的SphK2抑制剂分为非选择性和选择性抑制剂两类:
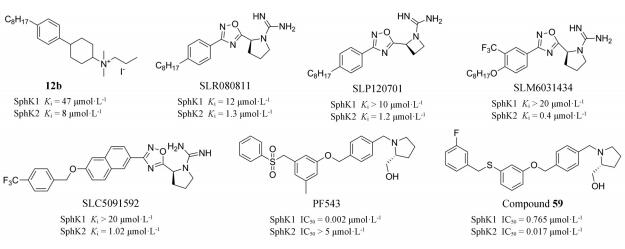
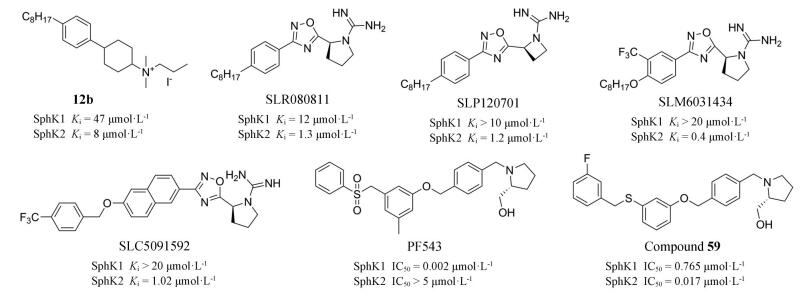
4.1 非选择性SphK2抑制剂最初开发的SphK2抑制剂主要为Sph类似物。将Sph进行还原或N, N-二甲基化分别得到了DHS[32]和DMS[33], 对两个亚型均表现出微摩尔水平的抑制活性。SKⅠ-Ⅱ是由Apogee Biotechnology公司高通量筛选得到的一个非选择性抑制剂, 对SphKs抑制活性Ki约为17 μmol·L-1 [34]。该化合物被报道可抑制多种肿瘤细胞的生长, 在体内也显示出良好的抗肿瘤活性[35, 36]。近几年开发SphK1抑制剂时, 发现部分含胍基基团的分子也显示出对SphK2的抑制活性(如化合物1、VPC96091), 但这些分子对SphK1的抑制能力更强。MP-A08是一种ATP竞争性的SphK1/SphK2抑制剂, 可诱导肿瘤细胞凋亡和抑制肿瘤血管生成来降低小鼠异种移植模型中人肺腺癌肿瘤的生长[37]。
|
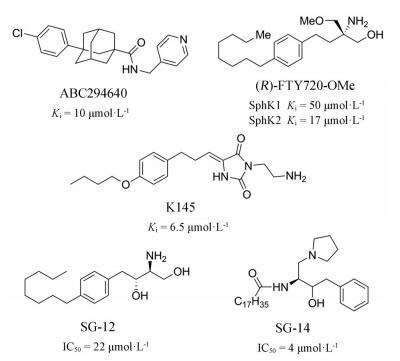
选择性SphK2抑制剂目前较少, 且大部分只有微摩尔水平的抑制活性。ABC294640在100 μmol·L-1对SphK1几乎无抑制活性, 而对SphK2则表现出较好的抑制能力(Ki = 9.8 μmol·L-1)。该化合物在乳腺癌、肾癌、结直肠癌、胰腺癌[38-41]、上皮性卵巢癌[42]、人皮肤鳞细胞癌[43]、胆管癌[44]中均显示出良好的抗癌活性。值得一提的是, ABC294640是所有SphKs抑制剂中唯一进入到临床Ⅱ期研究的分子, 目前在进行胆管癌和肝癌的临床研究(NCT03377179、NCT02939807)。K145也是SphK2的选择性抑制剂(Ki = 6.5 μmol·L-1), 在体内和体外均表现出优异的抗肿瘤活性。Liu课题组[28]发现K145可作为双重途径抑制剂, 抑制SphK2的同时抑制ART和AKT信号通路磷酸化, 从而实现对人白血病U937细胞的抗增殖和凋亡作用。
芬戈莫德(FTY720)是作用于S1P受体的自身免疫抑制剂, 其类似物具有SphK2选择性抑制活性。FTY720-OMe抑制SphK2的Ki为17 μmol·L-1 [45], 可抑制MCF-7乳腺癌细胞DNA合成, 并阻止S1P刺激的肌动蛋白重排[34]。Kim课题组[46]发现Sph的合成类似物SG-12 (IC50 = 22 μmol·L-1)和SG-14 (IC50 = 4 μmol·L-1)具有选择性抑制SphK2作用, 两者均可阻止Sph转化为S1P。随后该课题组报道了SG-12可加速小鼠B淋巴细胞A20/2J中Fas介导的细胞死亡进程[47]。
|
美国弗吉尼亚理工学院Raje等[48]发现化合物12b选择性抑制SphK2 (Ki = 8 μmol·L-1)。在此基础上, 该课题组又开发了一系列带有胍基的SphK1和SphK2抑制剂[49-51], 其中SLR080811、SLP120701和SLC5091592对SphK2的抑制活性得到一定提高(Ki = 1 μmol·L-1), 并表现出大于10倍的选择性。研究发现SLR080811可以降低人白血病U937细胞、Jurkat细胞和SKOV3卵巢癌细胞中的S1P和二氢S1P水平, 增加了鞘氨醇和二氢鞘氨醇水平[52]。近期Adams等[53]对SphK1选择性抑制剂PF543进行改造, 得到了若干高选择性抑制剂, 其中化合物59表现出非常高的SphK2抑制活性。该研究发现可通过降低砜基团的位阻效应来提高对SphK2的抑制活性。这些化合物属于新一代的SphK2抑制剂, 目前仅处于发现阶段, 还缺乏更深入的生物学研究。
该类新型抑制剂可作为先导化合物进行进一步开发。构效关系研究发现这类抑制剂主要具有1个极性的碱性基团作为头部, 1个芳香基团作为连接基, 1个疏水性基团作为尾部。其中胍基和羟甲基吡咯烷作为碱性头部时并未显示出很好的亚型选择性, 但可以提高化合物的抑制活性。K145的碱性头部仅为一个柔性氨基, 可能有利于提高对SphK2的选择性。可以考虑采用拼合原理将K145的碱性头部用于新型分子设计。在两个亚型抑制剂的连接基团即芳基并未发现明显区别, 但通过1个砜的结构连接末端疏水苯环时, 显示出很强的SphK1选择性, 而用O或C取代砜的基团, 则降低了选择性。在末端的疏水基团引入较大体积的取代基会增加化合物体积进而增强对SphK2的选择性。这可能是因为SphK1的J型结合口袋在末端位置存在1个苯丙氨酸, 而SphK2的该位置则为半胱氨酸, 结合空腔更大。由此可知, 在设计新型SphK2选择性抑制剂时, 需重点探索抑制剂分子末端取代基。
|
综上所述, 尽管SphK2抑制剂的种类和数量非常缺乏, 但活性研究已证明抑制SphK2具有巨大的应用价值, 目前已知的SphK2抑制剂在肿瘤领域的研究如表 1所示。
| Table 1 SphK2 inhibitors currently used in anti-tumor research |
SphK2会降低癌症放疗或化疗的敏感性。放化疗过程中会诱导细胞Cer大量表达, 促进细胞凋亡, 而高表达的SphK2会导致Cer含量降低。SphKs抑制剂与抗癌药物联用增效在许多体外实验中已被证明。ABC294640与Bcl抑制剂ABT-199[54, 55]、ABT-737[21]或ABT-263[13]联用均显示出在抑制骨髓瘤癌细胞或胆管癌细胞增殖方面有协同作用。Yang等[58]发现ABC294640和肿瘤坏死因子凋亡诱导配体(TRAIL)联合治疗可使耐药肺癌细胞对TRAIL诱导的凋亡产生敏感性而降低细胞长期存活率。此外, ABC294640和索拉非尼联用有效抑制肝癌和胰腺癌[61, 62], 与多柔比星和依托泊苷联用增加了乳腺癌MCF-7TN-R细胞凋亡[59], 与自噬抑制剂Baf或CQ联用降低了胆管癌细胞增殖[44]。
非选择性SphKs抑制剂SKⅠ-Ⅱ与替莫唑胺联用显示出对恶性胶质瘤更有效的作用[63], 与5-氟尿嘧啶联用显著减少了HepG2肝癌细胞的迁移和克隆存活, 增加诱导凋亡作用[57]。有人提出SphKs抑制剂可用做恶性胶质瘤化疗或放疗后的保守疗法, 用来避免因预后Cer降低而导致的疾病复发[64]。
5 小结与展望综上所述, SphK2通过诱导细胞凋亡、自噬、增加癌细胞治疗敏感性、调节信号通路中的一些关键因子等途径促进肿瘤的发生发展, 但其机制尚不完全清楚, 仍有待进一步研究。根据Oncomine数据库发现, SphK2在患者体内存在普遍过表达现象, 而且SphK2与总生存率有关。这些证据说明SphK2是治疗肿瘤的一个新策略, 具有良好的应用前景。
目前SphK2晶体结构依然未知, 其抑制剂存在数量少、结构类型单一以及活性弱等缺陷, 亟需受到研究者的关注。生物学研究大多使用基因手段或低活性抑制剂来实现对SphK2的活性控制。尽管ABC294640和K145已被广泛应用到生物学研究, 但这两个分子仍存在对其他靶点选择性低的问题。因此, 开发新型的高效高选择性SphK2抑制剂, 可作为药理工具对鞘脂信号通路的研究有着重要意义。随着近几年研究人员对SphK2在抗肿瘤领域的重视, 期望未来会出现更多更优的SphK2抑制剂, 并有望最终独立或与现有药物联用应用于肿瘤的临床治疗。
作者贡献:张金淼负责文献检索与分析、论文撰写; 郝清静负责文献检索与分析; 江凯旋负责文献检索; 李丽丽负责文献检索; 张卯玉负责文献数据整理; 王进欣负责论文修改与检查; 杨侃负责论文修改与检查。
利益冲突:本文研究内容无任何利益冲突。
| [1] |
Hannun YA, Obeid LM. Sphingolipids and their metabolism in physiology and disease[J]. Nat Rev Mol Cell Biol, 2018, 19: 175-191. DOI:10.1038/nrm.2017.107 |
| [2] |
Ogretmen B. Sphingolipid metabolism in cancer signalling and therapy[J]. Nat Rev Cancer, 2018, 18: 33-50. DOI:10.1038/nrc.2017.96 |
| [3] |
Zheng X, Li W, Ren L, et al. The sphingosine kinase-1/sphingosine-1-phosphate axis in cancer:potential target for anticancer therapy[J]. Pharmacol Ther, 2019, 195: 85-99. DOI:10.1016/j.pharmthera.2018.10.011 |
| [4] |
Cuvillier O, Pirianov G, Kleuser B, et al. Suppression of ceramide-mediated programmed cell death by sphingosine-1-phosphate[J]. Nature, 1996, 381: 800-803. DOI:10.1038/381800a0 |
| [5] |
Hait NC, Allegood J, Maceyka M, et al. Regulation of histone acetylation in the nucleus by sphingosine-1-phosphate[J]. Science, 2009, 325: 1254-1257. DOI:10.1126/science.1176709 |
| [6] |
Okada T, Ding G, Sonoda H, et al. Involvement of N-terminal-extended form of sphingosine kinase 2 in serum-dependent regulation of cell proliferation and apoptosis[J]. J Biol Chem, 2005, 280: 36318-36325. |
| [7] |
Gao P, Smith CD. Ablation of sphingosine kinase-2 inhibits tumor cell proliferation and migration[J]. Mol Cancer Res, 2011, 9: 1509-1519. DOI:10.1158/1541-7786.MCR-11-0336 |
| [8] |
Neubauer HA, Pham DH, Zebol JR, et al. An oncogenic role for sphingosine kinase 2[J]. Oncotarget, 2016, 7: 64886-64899. DOI:10.18632/oncotarget.11714 |
| [9] |
Igarashi N, Okada T, Hayashi S, et al. Sphingosine kinase 2 is a nuclear protein and inhibits DNA synthesis[J]. J Biol Chem, 2003, 278: 46832-46839. DOI:10.1074/jbc.M306577200 |
| [10] |
Chang YC, Chuang HL, Yin JH, et al. Significance of sphingosine kinase 1 expression in feline mammary tumors[J]. BMC Vet Res, 2019, 15: 155. DOI:10.1186/s12917-019-1883-z |
| [11] |
Wang Q, Li J, Li G, et al. Prognostic significance of sphingosine kinase 2 expression in non-small cell lung cancer[J]. Tumour Biol, 2014, 35: 363-368. DOI:10.1007/s13277-013-1051-1 |
| [12] |
Neubauer HA, Tea MN, Zebol JR, et al. Cytoplasmic dynein regulates the subcellular localization of sphingosine kinase 2 to elicit tumor-suppressive functions in glioblastoma[J]. Oncogene, 2019, 38: 1151-1165. DOI:10.1038/s41388-018-0504-9 |
| [13] |
Ding X, Zhang Y, Huang T, et al. Targeting sphingosine kinase 2 suppresses cell growth and synergizes with BCL2/BCL-XL inhibitors through NOXA-mediated MCL1 degradation in cholangiocarcinoma[J]. Am J Cancer Res, 2019, 9: 546-561. |
| [14] |
Xu D, Zhu H, Wang C, et al. SphK2 over-expression promotes osteosarcoma cell growth[J]. Oncotarget, 2017, 8: 105525-105535. DOI:10.18632/oncotarget.22314 |
| [15] |
Liang J, Zhang X, He S, et al. Sphk2 RNAi nanoparticles suppress tumor growth via downregulating cancer cell derived exosomal microRNA[J]. J Control Release, 2018, 286: 348-357. DOI:10.1016/j.jconrel.2018.07.039 |
| [16] |
Zhao WM, Dong ZY, Shi ZF, et al. Down-regulation of miR-205-5p sensitizes HNE1/DDP to cisplatin induced apoptosis in vitro[J]. Acta Pharm Sin (药学学报), 2019, 54: 1200-1206. |
| [17] |
Qiu W, Yang Z, Fan Y, et al. MicroRNA-613 inhibits cell growth, migration and invasion of papillary thyroid carcinoma by regulating SphK2[J]. Oncotarget, 2016, 7: 39907-39915. DOI:10.18632/oncotarget.9530 |
| [18] |
Dong J, Geng J, Tan W. MiR-363-3p suppresses tumor growth and metastasis of colorectal cancer via targeting SphK2[J]. Biomed Pharmacother, 2018, 105: 922-931. DOI:10.1016/j.biopha.2018.06.052 |
| [19] |
Zhang G, Zheng H, Zhang G, et al. MicroRNA-338-3p suppresses cell proliferation and induces apoptosis of non-small-cell lung cancer by targeting sphingosine kinase 2[J]. Cancer Cell Int, 2017, 17: 46. DOI:10.1186/s12935-017-0415-9 |
| [20] |
Takabe K, Spiegel S. Export of sphingosine-1-phosphate and cancer progression[J]. J Lipid Res, 2014, 55: 1839-1846. DOI:10.1194/jlr.R046656 |
| [21] |
Venkata JK, An N, Stuart R, et al. Inhibition of sphingosine kinase 2 downregulates the expression of c-Myc and Mcl-1 and induces apoptosis in multiple myeloma[J]. Blood, 2014, 124: 1915-1925. |
| [22] |
Panneer Selvam S, De Palma RM, Oaks JJ, et al. Binding of the sphingolipid S1P to hTERT stabilizes telomerase at the nuclear periphery by allosterically mimicking protein phosphorylation[J]. Sci Signal, 2015, 8:ra58. |
| [23] |
Zhang T, Liu J, Ding Y. Research advances of glutamine metabolism-related targetsin tumor treatment[J]. Acta Pharm Sin (药学学报), 2020, 55: 813-820. |
| [24] |
Evangelisti C, Evangelisti C, Buontempo F, et al. Therapeutic potential of targeting sphingosine kinases and sphingosine 1-phosphate in hematological malignancies[J]. Leukemia, 2016, 30: 2142-2151. DOI:10.1038/leu.2016.208 |
| [25] |
Schrecengost RS, Keller SN, Schiewer MJ, et al. Downregulation of critical oncogenes by the selective SK2 inhibitor ABC294640 hinders prostate cancer progression[J]. Mol Cancer Res, 2015, 13: 1591-1601. DOI:10.1158/1541-7786.MCR-14-0626 |
| [26] |
Wallington-Beddoe CT, Powell JA, Tong D, et al. Sphingosine kinase 2 promotes acute lymphoblastic leukemia by enhancing MYC expression[J]. Cancer Res, 2014, 74: 2803-2815. DOI:10.1158/0008-5472.CAN-13-2732 |
| [27] |
Zhang L, Liu X, Zuo Z, et al. Sphingosine kinase 2 promotes colorectal cancer cell proliferation and invasion by enhancing MYC expression[J]. Tumour Biol, 2016, 37: 8455-8460. DOI:10.1007/s13277-015-4700-8 |
| [28] |
Liu K, Guo TL, Hait NC, et al. Biological characterization of 3-(2-amino-ethyl)-5-[3-(4-butoxyl-phenyl)-propylidene]-thiazolidine-2, 4-dione (K145) as a selective sphingosine kinase-2 inhibitor and anticancer agent[J]. PLoS One, 2013, 8: e56471.
|
| [29] |
Adada MM, Canals D, Jeong N, et al. Intracellular sphingosine kinase 2-derived sphingosine-1-phosphate mediates epidermal growth factor-induced ezrin-radixin-moesin phosphorylation and cancer cell invasion[J]. FASEB J, 2015, 29: 4654-4669. DOI:10.1096/fj.15-274340 |
| [30] |
Hait NC, Sarkar S, Le Stunff H, et al. Role of sphingosine kinase 2 in cell migration toward epidermal growth factor[J]. J Biol Chem, 2005, 280: 29462-29469. DOI:10.1074/jbc.M502922200 |
| [31] |
Van Brocklyn JR, Jackson CA, Pearl DK, et al. Sphingosine kinase-1 expression correlates with poor survival of patients with glioblastoma multiforme:roles of sphingosine kinase isoforms in growth of glioblastoma cell lines[J]. J Neuropathol Exp Neurol, 2005, 64: 695-705. DOI:10.1097/01.jnen.0000175329.59092.2c |
| [32] |
Buehrer BM, Bell RM. Inhibition of sphingosine kinase in vitro and in platelets. Implications for signal transduction pathways[J]. J Biol Chem, 1992, 267: 3154-3159. |
| [33] |
Melendez AJ, Carlos-Dias E, Gosink M, et al. Human sphingosine kinase:molecular cloning, functional characterization and tissue distribution[J]. Gene, 2000, 251: 19-26. DOI:10.1016/S0378-1119(00)00205-5 |
| [34] |
Lim KG, Tonelli F, Li Z, et al. FTY720 analogues as sphingosine kinase 1 inhibitors:enzyme inhibition kinetics, allosterism, proteasomal degradation, and actin rearrangement in MCF-7 breast cancer cells[J]. J Biol Chem, 2011, 286: 18633-18640. DOI:10.1074/jbc.M111.220756 |
| [35] |
French KJ, Upson JJ, Keller SN, et al. Antitumor activity of sphingosine kinase inhibitors[J]. J Pharmacol Exp Ther, 2006, 318: 596-603. DOI:10.1124/jpet.106.101345 |
| [36] |
Maines LW, Fitzpatrick LR, French KJ, et al. Suppression of ulcerative colitis in mice by orally available inhibitors of sphingosine kinase[J]. Dig Dis Sci, 2008, 53: 997-1012. DOI:10.1007/s10620-007-0133-6 |
| [37] |
Pitman MR, Powell JA, Coolen C, et al. A selective ATP-competitive sphingosine kinase inhibitor demonstrates anti-cancer properties[J]. Oncotarget, 2015, 6: 7065-7083. DOI:10.18632/oncotarget.3178 |
| [38] |
French KJ, Zhuang Y, Maines LW, et al. Pharmacology and antitumor activity of ABC294640, a selective inhibitor of sphingosine kinase-2[J]. J Pharmacol Exp Ther, 2010, 333: 129-139. DOI:10.1124/jpet.109.163444 |
| [39] |
Gao P, Peterson YK, Smith RA, et al. Characterization of isoenzyme-selective inhibitors of human sphingosine kinases[J]. PLoS One, 2012, 7:e44543. |
| [40] |
Gestaut MM, Antoon JW, Burow ME, et al. Inhibition of sphingosine kinase-2 ablates androgen resistant prostate cancer proliferation and survival[J]. Pharmacol Rep, 2014, 66: 174-178. DOI:10.1016/j.pharep.2013.08.014 |
| [41] |
Xun C, Chen MB, Qi L, et al. Targeting sphingosine kinase 2(SphK2) by ABC294640 inhibits colorectal cancer cell growth in vitro and in vivo[J]. J Exp Clin Cancer Res, 2015, 34: 94. DOI:10.1186/s13046-015-0205-y |
| [42] |
Song K, Dai L, Long X, et al. Sphingosine kinase 2 inhibitor ABC294640 displays anti-epithelial ovarian cancer activities in vitro and in vivo[J]. OncoTargets Ther, 2019, 12: 4437-4449. DOI:10.2147/OTT.S208519 |
| [43] |
Zhou J, Chen J, Yu H. Targeting sphingosine kinase 2 by ABC294640 inhibits human skin squamous cell carcinoma cell growth[J]. Biochem Biophys Res Commun, 2018, 497: 535-542. DOI:10.1016/j.bbrc.2018.02.075 |
| [44] |
Ding X, Chaiteerakij R, Moser CD, et al. Antitumor effect of the novel sphingosine kinase 2 inhibitor ABC294640 is enhanced by inhibition of autophagy and by sorafenib in human cholangiocarcinoma cells[J]. Oncotarget, 2016, 7: 20080-20092. DOI:10.18632/oncotarget.7914 |
| [45] |
Lim KG, Sun C, Bittman R, et al. (R)-FTY720 methyl ether is a specific sphingosine kinase 2 inhibitor:effect on sphingosine kinase 2 expression in HEK 293 cells and actin rearrangement and survival of MCF-7 breast cancer cells[J]. Cell Signal, 2011, 23: 1590-1595. DOI:10.1016/j.cellsig.2011.05.010 |
| [46] |
Kim JW, Kim YW, Inagaki Y, et al. Synthesis and evaluation of sphingoid analogs as inhibitors of sphingosine kinases[J]. Bioorg Med Chem, 2005, 13: 3475-3485. DOI:10.1016/j.bmc.2005.02.053 |
| [47] |
Hara-Yokoyama M, Terasawa K, Ichinose S, et al. Sphingosine kinase 2 inhibitor SG-12 induces apoptosis via phosphorylation by sphingosine kinase 2[J]. Bioorg Med Chem Lett, 2013, 23: 2220-2224. DOI:10.1016/j.bmcl.2013.01.083 |
| [48] |
Raje MR, Knott K, Kharel Y, et al. Design, synthesis and biological activity of sphingosine kinase 2 selective inhibitors[J]. Bioorg Med Chem, 2012, 20: 183-194. DOI:10.1016/j.bmc.2011.11.011 |
| [49] |
Patwardhan NN, Morris EA, Kharel Y, et al. Structure-activity relationship studies and in vivo activity of guanidine-based sphingosine kinase inhibitors:discovery of SphK1-and SphK2-selective inhibitors[J]. J Med Chem, 2015, 58: 1879-1899. DOI:10.1021/jm501760d |
| [50] |
Childress ES, Kharel Y, Brown AM, et al. Transforming sphingosine kinase 1 inhibitors into dual and sphingosine kinase 2 selective inhibitors:design, synthesis, and in vivo activity[J]. J Med Chem, 2017, 60: 3933-3957. DOI:10.1021/acs.jmedchem.7b00233 |
| [51] |
Congdon MD, Kharel Y, Brown AM, et al. Structure-activity relationship studies and molecular modeling of naphthalene-based sphingosine kinase 2 inhibitors[J]. ACS Med Chem Lett, 2016, 7: 229-234. DOI:10.1021/acsmedchemlett.5b00304 |
| [52] |
Kharel Y, Raje M, Gao M, et al. Sphingosine kinase type 2 inhibition elevates circulating sphingosine 1-phosphate[J]. Biochem J, 2012, 447: 149-157. DOI:10.1042/BJ20120609 |
| [53] |
Adams DR, Tawati S, Berretta G, et al. Topographical mapping of isoform-selectivity determinants for J-channel-binding inhibitors of sphingosine kinases 1 and 2[J]. J Med Chem, 2019, 62: 3658-3676. DOI:10.1021/acs.jmedchem.9b00162 |
| [54] |
Xu L, Jin L, Yang B, et al. The sphingosine kinase 2 inhibitor ABC294640 inhibits cervical carcinoma cell growth[J]. Oncotarget, 2018, 9: 2384-2394. DOI:10.18632/oncotarget.23415 |
| [55] |
Sundaramoorthy P, Gasparetto C, Kang Y. The combination of a sphingosine kinase 2 inhibitor (ABC294640) and a Bcl-2 inhibitor (ABT-199) displays synergistic anti-myeloma effects in myeloma cells without a t(11;14) translocation[J]. Cancer Med, 2018, 7: 3257-3268. DOI:10.1002/cam4.1543 |
| [56] |
Magli E, Corvino A, Fiorino F, et al. Design of sphingosine kinases inhibitors:challenges and recent developments[J]. Curr Pharm Des, 2019, 25: 956-968. DOI:10.2174/1381612825666190404115424 |
| [57] |
Grbcic P, Tomljanovic I, Klobucar M, et al. Dual sphingosine kinase inhibitor SKI-Ⅱ enhances sensitivity to 5-fluorouracil in hepatocellular carcinoma cells via suppression of osteopontin and FAK/IGF-1R signalling[J]. Biochem Biophys Res Commun, 2017, 487: 782-788. DOI:10.1016/j.bbrc.2017.04.100 |
| [58] |
Yang J, Yang C, Zhang S, et al. ABC294640, a sphingosine kinase 2 inhibitor, enhances the antitumor effects of TRAIL in non-small cell lung cancer[J]. Cancer Biol Ther, 2015, 16: 1194-1204. DOI:10.1080/15384047.2015.1056944 |
| [59] |
Antoon JW, White MD, Slaughter EM, et al. Targeting NFκB mediated breast cancer chemoresistance through selective inhibition of sphingosine kinase-2[J]. Cancer Biol Ther, 2011, 11: 678-689. DOI:10.4161/cbt.11.7.14903 |
| [60] |
Beljanski V, Knaak C, Smith CD. A novel sphingosine kinase inhibitor induces autophagy in tumor cells[J]. J Pharmacol Exp Ther, 2010, 333: 454-464. DOI:10.1124/jpet.109.163337 |
| [61] |
Beljanski V, Knaak C, Zhuang Y, et al. Combined anticancer effects of sphingosine kinase inhibitors and sorafenib[J]. Invest New Drugs, 2011, 29: 1132-1142. DOI:10.1007/s10637-010-9452-0 |
| [62] |
Beljanski V, Lewis CS, Smith CD. Antitumor activity of sphingosine kinase 2 inhibitor ABC294640 and sorafenib in hepatocellular carcinoma xenografts[J]. Cancer Biol Ther, 2011, 11: 524-534. DOI:10.4161/cbt.11.5.14677 |
| [63] |
Noack J, Choi J, Richter K, et al. A sphingosine kinase inhibitor combined with temozolomide induces glioblastoma cell death through accumulation of dihydrosphingosine and dihydroceramide, endoplasmic reticulum stress and autophagy[J]. Cell Death Dis, 2014, 5:e1425. |
| [64] |
Sordillo LA, Sordillo PP, Helson L. Sphingosine kinase inhibitors as maintenance therapy of glioblastoma after ceramide-induced response[J]. Anticancer Res, 2016, 36: 2085-2095. |
 2020, Vol. 55
2020, Vol. 55

 ,
杨侃1
,
杨侃1