2. 西南医科大学附属医院放射科, 放射分子影像实验室, 四川 泸州 646000;
3. 病毒学国家重点实验室, 湖北 武汉 430072
2. Radiological Molecular Imaging Laboratory, Department of Radiology, the Affiliated Hospital of Southwest Medical University, Luzhou 646000, China;
3. The State Key Laboratory of Virology, Wuhan 430072, China
乳腺癌是一种发生在乳腺上皮组织中的恶性肿瘤, 在女性中, 乳腺癌是最常见的癌症之一, 其致死率也位居女性恶性肿瘤首位。根据世界卫生组织国际癌症研究机构最新公布的2018年全球肿瘤流行病统计数据(GLOBOCAN2018), 在女性患者中, 乳腺癌的发病率远远超过了肺癌、结肠癌等其他癌症, 其发病率和死亡率均居首位, 分别为24.2%和15.0%[1]。中国虽然不是乳腺癌高发国家, 但近20年来其发病率和死亡率均迅速增长, 形势依然严峻[2]。
1 乳腺癌治疗研究现状在乳腺癌的临床治疗过程中, 根据雌激素受体(estrogen receptor, ER)、孕激素受体(progesterone receptor, PR)、人类表皮生长因子受体-2 (human epidermal growth factor receptor-2, HER-2)表达水平不同, 采用的治疗方案也不同。主要分为以下4种情况: ①针对ER和PR阳性HER-2阴性乳腺癌, 其治疗药物主要为内分泌药物, 如他莫昔芬等; ②针对HER-2阳性乳腺癌, 主要采用靶向药物治疗, 如曲妥珠单抗等; ③针对ER、PR、HER-2均为阴性的三阴性乳腺癌(triple negative breast cancer, TNBC), 其尚无有效的靶向药物, 通常采用化疗药物, 如紫杉醇等; ④针对乳腺癌易感基因(BRCA)突变型乳腺癌, 其主要采用化疗药物与靶向药物开展联合治疗, 例如使用紫杉醇和奥拉帕尼等。
根据临床统计, 在乳腺癌患者中, 约有70%的患者表现为ER阳性[3], 因此雌激素受体对于ER阳性乳腺癌是一个非常重要的治疗靶点。作为靶向ER的选择性雌激素受体调节剂(selective estrogen receptor modulators, SERMs) —他莫昔芬, 通过拮抗ER表现出对乳腺癌细胞增殖的抑制作用, 从20世纪70年代发现至今, 在乳腺癌治疗中一直发挥着非常重要的作用[4]。然而由于他莫昔芬对其他组织中的ER同时还具有激动活性, 导致部分患者不仅会增加患子宫内膜癌风险[5], 而且还会随着他莫昔芬的长期使用产生耐药现象, 同时伴随有乳腺癌发生转移的风险[6, 7], 以上缺点限制了其在乳腺癌临床治疗中更广泛的应用。选择性雌激素受体下调剂(selective estrogen receptor down-regulators, SERDs)作为以ER为靶点的新一代ER阳性乳腺癌内分泌治疗药物, 不仅能够拮抗ER, 还能够降解ER, 进而通过降低ER蛋白表达水平来抑制ER信号通路, 达到抑制乳腺癌细胞增殖的作用, 这一不同于SERMs的作用机制能够克服乳腺癌耐药性问题。目前, 氟维司群是唯一一个临床批准使用的SERDs药物, 也是蛋白降解的疏水标签技术(hydrophobic tagging, HyT)的一个原始模型, 其在与ER结合后, 结构中的长烷基疏水侧链部分从与ER的结合口袋中伸出, 影响ER蛋白结构中的螺旋-12定位, 使得ER蛋白表面疏水性增加, 蛋白稳定性降低, 从而被26S蛋白酶体降解, 然而其口服生物利用度差, 限制其在临床上的广泛应用[8, 9]。为了克服氟维司群在临床使用中的局限性, 研究人员正在开发新的、具有高口服生物利用度的SERDs化合物。到目前为止, 已有部分候选SERDs进入临床试验评估阶段[10, 11]。此外, 基于氟维司群在临床上的应用表明, 通过降解ER蛋白的策略能够为乳腺癌, 尤其是对内分泌疗法有耐药性的乳腺癌治疗提供有效的途径, 然而氟维司群为注射给药, 部分患者顺应性较差。因此, 急需开发新一代SERDs药物, 通过不同方式来降低乳腺癌治疗中的耐药性和复发的可能性。近年来, 科学家将目光转向小分子靶向蛋白降解药物领域, 希望能够发现更有前景的靶向降解药物, 用于耐药性乳腺癌的治疗。例如近期通过引入靶向降解蛋白质的PROTAC技术来调控与乳腺癌有关的靶标已受到相关研究人员的广泛关注, 为开发抗乳腺癌药物带来新的希望。本文将对PROTAC技术进行概述, 并总结PROTAC分子在乳腺癌治疗中的研究进展。
2 PROTAC技术在药物研发过程中, 研究人员通常试图通过调控引起疾病的蛋白质表达水平来调节人体机能进而控制疾病的发展。其中, 基因敲除和RNA干扰等技术是在DNA以及RNA水平上对蛋白质水平进行调控, 尽管具有治疗潜力, 但其脱靶效应和代谢不稳定性限制了其广泛应用; 而传统的小分子抑制剂是通过与蛋白质结合来阻断蛋白质的功能, 这种作用模式往往需要较高的药物剂量以及足够高的亲和力, 通常会导致毒副作用以及产生耐药性, 并且在已发现疾病的相关蛋白中, 高达80%的蛋白质不能被现有的药物靶向调控, 如转录因子和支架蛋白等。蛋白水解靶向嵌合体(proteolysis targeting chimera, PROTAC)是目前新药发现的热点技术之一, 许多不能用小分子抑制剂调控的靶点以及靶蛋白过表达或突变而导致的耐药性都有望通过PROTAC技术解决, 该技术的核心是设计能够靶向目标蛋白并通过泛素-蛋白酶体来降解靶蛋白的药物分子[12, 13]。
PROTAC技术的概念是由Crews和Deshaies课题组在2001年首次提出[14]。该技术是通过泛素-蛋白酶体系统对靶蛋白进行泛素化标记和降解, 从而降低靶蛋白水平[15]。泛素-蛋白酶体系统(ubiquitin-proteasome system, UPS)是细胞内蛋白质降解的主要方式, 参与细胞内80%以上蛋白质的降解。该系统主要包括泛素(ubiquitin, Ub)、泛素活化酶(ubiquitin activating enzyme, E1)、泛素结合酶(ubiquitin conjugating enzyme, E2)、泛素连接酶(ubiquitin protein ligase, E3)以及26S蛋白酶体[16]。通过UPS降解靶蛋白的途径主要为: Ub分子首先与E1泛素活化酶连接并被激活, 然后转移到E2泛素结合酶上, 随后通过E3泛素连接酶将活化的Ub分子转移到靶蛋白上, 被泛素化标记的靶蛋白最后会被26S蛋白酶体识别进而被降解。通常, PROTAC分子由3部分组成:靶蛋白结合配体、E3连接酶配体以及两者中间的连接链[17]。如图 1所示, PROTAC分子作为一种双功能分子, 可以同时与靶蛋白(protein of interest, POI)以及E3连接酶结合, 进而形成靶蛋白-PROTAC分子-E3连接酶的三元复合物, 最后通过E3连接酶介导靶蛋白的泛素化以及降解[18, 19], 因此本身不能直接与E3连接酶结合的靶蛋白可以通过PROTAC分子这一桥梁被UPS所降解, 实现靶蛋白水平的降低。在PROTAC进一步机制研究过程中, 人们发现PROTAC分子只有与靶蛋白和E3连接酶同时结合形成三元复合物时才能起作用。当PROTAC分子的浓度超过一定限度时, 部分PROTAC分子只与靶蛋白连接或只与E3泛素连接酶连接, 形成二元络合物, 从而导致降解效用下降, 这种现象被称为Hook效应[20]。
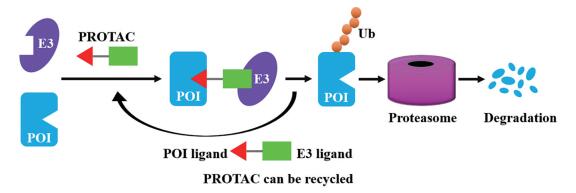
|
Figure 1 The mechanism of proteolysis targeting chimera (PROTAC) |
2001年, Crews课题组[14]首次报道了第一个基于肽类的PROTAC分子1 (图 2), 实现了对甲硫氨酸氨肽酶2 (methionine aminopeptidase-2, MetAP-2)的靶向降解。最初的PROTAC研究主要利用肽类分子作为E3连接酶配体, 由于这些肽类PROTAC分子细胞渗透性差, 药效活性低, 在体内的应用具有一定的局限性。2008年, Crews课题组[21]设计、合成了第一个基于小分子的PROTAC分子2 (图 2), 实现了对雄激素受体(androgen receptor, AR)的靶向降解, 从而开启了小分子PROTAC发展的新时代。随着E3连接酶(MDM2、cIAP1、CRBN和VHL)小分子配体的不断发现, PROTAC技术目前已得到了显著的发展。至今, 已有越来越多靶蛋白相应的PROTAC分子被报道[22, 23], 且部分化合物在体内外实验中表现出良好的作用效果, 有望进一步开发成为临床药物。2019年, Arvinas公司报道其开发的分别靶向降解ER和AR的两个PROTAC分子已进入临床试验, PROTAC蛋白降解疗法正式迈入临床试验阶段, 进一步表明PROTAC技术在新药研发领域的可行性。
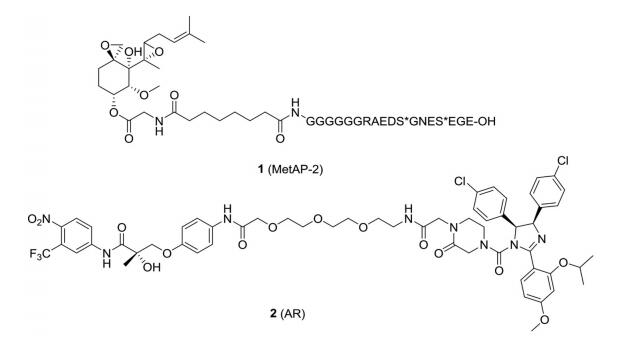
|
Figure 2 The structures of PROTACs 1 and 2 |
在乳腺癌药物研发过程中, 已发现多种相关靶点包括雌激素受体、人类表皮生长因子受体-2、细胞周期依赖性蛋白(cyclin dependent kinases, CDKs)等, 这些靶蛋白在体内的异常表达与乳腺癌的发生和发展密切相关, 虽然现在已有一些靶向这些蛋白的小分子抑制剂在临床中用于乳腺癌的治疗, 但是耐药性的产生以及本身的毒副作用也是该类小分子抑制剂面临的巨大挑战, 因此通过设计合成PROTAC分子来调控乳腺癌相关靶点具有良好的应用前景。
3.1 靶向雌激素受体(ER)的PROTAC分子雌激素受体属于核受体超家族, 其有两种主要的亚型: ERα和ERβ[24], 两者在体内具有不同分布, ERα主要分布在乳房、子宫等生殖系统中, 在心血管、骨骼、脑组织中也有分布; ERβ则广泛分布于子宫、胰腺等组织。ER在女性生殖系统的发育、骨代谢以及心血管系统和中枢神经系统发挥重要作用, 并且在乳腺癌患者中, 约70%表现为ER阳性乳腺癌, 因此ER是雌激素受体阳性乳腺癌药物研究中一个重要靶点, 研究人员针对该靶点设计合成了一系列PROTAC分子。
3.1.1 肽类PROTAC2003年, Sakamoto等[25]设计合成了第一个靶向ER的PROTAC分子3 (图 3)。该分子采用雌二醇作为ER配体, IκB-α磷酸肽作为E3连接酶配体, 实现在体外诱导ERα的泛素化及降解。化合物3在5~10 μmol·L-1时对ER具有最高降解活性, 当其浓度达到500 μmol·L-1时, 不再观察到ER水平的降低, 符合Hook效应。加入单独的配体部分或蛋白酶体抑制剂均能有效抑制化合物3对ER的降解, 结果表明该化合物对ER是通过泛素-蛋白酶体系统进行降解。然而由于该分子膜渗透性较差, 无法在活细胞内实现对ER的靶向降解, 限制了其进一步开发的潜力, 但PROTAC分子3的发现为靶向ER的PROTAC技术开启新的起点。
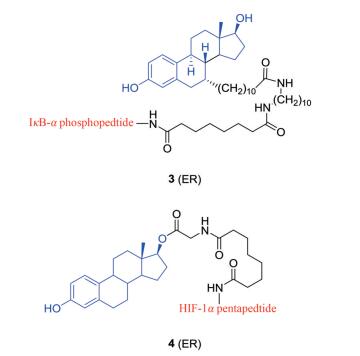
|
Figure 3 The structures of PROTACs 3 and 4 |
2004年, Zhang等[26]首次报道了在活细胞中靶向ER降解的PROTAC分子, 其ER配体为雌二醇, E3连接酶配体部分为招募VHL的HIF-1α八肽。ER阳性乳腺癌细胞MCF-7经100 μmol·L-1处理后, 观察到ER蛋白水平明显降低。随后, 该课题组在其结构基础上, 进一步改变了HIF-1α肽长度, 将八肽降为五肽, 得到的PROTAC分子4 (图 3)在2 μmol·L-1时显著降低人脐静脉内皮细胞HUVECs中的ERα蛋白水平, 并抑制内皮细胞分化[27], 在50 μmol·L-1时显著降低ER阳性乳腺癌细胞MCF-7和T47D中ERα蛋白水平, 抑制MCF-7和T47D的增殖(IC50分别为50和16 μmol·L-1), 同时观察到该化合物还可以减少细胞周期蛋白D1的表达, 将细胞周期停滞在G1期[28]。后期, 该课题组专注于靶向ER的PROTAC分子的设计优化, 如调整PROTAC分子中雌二醇的连接位点[29]和中间连接链长度[30]以及在HIF-1α五肽两端均引入雌二醇配体[31], 诱导产生更高效的靶蛋白泛素化和降解, 以进一步提高靶向降解效率。
2016年, Demizu等[32]采用细胞凋亡抑制蛋白1 (cIAP1)的结合配体MV1作为E3连接酶配体, 选择一种拟肽类雌激素受体调节剂作为ER靶向配体, 设计合成了一系列肽类PROTAC分子, 其在MCF-7细胞中诱导ERα和cIAP1自身的泛素化和降解, 但同时也观察到其具有一定的细胞毒性。
由于大多数肽类ER-PROTAC分子理化性质较差, 胞内稳定性低, 细胞穿透效率低, 从而导致细胞水平活性不高, Jiang等[33]和Dai等[34]基于稳定肽策略分别设计合成了细胞可渗透性全肽类PROTAC分子, 其E3连接酶配体均为HIF-1α五肽, 靶向ER配体部分均为拟肽类雌激素受体调节剂。研究发现这种全肽类PROTAC分子对MCF-7具有良好的细胞渗透性, 不仅在细胞水平上降低ERα蛋白水平和抑制MCF-7细胞增殖作用以及下调ERα相关基因表达, 在MCF-7细胞异种移植小鼠模型中也显著抑制肿瘤生长和降低肿瘤组织中的ERα蛋白水平, 并且不会引起小鼠体重变化和器官病理改变。这一研究为设计PROTAC分子的多样性以及开发以肽为基础的治疗提供新的可能性。
3.1.2 小分子类PROTAC由于肽类PROTAC细胞通透性差, 其细胞活性低, 大多只有微摩尔级别, 而基于小分子的PROTAC容易透膜被吸收, 与肽类PROTAC相比, 更具有开发潜力。
2011年, Itoh等[35]采用雌酮作为靶向ER配体, 选择cIAP1的另一种结合配体苯丁抑制素(bestatin)作为E3连接酶配体, 得到了首个基于小分子合成的PROTAC分子5 (图 4)。该化合物在30 μmol·L-1时显著降低MCF-7细胞中的ERα蛋白水平, 这是首次成功使用小分子类PROTAC来靶向ER并诱导ER的泛素化及降解。
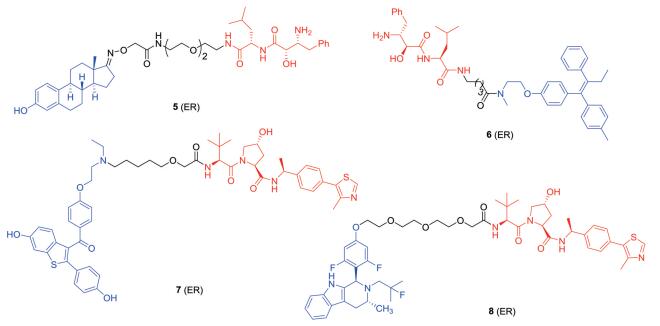
|
Figure 4 The structures of PROTACs 5-8 |
2012年, Demizu等[36]设计合成一系列PROTAC分子, 该类分子利用4-羟基他莫昔芬作为靶向ER配体, 选择bestatin作为E3连接酶配体, 两者通过不同长度烷基链连接, 在10~30 μmol·L-1时均明显降低MCF-7细胞中的ERα蛋白水平。随后, Okuhira等[37, 38]对其中一个化合物6 (图 4)进行了更系统的研究。发现PROTAC分子6不仅能够降解MCF-7细胞中的ERα蛋白, 还导致cIAP1自身的泛素化及降解, 以及诱导MCF-7细胞由于活性氧增加而导致的细胞坏死。
2019年, Hu等[39]设计合成了一系列靶向降解ER的PROTAC分子。通过对组成PROTAC分子的三部分进行大量系统优化, 如靶向ER配体部分选择了雷洛昔芬、他莫昔芬、拉索昔芬等ER调节剂, E3连接酶配体部分采用了CRBN和VHL相应小分子配体, 以及对中间连接链筛选了不同的化学结构组成及其链长, 最终成功得到PROTAC分子7 (图 4)。该化合物在MCF-7和T47D中DC50 (引起50%蛋白降解的有效浓度)分别为0.17和0.43 nmol·L-1, 而且在5 nmol·L-1浓度下可降解95%以上的ERα蛋白, 在1 μmol·L-1时观察到Hook效应。与氟维司群相比, 化合物7表现出更快的降解动力学和更完全的降解活性, 以及在MCF-7中具有更强的抑制癌细胞增殖作用, 其IC50值为0.77 nmol·L-1。同时机制实验证明了化合物7是一个高效的、基于PROTAC技术的ER降解剂, 具有用于治疗ER阳性乳腺癌的潜力。随后Gonzalez等[40]在该系列PROTAC分子中筛选到结构类似化合物7的一个PROTAC分子, 对于MCF-7以及ESR1突变型MCF-7均可高效靶向降解其ERα, 下调ER相关基因表达, 以及抑制上述两种乳腺癌细胞增殖, 同时对不表达ER的乳腺癌细胞无明显抑制作用, 后期将对该化合物做进一步深入研究。
2019年, Kargbo等[41]选择VHL小分子配体作为E3连接酶配体, 采用之前所报道的SERD化合物AZD9496[42]的母核结构作为靶向ER配体, 设计合成了一系列PROTAC分子。其中化合物8 (图 4)在MCF-7细胞中对ER蛋白的DC50为0.3 nmol·L-1, 0.3 μmol·L-1时对ER的降解率达到90%。
由于目前PROTAC分子量比较大、溶解性差, 影响其口服生物利用度以及体内药代动力学特性。因此, 为了改善这些化合物的局限性并提供可替代的体内传递途径, Dragovich等[43]将靶向ER降解的PROTAC分子与单克隆抗体相连, 研究数据表明, PROTAC抗体偶联物比单独的PROTAC分子更显著降低ERα蛋白水平, 并且偶联物具有良好的体内稳定性, 可用于药效学和/或有效性实验。
2019年, Arvinas公司靶向ER降解的PROTAC分子ARV-471 (化学结构未公开)进入临床Ⅰ期试验, 其临床前结果显示ARV-471能够在多种ER依赖性乳腺癌模型中显著抑制肿瘤的生长, 且根据Ⅰ期临床试验初步数据, ARV-471疗法取得了良好的耐受性。这是乳腺癌治疗中第一个进入临床试验的PROTAC分子。
3.2 靶向乳腺癌其他靶点的PROTAC分子随着研究的深入, 发现除了ER外, 还有一些与乳腺癌发生和发展相关的靶点。转录相关酸性卷曲蛋白3 (transforming acidic coiled-coil protein 3, TACC3)是调控微管蛋白组成和维持细胞有丝分裂稳定性的一种调控因子, 研究者发现在乳腺癌肿瘤组织中TACC3处于过表达状态, 明显高于正常组织[44]。Ohoka等[45]设计合成靶向TACC3的PROTAC分子, 该分子能够有效降解MCF-7细胞中的TACC3蛋白水平, 并诱导MCF-7细胞凋亡, 然而其活性不高, 需要进一步优化。
雌激素受体相关受体α (ERRα)是一种核受体, 研究证明其在乳腺癌组织中处于高表达状态, Bondeson等[46]利用ERRα配体噻唑烷二酮设计合成靶向ERRα的PROTAC分子, 其可以明显降低MCF-7细胞内ERRα蛋白水平。尽管PROTAC分子在体内外均表现出较强的降解靶蛋白能力, 但缺乏对其功能的控制仍然限制了其作为化学工具和治疗手段的应用。因此, Naro等[47]开发了一种光控PROTAC分子9 (图 5), 该分子是在上述靶向ERRα的PROTAC分子基础上对其E3连接酶配体部分安装上一个光敏基团。化合物9在黑暗条件下由于光敏基团的存在失去了其招募E3连接酶的能力, 因而对MCF-7细胞中的ERRα蛋白水平无降解活性。在光照条件下, 光敏基团不稳定从光控PROTAC分子上脱离, 游离出真正具有降解活性的PROTAC分子, 显著降低了MCF-7细胞中ERRα蛋白水平, 从而实现对蛋白质降解的光学控制。这种方法加强了对PROTAC功能的控制, 对于改善治疗指标, 避免全身毒性, 实现精准治疗具有较大意义。
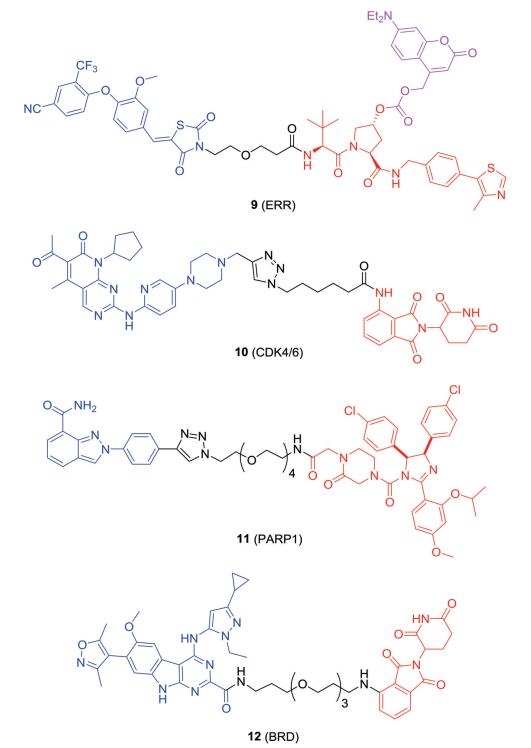
|
Figure 5 The structures of PROTACs 9-12 |
HER2是具有酪氨酸蛋白激酶活性的跨膜蛋白, HER2的过度表达与HER2阳性乳腺癌的发展密切相关。例如, 酪氨酸蛋白激酶抑制剂拉帕替尼在临床上用于治疗HER2阳性晚期或转移性乳腺癌。Burslem等[48]合成以拉帕替尼和VHL配体为基础的PROTAC分子, 发现其在ER阴性、HER2过表达的乳腺癌细胞SKBr3中显著降低HER2蛋白水平, 并能有效抑制SKBr3细胞增殖。
CDKs是细胞周期调控的关键, 其表达异常可影响肿瘤发展, 因而CDK抑制剂的研究成为肿瘤治疗的热点。选择性CDK4/6抑制剂帕博西尼和瑞博西尼已被批准用于临床治疗ER阳性、HER2阴性晚期乳腺癌患者。Zhao等[49]以帕博西尼作为靶向CDK配体, 泊马度胺作为E3连接酶配体招募CRBN, 设计合成了PROTAC分子10 (图 5)。研究发现, 在三阴性乳腺癌MDA-MB-231细胞中, 化合物10能够在纳摩尔浓度下选择性有效降解CDK4/6, 并抑制视网膜母细胞瘤蛋白的磷酸化, 导致细胞周期阻滞。
PARP1在DNA损伤反应中起着关键作用, 被认为是治疗癌症的重要靶点, PARP1抑制剂奥拉帕尼已被批准用于治疗BRCA突变转移性乳腺癌。Zhao等[50]报道了一种靶向PARP1的PROTAC小分子11 (图 5), 在MDA-MB-231细胞中, 有效诱导PARP1的显著裂解和细胞凋亡从而抑制癌细胞增殖。
溴结构域和额外末端(bromodomain and extra terminal, BET)蛋白家族由BRD2、BRD3、BRD4和BRDT组成, 在调节体内基因转录、细胞周期和细胞凋亡方面起着重要作用。研究发现在多种亚型乳腺癌肿瘤组织(包括TNBC)中, BET蛋白编码基因表达上调, BRD2、BRD3和BRD4蛋白水平较高[51], 因此BET蛋白已经成为治疗乳腺癌的一个新靶点。Bai等[52]设计合成一种BET蛋白降解剂PROTAC分子12 (图 5)。在TNBC细胞系中, 该化合物在纳摩尔浓度下高效、选择性地降解BET蛋白, 并表现出较强的生长抑制和细胞凋亡诱导活性。同时在TNBC异种移植小鼠肿瘤模型中, 有效减少肿瘤组织中的BET蛋白并抑制肿瘤生长, 这一结果表明靶向BET蛋白降解有望为治疗TNBC提供新的策略。Noblejas-López等[53]发现BET-PROTAC分子在TNBC及耐药性TNBA中均能有效地降解BRD4, 具有较强的抗癌细胞增殖作用。
3.3 扩展E3连接酶配体在PROTAC分子中, E3连接酶配体部分负责招募E3连接酶从而介导泛素-蛋白酶体系统对靶蛋白的降解, 该配体部分是决定靶蛋白是否发生降解的要素序列, 称之为蛋白降解子(degron)[54]。在PROTAC技术发展过程中, E3连接酶配体部分经历了从多肽结构到小分子结构的转变, 然而这些配体分子结构复杂, 使得整个PROTAC分子的分子量增加, 药代动力学性质较差, 这是其成药性的主要障碍, 因此开发新的结构简单的degron对于PROTAC的发展具有重要意义。研究人员发现将外部疏水性标签引入蛋白质表面, 能够使蛋白质折叠变得不稳定, 从而被蛋白酶体系统识别并降解, 因此疏水性标签作为一类分子量较小、合成简单、底物适应性强的degron部分已受到广泛关注, 被应用于AR等多种靶标蛋白的降解[55, 56], 常见的疏水性标签有:金刚烷、Boc3Arg等。2018年, Wang等[57]选择含有金刚烷基的类他莫昔芬结构作为靶向ER配体, 采用疏水性氨基酸、桥环烷烃及更简单的单环类似物作为degron部分, 合成了一系列新型PROTAC分子, 如化合物13 (图 6), 其在MCF-7细胞中具有显著的ERα降解活性和抗增殖活性, 并抑制ER相关基因的表达。随后, Zhou课题组[58, 59]基于其前期对氧桥双环庚烯磺酰胺(OBHSA)类化合物[60]作为SERD的研究基础上, 设计合成了一系列含有不同侧链的OBHSA类衍生物, 其中化合物14 (图 6)在1 μmol·L-1时能够完全降解ERα并抑制MCF-7细胞的增殖, 这一结果表明碱性侧链作为degron部分, 在ER蛋白降解中发挥着重要作用。这些研究丰富了PROTAC分子中degron的结构骨架多样性, 同时又简化了其结构的复杂性, 使其在成药方面更具有优势, 为新型PROTAC分子的开发提供了选择性, 也为乳腺癌治疗药物的开发提供了指导。
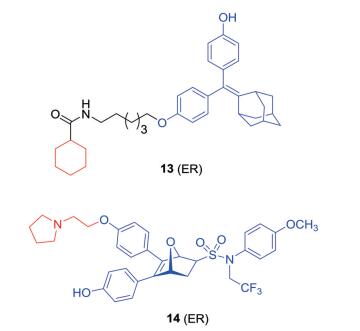
|
Figure 6 The structures of PROTACs 13 and 14 |
综上所述, 针对与乳腺癌相关的靶点, 如ER、CDK4/6、HER2等, 研究人员利用PROTAC技术设计合成了相应的PROTAC分子, 其中包括有基于肽类和小分子类PROTAC。这些PROTAC分子在细胞水平对靶蛋白均有降解作用, 部分化合物在动物体内也有较好的活性, 其中化合物ARD-471已进入临床Ⅰ期试验, 这些研究表明PROTAC技术用于乳腺癌治疗药物的开发, 具有良好的应用前景。由于PROTAC分子在降解一个靶蛋白分子后, 可从三元复合物中解离, 进入下一轮循环被再利用, 具有“催化”性能; 然而, 如果PROTAC无限制地降解靶蛋白, 或者组织选择性低, 将使正常组织细胞内的靶蛋白也被降解。缺乏对其降解功能进行外部有效的控制, 或将产生严重的毒性作用, 限制其作为化学工具和治疗手段的广泛应用。因此, 在今后的研究中, 除了利用PROTAC技术来设计合成具有更好活性的PROTAC分子外, 还需要结合其他学科, 例如药理学、药剂学、影像学及分子生物学等, 利用多学科交叉优势, 进一步改善PROTAC分子药效及提升成药性, 发展功能可控的PROTAC分子以实现高度靶向治疗, 并扩展于多种类型的乳腺癌治疗研究, 将为乳腺癌及其他疾病治疗开辟一个新的研究领域。
作者贡献:谢宝花负责综述的选题、资料收集以及文章撰写; 胡志烨、宁文涛和杨录参与了部分内容的撰写、文献整理和修改; 周海兵负责文章的选题、思路和框架的提出以及文章修改和检查。
利益冲突:本文无利益冲突。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68: 394-424. DOI:10.3322/caac.21492 |
| [2] |
Feng RM, Zong YN, Cao SM, et al. Current cancer situation in China:good or bad news from the 2018 Global Cancer Statistics?[J]. Cancer Commun (Lond), 2019, 39: 22. DOI:10.1186/s40880-019-0368-6 |
| [3] |
Burstein HJ, Temin S, Anderson H, et al. Adjuvant endocrine therapy for women with hormone receptor-positive breast cancer:American society of clinical oncology clinical practice guideline focused update[J]. J Clin Oncol, 2014, 32: 2255-2269. DOI:10.1200/JCO.2013.54.2258 |
| [4] |
Shagufta, Ahmad I. Tamoxifen a pioneering drug:an update on the therapeutic potential of tamoxifen derivatives[J]. Eur J Med Chem, 2018, 143: 515-531. DOI:10.1016/j.ejmech.2017.11.056 |
| [5] |
Staley H, McCallum I, Bruce J. Postoperative tamoxifen for ductal carcinoma in situ[J]. Cochrane Database Syst Rev, 2012, 10:CD007847. |
| [6] |
Tryfonidis K, Zardavas D, Katzenellenbogen BS, et al. Endocrine treatment in breast cancer:cure, resistance and beyond[J]. Cancer Treat Rev, 2016, 50: 68-81. DOI:10.1016/j.ctrv.2016.08.008 |
| [7] |
Arimidex T. Effect of anastrozole and tamoxifen as adjuvant treatment for early-stage breast cancer:100-month analysis of the ATAC trial[J]. Lancet Oncol, 2008, 9: 45-53. DOI:10.1016/S1470-2045(07)70385-6 |
| [8] |
Pike AC, Brzozowski AM, Walton J, et al. Structural insights into the mode of action of a pure antiestrogen[J]. Structure, 2001, 9: 145-153. DOI:10.1016/S0969-2126(01)00568-8 |
| [9] |
Liu J, Zheng S, Akerstrom VL, et al. Fulvestrant-3 boronic acid (ZB716):an orally bioavailable selective estrogen receptor down regulator (SERD)[J]. J Med Chem, 2016, 59: 8134-8140. DOI:10.1021/acs.jmedchem.6b00753 |
| [10] |
Weir HM, Bradbury RH, Lawson M, et al. AZD9496:an oral estrogen receptor inhibitor that blocks the growth of ER-positive and ESR1-mutant breast tumors in preclinical models[J]. Cancer Res, 2016, 76: 3307-3318. |
| [11] |
Bihani T, Patel HK, Arlt H, et al. Elacestrant (RAD1901), a selective estrogen receptor degrader (SERD), has antitumor activity in multiple ER+ breast cancer patient-derived xenograft models[J]. Clin Cancer Res, 2017, 23: 4793-4804. DOI:10.1158/1078-0432.CCR-16-2561 |
| [12] |
Neklesa TK, Winkler JD, Crews CM. Targeted protein degradation by PROTACs[J]. Pharmacol Ther, 2017, 174: 138-144. DOI:10.1016/j.pharmthera.2017.02.027 |
| [13] |
Duan YC, Zhai XY, Qin WP, et al. Advances in the treatment of cancer by PROTACs[J]. Acta Pharm Sin (药学学报), 2017, 52: 1801-1810. |
| [14] |
Sakamoto KM, Kim KB, Kumagai A, et al. PROTACs:chimeric molecules that target proteins to the Skp1-Cullin-F box complex for ubiquitination and degradation[J]. Proc Natl Acad Sci U S A, 2001, 98: 8554-8559. DOI:10.1073/pnas.141230798 |
| [15] |
Pettersson M, Crews CM. Proteolysis targeting chimeras (PROTACs)-past, present and future[J]. Drug Discov Today Technol, 2019, 31: 15-27. DOI:10.1016/j.ddtec.2019.01.002 |
| [16] |
Amm I, Sommer T, Wolf DH. Protein quality control and elimination of protein waste:the role of the ubiquitin-proteasome system[J]. Biochim Biophys Acta, 2014, 1843: 182-196. DOI:10.1016/j.bbamcr.2013.06.031 |
| [17] |
Paiva SL, Crews CM. Targeted protein degradation:elements of PROTAC design[J]. Curr Opin Chem Biol, 2019, 50: 111-119. DOI:10.1016/j.cbpa.2019.02.022 |
| [18] |
Gadd MS, Testa A, Lucas X, et al. Structural basis of PROTAC cooperative recognition for selective protein degradation[J]. Nat Chem Biol, 2017, 13: 514-521. DOI:10.1038/nchembio.2329 |
| [19] |
Churcher I. PROTAC-induced protein degradation in drug discovery:breaking the rules or just making new ones?[J]. J Med Chem, 2018, 61: 444-452. DOI:10.1021/acs.jmedchem.7b01272 |
| [20] |
Burslem GM, Crews CM. Small-molecule modulation of protein homeostasis[J]. Chem Rev, 2017, 117: 11269-11301. DOI:10.1021/acs.chemrev.7b00077 |
| [21] |
Schneekloth AR, Pucheault M, Tae HS, et al. Targeted intracellular protein degradation induced by a small molecule:En route to chemical proteomics[J]. Bioorg Med Chem Lett, 2008, 18: 5904-5908. DOI:10.1016/j.bmcl.2008.07.114 |
| [22] |
Wang Y, Long J, Chang Q, et al. The application of small molecule PROTAC in researches of different targets[J]. Acta Pharm Sin (药学学报), 2020, 55: 446-452. DOI:10.1002/cbic.202000381 |
| [23] |
Cui J, Wei HQ, Ning HX, et al. Research progress on small-molecule protein proteolysis-targeting chimeras as antitumor agents[J]. Drugs Clin (现代药物与临床), 2019, 34: 3187-3191. |
| [24] |
Katzenellenbogen BS, Katzenellenbogen JA. Estrogen receptor transcription and transactivation estrogen receptor alpha and estrogen receptor beta:regulation by selective estrogen receptor modulators and importance in breast cancer[J]. Breast Cancer Res, 2000, 2: 335-344. DOI:10.1186/bcr78 |
| [25] |
Sakamoto KM, Kim KB, Verma R, et al. Development of PROTACs to target cancer-promoting proteins for ubiquitination and degradation[J]. Mol Cell Proteomics, 2003, 2: 1350-1358. DOI:10.1074/mcp.T300009-MCP200 |
| [26] |
Zhang D, Baek SH, Ho A, et al. Degradation of target protein in living cells by small-molecule proteolysis inducer[J]. Bioorg Med Chem Lett, 2004, 14: 645-648. DOI:10.1016/j.bmcl.2003.11.042 |
| [27] |
Bargagna-Mohan P, Baek SH, Lee H, et al. Use of PROTACS as molecular probes of angiogenesis[J]. Bioorg Med Chem Lett, 2005, 15: 2724-2727. DOI:10.1016/j.bmcl.2005.04.008 |
| [28] |
Rodriguez-Gonzalez A, Cyrus K, Salcius M, et al. Targeting steroid hormone receptors for ubiquitination and degradation in breast and prostate cancer[J]. Oncogene, 2008, 27: 7201-7211. DOI:10.1038/onc.2008.320 |
| [29] |
Cyrus K, Wehenkel M, Choi EY, et al. Jostling for position:optimizing linker location in the design of estrogen receptor-targeting PROTACs[J]. ChemMedChem, 2010, 5: 979-985. DOI:10.1002/cmdc.201000146 |
| [30] |
Cyrus K, Wehenkel M, Choi EY, et al. Impact of linker length on the activity of PROTACs[J]. Mol Biosyst, 2011, 7: 359-364. DOI:10.1039/C0MB00074D |
| [31] |
Cyrus K, Wehenkel M, Choi EY, et al. Two-headed PROTAC:an effective new tool for targeted protein degradation[J]. Chembiochem, 2010, 11: 1531-1534. DOI:10.1002/cbic.201000222 |
| [32] |
Demizu Y, Ohoka N, Nagakubo T, et al. Development of a peptide-based inducer of nuclear receptors degradation[J]. Bioorg Med Chem Lett, 2016, 26: 2655-2658. DOI:10.1016/j.bmcl.2016.04.013 |
| [33] |
Jiang Y, Deng Q, Zhao H, et al. Development of stabilized peptide-based PROTACs against estrogen receptor α[J]. ACS Chem Biol, 2018, 13: 628-635. DOI:10.1021/acschembio.7b00985 |
| [34] |
Dai Y, Yue N, Gong J, et al. Development of cell-permeable peptide-based PROTACs targeting estrogen receptor α[J]. Eur J Med Chem, 2020, 187: 111967. DOI:10.1016/j.ejmech.2019.111967 |
| [35] |
Itoh Y, Kitaguchi R, Ishikawa M, et al. Design, synthesis and biological evaluation of nuclear receptor-degradation inducers[J]. Biorg Med Chem, 2011, 19: 6768-6778. DOI:10.1016/j.bmc.2011.09.041 |
| [36] |
Demizu Y, Okuhira K, Motoi H, et al. Design and synthesis of estrogen receptor degradation inducer based on a protein knockdown strategy[J]. Bioorg Med Chem Lett, 2012, 22: 1793-1796. DOI:10.1016/j.bmcl.2011.11.086 |
| [37] |
Okuhira K, Demizu Y, Hattori T, et al. Development of hybrid small molecules that induce degradation of estrogen receptor-alpha and necrotic cell death in breast cancer cells[J]. Cancer Sci, 2013, 104: 1492-1498. DOI:10.1111/cas.12272 |
| [38] |
Okuhira K, Demizu Y, Hattori T, et al. Molecular design, synthesis, and evaluation of SNIPER (ER) that induces proteasomal degradation of ERα[J]. Methods Mol Biol, 2016, 1366: 549-560. |
| [39] |
Hu J, Hu B, Wang M, et al. Discovery of ERD-308 as a highly potent proteolysis targeting chimera (PROTAC) degrader of estrogen receptor (ER)[J]. J Med Chem, 2019, 62: 1420-1442. DOI:10.1021/acs.jmedchem.8b01572 |
| [40] |
Gonzalez TL, Hancock M, Sun S, et al. Targeted degradation of activating estrogen receptor α ligand-binding domain mutations in human breast cancer[J]. Breast Cancer Res Treat, 2020, 10: 1-12. |
| [41] |
Kargbo RB. PROTAC-mediated degradation of estrogen receptor in the treatment of cancer[J]. ACS Med Chem Lett, 2019, 10: 1367-1369. DOI:10.1021/acsmedchemlett.9b00397 |
| [42] |
De Savi C, Bradbury RH, Rabow AA, et al. Optimization of a novel binding motif to (E)-3-(3, 5-difluoro-4-((1R, 3R)-2-(2-fluoro-2-methylpropyl)-3-methyl-2, 3, 4, 9-tetrahydro-1H-pyrido[3, 4-b]indol-1-yl)phenyl) acrylic acid (AZD9496), a potent and orally bioavailable selective estrogen receptor downregulator and antagonist[J]. J Med Chem, 2015, 58: 8128-8140. DOI:10.1021/acs.jmedchem.5b00984 |
| [43] |
Dragovich PS, Adhikari P, Blake RA, et al. Antibody-mediated delivery of chimeric protein degraders which target estrogen receptor alpha (ERα)[J]. Bioorg Med Chem Lett, 2020, 30: 126907. DOI:10.1016/j.bmcl.2019.126907 |
| [44] |
Jacquemier J, Ginestier C, Rougemont J, et al. Protein expression profiling identifies subclasses of breast cancer and predicts prognosis[J]. Cancer Res, 2005, 65: 767-779. |
| [45] |
Ohoka N, Nagai K, Hattori T, et al. Cancer cell death induced by novel small molecules degrading the TACC3 protein via the ubiquitin-proteasome pathway[J]. Cell Death Dis, 2014, 5: 1513. DOI:10.1038/cddis.2014.471 |
| [46] |
Bondeson DP, Mares A, Smith IE, et al. Catalytic in vivo protein knockdown by small-molecule PROTACs[J]. Nat Chem Biol, 2015, 11: 611-617. DOI:10.1038/nchembio.1858 |
| [47] |
Naro Y, Darrah K, Deiters A. Optical control of small molecule-induced protein degradation[J]. J Am Chem Soc, 2020, 142: 2193-2197. DOI:10.1021/jacs.9b12718 |
| [48] |
Burslem GM, Smith BE, Lai AC, et al. The advantages of targeted protein degradation over inhibition:an RTK case study[J]. Cell Chem Biol, 2018, 25: 67-77. DOI:10.1016/j.chembiol.2017.09.009 |
| [49] |
Zhao B, Burgess K. PROTACs suppression of CDK4/6, crucial kinases for cell cycle regulation in cancer[J]. Chem Commun, 2019, 55: 2704-2707. DOI:10.1039/C9CC00163H |
| [50] |
Zhao Q, Lan T, Su S, et al. Induction of apoptosis in MDA-MB-231 breast cancer cells by a PARP1-targeting PROTAC small molecule[J]. Chem Commun, 2019, 55: 369-372. DOI:10.1039/C8CC07813K |
| [51] |
Sahni JM, Keri RA. Targeting bromodomain and extraterminal proteins in breast cancer[J]. Pharmacol Res, 2018, 129: 156-176. DOI:10.1016/j.phrs.2017.11.015 |
| [52] |
Bai L, Zhou B, Yang CY, et al. Targeted degradation of BET proteins in triple-negative breast cancer[J]. Cancer Res, 2017, 77: 2476-2487. DOI:10.1158/0008-5472.CAN-16-2622 |
| [53] |
Noblejas-López MDM, Nieto-Jimenez C, Burgos M, et al. Activity of BET-proteolysis targeting chimeric (PROTAC) compounds in triple negative breast cancer[J]. J Exp Clin Cancer Res, 2019, 38: 383. DOI:10.1186/s13046-019-1387-5 |
| [54] |
Lucas X, Ciulli A. Recognition of substrate degrons by E3 ubiquitin ligases and modulation by small-molecule mimicry strategies[J]. Curr Opin Struct Biol, 2017, 44: 101-110. DOI:10.1016/j.sbi.2016.12.015 |
| [55] |
Neklesa TK, Tae HS, Schneekloth AR, et al. Small-molecule hydrophobic tagging-induced degradation of HaloTag fusion proteins[J]. Nat Chem Biol, 2011, 7: 538-543. DOI:10.1038/nchembio.597 |
| [56] |
Gustafson JL, Neklesa TK, Cox CS, et al. Small-molecule-mediated degradation of the androgen receptor through hydrophobic tagging[J]. Angew Chem Int Ed Engl, 2015, 54: 9659-9662. DOI:10.1002/anie.201503720 |
| [57] |
Wang L, Guillen VS, Sharma N, et al. New class of selective estrogen receptor degraders (SERDs):expanding the toolbox of PROTAC degrons[J]. ACS Med Chem Lett, 2018, 9: 803-808. DOI:10.1021/acsmedchemlett.8b00106 |
| [58] |
Li YY, Zhang SL, Zhang J, et al. Exploring the PROTAC degron candidates:OBHSA with different side chains as novel selective estrogen receptor degraders (SERDs)[J]. Eur J Med Chem, 2019, 172: 48-61. DOI:10.1016/j.ejmech.2019.03.058 |
| [59] |
Hu ZY, Li YY, Xie BH, et al. Novel class of 7-oxabicyclo[2.2.1] heptene sulfonamides with long alkyl chains displaying improved estrogen receptor α degradation activity[J]. Eur J Med Chem, 2019, 182: 111605.
|
| [60] |
Srinivasan S, Nwachukwu JC, Bruno NE, et al. Full antagonism of the estrogen receptor without a prototypical ligand side chain[J]. Nat Chem Biol, 2017, 13: 111-118. DOI:10.1038/nchembio.2236 |
 2020, Vol. 55
2020, Vol. 55


