2. 江西中医药大学生命科学学院, 江西 南昌 330004;
3. 江西中医药大学附属医院, 江西 南昌 330006
2. School of Life Sciences, Jiangxi University of Chinese Medicine, Nanchang 330004, China;
3. Affiliated Hospital of Jiangxi University of Traditional Chinese Medicine, Nanchang 330006, China
毒蛇咬伤是一类严重危害人类健康的疾病, 致死率和致残率高。在有毒动物导致的人类中毒病例中, 毒蛇咬伤占首要位置。据统计, 每年有180~270万人在被毒蛇咬伤后引起严重的临床疾病, 每年超过9.5万人死于毒蛇咬伤, 另有30万人有永久性残疾或毁容[1]。我国的蛇种类繁多, 每年夏秋季节为蛇伤事件高发期, 随着气温的逐渐升高, 蛇伤事件发生有逐年上升趋势。尽管如此, 毒蛇咬伤事件却未受到足够的关注与重视。因此, 2017年, 毒蛇咬伤被世界卫生组织再次列入A类被严重忽视热带疾病名录[2]。蛇毒成分复杂, 蛇伤机制不明, 蛇伤患者死亡率、致残率仍然较高, 毒蛇咬伤的治疗依然是目前极具挑战性的课题。
蛇毒中含有诸多复杂的生物活性分子, 所含成分不仅能致人死亡, 且具有潜在治疗作用。然而, 尽管人们对蛇毒进行了较多研究, 但只有少数的蛇毒成分被开发并应用于临床, 有待进一步深入研究。本文对一些主要蛇毒组分, 蛇毒毒性效应及其解毒, 蛇毒在肿瘤、心血管疾病、神经退行性疾病以及抗炎、抗菌、免疫调节、镇痛、抗病毒等方面的应用进行重点阐述。
1 蛇毒主要组分蛇毒是一类主要由高药理活性的蛋白质和多肽组成的混合物, 这些物质多以酶和非酶蛋白形式作为蛇类捕食、防御并帮助其消化食物的工具。研究较为广泛的酶包括金属蛋白酶、磷脂酶A2 (phospholipases A2, PLA2s)、透明质酸酶(hyaluronidase)、乙酰胆碱酯酶、L-氨基酸氧化酶(L-amino acid oxidase, LAAO)和丝氨酸蛋白酶等, 非酶蛋白包括三指毒素(three-finger toxins, 3FTxs)、C型凝集素样蛋白、解离素、富含半胱氨酸的分泌蛋白和蛋白酶抑制剂等[3]。蛇毒液的成分组成随物种的不同而变化, 并因大小、性别、生境、食物和季节的不同而发生改变, 每种蛇毒液具有其药理特征谱[4]。蛇毒具有较高的催化效率、热稳定性和抗蛋白质水解能力, 为生物化学家和结构生物学家提供了理想的研究模型。因此, 蛇毒成分的分离、分析与鉴定等研究已成为当前功能蛋白质领域的新热点。蛇毒的成分分类与组成见图 1。
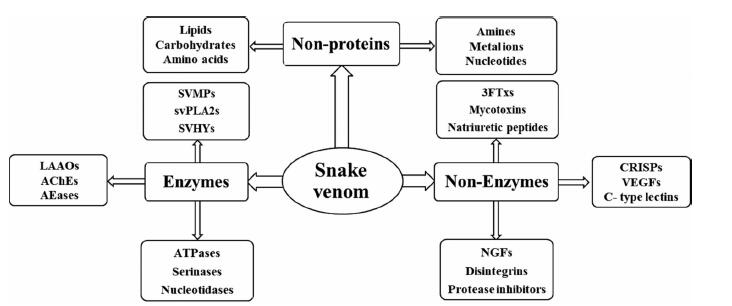
|
Figure 1 Classification and composition of snake venom components. SVMPs: Snake venom metalloproteinases; svPLA2s: Snake venom phospholipases A2; SVHYs: Snake venom hyaluronidases; 3FTxs: Three-finger toxins; LAAOs: L-Amino acid oxidases; AChEs: Acetylcholin esterases; AEases: Arginine esterases; CRISPs: Cysteine-rich secretory proteins; VEGFs: Vascular endothelial growth factors; ATPases: Adenosine triphosphatases; NGFs: Nerve growth factors |
SVMPs是由一类具有不同结构域组成的锌依赖性蛋白酶, 分为P-I、P-II和P-III 3种。据统计, SVMPs占大部分毒蛇的蛇毒总蛋白的30%[5]。SVMPs是引起蛇伤后出血的主要因素。研究表明, SVMPs可通过直接作用于毛细血管而引起出血, 分解基底膜组分的关键肽键, 这种降解导致毛细血管壁的机械稳定性减弱, 毛细血管壁膨胀、破坏, 发生血液渗漏以及微血管损伤[6]。SVMPs在蛇毒诱导的组织损伤的发生中起关键作用, 是开发新型抗蛇毒药物的重要靶点。
1.1.2 蛇毒磷脂酶A2 (snake venom PLA2s, svPLA2s)PLA2s是一类脂解酶的超家族, 主要催化甘油磷脂sn-2位点的酯键水解, 生成脂肪酸(花生四酸酯)和溶血磷脂[7]。svPLA2s具有广泛毒性效应, 包括肌毒性、心毒性、神经毒性、肾、肝毒性和全身出血等损伤, 还可诱导炎症介质、血管舒张和血管收缩介质的释放, 如前列腺素、组胺、血小板活化因子、儿茶酚胺、多巴胺、一氧化氮和内皮素[8]。蛇毒中的svPLA2s含量最为丰富, 可分为胞浆型(cytosolic PLA2s, cPLA2s)、分泌型(secreted PLA2s, sPLA2s)、Ca2+无关型(Ca2+ independent PLA2s, iPLA2s)、血小板活化因子乙酰水解酶(platelet-activating factor acetylhydrolases, PAF-AHs)和溶酶体PLA2等类型[9]。由于sPLA2s被认为是开发新型抗炎药物的重要靶点, 因此其在蛇毒酶组分中的研究最为广泛。
1.1.3 蛇毒透明质酸酶透明质酸酶广泛存在于各种人体器官和体液、微生物的外分泌物、线虫以及水蛭、蛇、蝎子、蜥蜴和其他昆虫的毒液中[10]。蛇毒透明质酸酶(snake venom hyaluronidases, SVHYs)是降解细胞外基质及血管、毛细血管、平滑肌周围结缔组织透明质酸的主要酶, 能损伤靶器官的结构完整性, 促进其他毒素的分布与毒性效应, 因而被称为“传播因子”[11]。SVHYs是一种分子质量分布范围较广的糖蛋白, 在28~70 kDa范围内, 最适酶活条件为pH 5.5、37 ℃, 但其催化活性极不稳定, 受蛇的年龄、种类与栖息地的影响较大[12, 13]。目前, SVHYs的研究重点在于开发这些酶的抗体及设计合成或筛选天然抑制剂, 以改善蛇伤的抗蛇毒血清的治疗有效性。
1.2 蛇毒多肽 1.2.1 3FTxs3FTxs家族多肽由60~74个氨基酸残基组成, 具有相似的独特保守结构, 由3个环和1个疏水性球形中心组成, 形似3根手指, 故名三指毒素[14]。3FTxs中存在4~5个二硫键, 三维结构稳定。虽然在结构上不同3FTxs的差异细微, 但在功能上不同3FTxs的靶点广泛, 可以结合不同受体并表现出多种生物学效应[15]。3FTxs靶蛋白主要位于神经系统及心脏, 其中神经系统靶点包括毒蕈碱乙酰胆碱受体与烟碱型乙酰胆碱受体, 能引起神经与肌肉损伤[16-18]。眼镜蛇属和唾蛇属3FTxs具有心脏及细胞毒性, 这些毒素可引起心肌收缩、抗凝血功能障碍、细胞裂解及膜稳态失衡等效应[15, 17]。
1.2.2 蛇毒解离素解离素是一类含Arg (或Lys)- Asp结构(Arg-Gly-Asp, RGD或Lys-Gly-Asp, KGD基序)的多肽, 解离素与金属蛋白酶由相同的前体蛋白修饰后产生, 富含半胱氨酸, 与解离素-金属蛋白酶蛋白家族在系统发育上相关, 是整合素的天然拮抗剂。整合素是一类异二聚体受体, 介导细胞与周围基质和邻近细胞的相互作用, 通过激活多种信号通路调节细胞的生长、凋亡、黏附、迁移和侵袭等过程[19, 20]。解离素通过RGD三肽基序竞争性阻断整合素与其配体结合, 是强效的整合素拮抗剂。解离素移动环顶端的三肽是其抑制整合素的主要决定因素, 其拮抗效力和受体选择性也受到其位于活性序列侧面残基的精细调节[21]。Ke等[22]从江浙短尾蝮蛇毒中分离得到1个含有RGD三肽序列的解离素GBV-Ⅳ4, 具有抑制血小板聚集的活性。目前, 应用模拟解离素分子结构进行药物设计的策略已被重点用于开发新型抗肿瘤和抗血栓药物。
2 蛇毒毒性效应及其解毒策略蛇毒毒性效应主要分为血液毒性(溶血与凝血)、神经毒性、细胞毒性以及实体器官(肝、肾等)毒性。这些毒性效应包括全身症状与局部效应:全身症状主要表现为神经毒性、肌毒性、心脏毒性、细胞毒性、溶血、凝血和低血压作用等; 局部效应包括出血、水肿、疼痛、肌坏死、皮肤坏死以及继发性感染等病理表现[23]。局部效应的发生较为迅速, 一般在蛇咬伤后5 min出现[24]。蛇毒局部效应成分能迅速增加血管通透性, 产生凝血级联反应, 引起肌肉衰竭(即横纹肌溶解)等局部损伤。
毒蛇咬伤症状复杂多样, 患者年龄和健康状况, 以及蛇的大小和毒液量, 甚至情绪等因素都使咬伤结果产生差异[25]。毒蛇咬伤也可能导致血小板减少、肾脏异常、垂体功能减退和生殖功能障碍等功能性损伤[26-28], 还可引起缺血性脑卒中、骨髓炎、关节炎、急性胰腺炎、咬伤部位恶性转化, 以及影响肌腱与周围组织之间的粘连形成等并发症[29], 这些表现可能持续几年甚至终生。蛇的唾液和毒齿含有多种病原微生物, 也能引起继发性感染。此外, 人们对毒蛇的恐惧心理根深蒂固, 蛇伤患者紧张、恐惧和焦虑, 易引发心动过速、呕吐、眩晕、昏厥以及发冷等心理或生理应激反应, 这也是影响蛇伤进展的重要因素。
抗蛇毒血清是蛇伤唯一特异性药物, 血清中含有蛇毒高亲和力抗体, 能有效减轻蛇毒所致的致死性全身作用, 可显著降低毒蛇咬伤的死亡率。然而, 抗蛇毒血清已被证明在治疗蛇毒引起的局部病理效应方面是无效的[30]。虽然体外实验证实通过毒液和抗蛇毒血清共孵育能有效中和产生局部组织损伤的毒素, 即抗蛇毒血清中有足够针对局部损伤作用毒素的抗体, 但在实际的毒蛇咬伤中, 因局部病变发展迅速, 蛇毒局部作用的毒理动力学与抗蛇毒血清抗体的药代动力学不匹配[31]。因此, 毒蛇咬伤患者尽管使用了抗蛇毒血清, 局部效应仍在继续发展。植物药能中和蛇毒中svPLA2s和SVHYs等多种酶, 可增强膈肌收缩, 减轻蛇毒对机体蛋白损伤等特性, 尤其在治疗蛇毒局部效应及并发症等方面优势明显[32, 33]。天然植物药作为替代或补充治疗将是蛇伤临床防治的重要方向。
3 蛇毒药理活性及其应用蛇毒是含有生物活性成分的天然物质, 不仅影响机体的病理生理过程, 还可用于多种疾病的新药开发。在过去的几十年里, 人们已经从蛇毒中分离或衍生出了多种进入临床试验或已应用于临床的药物。蛇毒成分衍生物卡托普利是美国食品药品监督管理局(Food and Drug Administration, FDA)批准的第1个血管紧张素转换酶抑制剂, 它在蛇毒药物研发中具有里程碑意义。
3.1 抗肿瘤作用蛇毒抗肿瘤的最早报道出现在20世纪30年代, 目前蛇毒抗肿瘤研究备受关注。LAAO是蛇毒中常见的蛋白质毒素, 可将L-氨基酸转换为α-酮酸, 释放氨和过氧化氢。体外实验显示, LAAO可通过产生过氧化氢诱导癌细胞氧化应激, 推测过氧化氢产生的活性氧是LAAO引起肿瘤细胞毒性的主要机制[34, 35]。Abdelkafi- Koubaa等[36]观察了角蝰蛇(Cerastes cerastes, CC)毒液中提取的L-氨基酸氧化酶(CC-LAAO)对不同细胞的毒性作用, 结果表明CC-LAAO的细胞毒作用具有选择性, 其对B16F10、PC12、MCF-7和MDA-MB-231等癌细胞系有显著细胞毒作用, 但对红细胞和外周血单核细胞等正常细胞无毒性, 并证实CC-LAAO可选择性结合癌细胞膜, 推测癌细胞膜表面特定区域能与CC-LAAO相互作用。由此可见, 基于蛇毒LAAO抗肿瘤药物开发具有很大的研究价值和潜力。
近年来, 人们尝试通过构建新型蛇毒制剂以获得减毒增效和提高靶向性的目的。Al-Sadoon等[37]研究发现, 将沙漠眼镜蛇(Walterinnesia aegyptia, WEV)蛇毒与纳米二氧化硅结合后, 可抑制人乳腺癌细胞株增殖并诱导细胞凋亡, 而对正常乳腺上皮细胞MCF- 10A细胞无明显影响。在裸鼠模型中对WEV+silica nanoparticles (NP)治疗多发性骨髓瘤的作用评价结果显示, WEV+NP能降低趋化因子受体CXCR3、CXCR4和CXCR6的表达, 抑制癌细胞迁移, 其活性高于单纯的WEV给药[38]。Yan等[39]证实冰茶栓(蝮蛇毒、冰片、茶叶和桂枝)可明显降低W256细胞诱导的骨癌痛大鼠骨组织破骨细胞的数量, 诱导破骨细胞凋亡并明显上调骨组织骨保护素表达。
3.2 抗神经退行性疾病神经退行性疾病(neurodegeneration disease, ND)是一组以原发性神经元变性为基础的慢性进行性神经系统疾病, 如阿尔茨海默症(Alzheimer's disease, AD), 帕金森氏病(Parkinson's disease, PD)、亨廷顿病和肌萎缩侧索硬化症等。尽管ND研究已有许多报道, 但用于治疗ND的药物数量仍然有限, 现有药物疗效不理想, 迫切需要开发新型抗ND候选药物。神经退行性病变是由多种细胞过程的激活引起的, 包括氧化应激、线粒体损伤、神经炎症、衰老、聚集形成、谷氨酸兴奋性毒性和凋亡[40, 41]。部分蛇毒多肽能够穿过血脑屏障, 可作为前药应用于治疗中枢神经系统疾病[42]。
当前, 小剂量蛇毒被证明在ND的防治中起重要作用。Ghazaryan等[43]应用侧脑室室内(intracerebroventricular, icv)注射β-淀粉样蛋白25-35诱导的AD大鼠模型, 通过肌肉注射方式注射地中海钝鼻蝰(Macrovipera lebetina, ML)蛇毒(5%半数致死剂量, 每次间隔1天, 连续注射7次)至AD大鼠。结果显示, 全身小剂量ML毒液可诱导AD大鼠海马神经元的结构特征发生积极改变, 海马区CA1和CA3神经元密度增加, 代谢正常化, Ca2+依赖性磷酸化增强, 提示小剂量毒液在大鼠AD模型中表现出明显的神经保护作用。Martins等[44]从矛头蝮(Bothrops atrox)毒液中分离出的三肽(Glu-Val-Trp)对PD细胞模型也具有神经保护和神经营养作用。
3.3 抗心血管疾病自首个以蛇毒为基础的药物卡托普利获批以来, 蛇毒已为高血压、血栓形成等心血管疾病防治药物的开发提供了极具价值的先导化合物。已获FDA批准的Integrilin® (eptifibatide)和Aggrastat® (tirofiban)是基于蛇毒成分开发的药物, 利钠肽、血凝酶和巴曲酶等药物被证实对心血管疾病有效(表 1)。目前, 抗心血管疾病研究仍然是蛇毒医学应用研发领域的热点。
| Table 1 Major snake venom source drugs in approved or clinical trials for cardiovascular disease |
整合素αⅡbβ3作为血小板聚集的关键因子, 对血栓形成有重要影响, αⅡbβ3拮抗剂的研究意义重大。现有的αⅡbβ3拮抗剂会出现血小板减少和出血等不良反应, 这与其配体诱导的整合素构象改变和结合位点的暴露有关。Kuo等[45]从竹叶青属(Flavoviridis)蛇毒液中提取的化合物TFV-1是αIIbβ3的新拮抗剂, 能有效防止动脉血栓形成而不引起出血。该团队从该蛇毒中提取的另一种化合物TMV-7可以拮抗整合素αⅡbβ3与其配体的结合, 可阻止血栓形成而不会引起血小板减少[46]。此外, TMV-7可下调心肌缺血再灌注(myocardial ischemia reperfusion, I-R)损伤大鼠的凋亡蛋白Bax (BCL2-associated X)和caspase-3 (cysteinaspartic acid protease-3), 显著降低I-R引起的心律失常、梗死体积和死亡率, 表明TMV-7也可能是具有心脏保护作用的强效抗心律失常药物[47]。
3.4 抗炎、抗菌及免疫调节作用现有研究表明, 蛇毒中含有大量具有抗炎、抗菌、免疫调节等不同生物活性的成分, 眼镜蛇毒(Naja naja atra venom, NNAV)成分已被证实具有治疗关节炎的巨大潜力。Chen等[48]研究了口服小剂量热处理的NNAV在类风湿性关节炎模型中的镇痛和抗炎作用, 发现经处理的NNAV可显著降低足爪水肿与肉芽增生率, 减小机械痛觉过敏, 降低血清肿瘤坏死因子α (tumor necrosis factor α, TNF-α)水平并升高白介素10 (interleukin-10, IL-10)的表达, 大鼠组织病理学得到改善, 且效果优于天然蛇毒。从NNAV中提取的心脏毒素也可以抑制佐剂诱导的关节炎的炎症反应和炎症性疼痛[49]。NNAV能降低肺纤维化小鼠血清中白介素1β (interleukin-1β, IL-1β)和TNF- α水平, 通过抑制核因子κB (nuclear factorkappaB, NF- κB)和TGF- β/Smad (transforming growth factor β/Sma and mad homologue)通路减轻肺纤维化[50]。
免疫排斥是目前困扰同种及异种移植发展的最主要问题, 需要寻找新的解决途径。口服NNAV及其成分(neurotoxin, NTX)可抑制T细胞介导的免疫反应, 进而降低同种异体皮肤排斥反应, 提示NNAV和NTX都是潜在的免疫抑制剂, 可防止对同种异体皮肤的免疫反应[51]。中国猕猴经高纯度蛇毒因子(cobra venom factor, CVF)等多因素处理后, 其移植肝均能存活到受体死亡, 所有受体猴移植肝经过病理学检查均未发生超急性排斥反应(hyperacute rejection, HAR)和延迟性异种排斥反应(delayed xenograft rejection, DXR), 受体死亡后移植肝组织内免疫球蛋白G (immune globulin G, IgG)、IgM和补体C3蛋白的沉积均低于免疫吸附后的供体肝组织, 推测CVF等多因素处理能有效克服猪-猴异种移植HAR的发生, 并有可能阻止或延缓DXR的发生[52]。
此外, 越来越多耐药菌株的出现和现有抗生素抗菌作用的局限性使得从蛇毒中寻找新型抗菌剂备受关注。研究显示, 蛇毒不仅可作为强大抗菌剂, 且能有效降低细菌对抗生素的耐药性[53, 54]。体内实验显示, 局部应用svPLA2后2周内可以完全清除金葡菌, 体外实验表明, svPLA2蛋白对金葡菌具有剂量依赖性的抑制(抑菌)和杀灭(杀菌)作用, 电子显微镜显示细菌膜损伤和微扰是其抗菌作用的主要机制[55]。眼镜王蛇抗菌肽(king cobra cathelicidin, OH-CATH)是含34个氨基酸残基的多肽, OH-CATH30及其类似物D-OHCATH30对584个临床分离菌株中85%的菌株均敏感, 与抗生素相比, L-和D-OH-CATH30对革兰阳性菌与阴性菌均有较强抗菌活性, 对不动杆菌的杀菌活性最高, 疗效优于常用的9种抗生素[56]。Rheubert等[57]提出应用蛇毒毒液蛋白组学、蛇类分类学、细菌革兰染色、细菌形态和细菌呼吸研究等策略能为准确预测蛇毒中潜在的抗菌性能因子提供重要思路与参考。
3.5 镇痛作用离子通道是细胞膜上一类大分子亲水性蛋白质微孔道, 是细胞间信息传递的重要通路, 在脑卒中、炎症、关节炎、癌症及偏头痛等疾病介导的疼痛感觉方面起重要作用。研究证实蛇毒是离子通道的特异性阻断剂和激活剂的新来源[58]。酸敏感离子通道(acid-sensing ion channels, ASICs)是导致疼痛的主要路径, 当细胞外pH值降低时, ASICs会迅速响应并产生一股向内电流, 该电流在质子持续存在的情况下会迅速失活[59]。有研究显示蛇毒能调控ASICs并起到镇痛作用, 黑曼巴蛇毒中的新型三指肽mambalgins能够通过抑制在中枢或周围神经元中表达的ASICs而消除疼痛, 这些肽对小鼠无毒, 但在中枢和外周系统中显示出与吗啡同样强度的止痛作用, mambalgins的镇痛作用机制可能是阻断了中枢神经元中的ASIC1a和ASIC2a亚基构成的异源通道以及感受器中含有的ASIC1b通道[60]。此外, mambalgins能抑制同源ASIC1a、1b及异源ASIC1a/2a、1a/2b和1a/1b通道。在急性和炎症性疼痛模型中, mambalgins通过抑制中枢神经系统ASIC1a和ASIC1a/2a通道或抑制外周神经系统ASIC1b通道起到镇痛作用, 其中枢镇痛作用与吗啡类似, 但不良反应较吗啡少[61]。这些均为开发新的ASICs通道抑制剂提供了重要依据。
电压门控钠通道Nav1.8在外周伤害感受神经元中的高表达能引起炎性和神经性疼痛, 已成为缓解疼痛的重要靶标。μ-EPTX-Na1a是从中国眼镜蛇毒中提取的含有62个氨基酸残基的三指肽, 实验证实μ-EPTXNa1a是Nav1.8的有效抑制剂, 其相对于其他电压门控钠通道亚型可表现出高选择性, 全细胞电压钳记录实验结果显示μ-EPTX-Na1a可阻断Nav1.8的电流。炎性和神经性疼痛动物模型实验结果显示, μ -EPTXNa1a的镇痛效果优于吗啡, 甚至在30倍有效镇痛作用剂量下对小鼠无明显的细胞和心脏毒性等不良反应, μ-EPTX-Na1a的发现为开发以Nav1.8为靶标的新型镇痛药提供了有成药前景的先导化合物[62]。
3.6 抗病毒活性在过去几十年中, 麻疹、登革热、埃博拉、非典、中东呼吸综合征以及H1N1等病毒感染性疾病在全球的肆虐已成为国际关注的公共卫生事件, 严重危害人类生命安全。对于由病毒引起的各种疾病, 现有抗病毒疫苗或药物种类与作用均有限, 迫切需要研发更有效的药物。有研究报道蛇毒成分对麻疹病毒、丙型肝炎病毒和人类免疫缺陷病毒(human immunodeficiency virus, HIV)等具有灭活作用[63-65], 提示其可作为抗病毒药物候选物的新来源。
svPLA2s是引起局部损伤的重要酶, 近年来也被发现具有抗病毒活性, 如svPLA2s及其衍生物可抑制HIV-1和HIV-2的复制[66, 67]。该酶的抗病毒机制可能是通过水解病毒脂质双层膜的甘油磷脂, 引起病毒表面糖磷脂的裂解, 使裸露的病毒RNA无法与细胞受体结合, 从而使病毒最大程度被灭活。该酶也能够灭活其他包膜病毒, 显示了其作为开发广谱抗病毒药物的潜力[68]。来自矛头蝮蛇(Bothrops leucurus)毒液的Bl-PLA2s能显著抑制登革热病毒(Dengue virus, DENV)对LLC-MK2细胞的感染, 有效降低了细胞中DENV病毒RNA的水平, 且对DENV感染的细胞具有较强的细胞毒性[69]。
综上所述, 蛇毒及其成分具有广泛的生理功能与药理活性, 随着蛇毒的不断探索与发掘, 其新功能将逐渐被阐释, 更多的新型候选药物将被发现, 在未来医药领域将可能得到更广泛的关注与应用。
4 结语与展望虽然目前蛇毒成分的分离和分析得到了快速发展, 但蛇毒复杂体系中尚有大量成分及其生理功能未被鉴定与识别。同一种蛇毒中往往含有大量生物功能相对立的成分, 可同时包含如出血性和止血性、增加血小板聚集和清除血小板、促炎和抗炎、致痛和镇痛、蛋白酶和蛋白酶抑制剂等成分, 这些成分之间的相互作用模式亦值得深入探究。另外, 同一种蛇毒成分也包括有害和有利两个方面, 如svPLA2s能引起广泛的各系统毒性, 同时又具有抗炎、抗病毒活性。因此, 如何将蛇毒“化害为利”, 其毒性作用机制研究是核心内容, 即只有“知彼”, 才能真正将其应用于药物开发及临床疾病的治疗。这需要借助新的超灵敏分析技术, 尤其对其中一些可能起重要作用的微量组分的分析将有助于对蛇毒药理和毒理活性的充分认知。在毒液研究中引入新的组学方法将极大地促进对毒素的新发现, 尤其有助于对蛇毒中未被发现或低含量化合物的检测与鉴定。高通量组学方法(如蛋白质组学、转录组学和基因组学)对蛇毒的识别和表征做出了巨大贡献, 利用这些组学方法来破译毒液的毒素组成已成为常规方法, 并已发现了一些新的具有重要生物学意义的天然药物分子。
在充分认识蛇毒成分的毒理与药理活性基础上, 如何获得大量高质量的药用分子也是决定蛇毒资源开发与利用的重要因素。毒蛇原料的来源及毒液纯化步骤的繁琐和产率低也是潜在问题, 制约了蛇毒的应用。新的化学提纯与合成方法、体外重组蛋白等技术为获取蛇毒活性蛋白或多肽提供了可能的解决途径, 如分子印迹技术能高效提取目的蛋白并提高产品得率。蛇毒成分的提纯与合成的深入研究, 将为蛇毒蛋白的靶向治疗和药物开发提供原料保证。
总之, 随着蛇毒成分的结构和功能阐明, 及其分子靶标的确定, 毒蛇咬伤诊疗方案将被逐步完善, 蛇毒在基础与临床中的应用范围也将逐渐拓宽。但同时不应低估毒液对机体的毒性作用, 对蛇毒源性药物的安全性、毒性机制、毒代动力学和智能给药系统等关键问题还有待研究, 使其真正为人类生命和健康服务。
作者贡献:董德刚完成了文献整理和初稿与终稿的撰写; 王万春分析并整理了蛇毒成分及其解毒策略; 邓中平提供了论文主题中心思想并完成了论文初稿修改。
利益冲突:所有作者均声明没有利益冲突。
| [1] |
The Lancet. Snake-bite envenoming:a priority neglected tropical disease[J]. Lancet, 2017, 390: 2. |
| [2] |
Sachan D. The snake in the room:snakebite's huge death toll demands a global response[J]. BMJ, 2018, 361. |
| [3] |
Munawar A, Ali SA, Akrem A, et al. Snake venom peptides:tools of biodiscovery[J]. Toxins (Basel), 2018, 10: 474. DOI:10.3390/toxins10110474 |
| [4] |
Shashidharamurthy R, Jagadeesha DK, Girish KS, et al. Variations in biochemical and pharmacological properties of Indian cobra (Naja naja naja) venom due to geographical distribution[J]. Mol Cell Biochem, 2002, 229: 93-101. DOI:10.1023/A:1017972511272 |
| [5] |
Fox JW, Serrano SM. Insights into and speculations about snake venom metalloproteinase (SVMP) synthesis, folding and disulfide bond formation and their contribution to venom complexity[J]. FEBS J, 2008, 275: 3016-3030. DOI:10.1111/j.1742-4658.2008.06466.x |
| [6] |
Gutiérrez JM, Escalante T, Rucavado A, et al. Hemorrhage caused by snake venom metalloproteinases:a journey of discovery and understanding[J]. Toxins (Basel), 2016, 8: 93. DOI:10.3390/toxins8040093 |
| [7] |
Burke JE, Dennis EA. Phospholipase A2 biochemistry[J]. Cardiovasc Drugs Ther, 2009, 23: 49-59. DOI:10.1007/s10557-008-6132-9 |
| [8] |
Samy RP, Gopalakrishnakone P, Stiles BG, et al. Snake venom phospholipases A2:a novel tool against bacterial diseases[J]. Curr Med Chem, 2012, 19: 6150-6162. DOI:10.2174/0929867311209066150 |
| [9] |
Schaloske RH, Dennis EA. The phospholipase A2 superfamily and its group numbering system[J]. Biochim Biophys Acta, 2006, 1761: 1246-1259. DOI:10.1016/j.bbalip.2006.07.011 |
| [10] |
Gao JF, Qu YF, Zhang XQ, et al. Neonate-to-adult transition of snake venomics in the short-tailed pit viper, Gloydius brevicaudus[J]. J Proteomics, 2013, 84: 148-157. DOI:10.1016/j.jprot.2013.04.003 |
| [11] |
Wahby AF, El-SM Mahdy, El-Mezayen HA, et al. Egyptian horned viper Cerastes cerastes venom hyaluronidase:purification, partial characterization and evidence for its action as a spreading factor[J]. Toxicon, 2012, 60: 1380-1389. DOI:10.1016/j.toxicon.2012.08.016 |
| [12] |
Bordon KC, Perino MG, Giglio JR, et al. Isolation, enzymatic characterization and antiedematogenic activity of the first reported rattlesnake hyaluronidase from Crotalus durissus terrificus venom[J]. Biochimie, 2012, 94: 2740-2748. DOI:10.1016/j.biochi.2012.08.014 |
| [13] |
Mahadeswaraswamy YH, Manjula B, Devaraja S, et al. Daboia russelli venom hyaluronidase:purification, characterization and inhibition by β-3-(3-hydroxy-4-oxopyridyl) α-amino-propionic acid[J]. Curr Top Med Chem, 2011, 11: 2556-2565. DOI:10.2174/156802611797633410 |
| [14] |
Kini RM. Molecular moulds with multiple missions:functional sites in three-finger toxins[J]. Clin Exp Pharmacol Physiol, 2002, 29: 815-822. DOI:10.1046/j.1440-1681.2002.03725.x |
| [15] |
Kini RM, Doley R. Structure, function and evolution of three-finger toxins:mini proteins with multiple targets[J]. Toxicon, 2010, 56: 855-867. DOI:10.1016/j.toxicon.2010.07.010 |
| [16] |
Tsetlin V, Utkin Y, Kasheverov I. Polypeptide and peptide toxins, magnifying lenses for binding sites in nicotinic acetylcholine receptors[J]. Biochem Pharmacol, 2009, 78: 720-731. DOI:10.1016/j.bcp.2009.05.032 |
| [17] |
Makarova YV, Kryukova EV, Shelukhina IV, et al. The first recombinant viper three-finger toxins:inhibition of muscle and neuronal nicotinic acetylcholine receptors[J]. Dokl Biochem Biophys, 2018, 479: 127-130. DOI:10.1134/S1607672918020205 |
| [18] |
Barber CM, Isbister GK, Hodgson WC. Alpha neurotoxins[J]. Toxicon, 2013, 66: 47-58. DOI:10.1016/j.toxicon.2013.01.019 |
| [19] |
Hynes RO. Integrins:bidirectional, allosteric signaling machines[J]. Cell, 2002, 110: 673-687. DOI:10.1016/S0092-8674(02)00971-6 |
| [20] |
Zakraoui O, Marcinkiewicz C, Aloui Z, et al. Lebein, a snake venom disintegrin, suppresses human colon cancer cells proliferation and tumor-induced angiogenesis through cell cycle arrest, apoptosis induction and inhibition of VEGF expression[J]. Mol Carcinog, 2017, 56: 18-35. DOI:10.1002/mc.22470 |
| [21] |
Lu X, Lu D, Scully MF, et al. Integrins in drug targeting-RGD templates in toxins[J]. Curr Pharm Des, 2006, 12: 2749-2769. DOI:10.2174/138161206777947713 |
| [22] |
Ke LL, Chen YY, Zhao NN, et al. Isolation of a novel disintegrin containing Arg-Gly-Asp tripeptide sequence from Gloydius brevicaudus venom and investigation of its biological activities[J]. Acta Pharm Sin (药学学报), 2019, 54: 897-905. |
| [23] |
Félix-Silva J, Silva-Junior AA, Zucolotto SM, et al. Medicinal plants for the treatment of local tissue damage induced by snake venoms:an overview from traditional use to pharmacological evidence[J]. Evid Based Complement Alternat Med, 2017, 2017: 5748256. |
| [24] |
Chippaux JP. Snake-bites:appraisal of the global situation[J]. Bull World Health Organ, 1998, 76: 515-524. |
| [25] |
Kohlhoff M, Borges MH, Yarleque A, et al. Exploring the proteomes of the venoms of the Peruvian pit vipers Bothrops atrox,B. barnetti and B. pictus[J]. J Proteomics, 2012, 75: 2181-2195. DOI:10.1016/j.jprot.2012.01.020 |
| [26] |
Jeevagan V, Katulanda P, Gnanathasan CA, et al. Acute pituitary insufficiency and hypokalaemia following envenoming by Russell's viper (Daboia russelii) in Sri Lanka:exploring the pathophysiological mechanisms[J]. Toxicon, 2013, 63: 78-82. DOI:10.1016/j.toxicon.2012.11.012 |
| [27] |
Torrez PP, Said R, Quiroga MM, et al. Forest pit viper (Bothriopsis bilineata bilineata) bite in the Brazilian Amazon with acute kidney injury and persistent thrombocytopenia[J]. Toxicon, 2014, 85: 27-30. DOI:10.1016/j.toxicon.2014.04.001 |
| [28] |
Herath N, Wazil A, Kularatne S, et al. Thrombotic microangiopathy and acute kidney injury in hump-nosed viper (Hypnale species) envenoming:a descriptive study in Sri Lanka[J]. Toxicon, 2012, 60: 61-65. DOI:10.1016/j.toxicon.2012.03.015 |
| [29] |
Sunitha K, Hemshekhar M, Thushara RM, et al. Inflammation and oxidative stress in viper bite:an insight within and beyond[J]. Toxicon, 2015, 98: 89-97. DOI:10.1016/j.toxicon.2015.02.014 |
| [30] |
Gutiérrez JM, Lomonte B, León G, et al. Trends in snakebite envenomation therapy:scientific, technological and public health considerations[J]. Curr Pharm Des, 2007, 13: 2935-2950. DOI:10.2174/138161207782023784 |
| [31] |
Gutiérrez JM, León G, Rojas G, et al. Neutralization of local tissue damage induced by Bothrops asper (terciopelo) snake venom[J]. Toxicon, 1998, 36: 1529-1538. DOI:10.1016/S0041-0101(98)00145-7 |
| [32] |
Santhosh MS, Hemshekhar M, Sunitha K, et al. Snake venom induced local toxicities:plant secondary metabolites as an auxiliary therapy[J]. Mini Rev Med Chem, 2013, 13: 106-123. DOI:10.2174/138955713804484730 |
| [33] |
Shabbir A, Shahzad M, Masci P, et al. Protective activity of medicinal plants and their isolated compounds against the toxic effects from the venom of Naja (cobra) species[J]. J Ethnopharmacol, 2014, 157: 222-227. DOI:10.1016/j.jep.2014.09.039 |
| [34] |
Tempone AG, Andrade HF, Spencer PJ, et al. Bothrops moojeni venom kills Leishmania spp[J]. Biochem Biophys Res Commun, 2001, 280: 620-624. DOI:10.1006/bbrc.2000.4175 |
| [35] |
Burin SM, Ghisla S, Ouchida AT, et al. CR-LAAO antileukemic effect against Bcr-Abl+ cells is mediated by apoptosis and hydrogen peroxide[J]. Int J Biol Macromol, 2016, 86: 309-320. DOI:10.1016/j.ijbiomac.2016.01.069 |
| [36] |
Abdelkafi-Koubaa Z, Aissa I, Morjen M, et al. Interaction of a snake venom L-amino acid oxidase with different cell types membrane[J]. Int J Biol Macromol, 2016, 82: 757-764. DOI:10.1016/j.ijbiomac.2015.09.065 |
| [37] |
Al-Sadoon MK, Abdel-Maksoud MA, Rabah DM, et al. Induction of apoptosis and growth arrest in human breast carcinoma cells by a snake (Walterinnesia aegyptia) venom combined with silica nanoparticles:crosstalk between Bcl2 and caspase 3[J]. Cell Physiol Biochem, 2012, 30: 653-665. DOI:10.1159/000341446 |
| [38] |
Al-Sadoon MK, Rabah DM, Badr G. Enhanced anticancer efficacy of snake venom combined with silica nanoparticles in a murine model of human multiple myeloma:molecular targets for cell cycle arrest and apoptosis induction[J]. Cell Immunol, 2013, 284: 129-138. DOI:10.1016/j.cellimm.2013.07.016 |
| [39] |
Yan JG, Wang YX, Yang YQ, et al. Inhibiting osteoclasts effect of compound preparation of Agkistrodon halyx venom in rats with bone cancer pain induced by W256 tumor cells[J]. Chin Tradit Pat Med (中成药), 2012, 34: 1216-1220. |
| [40] |
Quillinan N, Herson PS, Traystman RJ. Neuropathophysiology of brain injury[J]. Anesthesiol Clin, 2016, 34: 453-464. DOI:10.1016/j.anclin.2016.04.011 |
| [41] |
Wang Q, Liu Y, Zhou J. Neuroinflammation in Parkinson's disease and its potential as therapeutic target[J]. Transl Neurodegener, 2015, 4: 19. DOI:10.1186/s40035-015-0042-0 |
| [42] |
Zhan C, Yan Z, Xie C, et al. Loop 2 of Ophiophagus hannah toxin b binds with neuronal nicotinic acetylcholine receptors and enhances intracranial drug delivery[J]. Mol Pharm, 2010, 7: 1940-1947. DOI:10.1021/mp100238j |
| [43] |
Ghazaryan NA, Simonyan KV, Danielyan MH, et al. Neuroprotective effects of Macrovipera lebetina snake venom in the model of Alzheimer's disease[J]. Neurophysiology, 2017, 49: 412-423. DOI:10.1007/s11062-018-9704-8 |
| [44] |
Martins NM, Santos NA, Sartim MA, et al. A tripeptide isolated from Bothrops atrox venom has neuroprotective and neurotrophic effects on a cellular model of Parkinson's disease[J]. Chem Biol Interact, 2015, 235: 10-16. DOI:10.1016/j.cbi.2015.04.004 |
| [45] |
Kuo YJ, Chung CH, Pan TY, et al. A novel αIIbβ3 antagonist from snake venom prevents thrombosis without causing bleeding[J]. Toxins (Basel), 2019, 12: 11. DOI:10.3390/toxins12010011 |
| [46] |
Kuo YJ, Chen YR, Hsu CC, et al. An αIIb β3 antagonist prevents thrombosis without causing Fc receptor γ-chain IIa-mediated thrombocytopenia[J]. J Thromb Haemost, 2017, 15: 2230-2244. DOI:10.1111/jth.13803 |
| [47] |
Hung YC, Kuo YJ, Huang SS, et al. Trimucrin, an Arg-Gly-Asp containing disintegrin, attenuates myocardial ischemia-reperfusion injury in murine by inhibiting platelet function[J]. Eur J Pharmacol, 2017, 813: 24-32. DOI:10.1016/j.ejphar.2017.07.039 |
| [48] |
Chen CX, Chen JY, Kou JQ, et al. Suppression of inflammation and arthritis by orally administrated cardiotoxin from Naja naja atra[J]. Evid Based Complement Alternat Med, 2015, 2015: 387094. |
| [49] |
Zhu KZ, Liu YL, Gu JH, et al. Antinociceptive and anti-inflammatory effects of orally administrated denatured Naja Naja atra venom on murine rheumatoid arthritis models[J]. Evid Based Complement Alternat Med, 2013, 2013: 616241. |
| [50] |
Cui K, Kou JQ, Gu JH, et al. Naja naja atra venom ameliorates pulmonary fibrosis by inhibiting inflammatory response and oxidative stress[J]. BMC Complement Altern Med, 2014, 14: 461. DOI:10.1186/1472-6882-14-461 |
| [51] |
Xu YL, Kou JQ, Wang SZ, et al. Neurotoxin from Naja naja atra venom inhibits skin allograft rejection in rats[J]. Int Immunopharmacol, 2015, 28: 188-198. DOI:10.1016/j.intimp.2015.05.040 |
| [52] |
Liu Y, Zeng C, Liu Y, et al. Effect of cobra venom factor on the immune function of the pig to monkey liver xeno-transplantation[J]. Chin J Exp Surg (中华实验外科杂志), 2017, 34: 1907-1908. |
| [53] |
Charvat RA, Strobel RM, Pasternak MA, et al. Analysis of snake venom composition and antimicrobial activity[J]. Toxicon, 2018, 150: 151-167. DOI:10.1016/j.toxicon.2018.05.016 |
| [54] |
Almeida JR, Palacios ALV, Patiño RSP, et al. Harnessing snake venom phospholipases A2 to novel approaches for overcoming antibiotic resistance[J]. Drug Dev Res, 2019, 80: 68-85. DOI:10.1002/ddr.21456 |
| [55] |
Samy RP, Stiles BG, Gopalakrishnakone P, et al. Antimicrobial proteins from snake venoms:direct bacterial damage and activation of innate immunity against Staphylococcus aureus skin infection[J]. Curr Med Chem, 2011, 18: 5104-5113. DOI:10.2174/092986711797636108 |
| [56] |
Zhao F, Lan XQ, Du Y, et al. King cobra peptide OH-CATH30 as a potential candidate drug through clinic drug-resistant isolates[J]. Zool Res, 2018, 39: 87-96. DOI:10.24272/j.issn.2095-8137.2018.025 |
| [57] |
Rheubert JL, Meyer MF, Strobel RM, et al. Predicting antibacterial activity from snake venom proteomes[J]. PLoS One, 2020, 15. |
| [58] |
Khan N, Niazi ZR, Khan NR, et al. Simulation studies and dynamic interaction of venom peptides with ion channels[J]. Protein Pept Lett, 2018, 25: 652-662. DOI:10.2174/0929866525666180619095245 |
| [59] |
Baron A, Lingueglia E. Pharmacology of acid-sensing ion channels-physiological and therapeutical perspectives[J]. Neuropharmacology, 2015, 94: 19-35. DOI:10.1016/j.neuropharm.2015.01.005 |
| [60] |
Diochot S, Baron A, Salinas M, et al. Black mamba venom peptides target acid-sensing ion channels to abolish pain[J]. Nature, 2012, 490: 552-555. DOI:10.1038/nature11494 |
| [61] |
Brzezicki MA, Zakowicz PT. Mambalgins, the venom-origin peptides as a potentially novel group of analgesics:mini review[J]. CNS Neurol Disord Drug Targets, 2018, 17: 87-97. DOI:10.2174/1871527317666171221110419 |
| [62] |
Zhang F, Zhang C, Xu X, et al. Naja atra venom peptide reduces pain by selectively blocking the voltage-gated sodium channel Nav1.8[J]. J Biol Chem, 2019, 294: 7324-7334. DOI:10.1074/jbc.RA118.007370 |
| [63] |
Petricevich VL, Mendonça RZ. Inhibitory potential of Crotalus durissus terrificus venom on measles virus growth[J]. Toxicon, 2003, 42: 143-153. DOI:10.1016/S0041-0101(03)00124-7 |
| [64] |
Zabihollahi R, Pooshang Bagheri K, Keshavarz Z, et al. Venom components of Iranian scorpion Hemiscorpius lepturus inhibit the growth and replication of human immunodeficiency virus 1(HIV-1)[J]. Iran Biomed J, 2016, 20: 259-265. DOI:10.22045/ibj.2016.02 |
| [65] |
Shimizu JF, Pereira CM, Bittar C, et al. Multiple effects of toxins isolated from Crotalus durissus terrificus on the hepatitis C virus life cycle[J]. PLoS One, 2017, 12. DOI:10.22045/ibj.2016.02 |
| [66] |
Günther-Ausborn S, Stegmann T. How lysophosphatidylcholine inhibits cell-cell fusion mediated by the envelope glycoprotein of human immunodeficiency virus[J]. Virology, 1997, 235: 201-208. DOI:10.1006/viro.1997.8699 |
| [67] |
Fenard D, Lambeau G, Valentin E, et al. Secreted phospholipases A2, a new class of HIV inhibitors that block virus entry into host cells[J]. J Clin Invest, 1999, 104: 611-618. DOI:10.1172/JCI6915 |
| [68] |
Muller VD, Soares RO, dos Santos NN, et al. Phospholipase A2 isolated from the venom of Crotalus durissus terrificus inactivates Dengue virus and other enveloped viruses by disrupting the viral envelope[J]. PLoS One, 2014, 9. DOI:10.1371/journal.pone.0112351 |
| [69] |
Cecilio AB, Caldas S, Oliveira RA, et al. Molecular characterization of Lys49 and Asp49 phospholipases A₂ from snake venom and their antiviral activities against Dengue virus[J]. Toxins (Basel), 2013, 5: 1780-1798. DOI:10.3390/toxins5101780 |
 2020, Vol. 55
2020, Vol. 55


