2. 广东省药品检验所, 广东 广州 510700
2. Guangdong Institute for Drug Control, Guangzhou 510700, China
纳米载体在药物递送方面的优势已被广泛关注, 特别对于难溶性药物, 口服纳米给药系统不仅可以显著提高其溶解度, 而且能够促进其跨越黏膜屏障, 提高生物利用度[1-4]。影响纳米载体跨越生物屏障的因素很多, 如载体的粒径[5]、电荷[6]、柔性[7]和形状[8, 9]等。有文献[8]报道, 形状会对纳米载体在细胞黏附、摄取和细胞内的行为产生重要影响, 但关于纳米载体的形状对跨越生物屏障的影响的研究还比较少, 仍处于起步阶段。
传统脂质体是由磷脂和胆固醇等成分组装形成的类脂质双分子层结构, 在储存过程中容易发生聚集、不饱和键氧化、包载药物泄露等问题[10]。因此, 一类新型的有机-无机复合材料制成的纳米载体—硅质体(cerasome)受到越来越多的关注。
硅质体由含硅醚基团的有机-无机复合脂质材料构成, 是复合脂质材料在水溶液中自组装形成的具有类脂质双分子层的囊泡。硅质体能在温和的条件下通过溶胶-凝胶过程在表面形成硅酸盐网状结构, 该结构使硅质体相较于传统脂质体不易氧化, 更加稳定[11-14]。硅质体可以包载水溶性和脂溶性药物, 其在药物递送系统方面已有较多研究, 如还原敏感性递送系统[15]、温敏递送系统[11]和基因药物递送系统[16]等。
近年来, 有研究人员利用硅质体复合脂质与短链磷脂制备出了盘状的硅质体, 简称其为纳米盘[17]。与球形的硅质体(简称硅质体)相比, 纳米盘在细胞上表现出更快的摄取, 在肿瘤球上表现出更强的渗透。此外, 通过对纳米盘进行侧边的配体修饰, 还可以进一步提高纳米盘在细胞上的摄取及肿瘤球上的渗透[8]。基于上述结果, 本研究拟构建球形和盘状两种不同形状的硅质体, 以人源结肠癌Caco-2细胞作为肠上皮细胞单层的生物学模型, 探究其形状对纳米载体跨过细胞单层能力的影响。
材料与方法试剂 无水乙醇、三氯甲烷、甲醇、石油醚、碳酸氢钠(北京市通广精细化工公司); 碳酸钾、氨丙基三乙氧基硅烷(APTES)、乙酸乙酯(北京市百灵威科技有限公司); 十六胺、溴代十六烷(上海麦克林生化有限公司); 四氢呋喃(THF)、二氯甲烷[艾览(上海)化工科技有限公司]; 丁二酸酐(上海毕得医药科技有限公司); 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC∙HCl)、色谱级乙腈(美国Thermo Fisher Scientific公司); 冰乙酸、香豆素-6 (C6) (Aladdin Industrial Corporation); 无水硫酸钠(西陇科学股份有限公司); 柱层析硅胶(北京银河天虹化工有限公司); 1, 2-dihexanoyl-sn-glycero-3-phosphocholine (DHPC, 北京希凯创新科技有限公司); DMEM培养基(含高糖、丙酮酸钠、L-谷胺酰氨和25 mmol·L-1 HEPES, 北京中科迈晨科技有限公司); 胎牛血清(FBS, 美国Gibco公司)。
主要仪器 DZF-6020AB真空干燥箱(北京利康达圣科技发展有限公司); HARVARD PHD2000 Infusion微量注射泵(Harvard Apparatus Holliston); Nicolet-6700傅里叶变换红外光谱仪、酶标仪(美国ThermoFisher公司); MultiMode8原子力显微镜(美国Bruker公司); SCIENTE-IID超声波细胞粉碎机(宁波新芝生物科技股份有限公司); Malvern Zetasizer Nano-ZS型激光粒度仪(英国Marvern Instruments公司); JEM-200CX型透射电子显微镜(日本JEOL公司); LC-20AT高效液相色谱仪、SIL-20A自动进样器、LC solution色谱工作站(日本岛津公司); ZORBAX Eclipse XDB-C18色谱柱(250 mm×4.6 mm, 5 μm, 美国Agilent公司); CS SP8激光共聚焦扫描显微镜(德国Leica公司)。
细胞 人克隆结肠腺癌细胞Caco-2 (human colon adenocarcinoma cell line)购自中国典型培养物保藏中心(China Center For Type Culture Collection, CCTCC)。
硅质体复合脂质的合成 硅质体复合脂质(cerasome-forming lipid, CFL)的合成参照文献[12]并进行了改进。首先, 制备中间产物双十六胺(A, 合成路线图 1):取十六胺12 mmol, 加入无水乙醇20 mL, 搅拌至十六胺完全溶解。向反应体系中加入固体碳酸钾30 mmol, 然后用微量注射泵滴加溴代十六烷10 mmol。在搅拌下40 ℃回流24 h。反应停止后, 趁热抽滤除去碳酸钾, 滤液冷却至室温后再次进行抽滤, 所得固体用乙醇重结晶多次, 直至薄层层析色谱(TLC, 展开液为甲醇:三氯甲烷= 1:9)鉴定已除去原料十六胺与溴代十六烷, 将固体放置真空干燥箱内干燥24 h, 得到中间产物A; 然后, 制备中间产物4-(双十六胺基)-4-酮基丁酸(B, 合成路线图 1):称取中间产物A 6.5 mmol加入到圆底烧瓶中, 搅拌加入无水四氢呋喃至固体完全溶解, 再向反应体系中滴加预先溶于无水四氢呋喃的丁二酸酐13 mmol, 室温搅拌24 h, 减压旋转蒸发除去THF, 得到粗产物。加入适量三氯甲烷溶解粗产物, 得到的有机相先用10%柠檬酸溶液进行萃取, 收集有机相, 重复3次。再用饱和NaCl溶液进行破乳, 收集有机相, 重复3次。向得到的有机相中加入适量无水硫酸钠, 室温搅拌过夜以除水。过夜除水后经过滤除去无水硫酸钠、减压旋转蒸发除去三氯甲烷后, 经真空干燥箱干燥过夜得到中间产物B; 最后, 合成硅质体复合脂质(C, 合成线路图 1):称取适量中间产物B, 用无水二氯甲烷溶解, 加入其摩尔量1.2倍的EDC·HCl室温活化30 min, 再加入摩尔量为1.5倍的APTES, 室温搅拌过夜后, 减压旋转蒸发除去有机溶剂。硅胶层析柱对粗产物进行分离提纯(洗脱剂为乙酸乙酯:二氯甲烷:醋酸= 1:3:0.015)。将收集到的产物减压旋转蒸发处理后, 加入适量三氯甲烷使其溶解。用饱和碳酸氢钠溶液进行萃取, 收集有机相, 重复两次。再用饱和NaCl水溶液进行破乳, 收集有机相, 重复两次。得到的液体再次进行减压旋转蒸发处理, 获得产物C, 即有机-无机硅质体复合脂质材料(CFL)。采用质谱(mass spectrum)与核磁共振氢谱(proton nuclear magnetic resonance, 1H NMR)对CFL进行表征。

|
Scheme 1 Synthetic route of cerasome-forming lipid (CFL). A: Dihexadecylamine; B: N, N‐Dihexadecylsuccinamic acid; C: CFL |
|
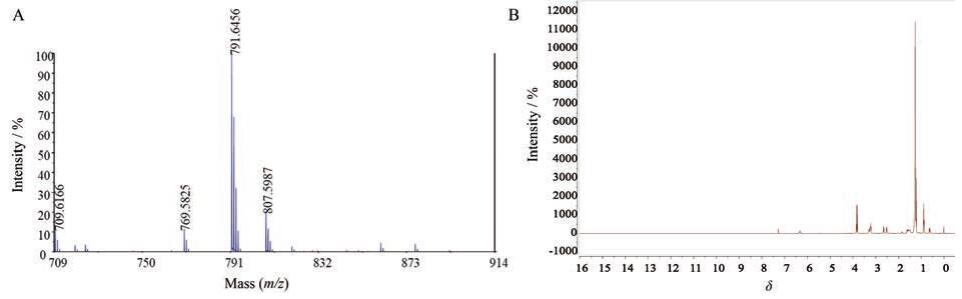
Figure 1 Mass spectrogram (A) and 1H NMR spectrogram (B) of CFL |
纳米载体的制备 采用薄膜水化法制备硅质体和纳米盘[11, 17]。纳米盘制备基本步骤如下:以三氯甲烷为溶剂配置质量浓度为5.38 mg·mL-1 CFL溶液与1 mg·mL-1 DHPC溶液, 备用。按照CFL:DHPC= 7:2 (摩尔比)的比例加入到茄形瓶中, 并加入适量C6作为荧光标记物。40 ℃减压旋转蒸发除去三氯甲烷, 形成均匀的薄层脂膜。向茄形瓶中加入去离子水1 mL, 置于55 ℃水浴中孵育30 min, 水浴超声10 min后, 再以40 W功率探头超声15 min。室温放置过夜后, 即得纳米盘。硅质体制备步骤与纳米盘相同, 只是在处方上保持CFL的物质的量与纳米盘中CFL的物质的量相同。
纳米载体的表征 粒径、zeta电位测定采用动态光散射法测定硅质体和纳米盘的粒径、多分散指数(PDI)及zeta电位。设定粒度测定仪入射光与散射光束的夹角为90°, 测定温度为25 ℃, 每个样品测定循环数为自动。3个参数均取3批制剂的平均值(n = 3)并计算SD。
透射电镜表征 采用透射电子显微镜观察其形态。常温下, 取适量硅质体和纳米盘溶液滴于铜网上, 吸附10 min后用滤纸吸干, 再滴加4.0%磷钨酸溶液于铜网上负染90 s后用滤纸吸干, 铜网放置过夜使其自然挥干, 用透射电子显微镜观察并摄制照片。
原子力显微镜表征 使用原子力显微镜(atomic force microscope, AFM)对纳米盘进行了形态学表征。将纳米盘溶液滴加在云母片的新鲜表面上, 吸附5 min, 去离子水轻轻冲洗, 自然干燥, 然后在原子力显微镜下观察。
红外光谱表征 采用傅里叶变换红外光谱仪(Fourier transform infrared spectrometer, FTIR spectrometer)对硅质体和纳米盘进行红外光谱表征。样品制备方法如下:将硅质体和纳米盘的冻干粉末与溴化钾充分混合后压片, 在400~4 000 cm-1波数内对其进行红外光谱扫描。
C6泄露的测定 吸取硅质体和纳米盘溶液各1 mL, 置于截留分子量为3 500的透析袋中, 两端扎紧, 置于50 mL空白DMEM培养液中, 37 ℃、100 r·min-1振摇, 分别于0.5、1、2、4、6和8 h自释放介质中取液0.5 mL, 并补充新鲜释放介质0.5 mL。将样品用甲醇稀释10倍后, 于14 000 r·min-1离心10 min, 吸取上清液待测。用高效液相色谱法测定C6的浓度[18], 并计算不同时间C6释放量。
纳米载体的细胞毒 采用CCK-8法考察了硅质体和纳米盘对Caco-2细胞的细胞毒作用。将细胞以每孔5×103个分别接种至96孔板。在CO2恒温培养箱中培养12 h后分别加入空白对照(磷酸盐缓冲液, PBS)和不同浓度的硅质体和纳米盘(1、5、10、25、50、100、250 μg·mL-1)。加样后继续培养36 h, 除去培养基, 每孔加入含10 μL CCK-8溶液的空白DMEM培养液110 μL, 37 ℃条件下继续避光孵育1~3 h, 随后使用酶标仪在450 nm处测定吸光度值, 计算各组细胞存活率。
纳米载体在Caco-2细胞上的实时摄取考察 将Caco-2细胞以每毫升2×105个接种于玻底小皿中, 培养12 h后进行实验。用PBS洗去培养液, 加入少量空白DMEM培养液润湿细胞。实验开始时将玻底小皿水平置于激光共聚焦显微镜(confocal laser scanning microscope, CLSM)载物台上, 调节物镜为40×油镜, 首先采集选定细胞单层区域的相差图像, 之后设定488 nm激发波长下的绿光激发通道, 在共聚焦显微镜的X-Y-t程序设定下每隔5 s分别对视野选定区域进行相差图像和绿光通道图像采集。在采集1、2张图片后, 缓慢加入500 μL空白DMEM培养液稀释的制剂中CFL浓度为200 μg·mL-1的纳米载体溶液。共聚焦图像的采集持续20 min。
Caco-2细胞单层的培养 将Caco-2细胞以每毫升4×105个接种于Transwell培养板的供给池中, 体积为0.5 mL, 同时向接收池中加入培养液1.5 mL, 再将Transwell培养板置于37 ℃、相对湿度95%和CO2含量5%的培养箱中进行培养。监测Transwell膜两侧的跨膜电阻(TEER)值, 当TEER值超过500 Ω·cm2后用于后续实验[19]。
纳米载体在Caco-2细胞单层上的实时摄取考察 将Caco-2细胞单层培养至符合实验要求后, 吸弃Transwell膜两侧的培养液, 加入空白DMEM培养液孵育约12 h, 使细胞适应无血清环境并稳定TEER值。用Hoechst 33342在37 ℃下孵育细胞1 h对细胞核进行染色, 然后再次使用PBS清洗细胞3次, 其余步骤同方法“纳米载体在Caco-2细胞上的实时摄取考察”。共聚焦图像的采集持续30 min。
共聚焦观察纳米载体在Caco-2细胞单层上的跨膜 Caco-2细胞以每毫升2×105个培养于玻底小皿中, 培养至细胞汇合度达80%以上后, 将符合实验要求的Caco-2细胞单层供给池轻轻放置在玻底小皿上方。向供给池中加入空白DMEM培养液稀释的制剂中CFL浓度为200 μg·mL-1的硅质体和纳米盘溶液, 分别孵育30和60 min后用4%多聚甲醛固定玻底小皿中的细胞10 min, PBS清洗3次后, 用Hoechst 33342孵育细胞10 min对细胞核进行染色, 然后再次使用PBS清洗细胞3次, 向其中加入抗荧光衰减封片剂。将玻底小皿水平置于激光共聚焦显微镜载物台上, 调节物镜为63×油镜, 首先采集选定细胞区域的405 nm激发波长下的蓝光激发通道, 之后设定488 nm激发波长下的绿光激发通道, 对视野选定区域进行蓝光通道和绿光通道图像采集。
HPLC法测定纳米载体在Caco-2细胞单层上的跨膜量 将Caco-2细胞单层培养至符合实验要求后, 吸弃Transwell膜两侧的培养液, 加入空白DMEM培养液孵育约12 h, 使细胞适应无血清环境并稳定TEER值。然后在供给池加入空白DMEM培养液稀释的制剂中CFL质量浓度为200 μg·mL-1的硅质体和纳米盘溶液, 同时在接收池加入空白DMEM培养液1.5 mL。将Transwell培养板置于细胞培养箱中孵育, 分别于1、2、4和24 h吸取接收池液体100 μL, 再加入900 μL甲醇, 作为测定下室C6浓度的样品。所有待测样品分别混合均匀后于14 000 r·min-1离心10 min, 吸取上清液待测。样品浓度测定方法同上。
数据分析 采用GraphPad Prism 8软件进行统计学分析, P < 0.05为具有显著性差异, P < 0.01为具有极显著性差异。
结果与讨论 1 CFL的合成及表征参考相关文献[12]并在原有合成步骤上进行优化, 合成了CFL。按照合成路线图 1, 通过溴化反应合成中间产物A, 亲核加成反应合成中间产物B, 然后通过酰化反应合成CFL。图 1A为CFL的质谱图, 相对分子质量为769.582 5 [M+H]+、791.645 6 [M+Na]+与807.598 7 [M+K]+处的峰与CFL的理论相对分子质量(Mw = 768.68)相符。其核磁共振氢谱图如图 1B所示, δ 0.6是硅氧键末端甲基峰, δ 0.9是长链烷基末端甲基峰, δ1.27是长链烷基上亚甲基峰, δ2.67和δ 2.54是与羰基相连的亚甲基峰, δ 3.25是与N原子相连的亚甲基峰, δ3.85是硅氧键上亚甲基峰, δ 6.34是酰胺键上氢的峰, 标志着CFL的成功合成, 可用于后续实验。
2 纳米载体的外观形态、粒径分布及zeta电位按照处方制备硅质体和纳米盘。两种硅质体溶液澄清略带乳光, 呈淡绿色, 为包载的模型药物C6本身的颜色。图 2A、B及表 1为动态光散射测定的粒径和粒径分布, 显示硅质体和纳米盘具有相似的粒径和分散度。二者的zeta电位均在-20~-30 mV之间。透射电镜下, 硅质体呈较规则、大小均一的圆球形(图 2C); 而纳米盘根据其在铜网上的附着状态不同, 在电镜下呈现两种不同的形态。根据透视原理, 以平面附着在铜网上的纳米盘在电镜下呈圆形, 而以侧面边缘直立附着在铜网上的纳米盘在电镜下呈棒状或长椭圆形(图 2D, 红色箭头所示)。纳米盘的理论结构为表面活性剂镶边的脂质双层膜结构, 内部疏水, 外部亲水。进一步采用原子力显微镜对其形态进行了考察。图 2E为纳米盘在原子力显微镜下的视图, 图 2F是纳米盘的高度示意图。图片中纳米盘的厚度小于7 nm, 约为一个脂质双层膜的厚度, 与纳米盘的理论结构相符[8]。

|
Figure 2 The morphology and size distribution of nanosphere (A, C) and nanodisc (B, D).The rod-like objects in figure (D) indicated by the red arrows are attributed to the projections of the edge-on bicelles.The atomic force microscope images (E) and the height profile (F) of nanodisc.Scale bar, 200 nm |
| Table 1 The size distribution and zeta potential of nanosphere and nanodisc determined by dynamic light scattering. PDI: Polydispersity index. n = 3, x±s |
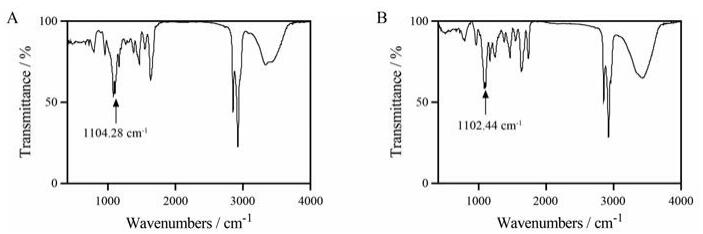
硅质体和纳米盘表面都有一层Si-O-Si的网络结构, 该结构能让硅质体更加稳定[17]。为证明Si-O-Si网络结构的存在, 对所制备的硅质体和纳米盘进行了红外光谱分析。如图 3所示, 硅质体和纳米盘均具有Si-O-Si的特征峰(1 100 cm-1)[8], 表明两种硅质体表面Si-O-Si网络结构的形成。
|
Figure 3 Fourier transform infrared spectroscopy of nanosphere (A) and nanodisc (B). Characteristic peaks at 1 100 cm-1 indicated by black arrow are attributed to the asymmetric stretching vibration of the siloxane bond |
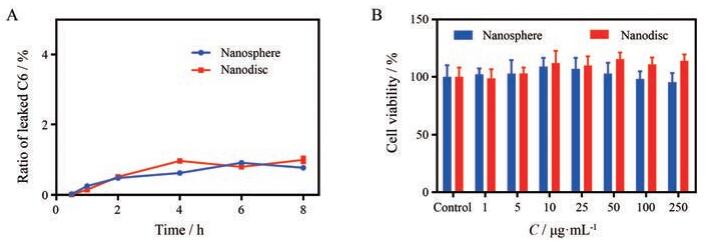
为保证疏水性模型药物C6的荧光能够指示纳米载体的胞内行为, 对包载C6的硅质体和纳米盘的泄露进行了考察。如图 4A所示, 在所观察的8 h内, C6从纳米载体中的泄漏率不到1%, 说明可以以C6代表整个纳米载体在胞内的行为。
|
Figure 4 C6 release profiles from nanosphere and nanodisc in blank DMEM (A). n= 3, x±s. Cytotoxicity of nanosphere and nanodisc at different concentrations (B). n= 6, x±s |
目前对硅质体的生物安全性评价主要在细胞水平。与具有相似粒径的二氧化硅纳米粒相比, 硅质体对细胞功能, 包括细胞增殖、细胞周期、细胞凋亡和内源性ROS水平等的影响程度较小[20]。采用CCK-8法测定硅质体和纳米盘对Caco-2细胞的细胞毒作用, 如图 4B所示, 在所选取的1~250 μg·mL-1浓度内, Caco-2细胞的存活率均在85%以上。故本研究选取质量浓度为200 μg·mL-1的纳米载体进行后续实验。
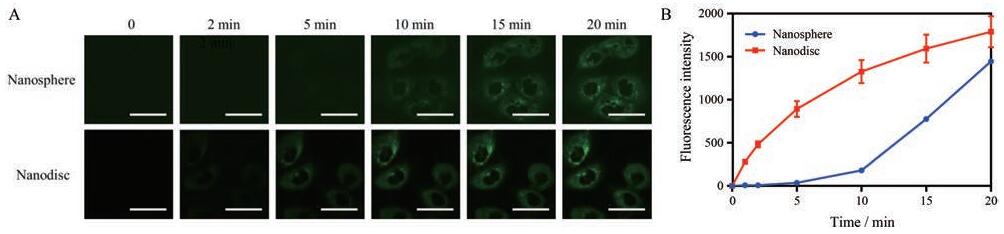
5 纳米载体在Caco-2细胞上的实时摄取为探究不同形状的纳米载体对细胞摄取速率的影响, 以Caco-2细胞为模型, 使用激光共聚焦扫描显微镜考察了Caco-2细胞在20 min内对硅质体和纳米盘的实时摄取情况。实时摄取的共聚焦图像结果如图 5A所示, 根据共聚焦结果统计分析得到的Caco-2细胞的胞浆的荧光强度见图 5B。从实验结果可以看出, 无论是硅质体还是纳米盘, 其摄取量都随时间延长而增加, 呈现出时间依赖性。但在20 min内纳米盘的摄取速率显著快于硅质体, 在20 min时细胞内荧光强度相差不多。这表明细胞摄取速率与所摄取的纳米载体的形状相关。由于纳米盘存在各向异性, 会以不同的部位(边缘处或平面处)与细胞接触。当纳米盘以边缘处与细胞接触时, 纳米盘的边缘处表面曲率大, 与细胞接触角大, 有利于细胞对纳米盘的包裹[13, 21]。因此, 盘状纳米粒表现出了更快的入胞速率。
|
Figure 5 Confocal laser scanning microscope (CLSM) image of nanosphere and nanodisc endocytosised by Caco-2 cells in real time (A). Scale bar, 50 μm. The fluorescence intensity of nanosphere and nanodisc in Caco-2 cells in real time (B). n= 3, x±s |
以Caco-2细胞单层为模型, 使用激光共聚焦扫描显微镜考察了Caco-2细胞单层在30 min内对硅质体和纳米盘的实时转运的情况。选取细胞核横截面积最大的一层进行观察, 结果如图 6所示, 随着时间延长, 硅质体和纳米盘在细胞内累积均逐渐增多。但与玻底小皿上贴壁细胞对硅质体和纳米盘的摄取情况(图 5)不同的是, 在30 min内, 硅质体在细胞单层胞内的荧光强度要强于纳米盘, 也就是说, 相较于纳米盘, 硅质体在细胞内的累积更多。

|
图 6 CLSM image of nanosphere and nanodisc endocytosised by Caco-2 cell monolayer in real time. Scale bar, 150 μm |
细胞单层上的荧光强度是摄取和跨膜综合作用的结果。纳米盘摄取多(图 5), 但胞内滞留量少(图 6), 可能是由于纳米盘跨膜量大造成的。进一步采用如图 7A所示的装置, 利用玻底小皿中Caco-2细胞的摄取作用对跨过Caco-2细胞单层的硅质体和纳米盘进行富集, 并采用共聚焦显微镜观察胶束的跨膜转运。选取玻底小皿中Caco-2细胞的细胞核横截面积最大的一层进行观察, 结果如图 7B所示, 在30和60 min时, 纳米盘的跨膜转运量(玻底小皿中细胞的荧光强度)均明显多于硅质体, 该结果证明纳米盘的跨膜转运能力强于硅质体。
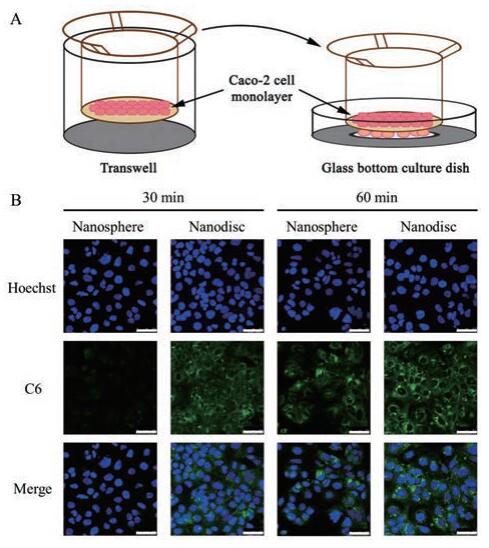
|
Figure 7 Schematic diagram of the methods used in the transportation experiment (A). The fluorescence intensity of C6 endocytosed by Caco-2 cells in glass bottom culture dish was visualized by CLSM (B). Scale bar, 50 μm |
在使用激光共聚焦显微镜观察到纳米盘比硅质体能更快地跨过Caco-2细胞单层的定性结果后, 采用HPLC对两种纳米载体跨Caco-2细胞单层的能力进行了定量考察。两种纳米载体跨膜转运量的结果如图 8A所示, 在开始的2 h内, 纳米盘的跨膜转运速率更快, 这与前面的结果一致。结合图 6与图 7的结果, 可以认为在开始的30 min内, 被Caco-2单层摄取的纳米盘更快地被转运出胞, 而硅质体更多地停留在胞内。在2 h后更长的时间里, 两种纳米载体的跨膜转运量无显著性差异, 可能是由于两种载体的转运已经达到平衡。根据所得到的研究结果推测, 在体内环境下, 由于跨过肠道屏障的纳米粒可更快地分布到全身, 不容易产生转运的饱和状态, 因此, 跨膜速率更快的纳米盘有利于增加跨膜量。初始时刻(0 h)及24 h时TEER值变化如图 8B所示, 与孵育前TEER值相比, 加入硅质体和纳米盘孵育24 h后TEER值变化均在20%内, 说明纳米载体对Caco-2细胞间紧密连接影响较小, 即本研究中不涉及打开紧密连接的细胞旁路转运途径。
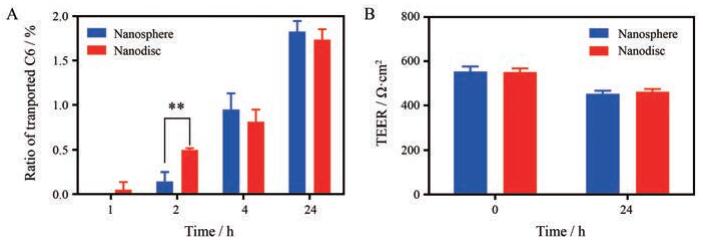
|
Figure 8 The accumulative amount of C6 transported across Caco-2 cell monolayer in receiver chamber at 37 ℃ after incubation nanosphere or nanodisc for 1, 2, 4, 24 h (A). n = 3, x±s.**P < 0.01. Changes of trans epithellal electric resistance (TEER) values after incubation with nanosphere and nanodisc for 0 and 24 h (B). n = 3, x±s |
本课题成功合成了硅质体复合脂质, 并与短链脂材DHPC通过薄膜水化法制备了硅质体和纳米盘。激光粒度仪和透射电镜法显示两种纳米载体具有相似的粒径和不同的形状, 红外光谱法证明纳米载体的表面有Si-O-Si网络结构形成。采用实时共聚焦显微镜考察了形状对纳米载体在Caco-2细胞上摄取的影响, 结果表明圆盘状的纳米盘的摄取速率显著快于圆球状的硅质体。采用HPLC法和共聚焦技术也考察了形状对纳米载体在Caco-2细胞单层跨膜转运的影响, 结果显示纳米盘能更快地被极性上皮细胞转运出胞。在口服纳米给药系统中, 纳米载体不仅需要有良好的细胞摄取能力, 还要具有快速穿过肠道屏障的能力。因此, 本研究的结果提示通过优化纳米载体的形状可以促进纳米载体的跨膜转运, 进而提高药物的吸收。
作者贡献:张润宇、宋阳和陈晴合成硅质体复合脂质; 张润宇完成其他实验内容; 邓海亮给出实验修改建议; 王学清、张华、代文兵、何冰、陈英和张强全程指导。
利益冲突:所有作者声明不存在利益冲突
| [1] |
Reinholz J, Landfester K, Mailänder V. The challenges of oral drug delivery via nanocarriers[J]. Drug Deliv, 2018, 25: 1694-1705. DOI:10.1080/10717544.2018.1501119 |
| [2] |
Niu Z, Conejos-Sánchez I, Griffin B, et al. Lipid-based nanocarriers for oral peptide delivery[J]. Adv Drug Deliv Rev, 2016, 106: 337-354. DOI:10.1016/j.addr.2016.04.001 |
| [3] |
Zhang L, Wang S, Zhang M, et al. Nanocarriers for oral drug delivery[J]. J Drug Target, 2013, 21: 515-527. DOI:10.3109/1061186X.2013.789033 |
| [4] |
Rao S, Prestidge CA. Polymer-lipid hybrid systems:merging the benefits of polymeric and lipid-based nanocarriers to improve oral drug delivery[J]. Exp Opin Drug Deliv, 2016, 13: 691-707. DOI:10.1517/17425247.2016.1151872 |
| [5] |
Bannunah AM, Vllasaliu D, Lord J, et al. Mechanisms of nanoparticle internalization and transport across an intestinal epithelial cell model:effect of size and surface charge[J]. Mol Pharm, 2014, 11: 4363-4373. DOI:10.1021/mp500439c |
| [6] |
Du XJ, Wang JL, Iqbal S, et al. The effect of surface charge on oral absorption of polymeric nanoparticles[J]. Biomater Sci, 2018, 6: 642-650. DOI:10.1039/C7BM01096F |
| [7] |
Yu MR, Xu L, Tian FL, et al. Rapid transport of deformation-tuned nanoparticles across biological hydrogels and cellular barriers[J]. Nat Commun, 2018, 9: 2607. DOI:10.1038/s41467-018-05061-3 |
| [8] |
Wang X, Lin L, Liu R, et al. Anisotropy in shape and ligand-conjugation of hybrid nanoparticulates manipulates the mode of bio-nano interaction and its outcome[J]. Adv Funct Mater, 2017, 27: 1700406. DOI:10.1002/adfm.201700406 |
| [9] |
Wang Z, Chen B, Yin Q, et al. Impacts of particle shape on cellular uptake and tumor imaging application of ultra-pH sensitive micelles[J]. Acta Pharm Sin (药学学报), 2018, 53: 797-805. |
| [10] |
Cao Z, Yue X, Li X, et al. Stabilized magnetic cerasomes for drug delivery[J]. Langmuir, 2013, 29: 14976-14983. DOI:10.1021/la401965a |
| [11] |
Liang X, Gao J, Jiang L, et al. Nanohybrid liposomal cerasomes with good physiological stability and rapid temperature responsiveness for high intensity focused ultrasound triggered local chemotherapy of cancer[J]. ACS Nano, 2015, 9: 1280-1293. DOI:10.1021/nn507482w |
| [12] |
Katagiri K, Hashizume M, Ariga K, et al. Preparation and characterization of a novel organic-inorganic nanohybrid "cerasome" formed with a liposomal membrane and silicate surface[J]. Chemistry, 2007, 13: 5272-5281. DOI:10.1002/chem.200700175 |
| [13] |
Yue X, Jing Y, Dai Z. Liposomal cerasome:a nanohybrid of liposome and silica[J]. Asia Pac J Chem Eng, 2011, 6: 569-574. DOI:10.1002/apj.592 |
| [14] |
Cao Z, Ma Y, Yue X, et al. Stabilized liposomal nanohybrid cerasomes for drug delviery applications[J]. Chem Commun, 2010, 46: 5265-5267. DOI:10.1039/b926367e |
| [15] |
Zhou G, Li L, Xing J, et al. Redox responsive liposomal nanohybrid cerasomes for intracellular drug delivery[J]. Colloids Surf B Biointerfaces, 2016, 148: 518-525. DOI:10.1016/j.colsurfb.2016.09.033 |
| [16] |
Li Y, Zheng S, Liang X, et al. Doping hydroxylated cationic lipid into PEGylated cerasome boostsr in vivor siRNA transfection efficacy[J]. Bioconjug Chem, 2014, 25: 2055-2066. DOI:10.1021/bc500414e |
| [17] |
Yasuhara K, Miki S, Nakazono H, et al. Synthesis of organic-inorganic hybrid bicelles-lipid bilayer nanodiscs encompassed by siloxane surfaces[J]. Chem Commun, 2011, 47: 4691-4693. DOI:10.1039/c1cc10254k |
| [18] |
Song X, Li R, Deng H, et al. Receptor mediated transcytosis in biological barrier:the influence of receptor character and their ligand density on the transmembrane pathway of active-targeting nanocarriers[J]. Biomaterials, 2018, 180: 78-90. DOI:10.1016/j.biomaterials.2018.07.006 |
| [19] |
Hidalgo IJ, Raub TJ, Borchardt RT. Characterization of the human colon carcinoma cell line (Caco-2) as a model system for intestinal epithelial permeability[J]. Gastroenterology, 1989, 96: 736-749. DOI:10.1016/S0016-5085(89)80072-1 |
| [20] |
Yue X, Dai Z. Recent advances in liposomal nanohybrid cerasomes as promising drug nanocarriers[J]. Adv Colloid Interf Sci, 2014, 207: 32-42. DOI:10.1016/j.cis.2013.11.014 |
| [21] |
Li Y, Yue TT, Yang K, et al. Molecular modeling of the relationship between nanoparticle shape anisotropy and endocytosis kinetics[J]. Biomaterials, 2012, 33: 4965-4973. DOI:10.1016/j.biomaterials.2012.03.044 |
 2020, Vol. 55
2020, Vol. 55


