多西紫杉醇(docetaxel, DTX)是紫杉醇的一种半合成紫杉类衍生物, 能够有效促使肿瘤细胞微管蛋白聚集, 维持微管稳定性[1], 抑制肿瘤细胞增殖, 对改善晚期肺癌患者的预后有重要作用。体内外研究表明, DTX有抑制和杀伤肺癌细胞作用[2], 其细胞毒性多与其可诱发细胞凋亡有关[3]。然而, DTX有一定的骨髓抑制作用, 在杀死肿瘤细胞的同时并发一定程度的不良反应[4], 另外, DTX水溶性较差, 对肿瘤组织缺乏特异性[5]。因此, 通过采用不同的制剂学手段, 如脂质体、纳米粒、聚合物胶束等作为载体包载DTX, 以改善其不良反应、提高水溶性及增强药物对肿瘤组织的特异性靶向递药, 已成为提高DTX临床疗效、减少毒副反应的关键。
过去十余年纳米技术在靶向给药方面的优势已引起研究者的广泛关注, 一系列pH值响应性纳米胶束被动或主动靶向递药系统已经被证明能够到达既定的靶组织, 突破系统或者细胞的屏障, 从而发挥更强疗效[6]。聚合物纳米粒显示出高度的生物相容性和较强的结构稳定性[7], 能够负载高容量的药物并延长其血浆半衰期等[8]。最近的证据表明, 紫杉醇类纳米制剂对肿瘤的治疗显示出显著的优势[9]。美国食品和药品管理局(FDA)已批准白蛋白结合型紫杉醇纳米粒(Abraxane®)用于乳腺癌、肺癌和胰腺癌等癌症的治疗。
聚乙二醇-聚乳酸[poly (ethylene glycol)-poly (lactic acid), PELA]是一种人工合成的生物相容性聚合物材料, 被FDA批准用作临床药用辅料[10]。聚乙二醇-聚乳酸-聚-β-氨基酯[poly (methoxy-ethylene glycol)-poly (lactic acid)-poly-(β-amino ester), PBAE]是在PELA的基础上, 修饰聚-β-氨基酯嵌段, 而聚-β-氨基酯嵌段[poly-(β-amino ester)]通常由二丙烯酸酯类和胺类以迈克尔加成反应(Michael addition reaction)合成[11], 其合成原料廉价易得、合成方法简单、可生物降解、具有pH值响应性, 因此成为被动靶向纳米载药系统的研究热点[12]。已报道的聚酰胺-胺型树枝状高分子[poly (amido amine), PAMAM]是一类非常有前景的非病毒基因载体, 具有pH值响应能力, 但因其表面含有大量氨基而具有较强的细胞毒作用, 因而应用受到限制[13]。以聚-L-赖氨酸(poly-L-lysine, PLL)为基础的载体材料表面携带正电荷, 易与血浆蛋白结合, 容易被网状内皮吞噬系统捕捉并快速清除, 因此其血液稳定性较差[14]。Song等[15]合成了一系列PEG-PBAE以考察不同胺类和二丙烯酸酯对pH敏感性的影响, 包载多柔比星(DOX)后, 胶束显示出对HeLa细胞的显著抑制作用且具有很好的生物相容性。基于聚乳酸[poly (lactic acid), PLA]或聚乳酸-羟基乙酸共聚物[poly-(D, L-lactic acid-co-glycolic acid, PLGA]的DTX纳米药物, 如Nanoxel-PM和BIND-014, 已经进入了临床研究[16, 17]。本研究通过合成两亲性聚合物材料PELA, 并在前期研究基础上通过改变聚-β-氨基酯嵌段种类及长度来合成三嵌段共聚物PBAE, 用于递送DTX, 考察其抑制小鼠Lewis肺癌移植瘤活性, 探索其在临床上治疗肺癌的可能性。
材料与方法实验仪器 RE-2000型旋转蒸发器(上海亚荣生化仪器厂); LGJ-10C冷冻干燥机(北京四环仪器厂); Nano ZS90激光粒度仪(Malvern公司); F-7000荧光分光光度计、H7650透射电镜(Hitachi公司); Acend-600核磁共振仪(Bruker公司); LC-20A型高效液相色谱仪(日本岛津公司)。
试剂材料 Lewis肺癌细胞(中国医学科学院细胞库); DMEM培养基、胎牛血清(FBS, 美国Gibco公司, 批号分别为8114371、8006350);胰蛋白酶(美国Sigma公司, 批号: DH355-2);磷酸盐缓冲液(PBS, HyClone公司, 批号: NAA1314); DTX (北京伊诺凯科技有限公司, 批号分别为P1086434、P1086436, 纯度均≥98%); PELA (批号: 20171011)与PBAE (批号: 20171020)均为本实验室自制; 0.9%氯化钠注射液(山东齐都药业有限公司, 批号: 3B16063006);水为去离子水; 乙腈、甲醇为色谱纯。其他试剂均为分析纯。
实验动物 SPF级C57BL/6小鼠, 雄性, 体质量20~22 g, 购自北京维通利华实验动物技术有限公司, 合格证号SCXK (京) 2016-0006。本实验符合动物伦理学标准, 并获得中国中医科学院中药研究所动物伦理委员会批准(批准号2017090110)。
pH敏感三嵌段聚合物PBAE 合成[18] PBAE的合成如合成路线1所示。以聚乙二醇单甲醚mPEG2k为引发剂, 在辛酸亚锡Sn(Oct)2催化下引发外消旋丙交酯开环聚合形成两嵌段聚合物PELA; PELA进一步与丙烯酰氯反应, 得到丙烯酰化PELA-A; PELA-A与1-氨基-4-甲基哌嗪, 1, 6-己二醇二丙烯酸酯分别按照1:10:11与1:15:16的摩尔比发生迈克尔加成反应, 合成最终产物PBAE1与PBAE2。
聚合物分子结构及分子量的确定 采用1H NMR法测定不同嵌段长度聚合物的结构与分子量。取适量聚合物, 溶于以四甲基硅烷为内标的氘代氯仿, 进行核磁共振扫描, 得各产物核磁氢谱, 对谱图解析, 计算, 即可确定聚合物的结构及分子量。
聚合物碱解离常数测定 采用酸碱滴定法测定聚合物的碱解离常数(pKb值)。分别取20 mg聚合物材料PELA及不同嵌段长度的PBAE1、PBAE2, 加入去离子水20 mL, 得到质量浓度为1 mg·mL-1溶液, 加入适量0.1 mol·L-1 HCl调节溶液pH至2.0, 再用0.1 mol·L-1 NaOH溶液滴定, 每次50 μL, pH计检测每次滴定后溶液pH值, 以pH值对NaOH溶液体积做滴定曲线, 以此计算出每种材料的pKb值。

|
Scheme 1 The synthesis routes of poly (methoxy-ethylene glycol)-polylactide (PELA) and poly (methoxy-ethylene glycol)-poly(lactic acid)-poly-(β-amino ester) (PBAE) |
聚合物临界胶束浓度的测定 临界胶束浓度(CMC)的测定采用芘荧光探针法。取各聚合物材料10 mg置于100 mL量瓶中采用去离子水溶解, 配制成100 μg·mL-1储备液, 待用。称取芘2 mg至100 mL量瓶中, 配制成1×10-4 mol·L-1芘丙酮溶液, 稀释10倍后待用。取芘溶液10 μL, 加入到10 mL量瓶中, 使芘的终浓度1×10-8 mol·L-1, 干燥过夜, 挥去溶剂。加入不同浓度梯度的聚合物溶液(0.01~100 μg·mL-1), 50 ℃超声2 h, 使芘充分进入聚合物形成的胶束。固定发射波长为390 nm, 在300~360 nm扫描一系列聚合物溶液的荧光光谱。激发和发射的狭缝均为50 nm, 以336和334 nm处荧光强度比值对聚合物浓度的对数作图, 确定各聚合物CMC。
载多西紫杉醇纳米胶束的制备及表征 分别称取3种聚合物材料各100 mg, DTX 6 mg, 采用薄膜水化法制备各聚合物胶束[19], 得到PELA-DTX、PBAE1-DTX和PBAE2-DTX载药胶束, 过0.22 μm滤膜, 冻干, 待用。胶束粒径及稳定性通过激光粒度仪检测, 取冻干粉各20 mg, 加入PBS (pH 7.4)4 mL溶解后检测粒径。另取DTX载药胶束30 mg, 加入含10% FBS的PBS (pH 7.4)15 mL, 分别置于37℃和25℃条件下, 检测不同时间间隔胶束的粒径变化, 以评估载药胶束稳定性。采用透析法考察载药胶束在中性(pH 7.4)和弱酸性环境(pH 6.5)条件下的释放行为。HPLC检测其载药量(LC)及包封率(EE)[20], 取载药胶束适量, 加一定量流动相溶解, 超声5 min, 过0.22 μm微孔滤膜, 检测DTX含量, 计算公式如下:
| $ {\rm{LC = }}{W_{\rm{d}}}/{W_1} \times 100\% $ | (1) |
| $ {\rm{EE = }}{W_{\rm{d}}}/{W_{\rm{a}}} \times 100\% $ | (2) |
其中, Wd为载药胶束中的药物质量; Wl为载药胶束的质量; Wa为药物投料质量。
小鼠Lewis肿瘤模型建立 取对数生长期的Lewis细胞以0.25%胰酶消化, 收集细胞, 1 000 r·min-1离心5 min, 去上清, 用PBS洗涤2次, 后稀释至适中浓度, 取适量于血球计数板进行细胞计数, 调整细胞数为1×106个/mL, 对C57BL/6小鼠进行皮下接种, 接种量每只0.2 mL, 建立小鼠Lewis肿瘤模型。
多西紫杉醇纳米胶束体内抑瘤活性 小鼠移植瘤建模成功后, 将小鼠随机分为5组, 分别为生理盐水(saline)组、游离药物DTX (剂量10 mg·kg-1)、非pH敏感载药胶束PELA-DTX组(剂量10 mg·kg-1)、pH敏感载药胶束PBAE1-DTX组(剂量10 mg·kg-1)和pH敏感载药胶束PBAE1-DTX (剂量20 mg·kg-1), 每组4只。分别在第0、3、6和9天给药(给药时称重), 每隔两日量取肿瘤体积、小鼠称重。第18天(从第一次给药起)处死小鼠, 提取肿瘤, 绘制小鼠肿瘤体积生长曲线、小鼠体重变化曲线, 拍摄各组肿瘤照片, 并对各组小鼠肿瘤称重, 对肿瘤组织进行H & E染色。计算肿瘤体积(V, mm3), 公式如下:
| $ V = ({W^2} \times L)/2 $ | (3) |
其中, W和L分别为肿瘤的短径长(mm)和长径长(mm)。
统计学分析 应用SPSS15.0软件进行统计分析。所有实验均独立重复3次, 数据以x±s表示, 各组分别与对照组进行单因素方差分析。
结果 1 聚合物PELA和PBAE合成及表征 1.1 聚合物结构及分子量采用1H NMR法测定聚合物PELA、PBAE的结构及分子量。聚合物PELA的氢归属为: mPEG重复单元结构中δ (-OCH3) 3.4, δ (-O-CH2-CH2-O-) 3.6;聚乳酸重复单元结构中δ (-COO-CH-O-) 5.2, δ (-CH3-) 1.6。PELA-A中氢归属除了PELA结构中的质子外, 在δ5.5~7.0出现3个不同化学环境的质子峰, 分别为丙烯酰基上亚甲基(=CH2)和次甲基(-O-CO-CH=)上的氢。PBAE1和PBAE2的核磁谱图上丙烯酰基上的氢质子峰消失, 而在δ2.9附近出现2个峰, 分别为1-氨基-4-甲基哌嗪中的N-CH2-上的亚甲基质子峰和N-CH3上的甲基质子峰。
各聚合物分子量(M)的计算主要根据核磁谱图中氢的积分高度比与不同化学环境中氢质子的数目来确定。分子量计算根据公式:A5.2/A3.4=n/3(n为聚乳酸重复单元数), mPEG的分子量为2 000 Da, 可得出连接的聚乳酸重复单元数n=10, 聚乳酸重复单元M(PLA)=3×10×72=2 160 Da, 故M(PELA)=4 160 Da。同理, 利用δ 2.9处两个质子峰的积分高度也可计算出M(PBAE1)为4 945 Da, M(PBAE2)为5 244 Da。
1.2 聚合物pKb的测定采用酸碱滴定法测定聚合物pKb值。图 1为聚合物PELA、PBAE1和PBAE2的滴定曲线, PELA材料的滴定曲线较缓和, 而PBAE1、PBAE2两种材料的滴定曲线却显示出明显的滴定突变。随着NaOH加入量增加, 聚合物开始发生去质子化, 当NaOH继续增加, 聚合物去质子化完全, 曲线趋于平缓。对滴定曲线数据分析, 发现两种PBAE聚合的pKb均在6.5左右, 表明两种PBAE均具有pH敏感性。
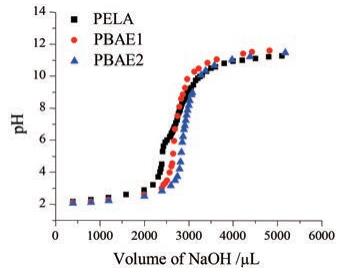
|
Figure 1 The acid-base titration curves of copolymers of PELA, PBAE1, and PBAE2 |
形成胶束的聚合物材料由亲水嵌段和疏水嵌段两部分组成。当聚合物的浓度达到一定值时, 就会自组装形成胶束, 以增加其在水溶液中的溶解度。芘不溶于水, 而聚合物材料可以增加芘在水溶液中的溶解度, 且不同聚合物对芘的增溶效果不尽相同。如图 2所示, 随着聚合物浓度增大芘的荧光强度增大, 最大吸收波长由334 nm向336 nm迁移, 利用荧光分光光度计扫描, 以I336/I334对聚合物浓度的对数作图, 以最小二乘法对图像拟合, 计算出PELA、PBAE1和PBAE2的CMC分别为1.1、3.0和0.8 μg·mL-1。

|
Figure 2 The critical micelle concentration (CMC) values of PELA, PBAE1 and PBAE2 copolymers |
胶束制备采用薄膜水化法, 操作方便, 可控性强。载药胶束粒度在10~100 nm之间, 3种胶束的载药量及包封率值无显著性差异, 结果见表 1。但在37 ℃条件下, 48 h后载药胶束PBAE2-DTX的粒度变化较大, 相比之下, PELA-DTX与PBAE1-DTX在48 h内较稳定, 粒径变化无统计学差异, 结果见图 3, 因此选择PELA-DTX与PBAE1-DTX两种胶束进行后续实验研究。DTX胶束的体外释放结果显示, 在pH 7.4条件下, 两种载药胶束48 h释放量无统计学差异, 而在pH 6.5条件下, PBAE1-DTX与PELA-DTX胶束48 h时最高释放率分别达到(89.7 ± 0.71)%和(75.7 ± 0.33)%, 且PBAE1-DTX释放速率更快(P < 0.05)[21]。
| Table 1 Characterization of docetaxel (DTX) loaded polymer micelles (n = 3, x±s). PDI: Polydispersity index; DL: Drug loading; EE: Encapsulation efficiency |
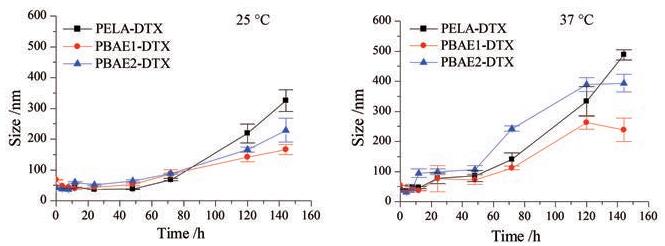
|
Figure 3 The stability of DTX loaded PELA and PBAEs micelles in pH 7.4 PBS at 25 ℃ and 37 ℃, respectively (n = 3, x±s) |
通过C57BL/6小鼠接种Lewis细胞建立小鼠肺癌移植瘤模型评价DTX纳米胶束的抗肿瘤活性, 结果见图 4。Saline组及各DTX胶束给药组中小鼠肿瘤体积随时间延长而增加。通过对不同治疗组小鼠肿瘤体积增长速率进行比较发现, 各组肿瘤生长率PBAE1-DTX 20 mg·kg-1 < PBAE1-DTX 10 mg·kg-1 < PELA-DTX 10 mg·kg-1 < DTX 10 mg·kg-1 < saline, 各给药组与saline组相比均能抑制肿瘤体积增长, 而PBAE1-DTX 20 mg·kg-1组的作用最为显著。在给药期间, 各组小鼠体重变化无显著差异, 与游离药组相比, 载药胶束组小鼠体重略有增加。图 5为各给药组小鼠处死后小鼠重量直观图及分析图, 通过比较各组肿瘤重量, 并采用SPSS15.0软件对各组数据对比发现:给药剂量为10 mg·kg-1时, 各组肿瘤重量为PBAE1-DTX < PELA-DTX < DTX, 并且3组数据之间具有显著性差异, 而PBAE1-DTX组的疗效更为显著。
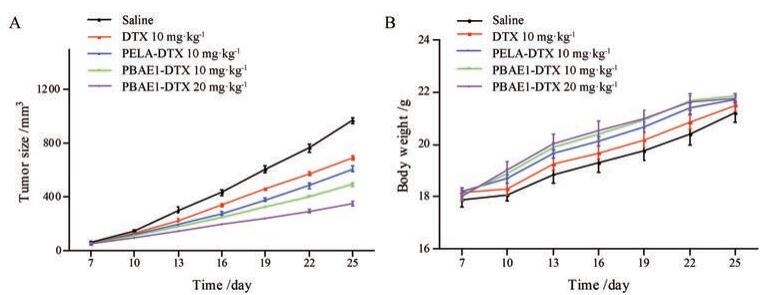
|
Figure 4 In vivo tumor inhibition studies.A:The sizes of mice Lewis tumor post treatment via i.v.administration.The injections were carried out at days 0, 3, 6, and 9;B: The body weight of mice in various groups after treatments (n=4, x±s) |
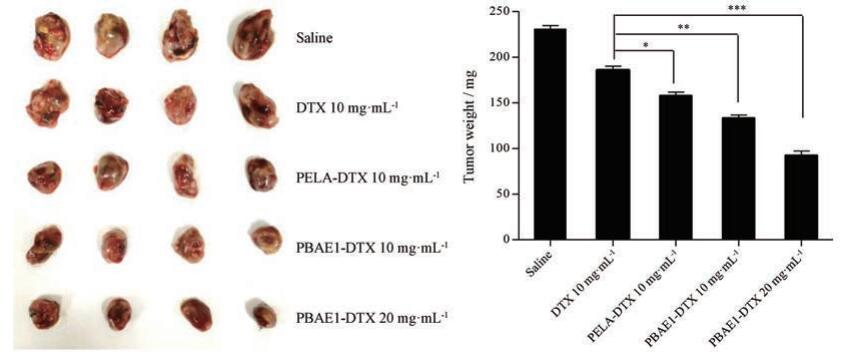
|
Figure 5 The weight of tumor tissues in different DTX formulation groups after treatments (n=4, x±s).*P < 0.05, **P < 0.01, ***P < 0.001 |
肿瘤组织取出后用10%多聚甲醛固定, 进行H & E染色, 荧光显微镜拍照, 如图 6所示, 肿瘤组织经H & E染色后, 细胞核及细胞质中嗜碱性物质呈蓝色, 而细胞浆为深浅不一的红色, 故各组织的病变可通过观察被染色的细胞形态来显示。由图可知, saline组肿瘤细胞排列紧密, 形态结构稳定, 而不同给药组中肿瘤细胞排列不再紧凑, 在最大给药剂量20 mg·kg-1时, 可明显看出PBAE1-DTX组肿瘤细胞大小不均, 胞浆呈红色, 且颜色较深, 说明细胞受损严重; 其他各低剂量(10 mg·kg-1)给药组也出现类似现象, 但细胞受损程度均低于PBAE1-DTX高剂量组, 表明PBAE1-DTX纳米胶束具有更强的抑瘤活性。
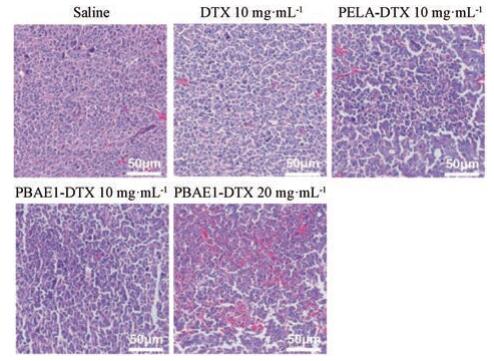
|
Figure 6 The histopathology graphs of Lewis tumors of C57BL/6 mice after treatment by various DTX formulations groups (tumors were isolated post 18 days of treatment) |
本研究采用开环聚合方法合成两亲性嵌段共聚物PELA, 在此基础上通过Michael加成引入含有胺基结构的聚-β-氨基酯, 获得pH敏感三嵌段聚合物PBAE。该聚合物材料的优势在于:①可通过物理包埋方式将药物包裹在胶束内核, 与外界环境隔离, 具有良好的稳定性; ②聚合物胶束表面的亲水基团能够减少血浆蛋白的吸附, 减少被网状内皮系统的吞噬, 延长药物在体内的循环时间, 提高生物利用度; ③该聚合物材料可对环境pH值的变化做出响应, 实现其响应性释放药物的目的[22]; ④聚合物链上有很多重复的酯键单元, 酯键在水中可以缓慢水解, 酸性条件下加速水解, 聚合物材料被水解成小分子排出体外, 具有较好的生物相容性。
本研究采用酸碱滴定法检测PELA、PBAE1和PBAE2的pH敏感性, 其中PELA材料也显示出一定的缓冲作用, 这主要源自于其结构中的酯键水解效应, 而PBAE1与PBAE2除了酯键外还有胺基基团可发生质子化效应, 因此显示出更好的缓冲作用, 这为药物在弱酸性条件下释放提供了可能[23]。CMC是用来评价聚合物材料形成胶束能力的一个参数, PELA、PBAE1和PBAE2的CMC均较低, 说明聚合物材料更易在低浓度下自发形成胶束, 有助于保持胶束在生理条件下的稳定性[24]。
本研究通过薄膜水化法制备了DTX聚合物胶束,方法简单可行。3种聚合物材料均显示出较高的载药量(5%左右), 载药胶束粒径为10~100 nm, 有利于载药胶束通过高渗透长滞留(EPR)效应聚集在肿瘤部位[25]。胶束在25 ℃和37 ℃两种条件的稳定性结果表明, 3种载药胶束在25 ℃条件下48 h内均能保持较稳定状态。而在37 ℃条件下, 载药胶束PBAE2-DTX的粒度变化较大, 可能原因是其疏水核较大, 由于聚-β-氨基酯嵌段的质子化作用引起的聚合物链之间的静电排斥效应使得胶束膨胀, 药物快速释放导致粒径增大。
2018年中国肿瘤登记中心数据显示, 肺癌在男性肿瘤患者中的发病率为29.28%, 在女性肿瘤患者中的发病率为22.96%, 肺癌具有高死亡率、高转移率和高复发率的特点[26], 目前临床上化疗仍是主要治疗手段之一, 但化疗患者会出现恶心呕吐、脱发、免疫功能下降、虚弱和疲劳乏力等综合征[27]。将多西紫杉醇纳米胶束通过静脉注射方式给药, 可望通过在肿瘤部位的增强聚集效应来达到靶向治疗肺癌的作用。本文制备的DTX纳米胶束抑制Lewis肺癌小鼠移植瘤活性研究结果表明, 在给药期间各组小鼠体重变化无显著性差异, 然而, 载药胶束组抑瘤作用明显强于游离药物组, 其原因可能是pH敏感DTX纳米胶束能够靶向肿瘤部位, 从而更好的发挥治疗作用[28]。H & E染色结果显示, saline组肿瘤细胞排列紧密, 形态结构稳定, 而不同给药组中肿瘤细胞排列不再紧凑, 并且各给药组肿瘤细胞大小不均, 胞浆被成片染成红色, 且颜色较深, 进一步说明pH敏感DTX纳米胶束能显著提高多西紫杉醇的抗肿瘤活性。然而, 本研究仍存在不足之处, 稳定性观察时间过短, 缺少对不同剂型药物的药代动力学分析等。对于能否通过改变疏水链和亲水链的长度以提高胶束的载药量和稳定性, 需进一步实验验证。另外, DTX载药胶束发挥抑瘤作用机制尚不明确, 还需进一步研究。
作者贡献:郝单丽、王杰为实验的主要完成人, 郝单丽撰写了本论文;谢冉、岳巧欣参与了动物实验工作; 易红对本文的实验设计提供了积极建议; 臧琛对本文进行了修改; 赵庆贺、陈燕军对本文进行修订并完成定稿。
利益冲突:本文作者声明无任何利益冲突。
| [1] |
Cao X. Research progress of docetaxel polymer micelles[J]. Chin New Drug J (中国新药杂志), 2017, 26: 1137-1143. |
| [2] |
Hua XM, Peng H, Wang JT, et al. Application effect of docetaxel in chemotherapy for advanced non-small cell lung cancer[J]. Chin Mod Med (中国当代医药), 2019, 26: 53-55. |
| [3] |
Chen Y, Li J, Chen S, et al. Nab-paclitaxel in combination with cisplatin versus docetaxel plus cisplatin as first-line therapy in non-small cell lung cancer[J]. Sci Rep, 2017, 7: 10760. DOI:10.1038/s41598-017-11404-9 |
| [4] |
Liang Z. Studies on the Anti-tumor Efficacy of the Docetaxel Targeting Nanoparticles for Small Cell Lung Cancer (多西紫杉醇靶向纳米药物对小细胞肺癌治疗作用的研究)[D]. Beijing: Peking Union Medical College, 2015.
|
| [5] |
Zhang W, Shi Y, Chen Y, et al. Enhanced antitumor efficacy by paclitaxel-loaded pluronic P123/F127 mixed micelles against non-small cell lung cancer based on passive tumor targeting and modulation of drug resistance[J]. Eur J Pharm Biopharm, 2010, 75: 341-353. DOI:10.1016/j.ejpb.2010.04.017 |
| [6] |
Huang RB, Tang GT. Progress in the study of acid-sensitive micelles for the targeting drug delivery system[J]. Acta Pharm Sin (药学学报), 2012, 47: 440-445. |
| [7] |
Kamaly N, Xiao Z, Valencia PM, et al. Targeted polymeric therapeutic nanoparticles:design, development and clinical translation[J]. Chem Soc Rev, 2012, 41: 2971-3010. DOI:10.1039/c2cs15344k |
| [8] |
Barreto JA, O'Malley W, Kubeil M, et al. Nanomaterials:applications in cancer imaging and therapy[J]. Adv Mat, 2011, 23: H18-H40. DOI:10.1002/adma.201100140 |
| [9] |
Doppalapudi S, Jain A, Domb AJ, et al. Biodegradable polymers for targeted delivery of anti-cancer drugs[J]. Expert Opin Drug Deliv, 2016, 13: 891-909. DOI:10.1517/17425247.2016.1156671 |
| [10] |
Nicolas J, Mura S, Brambilla D, et al. Design, functionalization strategies and biomedical applications of targeted biodegradable/biocompatible polymer-based nanocarriers for drug delivery[J]. Chem Soc Rev, 2013, 42: 1147-1235. DOI:10.1039/C2CS35265F |
| [11] |
Li WN, Xu Q, Wang YH, et al. Poly(β-amino esters)-based barriers for tumor targeted delivery system[J]. Acta Pharm Sin (药学学报), 2015, 50: 434-439. |
| [12] |
Zhang C, An T, Wang D, et al. Stepwise pH-responsive nanoparticles containing charge-reversible pullulan-based shells and poly(β-aminoester)/poly(lactic-co-glycolic acid) cores as carriers of anticancer drugs for combination therapy on hepatocellular carcinoma[J]. J Control Release, 2016, 226: 193-204. DOI:10.1016/j.jconrel.2016.02.030 |
| [13] |
Wang W, Xiong W, Wan JL, et al. The decrease of PAMAM dendrimer-induced cytotoxicity by PEGylation via attenuation of oxidative stress[J]. Nanotechnology, 2009, 20: 105103. DOI:10.1088/0957-4484/20/10/105103 |
| [14] |
Patil ML, Zhang M, Minko T. Multifunctional triblock nanocarrier (PAMAM-PEG-PLL) for the efficient intracellular siRNA delivery and gene silencing[J]. ACS Nano, 2011, 5: 1877-1887. DOI:10.1021/nn102711d |
| [15] |
Song W, Tang Z, Li M, et al. Tunable pH-sensitive poly(β-amino ester)s synthesized from primary amines and diacrylates for intracellular drug delivery[J]. Macromol Biosci, 2012, 12: 1375-1383. DOI:10.1002/mabi.201200122 |
| [16] |
Hrkach J, Von Hoff D, Ali MM, et al. Preclinical development and clinical translation of a PSMA-targeted docetaxel nanoparticle with a differentiated pharmacological profile[J]. Sci Transl Med, 2012, 4: 128-139. |
| [17] |
Von Hoff DD, Mita MM, Ramanathan RK, et al. Phase I study of PSMA-targeted docetaxel-containing nanoparticle BIND-014 in patients with advanced solid tumors[J]. Clin Cancer Res, 2016, 22: 3157-3163. DOI:10.1158/1078-0432.CCR-15-2548 |
| [18] |
Du LJ, Yue QX, Li ZZ, et al. Preparation of paclitaxel-loaded copolymer micelles and its pH-responsive properties[J]. Chin J Exp Trad Med Form (实验方剂学杂志), 2015, 9-12. |
| [19] |
Chen YJ, Yue QX, De GJ, et al. Inhibition of breast cancer metastasis by paclitaxel-loaded pH responsive poly (β-amino ester) copolymer micelles[J]. Nanomedicine, 2017, 12: 147. DOI:10.2217/nnm-2016-0335 |
| [20] |
Li S, Xiao YY, Su ZG, et al. Preparation of BSA-coated cationic nanostructure lipid carries and pharmacokinetics and biodistribution after intravenous injection[J]. J China Pharm Univ (中国药科大学学报), 2012, 43: 406-411. |
| [21] |
Wang YJ, Wang J, Hao DL, et al. Preparation of docetaxel-loaded nanomicelles and their anti-Lewis lung cancer effect in vitro[J]. China J Chin Mater Med (中国中药杂志), 2019, 44: 2251-2259. |
| [22] |
Ma YY, Li L, Huang HF, et al. Advances of tumor targeting peptides drug delivery system with pH-sensitive activities[J]. Acta Pharm Sin (药学学报), 2016, 51: 717-724. |
| [23] |
Kamat CD, Shmueli RB, Connis N, et al. Poly(β-amino ester) nanoparticle delivery of TP53 has activity against small cell lung cancer in vitro and in vivo[J]. Mol Cancer Ther, 2013, 12: 405-415. DOI:10.1158/1535-7163.MCT-12-0956 |
| [24] |
Jia L, Qiao MX, Hu HY, et al. The characteristics of temperature/pH sensitive block copolymer micelles in vitro[J]. Acta Pharm Sin (药学学报), 2011, 46: 839-844. |
| [25] |
Maeda H, Wu J, Sawa T, et al. Tumor vascular permeability and the EPR effect in macromolecular therapeutics:a review[J]. J Control Release, 2000, 65: 271-284. DOI:10.1016/S0168-3659(99)00248-5 |
| [26] |
Gebauer F, Gelis S, Zander H, et al. Tenascin-C serum levels and its prognostic power in non-small cell lung cancer[J]. Oncotarget, 2016, 7: 20945. DOI:10.18632/oncotarget.7976 |
| [27] |
Sriraman SK, Aryasomayajula B, Torchilin VP. Barriers to drug delivery in solid tumors[J]. Tissue Barriers, 2014, 2: e29528. DOI:10.4161/tisb.29528 |
| [28] |
Wang J, Wang YJ, Hao DL, et al. Pharmacokinetics and tumor tissue distribution of docetaxel nanomicelles in mice[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2019, 25: 140-145. |
 2020, Vol. 55
2020, Vol. 55


