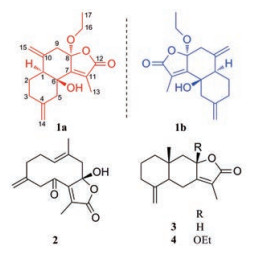
宽叶金粟兰(Chloranthus henryi Hemsl.)为金粟兰科金粟兰属植物, 民间多以全草入药, 广泛用于治疗跌打损伤、瘀血肿痛、风湿性关节炎等疾病[1]。宽叶金粟兰在江西有着广泛的分布, 药用植物资源种类丰富、蕴藏量大, 被《全国中草药汇编》和《江西省中药材标准》(1996年版、2014年版)收录, 作为多种中药制剂的原料药应用[2], 如江西省中药企业生产的“钻山风糖浆”、“钻山风合剂”处方中, 宽叶金粟兰为其主要药味。然而目前对宽叶金粟兰的药效物质基础研究不够深入[3], 严重影响了这一具有江西特色中药材的应用开发。本课题组在前期工作中, 从宽叶金粟兰分离得到了一系列倍半萜、倍半萜二聚体和二萜类化合物, 通过药理研究显示部分化合物具有较好的神经保护和抗乳腺癌转移等活性[4-7]。为了拓展宽叶金粟兰化学物质基础范围, 补充和完善其生物活性研究内容, 为创新药物的研发提供先导化合物和江西特色中药资源的开发提供科学资料。本实验运用硅胶柱色谱、MCI柱色谱、Sephadex LH-20凝胶柱色谱、制备液相和手性拆分等多种色谱技术对宽叶金粟兰乙醇提取物进行分离纯化。从中分离得到5个倍半萜类化合物, 并应用波谱学方法(MS、IR、NMR)和单晶X射线衍射对分离得到的化合物结构进行了鉴定, 分别鉴定为: (1S, 6S, 8R)-8-ethoxychlomultin C (1a)、(1R, 6R, 8S)-8-ethoxychlomultin C (1b)、(+)-phaeocaulin D (2)、白术内酯Ⅰ (3)和8-β-ethoxyasterolid (4) (图 1)。其中化合物1a和1b为1对新的倍半萜对映体, 化合物2~4为首次从宽叶金粟兰中分离得到。在10 μmol·L-1浓度下, 化合物1a、1b、2和3使H2O2损伤的PC12细胞的细胞存活率从(43.41 ± 1.59) %分别提高到(61.71 ± 7.56) %、(66.05 ± 5.61) %、(74.34 ± 3.32) %和(69.58 ± 5.02) %。
|
Figure 1 Sesquiterpene lactones from the roots of Chloranthus henryi |
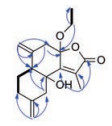
化合物1 白色针状结晶(甲醇), [α] ≈ 0 (c 0.1, CH3OH), HR-TOF-MS给出准分子离子峰m/z 291.160 2 [M+H]+ (calcd. for C17H23O4, 291.159 6), 结合1H NMR和13C NMR推测化合物1的分子式是C17H22O4。通过IR图谱中3 527、3 089、1 765和1 386 cm-1等信号推断化合物中存在着羟基、双键、羰基和甲基等官能团。1H NMR (600 MHz, CDCl3)显示有2个甲基信号δ 1.22 (3H, t, J = 6.6 Hz, 17-CH3)、2.06 (3H, s, 13-CH3)。有4个烯氢信号δ 5.00 (1H, s, H-15a)、4.90 (1H, s, H-15b)、4.98 (1H, s, H-14a)、4.84 (1H, s, H-14b) (表 1)。13C NMR (150 MHz, CDCl3)显示17个碳信号, 其中有2个甲基碳信号δ 9.8 (C-13)、15.4 (C-17)。同时可以看到有1个酯羰基碳信号171.7 (C-12), 6个烯碳信号143.0 (C-4)、112.1 (C-14)、159.7 (C-7)、129.7 (C-11)、141.4 (C-10)、113.8 (C-15), 1个缩酮碳信号105.8 (C-8)和1个连氧取代碳信号71.6 (C-6)。结合碳信号δ 159.7 (C-7)、105.8 (C-8)、129.7 (C-11)、171.7 (C-12)、9.8 (C-13)的出现推断化合物中可能存在13-甲基-8, 12-α, β-五元不饱内酯环片段。1H-1H COSY谱(图 2)中显示了H-16 (δH 3.53~3.32)与H-17 (δH 1.22)之间的相关, 说明结构中有一个乙氧基的存在。同时显示了H-1/H-2/H-3之间的相关。
|
Figure 2 1H-1H COSY and key HMBC correlations of compound 1 |
| Table 1 1H NMR (600 MHz, CDCl3) and 13C NMR (150 MHz, CDCl3) data of compound 1 (J in Hz) |
HMBC谱中, 通过H-14 (δH 4.98, 4.84)与33.8 (C-3)、143.0 (C-4)、44.4 (C-5)之间的相关和H-15 (δH 5.00, 4.90)与41.7 (C-9)、45.4 (C-1)、141.4 (C-10)之间的相关确定了两个末端双键的连接位置。通过H-13 (δH 2.06)与159.7 (C-7)、129.7 (C-11)、171.7 (C-12)、71.6 (C-6)、105.8 (C-8)之间的相关进一步确证了α, β-五元不饱内酯环的存在。通过H-16 (δH 3.53~3.32)与105.8 (C-8)之间的相关推断乙氧基连接在C-8。基于以上信息并结合文献推断化合物1为8位连有乙氧基的杜松烷型倍半萜内酯类, 与chlomultin C类似[8]。
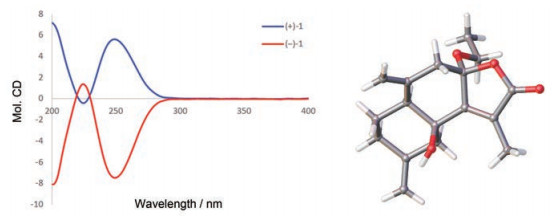
但是该化合物的比旋光度值比较小, 而且ECD图谱中Cotton效应较弱, 推测化合物1可能为消旋体。通过手性柱HPLC分析, 显示峰面积接近1:1的两个峰, 这确证了该化合物为外消旋体。用半制备手性柱HPLC进行拆分, 分别得到1a: [α] +62.0 (c 0.1, CH3OH), ECD图谱在225 nm处(Δε = -0.40)呈现负的Cotton效应, 在249 nm处(Δε = +5.63)呈现正的Cotton效应; 1b: [α] -82.0 (c 0.1, CH3OH); ECD图谱在224 nm处(Δε = +1.39)显示正的Cotton效应, 在249 nm处(Δε = -7.45)显示负的Cotton效应。二者的ECD图谱呈镜像关系(图 3), 说明确为一对对映异构体。通过X单晶衍射的方法对其绝对构型进行了确证(CCDC: 1994887), 1a的结构为(1S, 6S, 8R)-8-ethoxychlomultin C, 而1b的结构为(1R, 6R, 8S)-8-ethoxychlomultin C。
|
Figure 3 ECD spectra of 1a/1b (left) and crystal structure of 1a (right) |
化合物2~4为已知化合物, 经核磁波谱分析并与文献数据进行比较, 鉴定为(+)-phaeocaulin D (2)[9]、白术内酯Ⅰ (3)[10]和8-β-ethoxyasterolid (4)[11]。
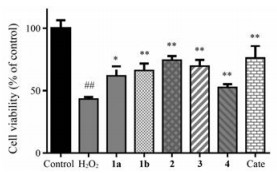
2 活性评价采用H2O2损伤的PC12细胞模型对分离鉴定的化合物进行了神经保护活性评价。在10 μmol·L-1浓度下, 化合物1a、1b、2~4使细胞存活率从(43.41 ± 1.59) %分别提高到(61.71 ± 7.56) %、(66.05 ± 5.61) %、(74.34 ± 3.32) %和(69.58 ± 5.02) %, 阳性对照药儿茶素在50 μmol·L-1浓度下的细胞生存率为(76.18 ± 9.80) % (图 4)。结果表明所分离鉴定的倍半萜内酯类化合物均表现出一定的神经保护活性。
|
Figure 4 Neuroprotective effects of compounds 1-4 (10 μmol·L-1) on H2O2 damaged PC12 cells. Catechin hydrate (Cate, 50 μmol·L-1) were used as the positive controls. Results were obtained from three independent experiments and were expressed as the mean ± SD. ##P < 0.01 vs control; *P < 0.05, **P < 0.01 vs model |
JASCO P2000型旋光仪(日本JASCO公司); JASCO J-815型圆二色谱仪; Nicolet impact 5700型傅里叶变换红外光谱仪(美国Thermo Electron Corporation公司); Agilent 1100系列LC/MSD离子阱质谱仪; Bruker AVANCE Ⅲ HD 600 MHz型核磁共振波谱仪; 薄层色谱硅胶GF254和柱色谱用硅胶(100~200目, 200~300目)均为青岛海洋化工厂产品; 葡聚糖凝胶Sephadex LH-20为Amersham Pharmacia Biotech公司产品; Buchi R-200型旋转蒸发仪; Waters 2695-2998型高效液相; Waters 515型制备液相; YMC-Pack ODS-A C18 (20 mm×250 mm, 5 μm), 分析型反相色谱柱: Kromasil 100A C18 (4.6 mm×150 mm, 5 μm); 手性半制备柱: Daicel Chiralpak AD-H (10 mm×250 mm, 5 μm); 所用试剂均为分析纯或色谱纯。
药材于2014年10月采自江西井冈山市, 由江西中医药大学邓可众教授鉴定为金粟兰科金粟兰属植物宽叶金粟兰Chloranthus henryi Hemsl., 凭证标本保存于江西中医药大学中药化学科研室(20141012)。
1 提取分离干燥的宽叶金粟兰根(13 kg)切碎后用95%乙醇冷浸提取3次, 每次浸泡7天。合并提取液减压回收后得浸膏404 g, 经过硅胶(100~200目)柱色谱, 分别用石油醚、氯仿、乙酸乙酯、丙酮、甲醇洗脱, 减压回收溶剂后得到石油醚部位2 g、氯仿部位80 g、乙酸乙酯部位88 g、丙酮部位62 g、甲醇部位161 g。氯仿部位80 g经硅胶柱色谱分离(石油醚-乙酸乙酯, 20:1~0:1)为洗脱剂梯度洗脱, 得到6个组分A~F。组分A (31 g)经硅胶柱色谱(石油醚-丙酮, 40:1~1:1), TLC分析合样, 得到5个组分A1~A5。组分A3 (6 g)经凝胶柱色谱和制备液相分离, 得到化合物3 (15 mg)。组分A4 (6 g)经MCI柱色谱和制备液相分离, 得到化合物1 (8 mg)、2 (13 mg)和4 (22 mg)。化合物1经手性半制备柱(正己烷-异丙醇, 40:1, 流速1 mL·min-1)分离得到(+)-1 (tR=17.27 min)和(-)-1 (tR=19.70 min)。
2 结构鉴定化合物1 无色针状结晶(CH3OH); mp 168~169 ℃; IR (microscope) νmax 3 528, 3 090, 2 980, 2 949, 1 766, 1 647, 1 435, 1 386, 1 303, 1 243, 1 196, 1 113 cm-1; HR-TOF-MS m/z 291.160 2 [M+H]+ (计算值291.159 6); 1H NMR和13C NMR数据见表 1。1a: [α] +62.0 (c 0.1, CH3OH); ECD (MeOH) λmax (Δε) 225 (-0.40), 249 (+5.63)。1b: [α] -82.0 (c 0.1, CH3OH); ECD (MeOH) λmax (Δε) 224 (+ 1.39), 249 (-7.45)。
化合物1 为无色针状结晶(甲醇), 分子式为C17H22O4, M = 290.35, 单斜晶系, 晶胞参数为a = 12.827 2 (3) Å, b = 9.330 0 (2) Å, c = 12.841 4 (3) Å, β = 101.947 (2)°, U = 1 503.54 (6) Å 3, T = 108.0 (10), 空间群为P21/c (no. 14), Z = 4, μ (Cu Kα) = 0.734, 收集衍射点数为7 114, 独立衍射点数2 862 (Rint = 0.028 7), wR (F2)为0.116 8。
3 神经保护活性研究取对数生长期的PC12细胞以每毫升1×104个细胞的浓度接种于96孔培养板中, 每孔加入100 μL细胞混悬液, 每组设3个以上复孔。设空白组、对照组、H2O2损伤组、给药组和阳性药对照组, 给药组每孔加入10 μmol·L-1浓度的化合物, 各加10 μL, 其他组加入等体积的培养基。阳性药组加入等量的儿茶素(50 μmol·L-1), 其他组加入等体积的培养基。同时H2O2损伤组、给药组和阳性药对照组每孔加入终浓度为500 μmol·L-1的H2O2, 共孵育24 h, 之后加入5 μL浓CCK8继续培养2 h, 酶标仪测450 nm处OD值。根据吸光值计算细胞存活率, 公式为:细胞生存率= (OD给药-OD空白)/(OD对照-OD空白)×100%[12-14]。
作者贡献:陈芳有负责完成实验的设计、实验的实施和文章的撰写; 李宏焘参与实施实验和数据分析; 陈杰负责数据的分析和审阅文章; 双鹏程主要负责实验数据的采集、分析; 罗永明为实验提供指导、设计方案并对文章进行了审阅。
利益冲突:所有作者申明无任何利益冲突。
| [1] |
Jiangsu New Medical College. Dictionary of Traditional Chinese Medicine (中药大辞典)[M]. Shanghai: Shanghai Science and Technique Publishing House, 1977: 652.
|
| [2] |
Liu Y, Zhang Q, Peng YJ, et al. Pharmacognostical study on four origin plants of folk medicine Sikuaiwa[J]. China J Chin Mater Med (中国中药杂志), 2015, 40: 4177-4181. |
| [3] |
Zhang ML, Liu D, Fan GQ, et al. Constituents from Chloranthaceae plants and their biological activities[J]. Heterocycl Commun, 2016, 22: 175-220. |
| [4] |
Li CJ, Zhang DM, Luo YM. Studies on the chemical constituents from the roots of Chloranthus henryi[J]. Acta Pharm Sin (药学学报), 2005, 40: 525-528. |
| [5] |
Chen FY, Li HT, Li CJ, et al. Neuroprotective racemic germacranolides from the roots of Chloranthus henryi[J]. Fitoterapia, 2020, 141: 104472. DOI:10.1016/j.fitote.2020.104472 |
| [6] |
Zhang SS, Fu JJ, Chen HY, et al. Sesquiterpenes with anti-metastasis breast cancer activity from Chloranthus henryi[J]. China J Chin Mater Med (中国中药杂志), 2017, 42: 3938-3944. |
| [7] |
Li CJ, Zhang DM, Luo YM, et al. Bis-sesquiterpenes and diterpenes from Chloranthus henryi[J]. Phytochemistry, 2008, 69: 2867-2874. DOI:10.1016/j.phytochem.2008.08.022 |
| [8] |
Zhang S, Su ZS, Yang SP, et al. Four sesquiterpenoids from Chloranthus multistachys[J]. J Asian Nat Prod Res, 2010, 12: 522-528. DOI:10.1080/10286020.2010.492599 |
| [9] |
Xia GY, Sun DJ, Ma JH, et al. (+)/(-)-Phaeocaulin A-D, four pairs of new enantiomeric germacrane-type sesquiterpenes from Curcuma phaeocaulis as natural nitric oxide inhibitors[J]. Sci Rep, 2017, 7: 43576. DOI:10.1038/srep43576 |
| [10] |
Dong HY, He LC, Huang M, et al. Anti-inflammatory components isolated from Atractylodes macrocephala Koidz[J]. Nat Prod Res, 2008, 22: 1418-1427. DOI:10.1080/14786410801931629 |
| [11] |
Chen ZL. The acetylenes from Atractylodes macrocephala[J]. Plant Med, 1987, 53: 493-494. DOI:10.1055/s-2006-962780 |
| [12] |
Chen FY, Li CJ, Ma J, et al. Neuroprotective dihydroagarofuran sesquiterpene derivatives from the leaves of Tripterygium wilfordii[J]. J Nat Prod, 2018, 81: 270-278. DOI:10.1021/acs.jnatprod.7b00615 |
| [13] |
Chen BY, Yue RC, Yang YG, et al. Protective effects of (E)-2-(1-hydroxyl-4-oxocyclohexyl) ethyl caffeine against hydrogen peroxide-induced injury in PC12 cells[J]. Neurochem Res, 2015, 40: 531-541. DOI:10.1007/s11064-014-1498-5 |
| [14] |
Zhang W, Song JK, Zhu XY, et al. Isorhamnetin activates Sirt1/PGC-1α signaling pathway to inhibit MPP+-induced SH-SY5Y cell injury[J]. Acta Pharm Sin (药学学报), 2019, 54: 1976-1981. |
 2020, Vol. 55
2020, Vol. 55


