顺铂(cisplatin, CP)是一种无机铂衍生物, 具有非常好的抗癌作用, 与多种抗肿瘤药物有协同作用, 临床广泛用于治疗各种癌症, 包括膀胱癌、卵巢癌、肺癌和睾丸癌等[1]。因顺铂能有效减缓癌症的生长、无交叉耐药, 是目前最常用最有效的化疗药物之一[2, 3]。肾毒性是限制顺铂临床应用的主要因素之一, 30%使用顺铂的患者受其影响[4]。顺铂的临床疗效与其剂量呈正相关, 肾损伤也呈剂量依赖性[5]。顺铂引起肾损伤的机制涉及到很多方面, 包括细胞毒作用、氧化应激、细胞凋亡和炎症反应等[6, 7]。顺铂主要由肾脏排出, 通过位于肾小管细胞基底外侧的有机阳离子转运体在肾近端肾小管细胞中蓄积, 进而导致肾小管细胞死亡[8, 9]。管状损伤的核心是线粒体功能失调。越来越多的证据表明, 顺铂聚集在肾近端小管细胞的线粒体中, 破坏线粒体氧化还原平衡, 最终导致线粒体功能障碍[10]。最近的研究[11]报道, 线粒体功能受损不仅会损害细胞的能量代谢, 还会导致线粒体碎片化和过量产生线粒体活性氧(reactive oxygen species, ROS), 从而决定了顺铂诱导的急性肾损伤动物管状上皮细胞损伤的程度。
羟苯磺酸钙(calcium dobesilate, CaD)是一种微血管保护剂, 可以明显降低糖尿病肾病和非糖尿病肾病患者的尿蛋白、血肌酐(serum creatinine, Scr)及尿素氮(blood urea nitrogen, BUN)水平, 改善肾功能, 近年来已广泛应用于糖尿病肾病和慢性间质性肾炎等的治疗[12]。研究发现, CaD具有抑制细胞凋亡和炎症因子的作用[13], 能不同程度改善庆大霉素、妥布霉素和造影剂等药物引起的肾损伤, 这种肾脏保护作用可能归因于其抗氧化的性质[14-16]。此外, 有研究表明, CaD可以通过调控bcl-2和p53表达有效抑制原发性静脉曲张静脉血管壁细胞凋亡[17]。本文旨在探讨CaD对顺铂所致肾损伤的可能保护作用及其机制, 为临床安全合理用药提供参考。
此外, 本研究还检测了中性粒细胞明胶酶相关载脂蛋白(neutrophil gelatinase associated lipocalin, NGAL)和肾损伤因子1 (kidney injury molecule-1, KIM-1)肾损伤早期生物标志物。NGAL是一种小分子循环蛋白, 其最初发现于成熟的中性粒细胞中。研究发现, NGAL在血浆和尿液中均可被检测出, 能够用于早期预测急性肾损伤(acute kidney injury, AKI)及其严重程度。NGAL在AKI早期即可高表达于受损的肾脏组织, 属于敏感度较高的早期AKI标志物[18]。KIM-1是一种1型跨膜糖蛋白, 其基因或蛋白的表达在健康肾脏或尿液中无法检测到, 但在缺血性或中毒性肾损伤后, 其在近端小管细胞的顶端膜中快速表达。急性肾小管坏死患者尿中可检测到KIM-1, 可作为AKI患者肾近端小管损伤及不良临床结局(死亡及需要透析)的有用生物标志物[19]。对早期生物标志物的研究旨在为临床早期诊断和早期干预提供科学依据。
材料与方法细胞类型 人肾近端小管上皮细胞(HK-2, 美国菌种保藏中心)。
药品与试剂 RPMI 1640培养基、蛋白预染Marker (Thermo Scientific, 中国); 胎牛血清(HyClone, 美国); 0.25%胰酶(上海碧云天生物技术有限公司); 顺铂(上海希格玛高技术有限公司); 羟苯磺酸钙(Selleck, 中国); Annexin V-FITC/PI试剂盒(G003-1-3, 南京建成生物工程研究所); 线粒体膜电位检测试剂盒(BB-4105)、总活性氧检测试剂盒(BB-47049) (上海BestBio贝博生物); NGAL ELISA试剂盒、KIM-1 ELISA试剂盒(上海圆创生物科技有限公司)。
仪器 倒置显微镜(Olympus日本, IX71);低速离心机(上海卢湘仪离心机仪器有限公司, TDZ4B-WS); 流式细胞仪(BD-FACSVerse); 酶标检测仪(Thermo Scientific, 中国, MK3);一体式化学发光成像仪(ChemiScope, 上海, 5300 Pro); 电泳仪(美国BIO-RAD mini protean 3 cell)。
细胞培养及实验分组 取HK-2加入RPMI 1640完全培养基中, 并置于37 ℃、5% CO2恒温培养箱中常规培养。每隔1~2天更换培养基, 每隔4~5天用胰酶常规消化传代。取处于对数生长期生长良好的细胞进行后续实验。细胞实验分为A、B、C和D组。A组: HK-2 +无血清培养液; B组: HK-2 +顺铂(5 μg·mL-1); C组: HK-2 + CaD (200 μmol·L-1) +顺铂(5 μg·mL-1); D组: HK-2 + CaD (200 μmol·L-1)。C和D组分别在细胞融合增长到80%时加入相应浓度的CaD; A和B组给予等量的无血清培养基代替; 2 h后将顺铂(5 μg·mL-1)加入到B和C组。
CCK-8法检测细胞增殖 取对数生长期细胞经胰酶消化后接种于6孔板, 按照各组方法处理后, 向每孔加入CCK-8溶液10 μL, 置于37 ℃、5% CO2恒温培养箱中继续孵育2 h。用酶联免疫检测仪测定各孔在450 nm波长处的吸收度(A)值, 计算细胞的相对活力。每组设置3个复孔, 取测定结果均值, 实验重复6次。计算公式如下:
| $ {\rm{CV = (\% )(}}{A_{\rm{加药}}}{\rm{ - }}{A_{\rm{空白}}}{\rm{/}}{A_{\rm{未加药}}}{\rm{ - }}{A_{\rm{空白}}}{\rm{)}} \times {\rm{100\% }} $ | (1) |
其中, CV:细胞活力; A加药:加细胞、CCK溶液和药物溶液的吸收度值; A空白:加培养基和CCK溶液而没有细胞的吸收度值; A未加药:加细胞、CCK溶液而没有加药物的吸收度值。
流式细胞仪检测细胞凋亡 各组给予顺铂24 h后用不含乙二胺四乙酸的胰酶消化, 在室温下1 500 r·min-1离心5 min, 收集细胞; 用预冷至4 ℃的磷酸缓冲盐溶液(phosphate buffer saline, PBS)重悬细胞1次, 于1 500 r·min-1离心5 min, 洗涤细胞, 加入300 µL Binding Buffer悬浮细胞, 加入5 µL Annexin V-FITC后混匀, 避光, 室温孵育15 min; 再加入碘化丙啶(propidium iodide, PI) 10 µL染色, 将细胞轻轻混匀, 于室温避光条件下孵育10 min。用流式细胞仪检测, 并用CELLQuest软件分析。凋亡率是将AnnexinV+PI-和AnnexinV+PI+两个象限的细胞相加, 计算总细胞数的比例。
线粒体膜电位(mitochondrial membrane potential, MMP) 检测在室温条件下, 于1 500 r·min-1离心5 min后收集各组细胞, 细胞数控制在(2~5)×105个, PBS洗涤细胞2次, 1 500 r·min-1离心5 min收集细胞。用JC-1染色工作液500 µL将细胞重悬, 于37 ℃、5% CO2恒温培养箱孵育15~30 min, 4 ℃、800 r·min-1离心收集细胞, 用冷PBS洗涤细胞2次, 然后用PBS 500 µL将细胞重悬, 流式细胞仪检测结果。
ROS检测 按照1:1 000~1:2 000比例用无血清培养基稀释荧光染料DCFH-DA (2, 7-dichlorodi-hydrofluoresceindiacetate), 去除细胞培养基后用PBS洗涤细胞1次, 再加入适当体积稀释过的DCFH-DA, 加入量以能充分盖住细胞为宜, 通常在6孔板的1个孔加入稀释好的DCFH-DA的体积不少于1 mL; 于37 ℃避光孵育20 min, 用无血清细胞培养基洗涤细胞3次, 以充分去除未进入细胞内的DCFH-DA, 用荧光显微镜拍照观察实验结果。
蛋白表达检测 加RIPA裂解液提取各组蛋白样品, 并用BCA蛋白定量试剂盒进行蛋白定量。调整A、B、C和D组上样量25 μg, 于98 ℃水浴变性5 min。十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis, SDS-PAGE)后转移蛋白至PVDF膜, 加5%脱脂牛奶室温封闭1 h, 此后分别加入不同的待测Ⅰ抗, 4 ℃孵育过夜, TBST洗涤5 min共3次; 加入抗HRP标记的山羊抗兔II抗, 室温孵育1 h, TBST洗涤10 min, 共3次。于暗室中将PVDF膜的蛋白面浸入ECL (electrochemiluminescence)发光液中激发荧光, 经压片、显影及定影后对蛋白条带行灰度分析。
ELISA检测上清KIM-1和NGAL含量 按照试剂盒使用说明书操作, 450 nm波长依序测量各孔的A值。
数据分析 采用Excel软件进行数据统计分析。所有数据均用
取不同浓度50、100、200、400、800、1 600和3 200 μmol·L-1 CaD溶液加入HK-2细胞悬液作用24 h, 测得A值分别为0.45 ± 0.03、0.46 ± 0.05、0.56 ± 0.05、0.49 ± 0.05、0.48 ± 0.05、0.46 ± 0.04和0.41 ± 0.07。当浓度 < 200 μmol·L-1时, 活细胞数量随着CaD浓度增加而增加; 当浓度为200 μmol·L-1时, 细胞活力为69.48% (P < 0.05);当浓度 > 200 μmol·L-1时, 活细胞数量反而随着浓度的增加而减少(图 1)。结果显示, CP可以抑制细胞增殖, 而CaD能够减轻这种抑制作用, 且浓度为200 μmol·L-1时效果最为显著。
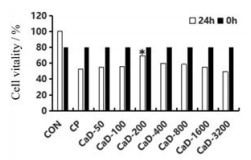
|
Figure 1 Effect of calcium dobesilate (CaD) on proliferation of human proximal tubular epithelial cells (HK-2). n = 6, |
为了研究CaD对CP所致细胞凋亡的影响, AnnexinV/PI染色后流式细胞仪检测凋亡率。用流式细胞术检测凋亡结果显示, CaD+CP组细胞凋亡率为12.30%, 与CP组(21.91%)相比细胞凋亡率明显下降(图 2)。结果说明, CaD能够抑制顺铂导致的细胞凋亡(P < 0.05)。
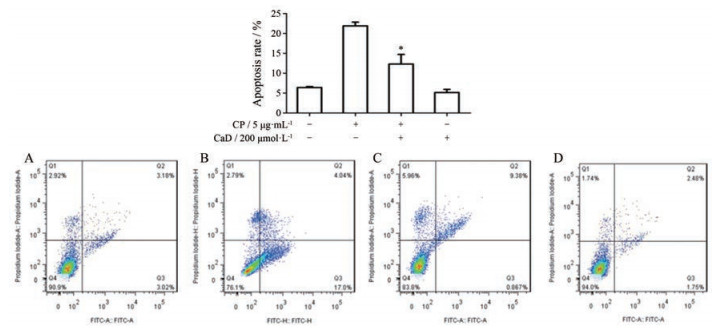
|
Figure 2 Effect of CaD on apoptosis of HK-2. A: Control; B: 5 μg·mL-1 CP; C: 200 μmol·L-1 CaD + 5 μg·mL-1 CP; D: 200 μmol·L-1 CaD. n = 3, |
线粒体在细胞凋亡的过程中起着枢纽作用, 多种细胞凋亡刺激因子均可诱导不同的细胞发生凋亡。已有研究表明顺铂能导致细胞凋亡, 表现为线粒体膜电位降低。流式图结果显示, 与CP组相比, CaD组的线粒体膜电位降低的细胞比例显著下降(P < 0.01, 图 3)。结果说明CaD能够显著抑制由顺铂引起的细胞凋亡。
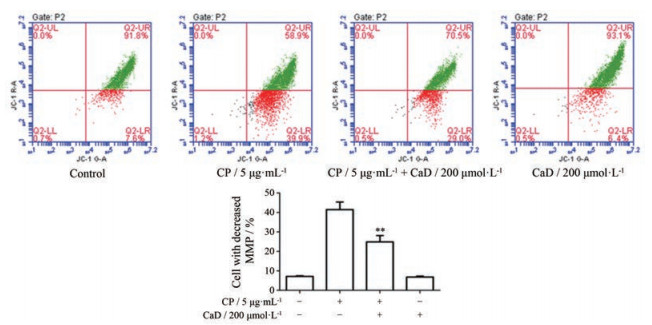
|
Figure 3 Effect of CaD on mitochondrial membrane potential. MMP: Mitochondrial membrane potential. n = 3, |
与对照组相比, 顺铂用于细胞后ROS水平显著上升, 而CaD能够抑制ROS水平的变化(P < 0.01, 图 4)。结果提示CaD可以减轻氧化应激反应。
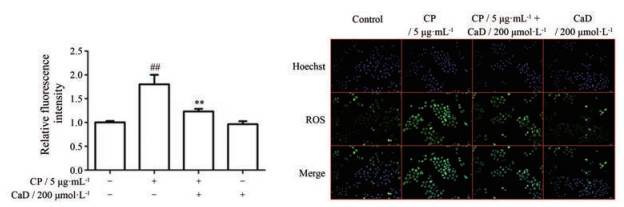
|
Figure 4 Effect of CaD on the level of reactive oxygen species (ROS). The fluorescence intensity can reflect ROS level. The stronger the fluorescence, the higher the ROS level. n = 3, |
与无血清培养液组相比, 顺铂组bax、caspase-3和p53蛋白表达水平显著升高, bcl-2蛋白表达水平显著降低; 相较于顺铂组, CaD+顺铂组在使用CaD后p53、caspase-3、bax的蛋白表达水平显著下降(P < 0.01), bcl-2水平显著升高(P < 0.01)。Bax、bcl-2和caspase-3等蛋白的变化结果(图 5)提示, CaD可能是通过caspase信号通路抑制顺铂诱导的HK-2凋亡。
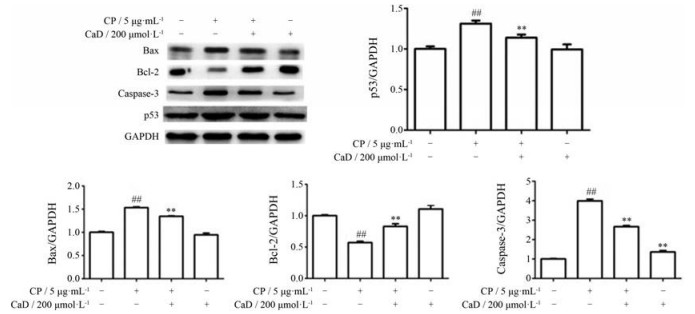
|
Figure 5 Effect of CaD on caspase pathway related protein and apoptosis related protein expression. HK-2 cells were pretreated with 200 μmol·L-1 CaD for 26 h. n = 3, |
KIM-1和NGAL作为顺铂引起的急性肾损伤的早期生物标志物, ELISA检测结果显示, 与无血清培养液组相比, 顺铂导致HK-2上清中KIM-1和NGAL含量升高, 而CaD能降低细胞上清中NGAL和KIM-1的含量(P < 0.01, 图 6)。结果说明, CaD对于顺铂引起的急性肾损伤可能会有一定作用。后续动物实验将进一步验证。
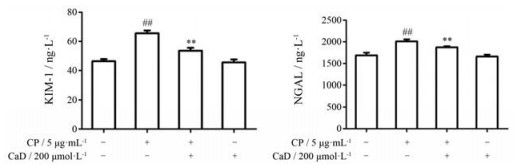
|
Figure 6 Effect of CaD on kidney injury molecule-1 (KIM-1) and neutrophil gelatinase associated lipocalin (NGAL), early biomarkers of acute kidney injury. HK-2 cells were pretreated with 200 μmol·L-1 CaD for 26 h. n = 3, |
CaD是一种人工合成的具有抗氧化、抗炎和抗血管生成特性的小分子化合物。大量研究表明, CaD在视网膜病变和肾脏微血管疾病方面是一种很有前途的治疗药物[20]。CaD的抗氧化和血管保护作用已在体内和体外实验中得到证实[21, 22]。体外实验证明CaD的抗氧化特性通过直接清除微血管损伤, 尤其是清除ROS而发挥重要作用[23]。本研究主要考察了CaD的抗氧化特性对顺铂所致HK-2细胞凋亡的影响。
线粒体是细胞内活性氧的主要来源, 又是ROS作用的主要靶点[24]。线粒体功能受损产生大量ROS, 导致线粒体膜发生脂质过氧化, 线粒体跨膜电位降低, 上调促凋亡蛋白bax表达, 抑制抗调亡蛋白bcl-2表达, 活化caspases-9和caspases-3蛋白, 使细胞进入不可逆的凋亡过程[25, 26]。线粒体跨膜电位的下降, 被认为是细胞凋亡级联反应过程中最早发生的事件。本研究基于HK-2模型, 探讨CaD对线粒体跨膜电位的影响。研究发现, 顺铂组ROS水平显著高于CaD保护组, 且相较于顺铂组, CaD保护组线粒体膜电位有所增加, 流式图中单阳性细胞比例有所下降。也验证了大量ROS的产生会导致线粒体跨膜电位降低, 进而引起细胞凋亡。
p53基因是一种重要的肿瘤抑制基因, 可促进细胞凋亡, 阻滞细胞生长过程。ROS可以激活p53介导的细胞凋亡通路, 同时p53蛋白也可以直接刺激线粒体释放ROS而引发细胞凋亡, 下调p53表达水平能够降低细胞内ROS的产生并减轻细胞凋亡程度[27]。p53还可促进线粒体外膜通透性变化, 引起膜间促凋亡因子从线粒体膜间隙中释放到胞质与细胞核中, 从而激活下游caspase家族蛋白启动细胞凋亡程序。以上研究表明, ROS介导的细胞凋亡与线粒体凋亡通路的激活密切相关, 能够激活p53, 改变线粒体跨膜电位, 影响bcl-2、bax及caspase家族等蛋白表达。
本项研究结果表明, CaD能抑制顺铂诱导的HK-2凋亡, 通过caspase信号通路发挥了重要作用。其潜在的临床应用价值有待深入研究, 今后将进一步开展动物研究深入探讨CaD抑制细胞凋亡作用, 为CaD临床应用提供实验依据。
作者贡献:任春霞完成实验相关以及论文撰写工作; 余自成负责指导实验与修改论文工作; 朱李飞负责对本课题实验思路进行指导。
利益冲突:所有作者声明不存在利益冲突。
| [1] |
Du C, Lin X, Xu W, et al. Sulfhydrated sirtuin-1 increasing its deacetylation activity is an essential epigenetics mechanism of anti-atherogenesis by hydrogen sulfide[J]. Antioxid Redox Signal, 2019, 30: 184-197. DOI:10.1089/ars.2017.7195 |
| [2] |
Ciarimboli G. Membrane transporters as mediators of cisplatin side-effects[J]. Anticancer Res, 2014, 34: 547-550. |
| [3] |
Chen X, Wei W, Li Y, et al. Hesperetin relieves cisplatin-induced acute kidney injury by mitigating oxidative stress, inflammation and apoptosis[J]. Chem Biol Interact, 2019, 308: 269-278. DOI:10.1016/j.cbi.2019.05.040 |
| [4] |
Manohar S, Leung N. Cisplatin nephrotoxicity:a review of the literature[J]. J Nephrol, 2018, 31: 15-25. DOI:10.1007/s40620-017-0392-z |
| [5] |
Zhang L, Gu Y, Li H, et al. Daphnetin protects against cisplatin-induced nephrotoxicity by inhibiting inflammatory and oxidative response[J]. Int Immunopharmacol, 2018, 65: 402-407. DOI:10.1016/j.intimp.2018.10.018 |
| [6] |
Deng J, Jiang W, Chen C, et al. Cordyceps cicadae mycelia ameliorate cisplatin-induced acute kidney injury by suppressing the TLR4/NF-κB/MAPK and activating the HO-1/Nrf2 and Sirt-1/AMPK pathways in mice[J]. Oxid Med Cell Longev, 2020. DOI:10.1155/2020/7912763 |
| [7] |
Zhao WM, Dong ZY, Shi ZF, et al. Down-regulation of miR-205-5p sensitizes HNE1/DDP to cisplatin induced apoptosis in vitro[J]. Acta Pharm Sin (药学学报), 2019, 54: 1200-1206. |
| [8] |
Holditch SJ, Brown CN, Lombardi AM, et al. Recent advances in models, mechanisms, biomarkers, and interventions in cisplatin-induced acute kidney injury[J]. Int J Mol Sci, 2019, 20: E3011. DOI:10.3390/ijms20123011 |
| [9] |
Huang D, Wang C, Duan Y, et al. Targeting Oct2 and P53:formononetin prevents cisplatin-induced acute kidney injury[J]. Toxicol Appl Pharmacol, 2017, 326: 15-24. DOI:10.1016/j.taap.2017.04.013 |
| [10] |
Liu Z, Su J, Xu S, et al. Numb depletion promotes Drp1-mediated mitochondrial fission and exacerbates mitochondrial fragmentation and dysfunction in acute kidney injury[J]. Antioxid Redox Signal, 2019, 30: 1797-1816. DOI:10.1089/ars.2017.7432 |
| [11] |
Yuan Y, Zhu L, Li L, et al. S-Sulfhydration of SIRT3 by hydrogen sulfide attenuates mitochondrial dysfunction in cisplatin-induced acute kidney injury[J]. Antioxid Redox Signal, 2019, 31: 1302-1319. DOI:10.1089/ars.2019.7728 |
| [12] |
Zhou Y, Qi C, Li S, et al. Diabetic nephropathy can be treated with calcium dobesilate by alleviating the chronic inflammatory state and improving endothelial cell function[J]. Cell Physiol Biochem, 2018, 51: 1119-1133. DOI:10.1159/000495491 |
| [13] |
Zhang X, Liu W, Wu S, et al. Calcium dobesilate for diabetic retinopathy:a systematic review and meta-analysis[J]. Sci China Life Sci, 2015, 58: 101-107. DOI:10.1007/s11427-014-4792-1 |
| [14] |
Jafarey M, Changizi Ashtiyani S, Najafi H. Calcium dobesilate for prevention of gentamicin-induced nephrotoxicity in rats[J]. Iran J Kidney Dis, 2014, 8: 46-52. |
| [15] |
Li YJ, Feng YJ, Meng J, et al. Protective effect of calcium dobesilate on tobramycin-induced nephrotoxicity in rats[J]. J Hebei Med Univ (河北医科大学学报), 2018, 39: 632-635. |
| [16] |
Yu FF, Ji WX, Shan WH, et al. Protective effects of calcium dobesilate on contrast-induced nephropathy in rats[J]. Chin J Intervent Cardiol (中国介入心脏病学杂志), 2015, 23: 42-46. |
| [17] |
Cai T, Wu XY, Zhang XQ, et al. Calcium dobesilate prevents diabetic kidney disease by decreasing bim and inhibiting apoptosis of renal proximal tubular epithelial cells[J]. DNA Cell Biol, 2017, 36: 249-255. DOI:10.1089/dna.2016.3276 |
| [18] |
Andreucci M, Faga T, Pisani A, et al. The ischemic/nephrotoxic acute kidney injury and the use of renal biomarkers in clinical practice[J]. Eur J Intern Med, 2017, 39: 1-8. DOI:10.1016/j.ejim.2016.12.001 |
| [19] |
Ghatanatti R, Teli A, Tirkey SS, et al. Role of renal biomarkers as predictors of acute kidney injury in cardiac surgery[J]. Asian Cardiovasc Thorac Ann, 2014, 22: 234-241. DOI:10.1177/0218492313502028 |
| [20] |
Wang Y, Lu YH, Tang C, et al. Calcium dobesilate restores autophagy by inhibiting the VEGF/PI3K/AKT/mTOR signaling pathway[J]. Front Pharmacol, 2019, 10: 886. DOI:10.3389/fphar.2019.00886 |
| [21] |
Unal Y, Tuncal S, Kosmaz K, et al. The effect of calcium dobesilate on liver damage in experimental obstructive jaundice[J]. J Invest Surg, 2019, 32: 238-244. DOI:10.1080/08941939.2018.1451936 |
| [22] |
Sivaskandarajah GA, Jeansson M, Maezawa Y, et al. Vegfa protects the glomerular microvasculature in diabetes[J]. Diabetes, 2012, 61: 2958-2966. DOI:10.2337/DB11-1655 |
| [23] |
Liu J, Li S, Sun D. Calcium dobesilate and micro-vascular injury[J]. Life Sci, 2019, 221: 348-353. DOI:10.1016/j.lfs.2019.02.023 |
| [24] |
Song E, Ramos SV, Huang X, et al. Holo-lipocalin-2-derived siderophores increase mitochondrial ROS and impair oxidative phosphorylation in rat cardiomyocytes[J]. Proc Natl Acad Sci U S A, 2018, 115: 1576-1581. DOI:10.1073/pnas.1720570115 |
| [25] |
Zhang X, Li CF, Zhang L, et al. TRAF6 restricts p53 mitochondrial translocation, apoptosis, and tumor suppression[J]. Mol Cell, 2016, 64: 803-814. DOI:10.1016/j.molcel.2016.10.002 |
| [26] |
Kaleem S, Siddiqui S, Siddiqui HH, et al. Eupalitin induces apoptosis in prostate carcinoma cells through ROS generation and increase of caspase-3 activity[J]. Cell Biol Int, 2016, 40: 196-203. DOI:10.1002/cbin.10552 |
| [27] |
Chen T, Deng Z, Zhao R, et al. SYKT alleviates doxorubicin-induced cardiotoxicity via modulating ROS-mediated p53 and MAPK signal pathways[J]. Evid Based Complement Alternat Med, 2018. DOI:10.1155/2018/2581031 |
 2020, Vol. 55
2020, Vol. 55


