脓毒症(sepsis)是感染合并全身炎性反应综合征, 是目前临床重症主要的死亡原因之一, 病死率高达30%~70%。血管渗漏是脓毒症常见的病理生理改变, 可引起大分子蛋白从循环系统进入组织, 是导致多器官功能障碍的主要原因。有关血管渗漏的研究有很多, 目前认为血管渗漏的发生机制主要包括细胞旁途径和跨细胞途径, 但是目前针对血管渗漏的治疗效果并不理想, 因此, 寻找更为有效的措施对治疗脓毒症血管渗漏具有重要的意义。
线粒体功能障碍是脓毒症致多器官功能障碍的重要原因, 针对线粒体功能障碍的防治研究被认为是脓毒症器官功能损害治疗的方向之一。线粒体通透性转换孔(mitochondrial permeability transition pore, MPTP)是一种非特异性孔道, 位于线粒体内、外膜之间, 对线粒体功能有重要调节作用。MPTP开放可引起线粒体外的Ca2+大量内流、线粒体基质渗透压升高、线粒体外膜损伤、膜电位下降等, 最终诱导细胞凋亡或死亡。环孢素A (cyclosporin A, CsA)是MPTP的特异性抑制剂, 通过与线粒体基质的亲环蛋白D结合抑制MPTP开放, 广泛应用于自身免疫性疾病的治疗以及对心肌缺血再灌注损伤的保护[1], 但是CsA能否对脓毒症引起的血管渗漏起保护作用, 目前尚不清楚。
本文通过应用健康成年Sprague-Dawley (SD)大鼠盲肠结扎穿孔模拟脓毒症模型, 观察CsA (1和5 mg·kg-1)对脓毒症大鼠肺脏、肾脏和肠道的血管通透性和对肾脏、肠道线粒体功能的影响; 并通过细胞水平实验应用脂多糖(lipopolysaccharide, LPS)刺激血管内皮细胞(vascular endothelial cell, VEC), 进一步观察了CsA对VEC通透率、线粒体功能及MPTP开放的影响。
材料与方法实验动物 成年SPF (specific pathogen free)级SD大鼠, 雌雄各半, 体重(200 ± 20) g, 由陆军特色医学中心实验动物中心提供。动物许可证号SCXK (渝) 20170002。动物福利和实验过程均遵循陆军军医大学动物伦理委员会的规定。
药品与试剂 CsA (英国Tocris公司), 溶于二甲基亚砜; LPS (美国Sigma公司), 用PBS (phosphate buffer saline)配制为10 mg·mL-1, 工作浓度1 μg·mL-1; 异硫氰酸荧光素标记的牛血清白蛋白(albumin-fluorescein isothiocyanate conjugate, FITC-BSA) (美国Sigma公司), 用生理盐水配制为1.8 mg·mL-1, 使用时按9 mg·kg-1大鼠体重剂量静脉注射; DAPI (diamidino phenyl indole) (中国中杉金桥公司); 伊文思蓝(Evans blue, EB) (美国Sigma公司), 用生理盐水配制为1.5% (w/v); 活性氧(reactive oxygen species, ROS)测定试剂盒(中国南京建成生物工程研究所); 兔抗大鼠闭锁小带蛋白1 (zonula occludes-1, ZO-1)抗体(中国博士德公司)。
主要实验仪器 Oxygraph液相氧电极(英国Hansatech公司); TCS-SP5激光共聚焦显微镜(德国Leica公司); BX51W1微循环显微镜(日本Olympus公司)。
脓毒症模型的制备 健康成年SD大鼠术前12 h禁食、不禁水, 按30 mg·kg-1大鼠体重剂量腹腔注射戊巴比妥那麻醉, 固定于鼠台, 碘伏消毒腹部, 在腹中部沿腹直线剪开2 cm小口, 游离暴露盲肠, 排除盲端气泡, 充盈盲肠末端粪便, 距盲肠末端0.7 cm处用缝合线结扎, 用锥形器在盲肠末端贯通穿刺(cecal ligation and puncture, CLP), 粪便自由流入腹腔, 复位盲肠, 剪去两侧大网膜, 缝合伤口, 按20 mL·kg-1大鼠体重剂量向腹中注射无菌生理盐水后, 放入笼中饲养, 禁食、不禁水, 待后续实验使用。模型成功率为66.6%。
肺脏和肾脏通透性测定 注射FITC-BSA (9 mg·kg-1)至大鼠颈静脉, 2 h后开腹结扎腹主动脉, 剪断腹主静脉, 从颈静脉缓慢匀速注入稀肝素进行灌洗, 待肺脏和肾脏变白, 处死大鼠, 取左肺上叶和左肾, 分别称量、剪碎组织、匀浆、离心(4 ℃, 8 000 ×g, 10 min)后, 取上清, 用荧光分光光度计测定500 nm (激发波长)和530 nm (发射波长)波长处的肺和肾匀浆液中FITC-BSA的荧光强度, 用多功能酶标仪测定匀浆液中总蛋白的吸光度, 并根据各自吸光度分别计算出肺和肾匀浆液的蛋白浓度和总蛋白浓度, 以匀浆液蛋白浓度和总蛋白浓度之比表示肺脏和肾脏的血管通透性。
肠道通透性的测定 各组大鼠处理完毕后处死, 距胃端6~7 cm处取一段6 cm小肠, 肠腔用PBS冲洗干净, 将其中一端结扎, 注入1.5% EB 0.2 mL, 结扎另一端制成肠囊, 放入37 ℃水浴30 min, 打开肠囊, 用生理盐水冲洗至冲洗液澄清, 于50 ℃烤箱中放置24 h后, 称重, 放入2 mL甲酰胺溶液中于37 ℃孵育24 h, 用分光光度计测定655 nm波长处的肠匀浆液吸光度, 并根据标准曲线计算肠干重所含EB含量(mg·g-1)。
肠系膜微循环血管渗漏测定 从大鼠腹中部剪开约2 cm小口暴露小肠, 将大鼠侧位放于观察板, 寻找合适直径的肠系膜细静脉, 在保持恒定温度和湿度的情况下, 通过静脉导管注射9 mg·kg-1的FITC-BSA, 待稳定5 min后, 计为测定零点, 记为0 min, 分别记录0、1、3和6 min的荧光强度, 用Image-Pro Plus 5.0软件测量静脉(intravenous, iv)和静脉周围间质(intravenous perivenous stroma, IPS)的荧光强度, 以静脉周围间质与静脉内荧光强度的比值来表示白蛋白渗漏量。
线粒体呼吸消耗速率测定 [2] 取大鼠肾脏(约5 g), 剪成小块, 用PBS清洗3次; 加入分离介质5 mL, 匀浆(冰上操作), 匀浆液离心(4 ℃, 1 600 ×g, 12 min); 将离心后的上清液转移至10 mL离心管中, 离心(4 ℃, 25 000 ×g, 12 min); 去除上清液, 在沉淀中加入肾分离介质2 mL, 吹散沉淀, 离心(4 ℃, 25 000 ×g, 12 min); 去除上清液, 向沉淀中加入肾分离介质1 mL, 放置4 ℃待测。
取长度约60 cm的大鼠肠道组织, PBS冲洗肠道内容物, 将肠道一端夹毕, 用0.25%枸橼酸钠冲洗肠道2次, 剖开肠道, 用手术刀片背部刮去肠黏膜, 弃之, 再刮取肠上皮, 置于离心管, 加入5 mL肠线粒体分离介质, 离心2次(4 ℃, 3 500 r·min-1, 3 min/次), 取沉淀, 加入5 mL肠线粒体分离介质匀浆, 匀浆液离心(4 ℃, 1 700 r·min-1, 10 min), 取上清, 离心(4 ℃, 10 500 r·min-1, 8 min), 取上清, 离心(4 ℃, 10 000 r·min-1, 8 min), 取沉淀, 加入1 mL肠分离介质, 轻摇制成混悬液待测。用Oxygraph液相氧电极测定线粒体呼吸消耗速率。
MPTP开放情况检测 [3]血管内皮细胞接种于激光共聚焦专用培养皿, 细胞密度达80%时换为无血清培养液培养, 按分组加入LPS (1 μg·mL-1)和CsA (1 μmol·L-1)分别处理细胞6或4 h; 加入calcein-AM (calcein acetoxymethyl ester) (2 μmol·L-1)和Mito-tracker (100 nmol·L-1)于4 ℃避光孵育30 min; 加入CoCl2 (2 nmol·L-1)于4 ℃孵育15 min; 加入无钙台氏液并于激光共聚焦显微镜下观察MPTP开放情况。
ZO-1的蛋白表达情况检测 [4]药物处理时间结束后, 弃掉细胞培养液, 于-20 ℃甲醇固定细胞20 min, 0.1% Triton透膜30 s, 加入山羊血清于室温孵育20 min, 加入ZO-1一抗(1:100)于4 ℃孵育过夜, 于37 ℃孵育二抗(1:100) 1 h, 加入DAPI (1:100)于37 ℃孵育30 min后, 于激光共聚焦显微镜观察ZO-1表达情况。
在体实验方案 实验分为5组, 分别为假手术组(sham-operated group, Sham)、脓毒症组(sepsis group, Sep)、常规治疗组(conventional treatment group, CT)、CsA (1和5 mg·kg-1)组[5]。其中用于检测肺脏、肾脏和肠道的血管通透性以及线粒体呼吸控制率指标的组别为每组8只动物, 用于血管渗漏测定的组别为每组6只动物。盲肠结扎穿孔12 h后, 行颈、股静脉插管, 各组进行如下处理: ①假手术组:只开腹, 不做盲肠结扎穿孔; ②脓毒症组:利用盲肠结扎穿孔制备脓毒症模型, 不予任何治疗; ③常规治疗组:脓毒症模型制备后给予乳酸林格液输注, 输注量约为大鼠总血容量的50%, 按70 mL·kg-1大鼠体重预估总血容量; ④ CsA (1和5 mg·kg-1)组:向乳酸林格液中分别加入CsA (1和5 mg·kg-1)后输注大鼠, 各组大鼠复苏的同时在乳酸林格液中加入抗生素头孢呋辛钠(100 mg·kg-1)和多巴胺(5 μg·kg-1·min-1), 输注时间为3 h, 复苏结束2 h后测定肺脏血管、肾脏血管和肠道的通透性, 以及肾脏、肠道线粒体呼吸消耗速率, 并观察肠系膜微静脉血管渗漏变化。
离体实验方案 取原代培养的血管内皮细胞, 实验分为正常对照组(normal, N)、LPS组和CsA组。正常对照组:实验前24 h将培养液换为无血清基础培养液; LPS组:用无血清基础培养液培养24 h, 加入LPS (1 μg·mL-1)孵育6 h; CsA组:用无血清基础培养液培养24 h, 加入LPS (1 μg·mL-1)孵育6 h后, 加入CsA (1 μmol·L-1)孵育4 h。测定各组血管内皮细胞的MPTP开放情况、ZO-1荧光表达和跨膜电阻。
统计学方法 数据采用SPSS17.0软件进行统计与分析, 结果用
与假手术组相比, 脓毒症大鼠肺脏、肾脏血管和肠道通透性显著升高(P < 0.01), 表现为肺脏、肾脏、肠道在FITC-BSA注射2 h后, 其荧光含量较假手术组大鼠分别升高了138%、122%和78%。常规治疗虽能部分改善其血管通透性, 但与脓毒症组大鼠相比无统计学差异(P > 0.05)。CsA (1 mg·kg-1)组与常规治疗组相比, 肾脏和肠道的血管通透性分别降低了12%和18%, 差异显著(P < 0.01)。CsA (5 mg·kg-1)组肺脏、肾脏和肠道的血管通透性与常规治疗组相比分别降低了13%、17%和25%, 差异显著(P < 0.05或P < 0.01) (图 1)。

|
Figure 1 The effects of cyclosporin A (CsA) on permeability of lung, kidney, and intestine in sepsis rats. A: The permeability of lung; B: The permeability of kidney; C: The permeability of intestine. Sham: Sham-operated group; Sep: Sepsis group; CT: Conventional treatment group, with lactated Ringer's solution; CsA 1 and 5 mg: CsA (1 and 5 mg·kg-1) treated group. n = 8, |
大鼠在注射FITC-BSA稳定5 min后, 计为测定零点, 记为0 min。假手术组大鼠在0~6 min肠系膜微静脉血管基本不发生荧光渗漏; 脓毒症组大鼠肠系膜微静脉血管发生较严重的渗漏; CsA (1和5 mg·kg-1)组大鼠血管渗漏情况均得到显著改善(P < 0.01), 其中CsA (5 mg·kg-1)组改善效果更为明显, 其在1、3和6 min的荧光渗漏分别减少84%、74%和68% (图 2)。
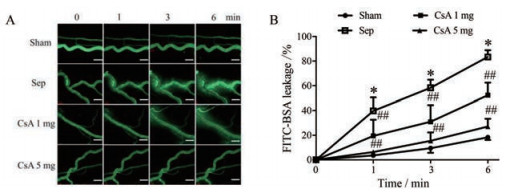
|
Figure 2 The effects of CsA on leakage of microvascular in sepsis rats. Each group was injected with albumin-fluorescein isothiocyanate (FITC-BSA) (9 mg·kg-1) respectively. The leakage of FITC-BSA was measured at 0, 1, 3, and 6 min after 5 min of circulation. A: The leakage of microvascular; B: Statistical analysis of FITC-BSA conjugate leakage. The scale bar represents 100 μm. n = 8, |
与假手术组比较, 脓毒症大鼠肾脏和肠道线粒体呼吸控制率显著下降(P < 0.01), 分别下降了52%和36%, 常规治疗后能部分提高线粒体呼吸控制率, 但与脓毒症组比较无统计学差异(P > 0.05), CsA (5 mg·kg-1)能显著改善大鼠肾脏和肠道线粒体呼吸控制率(P < 0.01), 与脓毒症模型组比较, 分别增加34%和27% (图 3)。

|
Figure 3 The effects of CsA on mitochondrial respiratory control ratio (RCR) of kidneys and intestines in sepsis rats. The mitochondria of kidneys and intestines of rats of each group were extracted and the RCR was measured. A: The mitochondrial RCR of kidneys; B: The mitochondrial RCR of intestines. n = 8, |
Mito-tracker用于标记线粒体, 呈现红色荧光; calcein-AM用于标记细胞内的Ca2+, 呈现绿色荧光。根据线粒体中绿色荧光的强弱来判断线粒体MPTP开放的程度:绿色荧光越强, 开放程度越低; 绿色荧光越弱, 开放程度越高。结果显示, 正常血管内皮细胞绿色荧光明显, 提示MPTP孔开放较少; LPS (1 μg·mL-1)刺激6 h后, 表现为绿色荧光减弱, 提示MPTP孔开放明显增多; LPS刺激以后再经CsA (1 μmol·L-1)孵育[5], 表现为绿色荧光由LPS刺激后的减弱变为增强, 提示CsA可明显减少MPTP孔开放(图 4)。

|
Figure 4 The effects of CsA on the opening of MPTP of vascular endothelial cells. N: Normal control group; LPS: The vascular endothelial cells incubated with LPS (1 μg·mL-1) for 6 h; CsA: The vascular endothelial cells incubated with CsA (1 μmol·L-1) for 4 h after incubating with LPS (1 μg·mL-1) for 6 h; Mito-tracker: Mitochondria tracker (100 nmol·L-1), for labeling mitochondria for 30 min; Calcein-AM: Calcein acetoxymethyl ester (2 μmol·L-1), for labeling intracellular calcium for 30 min; The scale bar represents 50 nm. LPS: Lipopolysaccharide; MPTP: Mitochondrial permeability transition pore |
各组血管内皮细胞跨膜电阻实验检测结果显示, 正常组血管内皮细胞的跨膜电阻几乎未发生明显改变; 经LPS处理后血管内皮细胞的跨膜电阻整体呈现降低趋势, 至检测终点2 h时出现显著性差异(P < 0.01), 提示LPS可显著降低血管内皮细胞的跨膜电阻; 与LPS组比较, CsA组血管内皮细胞跨膜电阻可获得明显改善, 与LPS组呈现显著性差异(P < 0.05) (图 5A)。

|
Figure 5 The effects of CsA on permeability of vascular endothelial cells. The immunofluorescence of zonula occludes-1 (ZO-1) and cell nucleus (stained by DAPI) were shown in green and blue, respectively. A: The normalized transendothelial electrial resistance (TER) of vascular endothelial cell; B: The immunofluorescence of ZO-1 of vascular endothelial cell. The scale bar represents 50 nm. n = 8, |
免疫荧光实验结果显示, 正常对照组血管内皮细胞ZO-1连接紧密, 表现为连续的线状; LPS刺激后ZO-1的表达呈不连续的点状, 分布紊乱, 分散在细胞间隙之间; 与LPS组比较, CsA的作用可使血管内皮细胞ZO-1表达明显增加, 表现为点状减少, 能明显看出ZO-1的大致分布呈线状, 提示CsA可有效降低LPS刺激引起的血管内皮细胞通透性的增加(图 5B)。
6 CsA对脓毒症大鼠存活时间的影响脓毒症后, 未经治疗的情况下, 大鼠平均存活时间为6.7 h, 经乳酸林格氏液常规治疗后, 动物存活时间没有明显延长, 常规治疗组大鼠平均存活时间为8.8 h。与常规治疗组比较, CsA可明显延长脓毒症大鼠平均存活时间, CsA (1和5 mg·kg-1)组大鼠平均存活时间分别为14.1和18.1 h, 分别延长了60.2%和105.7%, 其中CsA (5 mg·kg-1)对存活时间的延长效果更显著(P < 0.01) (图 6)。
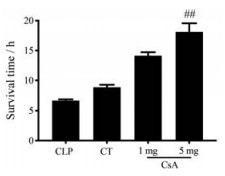
|
Figure 6 The effects of CsA on survival in sepsis rats. n = 16, |
脓毒症是各种损伤、创(烧)伤、休克和外科大手术后常见的并发症, 进一步发展可导致脓毒性休克和多器官功能不全综合征(multiple organ dysfunction, MODS), 是危重患者死亡的重要原因之一。
CsA作为一种强效免疫抑制剂被广泛应用于减轻心脏、肾脏、肝脏、胰腺和肺等多种器官和细胞移植后的排斥反应, CsA的早期应用还可以延缓自身免疫过程导致的Ⅰ型糖尿病等多种疾病, 并可用于治疗特发性膜性肾病, 且可避免联合糖皮质激素治疗的不良反应[6]。国内外研究表明, CsA对炎症反应具有明显的调理和抑制作用, 在缺血再灌注损伤早期应用能明显抑制炎症介质白介素-1β (interleukin-1β, IL-1β)的产生, 改善缺血再灌注损伤[7]。CsA对严重创伤失血性休克也具有较好的治疗效果[8]。但CsA对脓毒症引起的血管通透性增加是否有作用, 目前尚不清楚。本研究结果显示, CsA治疗可显著增加血管内皮细胞之间的紧密连接和血管内皮细胞跨膜电阻, 降低脓毒症大鼠重要脏器(肺脏、肾脏)血管和肠道的通透性, 提示CsA对脓毒症大鼠血管通透性具有保护作用。
MPTP是位于线粒体内、外膜之间的非特异性孔道, 能够调节线粒体膜的通透性, 在线粒体功能调节和细胞缺血缺氧性损伤过程中发挥着重要作用[9-12]。正常情况下, MPTP处于间歇性开放状态, 线粒体内膜通透性小, 但是当发生脓毒性休克或者缺血缺氧时, 线粒体内因缺血缺氧引起的活性氧产生以及磷酸盐含量的升高等因素会诱导MPTP的开放[13]。文献报道显示, MPTP在多种疾病的发生发展过程中具有至关重要的作用[14], 通过抑制MPTP开放可以达到治疗疾病或者缓解病情的作用[15]。本研究发现脓毒症大鼠的血管通透性明显增加, 线粒体功能出现障碍, 而通过CsA抑制线粒体膜上的重要孔道MPTP的开放, 则可有效增强血管内皮细胞线粒体的功能, 从而改善血管通透性, 延长脓毒症大鼠的存活时间。本研究提示CsA对脓毒症大鼠血管通透性的保护作用可能与抑制MPTP的开放进而保护线粒体功能有关。本研究结果将为脓毒症血管渗漏的治疗提供新方案, 为CsA在临床的应用提供理论参考。
作者贡献:吴跃负责血管通透性的测定(包括肺、肾、肠道血管通透性和肠系膜微静脉渗漏)、MPTP开放情况的测定以及文章的撰写; 朱娱负责血管内皮细胞的培养; 张杰负责ZO-1、TER的测定; 田昆仑负责动物模型的制备; 彭小勇负责线粒体提取及RCR的测定; 向鑫明负责动物存活观察; 刘良明负责相关文献的资料收集、信息分析; 李涛负责课题设计、文章作图和指导论文写作。全体作者都阅读并同意最终的文本。
利益冲突:所有作者均不存在利益冲突。
| [1] |
Upadhaya S, Madala S, Baniya R, et al. Impact of cyclosporine A use in the prevention of reperfusion injury in acute myocardial infarction:a meta-analysis[J]. Cardiol J, 2017, 24: 43-50. DOI:10.5603/CJ.a2016.0091 |
| [2] |
Kuang L, Zhu Y, Zhang J, et al. A novel cross-linked haemoglobin-based oxygen carrier is beneficial to sepsis in rats[J]. Artif Cells Nanomed Biotechnol, 2019, 47: 1496-1504. DOI:10.1080/21691401.2019.1602049 |
| [3] |
Lei Y, Peng X, Liu L, et al. Beneficial effect of cyclosporine A on traumatic hemorrhagic shock[J]. J Surg Res, 2015, 195: 529-540. DOI:10.1016/j.jss.2015.02.005 |
| [4] |
Zhang J, Yang GM, Zhu Y, et al. Role of connexin 43 in vascular hyperpermeability and relationship to Rock1-MLC20 pathway in sepsis rats[J]. Am J Physiol Lung Cell Mol Physiol, 2015, 309: L1323-L1332. DOI:10.1152/ajplung.00016.2015 |
| [5] |
Yang GM, Peng XY, Li T, et al. Beneficial effects of cyclosporin A on traumatic hemorrhagic shock in rats[J]. J Reg Anat Oper Surg (局解手术学杂志), 2014, 23: 250-252. |
| [6] |
Zheng DY, Wang SX, Cui Z, et al. A retrospective analysis of low-dose cyclosporine A monotherapy in idiopathic membranous nephropathy[J]. Chin J Pract Intern Med (中国实用内科杂志), 2016, 36: 882-886. |
| [7] |
Alam MR, Baetz D, Ovize M. Cyclophilin D and myocardial ischemia-reperfusion injury:a fresh perspective[J]. J Mol Cell Cardiol, 2015, 78: 80-89. DOI:10.1016/j.yjmcc.2014.09.026 |
| [8] |
Lei Y, Dong ZJ. Effects of cyclosporin A on acid-base balance after hypoxia-ischemia in rats[J]. J Reg Anat Oper Surg (局解手术学杂志), 2013, 22: 374-376. |
| [9] |
Vianello A, Casolo V, Petrussa E, et al. The mitochondrial permeability transition pore (PTP) -an example of multiple molecular exaptation[J]. Biochim Biophys Acta, 2012, 1817: 2072-2086. DOI:10.1016/j.bbabio.2012.06.620 |
| [10] |
Assaly R, de Tassigny Ad, Paradis S, et al. Oxidative stress, mitochondrial permeability transition pore opening and cell death during hypoxia-reoxygenation in adult cardiomyocytes[J]. Eur J Pharmacol, 2012, 675: 6-14. DOI:10.1016/j.ejphar.2011.11.036 |
| [11] |
Gill RS, Lee TF, Manouchehri N, et al. Postresuscitation cyclosporine treatment attenuates myocardial and cardiac mitochondrial injury in newborn piglets with asphyxia-reoxygenation[J]. Crit Care Med, 2013, 41: 1069-1074. DOI:10.1097/CCM.0b013e3182746704 |
| [12] |
Hausenloy DJ, Boston-Griffiths EA, Yellon DM. Cyclosporin A and cardioprotection:from investigative tool to therapeutic agent[J]. Br J Pharmacol, 2012, 165: 1235-1245. DOI:10.1111/j.1476-5381.2011.01700.x |
| [13] |
Fang QJ, Yan ZY, Li JA. Effects of cyclosporine A on protecting lung with ischemia/reperfusion in rabbits[J]. Acta Univ Med Anhui (安徽医科大学学报), 2012, 47: 793-796. |
| [14] |
Xiang SZ, Zhang M, Jiang B. The affection from mitochondrial permeability transition pore on cardiomyocytes induced-by ischemia reperfusion injury[J]. Mol Cardio China (中国分子心脏病学杂志), 2016, 16: 1940-1944. |
| [15] |
Liu YY, Yang GZ, Li HX, et al. Mitochondrial permeability transition pore and myocardial ischemia-reperfusion injury[J]. J Chin Pract Diagn Ther (中华实用诊断与治疗杂志), 2017, 31: 821-824. |
 2020, Vol. 55
2020, Vol. 55


