2. 中国医学科学院、北京协和医学院药物研究所, 天然药物活性物质与功能国家重点实验室, 北京 100050
2. State Key Laboratory of Bioactive Substance and Function of Natural Medicines, Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
肺纤维化既是独立的疾病也是多种慢性纤维增生性肺病的基本病理改变, 是许多慢性肺病致残和致死的重要原因[1]。近年来特发性肺纤维化发病率和致死率呈不断上升趋势。特发性肺纤维化临床诊断明确后的3年生存率不足50%, 5年死亡率达65%[2]。但是, 肺纤维化的发病机制尚未完全阐明, 更重要的是, 至今也没有公认的、真正能够逆转肺纤维化的药物[3]。
巨噬细胞作为机体中重要的非特异性免疫细胞, 在不同的环境刺激下向不同的方向分化。目前根据其活化状态和发挥功能的不同, 将其分为2类, 即经典活化的巨噬细胞和替代性活化的巨噬细胞。经典活化的巨噬细胞的主要特点是分泌大量的促炎性细胞因子, 如肿瘤坏死因子-α (tumor necrosis factor-α, TNF-α)、白细胞介素1β (interleukin-1β, IL1β)和白细胞介素6 (interleukin-6, IL6)等, 主要参与起始组织损伤后的炎症反应。而替代性活化的巨噬细胞的主要特点是分泌大量的抗炎因子, 例如白细胞介素10 (interleukin-10, IL10)和转化生长因子-β (transforming growth factor-β, TGF-β), 主要参与组织的修复和愈合[4]。大量研究证实, 替代性活化的巨噬细胞大量存在于纤维化组织中, 表现为促纤维化的表型[5-8], 其主要通过分泌大量的促纤维化因子来维持组织局部的促纤维化微环境, 进而促进成纤维细胞的增殖、迁移和向肌成纤维细胞的转化[9], 提示替代性活化的巨噬细胞在纤维化的发生发展中发挥了重要的作用。因此, 研究巨噬细胞分化和活化的调节机制是深入了解组织纤维化包括肺纤维化发病机制的关键, 也可能是开发抗纤维化药物的新途径。细胞周期抑制因子p21不仅是一种已知的细胞周期依赖性蛋白激酶抑制因子[10], 也被证实参与了机体先天免疫和适应性免疫的调控[11-15]。p21可通过调节T细胞功能抑制自身免疫[16, 17]。近年来, 大量研究证实p21在巨噬细胞活化方面发挥了重要的调节作用。p21缺失可增强脂多糖(lipopolysaccharide, LPS)诱导的巨噬细胞活化, 增加促炎因子的产生, 增强机体感染性休克的敏感性[18, 19]。p21通过调节巨噬细胞活化参与风湿性关节炎的转归[20]。p21通过调节p50-p50 NF-κB和干扰素β (interferon-β, IFN-β)介导巨噬细胞的重编程[21]。基于以上研究结果, 作者推测p21可能参与调节巨噬细胞所介导的免疫反应, 在肺纤维化的发生发展中发挥重要的调节作用。本研究观察了博来霉素(bleomycin, BLM)所致肺纤维化小鼠肺泡巨噬细胞中p21表达的改变, 并使用p21过表达病毒和敲低病毒探究了p21对肺泡巨噬细胞活化的调节作用。本研究的发现可能有助于深入理解肺纤维化的发病机制, 并为开发治疗肺纤维化的药物提供新的药靶和理论依据。
材料与方法主要实验仪器 冷冻高速离心机(美国Beckman公司); 电泳仪(北京六一仪器厂); PCR仪和荧光定量PCR仪(美国Bio-Rad公司); ImageQuant LAS 4000 mini成像系统(美国通用电气公司); 激光共聚焦显微镜(日本奥林巴斯公司); 流式细胞分析仪(美国BD公司); 细胞培养孵箱(日本Panasonic公司)。
动物 C57BL/6J小鼠(雄性, 6周龄)购自斯贝福(北京)实验动物科技有限公司。所有动物饲养在中国医学科学院药物研究所SPF级实验动物屏障设施系统。所有动物实验均满足中国医学科学院药物研究所实验动物福利和动物伦理要求。
材料和试剂 细胞培养基DMEM、RPMI-1640、胎牛血清(fetal bovine serum, FBS)及青链霉素混合液(Gibco公司); 硫酸博来霉素(上海赢瑞生物医药科技有限公司); 小鼠p21单克隆抗体(Santa Cruz Biotechnology公司); 小鼠α-平滑肌肌动蛋白(alpha-smooth muscle actin, α-SMA)抗体(博士德生物公司); 鬼笔环肽(Cell Signaling公司); F4/80 (Abcam公司); CD206 (BioLegend公司); Ⅰ型鼠尾胶原(Corning公司); 磷酸盐缓冲溶液(phosphate buffer saline, PBS) (北京细工生物科技有限公司); TransZolUp和EasyScript One-Step gDNA Removal and cDNA Synthesis SuperMix (北京全式金生物技术有限公司); RIPA (radio immunoprecipitation assay)裂解液和BCA (bicinchoninic acid)蛋白质测定试剂盒(碧云天技术有限公司); KAPA SYBR快速定量试剂盒(KAPA技术有限公司); p21过表达和敲低病毒(汉恒生物技术有限公司)。
动物模型 通过气管内重复给予BLM刺激诱导小鼠发生不可逆肺纤维化。用400 mg·kg-1三溴乙醇腹腔注射麻醉小鼠。使用微量进样针将50 μL的BLM (1 U·kg-1)喷雾到气管中, 重复6次, 每次喷雾间隔14天。
Western blot实验 取新鲜细胞及组织, 加入一定体积含有蛋白酶抑制剂[4-(2-氨乙基)苯磺酰氟盐酸盐、抑肽酶、抑氨肽酶、亮肽素、胃酶抑素A、N-反式-环氧琥珀酰-L-亮氨酸-4-胍基丁酰胺, Selleck公司]和苯甲基磺酰氟(phenylmethylsulfonyl fluoride, PMSF)的RIPA裂解液, 冰上裂解, 30 min后, 12 000 r·min-1离心30 min。收集上清液, 测定其蛋白浓度并进行定量, 加入5×loading buffer, 于98 ℃变性10 min, 取10 μL上样, 进行SDS-聚丙烯酰胺凝胶电泳并转膜, 5%脱脂奶粉封闭30 min后, 一抗4 ℃孵育过夜, 次日用TBST (Tris-buffered saline and tween 20)溶液洗膜3次(10 min/次), 加入二抗, 室温孵育2 h, TBST洗膜3次(10 min/次), 进行ECL (electro-chemi-luminescence)显影并拍照。
免疫荧光染色实验 取冰冻组织切片或接种细胞的盖玻片, 用PBS清洗, 4%多聚甲醛固定细胞15 min, PBS洗3次, 0.5% Triton X-100透化20 min, PBS清洗3次, 3%牛血清白蛋白(albumin from bovine serum, BSA)室温封闭30 min, 加入α-SMA一抗和异硫氰酸荧光素(fluorescein isothiocyanate, FITC)标记的鬼笔环肽(1:100), 4 ℃孵育过夜, PBS清洗3次(5 min/次), 加入对应的二抗(1:200), 室温避光孵育2 h, PBS清洗3次(5 min/次), 用含有4', 6-二脒基-2-苯基吲哚(4', 6-diamidino-2-phenylindole, DAPI)的封片剂进行封片, 荧光显微镜观察并拍照。
胶原收缩实验(三维胶原蛋白凝胶) 将每mL细胞数为2×105个的原代小鼠肺成纤维细胞悬液与Ⅰ型鼠尾胶原蛋白(3 mg·mL-1)以2:1的比例混合后, 接种于24孔板中, 使胶原在37 ℃下凝固1 h, 使凝胶边缘与孔壁分离, 加入500 μL含5% FBS的DMEM培基和500 μL原代肺泡巨噬细胞的培养上清, 于37 ℃、5% CO2条件下共培养, 48 h后拍摄凝胶图像, 并使用Image J软件测量凝胶面积。
流式细胞术分析 用刮子轻柔的将细胞刮下, 于400 ×g离心5 min; 加入固定液, 室温避光孵育20 min, 400 ×g离心5 min, 弃上清; PBS清洗3次, 用100 μL PBS重悬细胞, 加入小鼠F4/80-PE和小鼠CD206-FITC抗体, 冰上避光染色45 min; PBS清洗3次并重悬细胞, 用流式细胞仪检测。
原代肺成纤维细胞分离 将野生小鼠处死, 打开胸腔, 剥取完整肺组织, 去除气管和结缔组织, 将肺组织放入1.5 mL离心管中, 加入1 mL DMEM培基, 用剪刀将肺剪碎, 于300 ×g离心15 min, 弃上清, 沉淀重悬后, 铺于10% FBS的DMEM培基中, 37 ℃、5% CO2培养5天后, 细胞进行传代。
肺泡巨噬细胞分离 将野生小鼠处死, 用镊子剥离肌肉, 暴露气管, 并进行气管插管。吸取1 mL生理盐水, 反复冲洗肺泡3次, 将肺泡灌洗液收集于离心管中, 重复此操作1次。将收集的肺泡灌洗液于300 ×g离心15 min, 弃上清, 沉淀重悬后, 铺于含10% FBS的RPMI-1640培基中, 37 ℃、5% CO2培养1 h, 待细胞贴壁后换液。
RNA提取和实时PCR ①细胞总RNA提取:用PBS清洗细胞后, 将TransZolUp溶液加入到细胞中, 收集细胞并涡旋使细胞充分裂解后, 加入氯仿涡旋混匀, 静置5 min, 于4 ℃、10 000 ×g离心15 min, 取上清液至新的离心管中, 并加入一定比例的异丙醇, 颠倒混匀, 静置10 min, 4 ℃、10 000 ×g离心10 min, 弃上清, 加入等体积的75%乙醇, 4 ℃、7 500 ×g离心10 min, 弃上清, 室温晾干后, 加RNase-free水, 静置5 min, 10 000×g离心5 min后, 测定RNA浓度; ② RNA逆转录成cDNA:按照全式金逆转录试剂盒说明书进行; ③定量PCR (quantitative-PCR, q-PCR)反应:反应体系(20 μL)如下: SYBR Premix ExTaq TM 10 μL, 去离子水6 μL, 上下游引物各1 μL, 模板cDNA 2 μL。引物由北京擎科新业生物技术有限公司合成, 序列如下: Tgf-β1 forward (F): 5'-GACATTCGGGAAGCAG-3'; Tgf-β1 reverse (R): 5'-CCACTCAGGCGTATCAG-3';发现于炎症区域分子1 (found in inflammatory zone 1, Fizz1) F: 5'-GAACTTC TTGCCAATCC-3'; Fizz1 R: 5'-GAACTTCTTGCCAAT CC-3';几丁质酶样蛋白3 (chitinase-like protein 3, Chil3) F: 5'-TCCTCAGAACCGTCAG-3'; Chil3 R: 5'-GAGTAGCAGCCTTGGA-3'; Il10 F: 5'-GGGGCCAGT ACAGCCGGGAA-3'; Il10 R: 5'-CTGGCTGAAGGCA GTCCGCA-3';信号传导及转录激活蛋白6 (signal transducer and activator of transcription 6, Stat6) F: 5'-ACGACAACAGCCTCAGTGTGGA-3'; Stat6 R: 5'-CA GGACACCATCAAACCACTGC-3';信号传导及转录激活蛋白3 (signal transducer and activator of transcription 3, Stat3) F: 5'-AGGAGTCTAACAACGGCAGCCT-3'; Stat3 R: 5'-GTGGTACACCTCAGTCTCGAAG-3';干扰素调控因子4 (interferon regulatory factor 4, Irf-4) F: 5'-GAACGAGGAGAAGAGCGTCTTC-3'; Irf-4 R: 5'-GTAGGAGGATCTGGCTTGTCGA-3';转录因子CCAAT增强子结合蛋白β (CCAAT/enhancer binding protein β, C/ebp-β) F: 5'-CAACCTGGAGACGCAGCA CAAG-3'; C/ebp-β R: 5'-GCTTGAACAAGTTCCGCA GGGT-3'。两步法反应过程如下: 95 ℃预变性30 s, 95 ℃变性5 s, 60 ℃退火和延伸30 s, 循环次数40次。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, Gapdh)作为内参, 将Ct值按照2-ΔΔCt的方法进行处理。
统计学分析 使用Graphpad Prism 5统计分析软件进行数据统计和计算, 3次以上重复实验获得的数据用mean ± standard error of mean (SEM)表示, 用Student's t检验两组间数据的显著性差异, 采用单因素方差分析(one-way ANOVA)检验多组间的显著性差异, 显著性结果以P < 0.05、P < 0.01或P < 0.001表示。
结果 1 肺纤维化小鼠肺泡巨噬细胞呈现促纤维化表型肺泡巨噬细胞参与肺纤维化的发病, 替代性活化的巨噬细胞呈现促纤维化表型, 大量存在于肺纤维化组织中。同样, 在博来霉素所致小鼠肺纤维化模型中, 可观察到替代性活化的巨噬细胞的标志蛋白CD206的表达显著增加(图 1A), 以及抑制性免疫因子Fizz1、Chil3、Il10和Tgf-β1的mRNA水平显著提高(图 1B)。并且, 作者建立了模型组巨噬细胞与正常小鼠成纤维细胞共培养体系, 结果显示, 与模型组巨噬细胞共培养后, α-SMA阳性的肌成纤维细胞细胞数目显著增加(图 1C), 胶原收缩能力增强(图 1D)。以上结果进一步证实博来霉素损伤导致小鼠肺泡巨噬细胞呈现促纤维化表型。
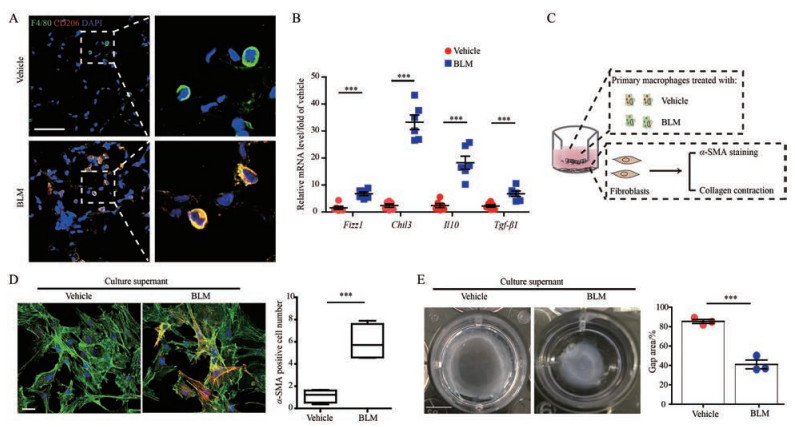
|
Figure 1 Alveolar macrophages (AMs) associate with a profibrotic phenotype in pulmonary fibrosis (PF).A: Confocal images showing the expression of F4/80 and CD206 in lung tissues from fibrotic mice. Scale bar, 50 µm; B: Quantitative analyses of mRNA levels of found in inflammatory zone 1 (Fizz1), chitinase-like protein 3 (Chil3), interleukin-10 (Il10), and transforming growth factor-β1 (Tgf-β1) in alveolar macrophages from wild type (WT) mice and multiple bleomycin (mBLM)-challenged mice; C: The experimental scheme for detecting the communication of alveolar macrophages from PF mice and primary lung fibroblasts; D and E: The activation of lung fibroblasts was evaluated by the expression α-smooth muscle actin (α-SMA) (D) in primary fibroblasts and the fibroblast contractility in 3-dimensional collagen matrices (E). Scale bars, 25 µm (D) and 5 mm (E). n = 3, mean ± standard error of mean (SEM). ***P < 0.001 vs vehicle |
已有文献[21]报道p21参与巨噬细胞活性的调节。为研究p21在肺纤维化中的作用, 首先检测了p21蛋白在肺泡巨噬细胞中的表达变化。免疫荧光结果显示, 与对照组相比, 模型组小鼠肺泡巨噬细胞表达显著增加(图 2A)。Western blot实验也得出了一致的结果(图 2B)。以上结果表明, 博来霉素损伤导致肺泡巨噬细胞中p21蛋白表达增加。
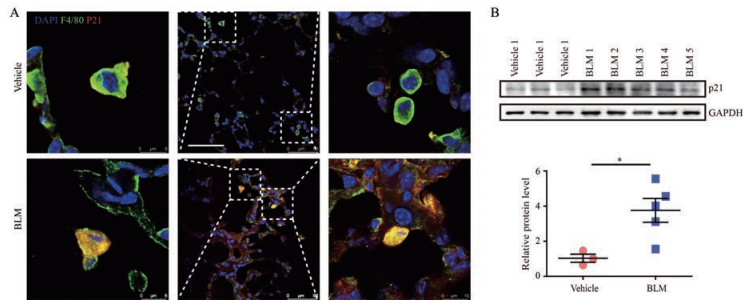
|
Figure 2 The expression of p21 increases in AMs during PF.A: Confocal images showing the expression of F4/80 and p21 in lung tissues from BLM challenged mice. Scale bars, 50 µm; B: Quantitative analyses of p21 expression in AMs from mouse lung tissues after mBLM injury. glyceraldehyde-3-phosphate dehydrogenase (GAPDH) was used as a loading control. n = 3, mean ± SEM. *P < 0.05 vs vehicle |
为探究p21是否参与肺纤维化发病过程中巨噬细胞促纤维化表型的转化, 使用p21敲低腺病毒处理肺纤维化小鼠的肺泡巨噬细胞进行检测。流式和RT-PCR结果分别显示, 敲低p21可抑制巨噬细胞活化标志蛋白CD206的表达(图 3A), 以及Fizz1、Chil3、Il10和Tgf-β1的mRNA水平(图 3B), 提示p21参与调节肺泡巨噬细胞的活化。此外, 将敲低p21的肺泡巨噬细胞与成纤维细胞共培养的结果显示(图 4A), 与对照病毒处理的巨噬细胞相比, 敲低p21的巨噬细胞可显著降低α-SMA阳性的肌成纤维细胞细胞数目(图 4B), 抑制成纤维细胞的胶原收缩能力(图 4C)。以上结果表明, 敲低p21可逆转肺纤维化小鼠肺泡巨噬细胞的促纤维化表型。
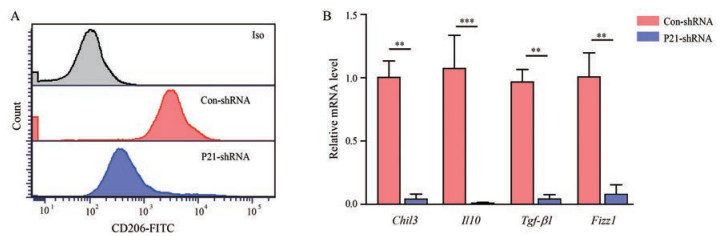
|
Figure 3 Depletion of p21 suppresses macrophage activation.A: The expression of CD206 in alveolar macrophages from mice with PF was evaluated with flow cytometry after p21 knockout adenovirus treatment; B: Quantitative analyses of mRNA levels of Fizz1, Chil3, Il10, and Tgf-β1 in alveolar macrophages from BLM-challenged mice after p21 depletion. n = 3, mean ± SEM. **P < 0.01, ***P < 0.001 vs Con-shRNA. Iso: Isotype antibody; FITC: Fluorescein isothiocyanate; Con-shRNA: Control short hairpin RNA; P21-shRNA: p21 short hairpin RNA |

|
Figure 4 p21 knockdown in AMs suppresses fibroblast activation.A: The schematics of the co-culture approach. Mouse AMs isolated from BLM-exposed WT mice were first treated with p21 knockout adenovirus, and then co-cultured with primary mouse fibroblasts for the indicated time; B and C: The activation of lung fibroblasts was evaluated by the expression of α-SMA (B) in primary fibroblasts and the fibroblast contractility in 3-dimensional collagen matrices (C). Scale bars, 25 µm (B) and 5 mm (C). n = 3, mean ± SEM. **P < 0.01 vs shControl (control short hairpin RNA). shP21: p21 short hairpin RNA |
为进一步确认p21对肺泡巨噬细胞活化的调节作用, 分离了正常小鼠的肺泡巨噬细胞, 使用p21过表达病毒预处理。结果显示, 过表达p21可显著增加巨噬细胞活化标志因子Fizz1、Chil3、Il10和Tgf-β1的mRNA水平(图 5A)。此外, 将该细胞与正常小鼠的肺成纤维细胞共培养(图 5B), 结果显示, 与对照肺泡巨噬细胞相比, 过表达p21的肺泡巨噬细胞显著促进成纤维细胞的活化, 体现在α-SMA阳性的肌成纤维细胞细胞数目增加(图 5C), 成纤维细胞的胶原收缩能力增强(图 5D)。以上结果提示, 过表达p21可促进肺泡巨噬细胞促纤维化表型的转化。
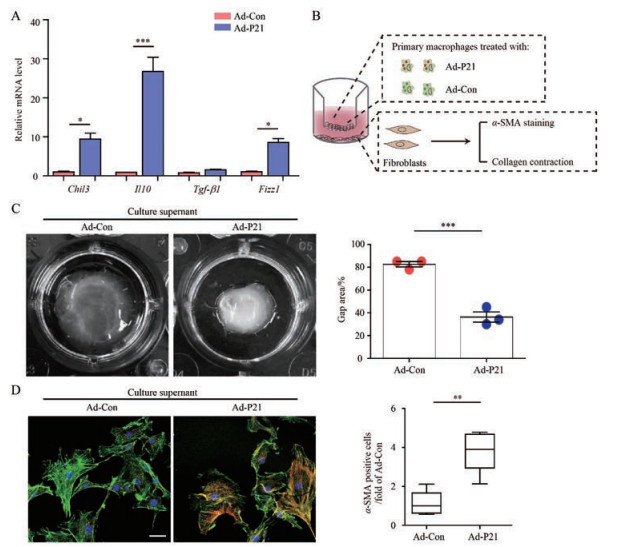
|
Figure 5 p21 overexpression in AMs promotes fibroblast activation.A: Quantitative analyses of mRNA levels of Fizz1, Chil3, Il10, and Tgf-β1 in alveolar macrophages from mBLM-challenged mice after p21 overexpression; B: The schematics of the co-culture approach. Mouse alveolar macrophages isolated from phosphate buffer saline (PBS)-exposed WT mice were first infected with p21 overexpressing adenovirus, and then co-cultured with primary mouse fibroblasts for the indicated time; C and D: The activation of lung fibroblasts was evaluated by the fibroblast contractility in 3-dimensional collagen matrices (C) and the expression of α-SMA (D) in primary fibroblasts. Scale bars, 25 µm (C) and 5 mm (D). n = 3, mean ± SEM. *P < 0.05, **P < 0.01, ***P < 0.001 vs Ad-Con (control adenovirus). Ad-P21: p21 over expression adenovirus |
为探究p21如何调控巨噬细胞的活化, 分析了改变p21的表达对多种已知的调控巨噬细胞活化的转录因子表达的影响。结果显示, 过表达p21可增加促巨噬细胞活化转录因子Irf-4、Stat6、C/ebp-β和Stat3的mRNA水平(图 6A); 相反, 敲低p21可显著降低上述因子基因的mRNA水平(图 6B)。结果提示, p21通过增加多种转录因子的表达诱导巨噬细胞的促纤维化表型。
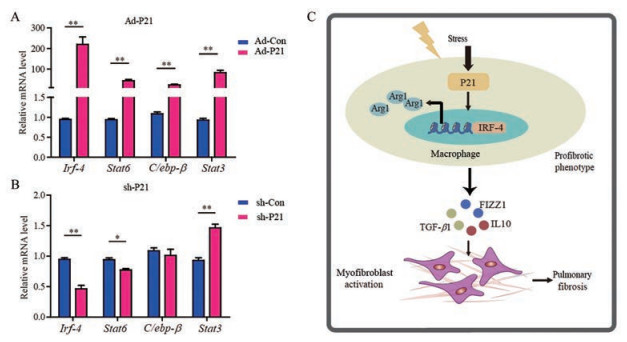
|
Figure 6 p21 regulates the expression of transcriptional factors inducing macrophage activaiton.A: Quantitative analyses of mRNA levels of Irf-4 (interferon regulatory factor 4), Stat6 (signal transducer and activator of transcription 6), C/ebp-β (CCAAT/enhancer binding protein β), and Stat3 (signal transducer and activator of transcription 3) in alveolar macrophages after p21 overexpression; B: Quantitative analyses of mRNA levels of Irf-4, Stat6, C/ebp-β, and Stat3 in alveolar macrophages after p21 knockdown; C: The graphic abstract of this study. n = 3, mean ± SEM. *P < 0.05, **P < 0.01 vs Ad-Con. Arg1: Arginase 1 |
博来霉素所致的小鼠肺纤维化模型是最常用的肺纤维化模型[22]。博来霉素损伤引起炎症反应, 由自由基的过量产生触发, 诱导促炎性细胞因子以及巨噬细胞和嗜中性粒细胞的活化。目前存在单次高剂量和多次低剂量2种诱导模型。单次博来霉素损伤导致的肺纤维化模型, 通常在最初7天引起炎症反应和上皮细胞凋亡增加, 与急性肺损伤非常相似。随后是过渡期3天, 在该过渡期之后, 炎症消退并出现纤维化的病理改变。纤维化阶段持续至博来霉素损伤后3~4周。然而, 研究发现该模型所致的纤维化在损伤45天后已经自发性消退和恢复。而多次博来霉素损伤所致的肺纤维化模型, 在最后一次博来霉素滴注后10周, 纤维化仍持续, 这表明其处于慢性纤维化状态。此外, 该模型炎症较少, 更符合纤维化患者的病理特点[23]。这种新模型可以使人们深入了解肺纤维化的慢性纤维化阶段, 是迄今为止其他肺纤维模型所缺乏的, 因此, 本研究使用了更符合患者病理特征的多次博来霉素刺激模型。
近年来, 肺纤维化的发病率和致死率呈不断上升趋势, 尽管尼达尼布和吡非尼酮已被美国食品药品监督管理局(Food and drug administration, FDA)批准用于肺纤维化的治疗, 但这2种药物也仅能延缓肺纤维化的发病, 并不能逆转纤维化的病理改变[24]。大量研究证实, 由浸润肺组织的免疫细胞和受损肺上皮细胞分泌的多种促纤维化的细胞因子和生长因子是促进原位成纤维细胞或周围细胞转变成肌成纤维细胞的重要信号, 因此也是促进纤维化的重要原因[25]。在肺纤维化组织中, 巨噬细胞被证实存在于活化的肌成纤维细胞的周围, 是肺组织慢性炎症的诱因。肺纤维化组织中肺泡巨噬细胞主要为替代活化型, 其可通过释放大量的促纤维化因子促进肺纤维化效应器细胞肌成纤维细胞的活化[9, 10]。因此, 靶向抑制肺部巨噬细胞的活化有望扭转抑制性的免疫微环境, 促进肺纤维化的转归。基于此, 本研究初步阐明了肺泡巨噬细胞活化的调控机制, 为肺纤维化的靶向治疗提供了理论依据。
p21蛋白是一种重要的细胞周期依赖性蛋白酶的抑制因子[10]。近年来, 大量研究证实p21在纤维化发病过程中发挥了重要的作用, 包括肝纤维化、肺纤维化以及肾纤维化等[26, 27]。其中报道最多的是p21在肺纤维化中的作用[24-26]。已有研究发现, 肺组织内过表达p21能够增加细胞的抗凋亡能力, 从而抑制博来霉素所致小鼠肺纤维化, 该研究提示, 诱导p21表达可能是纤维化治疗的一个有效策略[28]。然而, 也有研究证实p21在肺纤维化组织中表达增加, 降低II型上皮细胞内p21的表达抑制博来霉素所致的上皮细胞老化, 进而逆转肺纤维化[29]。以上结果提示, p21可能在肺纤维化发病过程中, 尤其是肺组织的不同细胞类型中发挥了完全不同的作用。本研究发现, 博来霉素损伤导致肺泡巨噬细胞中p21表达增加。敲低模型组小鼠肺泡巨噬细胞中p21的表达抑制了肺泡巨噬细胞活化标志蛋白的表达, 并逆转巨噬细胞的促纤维化表型。此外, 过表达正常肺泡巨噬细胞中的p21可促进巨噬细胞促纤维化表型的转化。结果提示, 靶向降低肺泡巨噬细胞中的p21可能是肺纤维化治疗的一个有效策略。然而本研究并未阐明肺泡巨噬细胞p21上调的分子机制, 后续将从mRNA水平和蛋白稳定性水平探究调控p21表达上调的分子机制。同时, 还需在整体动物水平证实p21在肺纤维化发生发展中的作用。
大量研究证实p21参与巨噬细胞活性的调控。Trakala等[18]发现p21缺失可增强LPS诱导的NF-κB信号通路, 促进巨噬细胞转化为经典活化的巨噬细胞。该结果提示增加p21的表达能够抑制巨噬细胞活化为经典活化的巨噬细胞, 可能是炎症相关疾病的有效治疗策略。然而, Rackov等[21]发现p21通过改变活化型p65-p50和抑制型p50-p50 NF-κB之间的平衡调控巨噬细胞的重编程。p21缺失可降低p50-p50同源二聚体的DNA结合能力, 增加IFN-β产生, 进而抑制巨噬细胞转化为替代活化的巨噬细胞。这项研究证实p21过表达促进巨噬细胞向替代活化的巨噬细胞的转化。本研究结果进一步证实了该结论。巨噬细胞的活化受多种转录因子的调控, 本研究发现p21调控多种转录因子的表达, 提示p21可能通过诱导转录因子的表达促进巨噬细胞的促纤维化表型, 但在肺纤维化发展过程中, p21如何诱导转录因子的表达促进肺泡巨噬细胞促纤维化表型的转化有待进一步研究。
综上所述, 本研究结果表明, 肺纤维化组织中肺泡巨噬细胞表现为促纤维化表型, 博来霉素损伤诱导肺泡巨噬细胞中p21表达上调, 过表达的p21促进肺泡巨噬细胞促纤维化表型的转化(图 6C)。本研究将有助于深入理解肺纤维化的发病机制, 并为临床治疗肺纤维化提供新的理论依据。
作者贡献:魏旭鹏负责原代细胞分离培养及表型分析实验; 王婉玉、李云炫和刘畅参与了部分细胞实验; 吕晓希参与了数据分析及文献整理; 刘姗姗和赵燕燕是文章框架的构思者及负责人。
利益冲突:所有作者均不存在利益冲突。
| [1] |
Noble PW, Barkauskas CE, Jiang D. Pulmonary fibrosis:patterns and perpetrators[J]. J Clin Invest, 2012, 122: 2756-2762. DOI:10.1172/JCI60323 |
| [2] |
Meneghin A, Hogaboam CM. Infectious disease, the innate immune response, and fibrosis[J]. J Clin Invest, 2007, 117: 530-538. DOI:10.1172/JCI30595 |
| [3] |
King TE Jr, Pardo A, Selman M. Idiopathic pulmonary fibrosis[J]. Lancet, 2011, 378: 1949-1961. DOI:10.1016/S0140-6736(11)60052-4 |
| [4] |
Gordon S, Martinez FO. Alternative activation of macrophages:mechanism and functions[J]. Immunity, 2010, 32: 593-604. DOI:10.1016/j.immuni.2010.05.007 |
| [5] |
He C, Ryan AJ, Murthy S, et al. Accelerated development of pulmonary fibrosis via Cu, Zn-superoxide dismutase-induced alternative activation of macrophages[J]. J Biol Chem, 2013, 288: 20745-20757. DOI:10.1074/jbc.M112.410720 |
| [6] |
Larson-Casey JL, Deshane JS, Ryan AJ, et al. Macrophage Akt1 kinase-mediated mitophagy modulates apoptosis resistance and pulmonary fibrosis[J]. Immunity, 2016, 44: 582-596. DOI:10.1016/j.immuni.2016.01.001 |
| [7] |
Pechkovsky DV, Prasse A, Kollert F, et al. Alternatively activated alveolar macrophages in pulmonary fibrosis-mediator production and intracellular signal transduction[J]. Clin Immunol, 2010, 137: 89-101. DOI:10.1016/j.clim.2010.06.017 |
| [8] |
Redente EF, Keith RC, Janssen W, et al. Tumor necrosis factor-alpha accelerates the resolution of established pulmonary fibrosis in mice by targeting profibrotic lung macrophages[J]. Am J Respir Cell Mol Biol, 2014, 50: 825-837. DOI:10.1165/rcmb.2013-0386OC |
| [9] |
Byrne AJ, Maher TM, Lloyd CM. Pulmonary macrophages:a new therapeutic pathway in fibrosing lung disease?[J]. Trends Mol Med, 2016, 22: 303-316. DOI:10.1016/j.molmed.2016.02.004 |
| [10] |
Harper JW, Adami GR, Wei N, et al. The p21 Cdk-interacting protein Cip1 is a potent inhibitor of G1 cyclin-dependent kinases[J]. Cell, 1993, 75: 805-816. DOI:10.1016/0092-8674(93)90499-G |
| [11] |
Allouch A, David A, Amie SM, et al. p21-mediated RNR2 repression restricts HIV-1 replication in macrophages by inhibiting dNTP biosynthesis pathway[J]. Proc Natl Acad Sci U S A, 2013, 110: E3997-E4006. DOI:10.1073/pnas.1306719110 |
| [12] |
Van den Broeke C, Radu M, Chernoff J, et al. An emerging role for p21-activated kinases (Paks) in viral infections[J]. Trends Cell Biol, 2010, 20: 160-169. DOI:10.1016/j.tcb.2009.12.005 |
| [13] |
Zhu B, Symonds AL, Martin JE, et al. Early growth response gene 2(Egr-2) controls the self-tolerance of T cells and prevents the development of lupuslike autoimmune disease[J]. J Exp Med, 2008, 205: 2295-2307. DOI:10.1084/jem.20080187 |
| [14] |
Chen H, Li C, Huang J, et al. CD4+ T cells from elite controllers resist HIV-1 infection by selective upregulation of p21[J]. J Clin Invest, 2011, 121: 1549-1560. DOI:10.1172/JCI44539 |
| [15] |
Lloberas J, Celada A. p21(waf1/CIP1), a CDK inhibitor and a negative feedback system that controls macrophage activation[J]. Eur J Immunol, 2009, 39: 691-694. DOI:10.1002/eji.200939262 |
| [16] |
Arias CF, Ballesteros-Tato A, García MI, et al. p21CIP1/WAF1 controls proliferation of activated/memory T cells and affects homeostasis and memory T cell responses[J]. J Immunol, 2007, 178: 2296-2306. DOI:10.4049/jimmunol.178.4.2296 |
| [17] |
Daszkiewicz L, Vázquez-Mateo C, Rackov G, et al. Distinct p21 requirements for regulating normal and self-reactive T cells through IFN-γ production[J]. Sci Rep, 2015, 5: 7691. DOI:10.1038/srep07691 |
| [18] |
Trakala M, Arias CF, García MI, et al. Regulation of macrophage activation and septic shock susceptibility via p21(WAF1/CIP1)[J]. Eur J Immunol, 2009, 39: 810-819. DOI:10.1002/eji.200838676 |
| [19] |
Scatizzi JC, Mavers M, Hutcheson J, et al. The CDK domain of p21 is a suppressor of IL-1β-mediated inflammation in activated macrophages[J]. Eur J Immunol, 2009, 39: 820-825. DOI:10.1002/eji.200838683 |
| [20] |
Mavers M, Cuda CM, Misharin AV, et al. Cyclin-dependent kinase inhibitor p21, via its C-terminal domain, is essential for resolution of murine inflammatory arthritis[J]. Arthritis Rheum, 2012, 64: 141-152. DOI:10.1002/art.33311 |
| [21] |
Rackov G, Hernández-Jiménez E, Shokri R, et al. p21 mediates macrophage reprogramming through regulation of p50-p50 NF-κB and IFN-β[J]. J Clin Invest, 2016, 126: 3089-3103. DOI:10.1172/JCI83404 |
| [22] |
Mouratis MA, Aidinis V. Modeling pulmonary fibrosis with bleomycin[J]. Curr Opin Pulm Med, 2011, 17: 355-361. DOI:10.1097/MCP.0b013e328349ac2b |
| [23] |
Degryse AL, Tanjore H, Xu XC, et al. Repetitive intratracheal bleomycin models several features of idiopathic pulmonary fibrosis[J]. Am J Physiol Lung Cell Mol Physiol, 2010, 299: L442-L452. DOI:10.1152/ajplung.00026.2010 |
| [24] |
Richeldi L, Collard HR, Jones MG. Idiopathic pulmonary fibrosis[J]. Lancet, 2017, 389: 1941-1952. DOI:10.1016/S0140-6736(17)30866-8 |
| [25] |
Mi S, Li Z, Liu H, et al. Blocking IL-17A protects against lung injury-induced pulmonary fibrosis through promoting the activation of p50NF-κB[J]. Acta Pharm Sin (药学学报), 2012, 47: 739-744. |
| [26] |
Zheng J, Dong P, Mao Y, et al. LincRNA-p21 inhibits hepatic stellate cells activation and liver fibrogenesis via p21[J]. FEBS J, 2015, 282: 4810-4821. DOI:10.1111/febs.13544 |
| [27] |
Inoshima I, Kuwano K, Hamada N, et al. Induction of CDK inhibitor p21 gene as a new therapeutic strategy against pulmonary fibrosis[J]. Am J Physiol Lung Cell Mol Physiol, 2004, 286: L727-L733. DOI:10.1152/ajplung.00209.2003 |
| [28] |
Blundell R, Kaminski N, Harrison D, et al. Increase in p21 expression independent of the p53 pathway in bleomycin-induced lung fibrosis[J]. Exp Mol Pathol, 2004, 77: 231-237. DOI:10.1016/j.yexmp.2004.07.003 |
| [29] |
Jiang C, Liu G, Luckhardt T, et al. Serpine 1 induces alveolar type Ⅱ cell senescence through activating p53-p21-Rb pathway in fibrotic lung disease[J]. Aging Cell, 2017, 16: 1114-1124. DOI:10.1111/acel.12643 |
 2020, Vol. 55
2020, Vol. 55


