化疗是恶性肿瘤目前治疗的主要方式之一, 常用的一线化疗药物可通过干扰核酸的合成代谢、抑制有丝分裂、抑制蛋白质合成及干扰DNA复制等[1]机制, 有效抑制癌细胞增殖。然而这些化疗药物存在体内快速清除、非特异性分布、肿瘤多药耐药性(multidrug resistance, MDR)等诸多不足, 严重降低了抗肿瘤疗效, 并易造成对正常组织的毒副作用。随着科学技术的发展, 相继出现了许多新的肿瘤治疗方式。光热治疗(photothermal therapy, PTT)是一种非侵入性肿瘤治疗方法, 采用近红外激光(NIR, 波长700~1 400 nm)激发光热试剂, 使其将吸收的近红外光能转化为有效热能, 通过热消融杀死肿瘤细胞, 具有高选择性、无毒性、易于操作等特点[2], 但由于存在肿瘤异质性和深度组织光热转化效率低等问题, 单一光热疗法根除肿瘤的结果仍然不理想。研究表明光热治疗可能上调肿瘤细胞内的热休克蛋白(heat shock proteins, HSPs), 继而增加癌细胞的热应激耐受性并降低热效应, 导致产生的热量不足以杀死肿瘤细胞[3, 4]。因此, 将多种药物或治疗模式联合应用, 构建多模式协同治疗体系以提升治疗效果和降低化疗药物毒性, 具有重要意义。目前, 光热疗法联合传统化疗, 表现出较好的协同抗肿瘤效果[5], 但如何将化疗药物和光热试剂专属高效的递送到肿瘤组织, 是该联合抗肿瘤模式应用中亟需解决的重要问题。近年来随着纳米材料和纳米医学的快速发展, 多功能纳米载体为抗肿瘤药物的高效传递带来了光明。因此, 本文将从光热治疗与化疗联合的作用机制、采用纳米共传递两种治疗物质的抗肿瘤优势、常用于两者联合治疗的纳米载体类型、纳米共载的方式等角度, 对基于纳米共递送的光热治疗和化疗联合抗肿瘤(图 1)现状进行综合分析, 为开发高效低毒的肿瘤治疗策略提供新的思路。
|
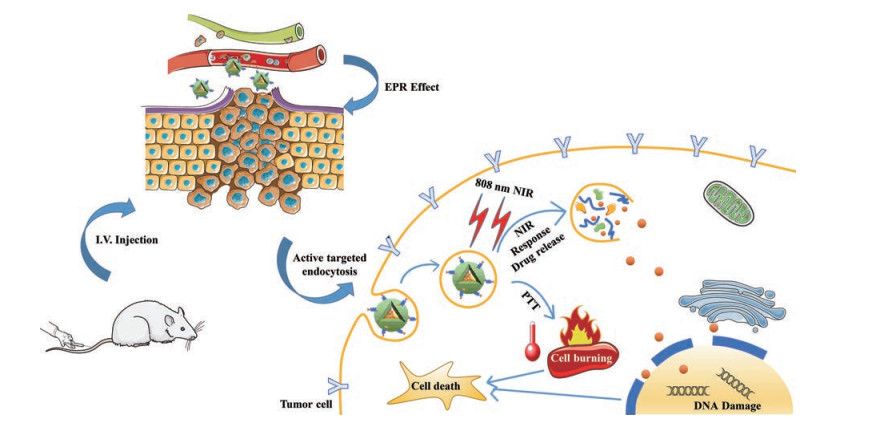
Figure 1 Schematic diagram of combined therapy. EPR: Enhanced permeability and retention; NIR: Near-infrared; PTT: Photothermal therapy |
光热治疗过程由于光热物质的热转化效应, 使局部组织/细胞温度超过40 ℃, 从而促使肿瘤细胞蛋白变性, 同时产生的热量提高了药物与肿瘤细胞DNA之间的交联和化学反应速率, 并抑制化疗后肿瘤细胞中DNA修复酶的活性, 扰乱细胞DNA合成和修复, 导致癌细胞的死亡[6]。此外, 光热治疗产生的高热不仅能促进纳米药物通过渗透滞留效应(enhanced permeability and retention effect, EPR效应)集中于肿瘤组织, 提高细胞膜的渗透性, 加速癌细胞对纳米制剂的摄取来提升化疗药物在细胞内的堆积, 还可以提高化疗药物在肿瘤微环境的溶解度并加速其热运动, 进一步加速药物的释放, 增强化疗效率。Zhang等[7]设计了一种包载前药透明质酸-甲氨蝶呤结合体的氧化石墨烯纳米体系, 旨在实现基于肿瘤靶向策略的光热治疗和化疗联合治疗, 研究结果显示, 给予808 nm激光照射后, 对HeLa细胞增殖抑制作用最强的为联合给药制剂组, 对HeLa细胞接种造模的BALB/C裸鼠肿瘤组织增长具有高效的协同抑制效应。Feng等[6]制备了具有良好肿瘤靶向性和近红外响应的药物传递系统(PEG-DOX-IONP@HMCuS), 即将中空介孔CuS纳米粒(HMCuS NPs)与超顺磁性氧化铁纳米粒(IONPS)结合用于递送化疗药物多柔比星(DOX), 并用近红外激光(808 nm, 2 W·cm-2)照射包载DOX的光热材料纳米处理细胞3 min后, DOX在MCF-7细胞内呈爆发性释放, 释放率约为57.8%, 高浓度DOX大量进入细胞核从而显著增强细胞毒性作用, 可能是因为光热材料产生的高温破坏了膜结构生物完整性, 使其通透性增强, 增加化疗药物在细胞核的高度蓄积。
1.2 光热治疗增强肿瘤细胞对化疗药物的敏感性光热治疗产生的高热能改变药物在体内的代谢方式与途径, 从而有效地改变化疗药物的作用活性, 提高肿瘤细胞对化疗药物的敏感程度。某些化疗药物在37 ℃下几乎不表现出细胞毒性作用, 但在热作用下可改变化疗药物的化学结构从而对细胞产生毒性作用。例如在37 ℃下苯甲醛几乎没有抗肿瘤作用, 但当其在42 ℃或43 ℃温热作用下会阻碍生物膜的活动和乳酸的通透性, 从而使癌细胞内pH值进一步下降, 增强苯甲醛的抗肿瘤活性[8]。另外, 光热治疗产生的局部高温能直接增强某些常用化疗药物的细胞毒性。当环磷酰胺、顺铂、卡铂、卡氮芥等化疗药物与光疗协同作用于癌细胞时, 随着肿瘤局部温度从37 ℃升高到40 ℃, 这些药物的细胞毒性作用呈线性的增强。Urano等[9]的研究进一步表明在局部温度上升到40.5~43.0 ℃时能最大程度地增强化疗药物的毒性。
1.3 光热治疗诱导肿瘤免疫功能激活光热治疗产生的高热能增强机体的固有免疫和获得性免疫功能, 与化疗药物联合应用, 明显减轻化疗药物导致的机体免疫抑制状态, 提高机体抗肿瘤能力。研究发现恶性肿瘤患者免疫功能之所以低下, 其部分原因为肿瘤细胞自身会分泌可溶性免疫抑制因子[10], 如IL-10、TGF-β和BAY 11-7082等, 抑制免疫细胞发挥正常的功能, 最终将直接导致免疫系统的崩溃。Li等[11]构建了一种具有巨噬细胞极化调控作用的光热-化疗联合应用仿生白蛋白修饰金纳米棒, 通过给予近红外照射, 可抑制肿瘤组织M1型巨噬细胞向M2型巨噬细胞转化, 促使M1表型巨噬细胞分泌抗肿瘤细胞因子或直接“吞噬”肿瘤细胞, 下调肿瘤组织内M2型肿瘤相关巨噬细胞数量, 产生更多的抗肿瘤细胞因子, 并协同化疗促进了肿瘤细胞凋亡。
1.4 光热治疗联合化疗克服肿瘤细胞的多药耐药性多药耐药性(multidrug resistance, MDR)是化疗失败的重要原因之一。研究者们发现通过高温引发的线粒体功能障碍来抑制ATP的生成及释放治疗药物可能是克服MDR的有效策略。例如Tu等[12]以三嗪为原料合成了具有pH触发的共载化疗药物DOX的纳米石墨薄片(NG), 并对其进行功能化改性, 然后用超支化聚甘油胺(HPGNH2)对其进行修饰, 将线粒体靶向配体三苯基膦(TPP)偶联到纳米制剂的表面, 在近红外激光的照射下纳米体系产生的高热能扰乱线粒体功能和抑制ATP的产生, 继而抑制多药耐药基因和多药耐药相关蛋白的表达, 有效的逆转了肿瘤MDR, 以提高化疗效果。Xing等[13]成功合成了能高效载荷DOX和药物外排抑制剂TPGS (D-α-生育酚聚乙二醇1000琥珀酸酯)的介孔聚多巴胺纳米粒(MPDA), 通过NIR照射可加速纳米从细胞内涵体中逸出并将负载的药物释放到细胞质中, 实现逆转肿瘤MDR, 增强对MCF-7/ADR细胞的细胞毒性。
2 光热治疗/化疗联合纳米共载的优势 2.1 增加光热试剂和化疗药物溶解度大多数光热试剂和化疗药物都是疏水性的, 因此在进行治疗时最大的问题在于药物血液溶解度低, 从而大大降低了后续的治疗效果, 随着纳米技术的发展, 此难题也随之而解。脂质体内的亲水部分及磷脂双分子层围成的疏水部分, 可以分别负载疏水性及亲水性药物, 为共递送治疗剂提供了有利条件; 两亲性嵌段聚合物的浓度一旦超过其临界聚集浓度, 就会自组装形成聚合物胶束, 内层疏水核可以包封水不溶性药物, 外层亲水壳有利于延长其血液循环时间, 从而大大改善药物溶解度; 另外还可以利用合适的连接基团将药物小分子共价连接到线性聚合物的侧链上, 形成聚合物-药物结合物从而达到增溶的效果。Sun等[14]制备了气泡型光热响应纳米陶瓷体, 该陶瓷体的结构与脂质体类似, 具有双分子层, 利用其内部疏水空间共同包载了DOX和DiR (细胞膜近红外荧光探针), 显著提高了两者在血液中的溶解度, 实现了基于CO2促进DOX释放的光热化疗协同抗肿瘤效应。
2.2 提高光热试剂和化疗药物体内稳定性光热试剂和化疗药物在体内到达靶部位前保持稳定而不被降解或清除, 直接影响光热治疗和化疗效率。光热试剂和化疗药物经纳米载体递送, 不仅使其到达作用部位前保持结构的完整性, 从而提高生物活性, 而且能逃避吞噬细胞的内吞作用, 显著延长药物的循环时间, 增加生物利用度和减少毒副作用; 同时形成的纳米制剂很容易内吞入靶细胞, 不易外排, 从而使光热试剂和药物免遭生物侵蚀[15]。例如, 吲哚菁绿(ICG)是被美国FDA批准的一种用途广泛的近红外有机光热转换材料, 然而ICG的一些物理化学特性, 如浓度依赖的聚集性、水稳定性差、与蛋白质的非特异性结合和缺乏特异性靶点等, 限制了ICG的应用[16]。Song等[17]对在825 nm处有较强近红外吸收能力的纳米粒IR825进行了PEG修饰, 得到具有良好水溶性和稳定性的IR825-PEG纳米胶束, 与游离ICG相比, 在808 nm光辐射下, 具有良好的光热效应和光稳定性并延长了其血液循环时间。
2.3 统一光热试剂和化疗药物的体内药动学行为及提高两者的肿瘤靶向性在联合治疗中, 光热试剂和化疗药物以游离形式应用时, 常因两者具有不同的药动学行为, 难以保证两者以最佳配比进入肿瘤组织, 达到最佳联合效果。然而通过纳米载体将两者共递送时, 有利于统一其在体内的药动学行为[18]。Houdaihed等[19]研究了一种共递送紫杉醇和依维莫司的聚合物纳米粒, 两者在体内半衰期分别为5.8和30 h, 由于不同的药代动力学行为, 故通过制备聚合物纳米载体, 使紫杉醇和依维莫司能够在体内维持最优比率1:0.5, 从而精准地控制联合用药在肿瘤部位的比率和联合抗肿瘤效果。同时, 相比于正常组织而言, 肿瘤组织血管丰富, 结构完整性差, 不仅血管内皮细胞缺损及血管壁间隙较宽, 而且淋巴回流受阻, 继而可使得载药纳米制剂通过EPR效应被动靶向于同一肿瘤部位发挥联合治疗疗效。但经文献检索, 目前尚未有研究对光热试剂和化疗药物经纳米材料共载前后的体内药动学对比研究, 其原因可能是①游离态的光热试剂如ICG在血液循环中很容易被机体消除或降解; ②光热试剂在被纳米载体包裹后其自身呈一种团聚状态而发生荧光自淬灭, 从而不显或只显示微弱的荧光, 很难对其即时定位。但已有大量研究证实了纳米共载策略对于药物共载的优势, 说明纳米共载有利于光热剂和药物的共传递。
2.4 控制光热试剂和化疗药物在细胞/瘤内的释放纳米给药系统可以通过调节纳米制剂的结构, 从而能控制被包载的联用药物在不同刺激下的释放响应机制和释放速率, 实现了其在肿瘤部位的定点、定量和实时的释放, 使得给药过程更为精准, 提高联合作用的效果。在肿瘤治疗中常用的刺激响应方式主要包括内源性响应(如pH型、缺氧型、还原型、酶响应型等)和外源性响应(温度、磁场、超声波、光等), 例如研究人员[20]研制了包载DOX的磁靶向光敏脂质体(DOX-Fe3O4@TSL), 其不仅能够通过磁靶向作用使纳米制剂聚集在肿瘤部位, 而且当光疗引起高于生理温度的相变温度时, 该纳米制剂会从胶晶态转变为液晶态继而导致磷脂双分子层的通透性增加, 促进DOX的释放。Huang等[21]设计了一种具有光和pH双重响应的纳米制剂(IR820-LA-DOX@GO), 当用近红外光照射时, 光热试剂衍生物IR820-LA将光能转化为热能, 不仅可直接消融部分肿瘤细胞, 而且与肿瘤部位的异常低pH值环境协同促进了DOX的释放。
3 联合抗肿瘤的常用纳米载体类型及特点 3.1 有机纳米材料有机纳米载体主要包括聚合物胶束、聚合纳米颗粒、脂质体和树枝状大分子等, 其优点是具有良好的生物相容性, 且本身在体内易被降解, 因而毒性比其他载体低, 另外有机纳米粒具有特殊的疏水结构, 可用于装载药物和控制药物的释放。
3.1.1 聚合物胶束聚合物胶束有着很高的热稳定性和动力学稳定性, 可以通过调整嵌段共聚物的结构和组成来优化药物载体性能[22], 如Zhang等[23]设计了一种新型的基于两亲性共聚物聚己内酯-β-聚乙二醇-β-聚己内酯(PCL-ss-PEG-ss-PCL)、聚己内酯-缩醛-聚乙二醇(PCL-acetal-PEG)和1, 2-二硬脂酰-sn-甘油-3磷乙醇胺-N-[叶酸酯(聚乙二醇2000)] (DSPE-PEG 2000-folate)的pH/还原物双重响应聚合物胶束, 化疗药物DOX和光热剂ICG被共同包封于该纳米胶束中, 用于近红外成像和靶向化学-光热联合治疗。该聚合物胶束由于PEG的修饰从而延长了体内循环时间, 增强了EPR效应, 同时由于叶酸的介导使该聚合物胶束能够精确靶向肿瘤细胞, 提高了联合治疗效果。
3.1.2 脂质体脂质体是纳米级的由同心脂质双层膜构成的小泡, 能在细胞膜中携带脂溶性的物质(如亲脂性药物和蛋白质), 以及亲水性分子(如亲水性药物和核酸材料)。此外, 脂质体具有极强的生物相容性、可降解性和低免疫原性。Nguyen等[24]将光热试剂聚吡咯和雷帕霉素共载于曲妥珠单抗偶联脂质体中, 通过靶向乳腺癌的HER2/neu受体, 实现光热治疗和化疗联合的肿瘤靶向应用。该脂质体体系粒径为172.2 ± 9.6 nm, 同时表现出良好的分散性。体外细胞实验表明, 乳腺癌细胞对该脂质体共载物的摄取率很高, 可能由于脂质体的脂双层结构与细胞膜的结构相似, 其允许脂质-脂质交换, 通过EPR效应被动靶向癌细胞, 再结合表面抗体主动靶向, 从而最终实现化疗剂雷帕霉素在靶细胞的浓度高度集中, 抗癌疗效大大增强。
3.2 无机纳米材料与传统的有机药物载体相比, 无机纳米载体不仅具有独特的光学、磁学、电学及物理学性能, 而且其在水溶液中具有高分散性、物理稳定性好、粒子大小及形态简单可控、易于表面修饰, 因此在药物载体方面展现出良好的前景, 如金属纳米粒、四氧化三铁、碳基纳米材料和二氧化硅等。
3.2.1 金属纳米材料金属纳米材料主要包括金、银、铂等, 尤其以金纳米棒(gold nanorod, GNR)最常应用, 它作为一种纳米载体, 不仅载药量较高, 而且在近红外光源的照射下能将光能转化为热能从而直接杀死癌细胞[25]。另外, 为了避免GNR在溶液中发生团聚, 提高其稳定性和生物相容性, 研究者们常对粒子表面进行功能化以实现多种可能的生物医学应用, 如Liao等[26]制备了聚合物修饰的GNR来递送DOX, 从而实现了光热化疗的协同治疗。为了减少相关的细胞毒性, 两亲性嵌段共聚物mPEG-PCL通过静电吸附用于对GNR进行表面修饰。
3.2.2 碳基纳米材料自1985年Smalley及其同事发现富勒烯以来, 研究者们陆续又发现了很多纳米尺寸级别的同素异形体, 如石墨烯、碳纳米管和碳点等, 其中由碳原子形成的碳纳米管具有一维空心管状体结构, 其独特的结构和性质使得碳纳米管逐渐应用于材料、催化和生命科学等领域, 尤其是在肿瘤治疗方面, 已经成为高效递送药物和生物分子的候选物[27, 28]。另外, 碳纳米管自身不仅由于具有高表面积/体积比可作为纳米递送载体, 而且在近红外照射后具有超强的生热能力, 可作为光热试剂产生局部高温, 因而能直接杀死癌细胞或与化疗药物产生协同杀伤作用。Zhang等[29]开发了一种具有优秀的磁性和荧光特性的磁荧光碳纳米管(EGFR-DOX-GdN@CQDs-MWCNTs), 用于磁共振和荧光双重成像和光热/化学治疗。他们发现该纳米制剂具有很强发热能力, 并且由于修饰了EGFR抗体而具有精准的肿瘤靶向能力。药物递送实验表明, 该复合型碳纳米管同时具有pH值和热响应药物释放行为。
3.2.3 介孔二氧化硅二氧化硅由于其良好的生物相容性、较高的孔隙率、较大的比表面积及较好的稳定性, 从而备受广大研究者的关注。纳米多孔二氧化硅作为药物载体, 可以通过其纳米孔道结构形貌、对孔道的控制及表面功能化修饰来实现药物的速释、缓释及pH值或温度敏感释放[30]。如Gao等[31]利用空间受限电偶替换法, 分别以金纳米粒和介孔二氧化硅为卵黄和外壳, 构建了GC-PtAu@mSiO2-TD纳米体系, 作为一种具有有效光热转化效率的优良药物纳米载体, 充分利用Au@mSiO2框架的高温响应性能, 创造性地将相变材料1-十四醇(TD)用作门控, 智能控制顺铂的释放。然后将活性靶向七肽甘氨酸-半胱氨酸-甘氨酸-丙氨酸-丙氨酸-天冬酰胺-亮氨酸(GCGAANL)修饰在制备的纳米框架表面, 在近红外光照射下, 该纳米体系不仅表现出较高的局部温度响应, 而且促进了内部化疗药物的快速释放, 从而提高了化疗疗效。同时, 激光共聚焦显微镜和流式细胞图表明, 该肽促进了MGC-803细胞内对纳米制剂的摄取。
3.2.4 其他类型无机纳米材料其他类型的纳米载体还有很多种, 如硫化铜、黑磷等。中空介孔硫化铜(HMCuS)纳米粒的中空空腔和孔道结构均可荷载客体物质, 比表面积较大, 载药能力较强, Wang等[32]合成了透明质酸修饰的中空介孔硫化铜纳米递药体系(HA-DOX@HMCuS), 其中透明质酸为“盖帽剂”修饰在HMCuS表面, 形成紧密的层状结构, 有效防止HMCuS内部药物分子在体循环过程中泄漏, 最终可实现光热治疗-光动力治疗-化疗的联合治疗作用。此外, Chen等[33]提出了一种基于黑磷(black phosphorus, BP)纳米片的药物递送系统, 也可用于协同作用的光动力/光热/化学疗法。他们发现BP比报道的2D材料在表面上能容纳更多量的DOX。该药物递送系统不仅具有高效的药物装载效率和智能的pH/光响应性药物释放体系, 而且能够产生1O2和光热活性以增强抗癌药物的治疗效果。目前, 光热治疗联合化疗药物抗肿瘤的其他常用纳米载体类型及特点的研究报道见表 1[34-64]。
| Table 1 The previous reported combination cases between photothermal therapy and chemotherapeutics based on nano-carriers encapsulation. HA: Hyaluronic acid; FA: Folic acid; ICG: Indocyanine green; DOX: Doxorubicin; PEG-PCL-PNIPAM: Poly(ethylene glycol)-poly(ε-caprolactone)-poly(nisopropylacrylamide); PLGA: Poly(lactic-co-glycolic acid); NIPAM: N-[5-(phenylamino)-2, 4-pentadienyl-ene]aniline hydrochloride; MACyanine : Acrylated cyanine dye; MCMEMA: 2-[(Methoxy-carbonyl)methoxy]-ethyl methacrylate; TPGS: D-α-tocopheryl polyethylene glycol 1000 succinate; Btz: Bortezomib; DSPE-PEG: 1, 2-Distearoyl-sn-glycero-3-phosphoethanolamine-N-[methoxy(polyethylene glycol)-2000]; Sn38: 7-Ethyl-10-hydroxycamptothecin; PCPTA: 2-(Dodecylthiocarbonothioylthio)-2 methylpropionic acid-camptothecin-2-hydroxylethyl acrylate; PMPC: Poly-2-methacryloxyethylphosphorylcholine; PPy: Polypyrrole; RPM: Rapamycin; PoP: Porphyrin-phospholipid; CQDs: Carbon quantum dots; TSL: Temperature-sensitive-liposomes; G: PAMAM dendrimers generation; MSCs: Mesenchymal stem cells; PAMAMs: Generation 4 PAMAM dendrimer; PAA: Polyacrylic acid; CaP: Calcium phosphate; GSH: Reduced glutathione; SPNS: Ultrasmall Pd nanosheets; ADH: Adipicdihydrazide; NGR: NGR peptides (CNGRCK2HK3HK11); NHBP: Amino-terminated hyperbranched polymer; CMC: Carboxymethyl chitosan; TC: TAT(TAT peptide with the 124 amino acid sequence of YGRKKRRQRRR)-chitosan; PPTA: Polyethylene glycol-COOH (mPEG)-polyethyleneimine (PEI)-3, 4, 5, 6-tetrahydrophthalic anhydride (TA); C-dotsCL: Carbon-dots clathrates; CMCTS: Carboxymethyl chitosan; DMSA: Meso-2, 3-dimercaptosuccinic acid; CS: Chitosan; PNE: Polynorepinephrine; Art: Artemisinin; GCGAANL: Glycine-cysteine-glycine-alanine-alanine-asparagine-leucine; TD: 1-Tetradecanol; GC: Glutamic-modified cisplatin; HAD: Hydroxyapatite; BT: Black TiO2; ACD: Acrylated cyanine dye; BP: Black phosphorus |
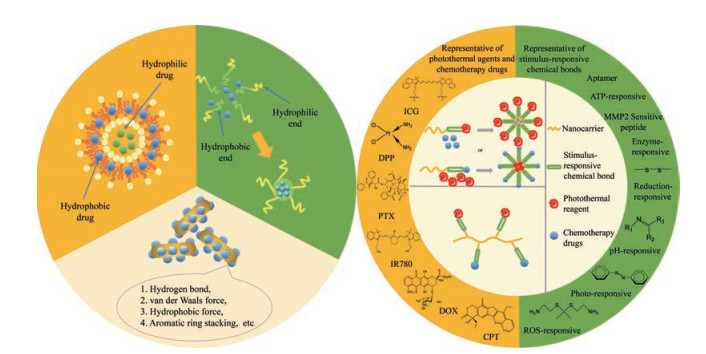
纳米载药体系递送药物的原理既可以是简单的物理包载(图 2左), 也可通过化学键共价作用实现载体与药物的连接(图 2右), 另外也有文献[7, 65]报道两者的联合应用可多级递送更多类型的药物, 以提高纳米共载的效率。
|
Figure 2 Schematic diagram of nano carriers promoting the delivery of photothermal agents/chemotherapy drugs. Left: Physical load; right: Chemical bonding |
材料与药物可通过氢键、弱范德华力、疏水作用力、芳环π-π堆积作用等物理相互作用将药物包埋、吸附或自组装于纳米载体上, 常用的物理包载法主要有透析法、水包油乳化法、固相分离法和微相分离法。物理载药有许多优势, 如制备过程较简单, 反应条件容易控制, 且可以最大程度的保留抗肿瘤药物活性。Luo等[42]通过物理包载的方式将DOX包封在脂质体的类脂质双分子层内, 并同时将合成的聚乙二醇磷脂(DSPE-PEG-2K)掺入脂质体中, 制备了空间稳定的“隐形”脂质体, 可以显著延长DOX的循环时间和增加肿瘤中的药物积累, 增强抗肿瘤功效。Zhang等[29]利用π-π堆积、范德华力和疏水相互作用等分子间作用力将抗癌药物DOX吸附于还原型氧化石墨烯上(rGO)以制备纳米制剂。Zhu等[35]将合成的聚合链(PEG-PCL-PNIPAM)与ICG、DOX通过物理自组装形成了具有pH/氧化还原双重响应的聚合物囊泡。
4.2 化学键合Ringsdorf在20世纪70年代中期首次提出将化学治疗剂与水溶性聚合物共价连接的想法, 在该模型中, 不仅可以调节附着在聚合物载体上的药物的药代动力学, 而且还可以通过将化疗药物负载于聚合物载体上来实现主动靶向。这些纳米制剂的早期临床试验结果表明, 与相应的母体药物相比, 它具有多个优势[66]:首先, 将水溶性差的化疗药物连接到可溶性纳米载体上能改善其水溶性、降低其团聚产生的毒性和增加药物的稳定性; 其次, 将化疗药物连接到纳米载体上可提高药物包封率和递送的靶向性, 从而增强治疗疗效; 最后, 用于键合化药的化学键具有选择多样性, 如pH值敏感(腙键、缩醛、缩酮)、还原敏感(二硫键、二硒键、琥珀酰亚胺-硫醚键)和酶敏感(各种类型的多肽)等, 可以实现所载药物在肿瘤微环境中的响应性释放, 继而提升抗肿瘤疗效。但应注意其制备条件比较剧烈、操作复杂、控制条件比较苛刻, 由于光热试剂及药物与纳米载体之间结合紧密, 不易脱落, 不仅可能影响光热试剂的光热转换效率, 同时也可能无法精确掌握药物的释放程度和速度。如Yang[16]将合成的共聚物与水合肼反应先发生共聚物的酰肼官能团化, 然后利用DOX的氨基与其形成腙键从而使化疗药物负载于纳米共聚物上制得了药物-聚合物纳米制剂。Dong等[52]利用DOX的氨基和多壁碳纳米管上的羧基在偶合剂的作用下可进行缩合反应的原理, 将DOX负载于多壁碳纳米管上从而达到纳米递送药物的目的。
5 结语与展望随着新技术的发展, 光热治疗由于具有微创、可控、高效、特异性强和不良反应少等特点在临床逐渐发展起来。虽然光热治疗疗效显著, 但单一治疗模式难以取得完全根除肿瘤细胞的效果, 本文阐述了将光热治疗与化疗联合治疗肿瘤的策略, 此类联合治疗模式通过两者的优势互补, 不仅可以直接消融部分癌细胞, 加速癌细胞对化疗药物的摄取, 显著逆转癌细胞多药耐药性及降低化疗药物的不良反应, 在短时间内更加高效地杀伤肿瘤细胞, 而且从长远眼光来看可以激活身体的免疫系统, 发挥持续性的抗肿瘤效果。但也存在着一些问题, 如光热试剂的溶解性较低和肿瘤区域靶向性较差, 在体内容易团簇聚集及对近红外光的敏感性较差, 同时无法更加精确地掌控治疗进程等。随着纳米技术的发展和成像设备的出现, 可以通过纳米粒共载光热试剂和化疗药物的手段对肿瘤进行靶向治疗, 并联合荧光、核磁共振、CT等显影技术实现肿瘤诊疗一体化。目前, 光热联合化疗策略已在动物身上取得良好的效果, 但在人体临床应用上遇到了诸多难点, 相信随着光热治疗和纳米技术的不断完善与优化, 光热化疗联合应用将会在肿瘤治疗中发挥更重要的作用。
作者贡献: 胥海婷:论文的撰写和文章整体规划; 吴亿晗:参与文献资料检索与整理; 石金凤和李佳鑫:图表制作; 章津铭:文章思路设计; 傅超美:基金支持。
利益冲突: 所有作者声明没有利益冲突。
| [1] |
Krall N, Scheuermann J, Neri D. Small targeted cytotoxics:current state and promises from DNA-encoded chemical libraries[J]. Angew Chem Int Ed Engl, 2013, 52: 1384-1402. DOI:10.1002/anie.201204631 |
| [2] |
May JP, Li SD. Hyperthermia-induced drug targeting[J]. Expert Opin Drug Deliv, 2013, 10: 511-527. DOI:10.1517/17425247.2013.758631 |
| [3] |
Lal S, Clare SE, Halas NJ. Nanoshell-enabled photothermal cancer therapy:impending clinical impact[J]. Acc Chem Res, 2008, 41: 1842-1851. DOI:10.1021/ar800150g |
| [4] |
Zhang ZJ, Wang J, Chen CY. Near-infrared light-mediated nanoplatforms for cancer thermo-chemotherapy and optical imaging[J]. Adv Mater, 2013, 25: 3869-3880. DOI:10.1002/adma.201301890 |
| [5] |
Hauck TS, Jennings TL, Yatsenko T, et al. Enhancing the toxicity of cancer chemotherapeutics with gold nanorod hyperthermia[J]. Adv Mater, 2008, 20: 3832-3838. DOI:10.1002/adma.200800921 |
| [6] |
Feng QH, Zhang YY, Zhang WX, et al. Programmed near-infrared light-responsive drug delivery system for combined magnetic tumor-targeting magnetic resonance imaging and chemo-phototherapy[J]. Acta Biomater, 2017, 49: 402-413. DOI:10.1016/j.actbio.2016.11.035 |
| [7] |
Zhang HB, Li Y, Pan Z, et al. Multifunctional nanosystem based on graphene oxide for synergistic multistage tumor-targeting and combined chemo-photothermal therapy[J]. Mol Pharm, 2019, 16: 1982-1998. DOI:10.1021/acs.molpharmaceut.8b01335 |
| [8] |
Kang YX. Experimental Study of the Effect of Hyperthermia Combined with Chemotherapy on Lung Cancer Cell Lines (热疗联合化疗对肺癌细胞株作用的实验研究)[D]. Xian: The Fourth Military Medical University, 2008.
|
| [9] |
Urano M, Kuroda M, Nishimura Y. For the clinical application of thermochemotherapy given at mild temperatures[J]. Int J Hyperthermia, 1999, 15: 79-107. DOI:10.1080/026567399285765 |
| [10] |
Kurilin VV, Khantakova JN, Tereschenko VP, et al. The effects of immunosuppressive factors on primary dendritic cells from C57BL/6 and CBA mice[J]. J Immunol Res, 2019, 2019: 7029726. |
| [11] |
Li DD, Zhang M, Xu F, et al. Biomimetic albumin-modified gold nanorods for photothermo-chemotherapy and macrophage polarization modulation[J]. Acta Pharm Sin B, 2018, 8: 74-84. DOI:10.1016/j.apsb.2017.09.005 |
| [12] |
Tu Z, Qiao H, Yan Y, et al. Directed graphene-based nanoplatforms for hyperthermia:overcoming multiple drug resistance[J]. Angew Chem Int Ed Engl, 2018, 57: 11198-11202. DOI:10.1002/anie.201804291 |
| [13] |
Xing YX, Zhang JX, Chen F, et al. Mesoporous polydopamine nanoparticles with co-delivery function for overcoming multidrug resistance via synergistic chemo-photothermal therapy[J]. Nanoscale, 2017, 9: 8781-8790. DOI:10.1039/C7NR01857F |
| [14] |
Sun SH, Sun SJ, Sun Y, et al. Bubble-manipulated local drug release from a smart thermosensitive cerasome for dual-mode imaging guided tumor chemo-photothermal therapy[J]. Theranostics, 2019, 9: 8138-8154. DOI:10.7150/thno.36762 |
| [15] |
Vallet-Regi M, Rámila A, del Real RP, et al. A new property of MCM-41:drug delivery system[J]. Chem Mater, 2001, 13: 308-311. DOI:10.1021/cm0011559 |
| [16] |
Yang R. Construction of Nano Carriers Based on Cyanine Dye Molecular Polymer and Its Application in the Combined Treatment of Tumor Photothermal and Chemotherapy (基于花菁染料分子聚合物纳米运载体的构建及其在肿瘤光热/化疗联合治疗中的应用)[D]. Tianjin: Tianjin University of Technology, 2019.
|
| [17] |
Song XJ, Gong H, Liu T, et al. J-aggregates of organic dye molecules complexed with iron oxide nanoparticles for imaging-guided photothermal therapy under 915-nm light[J]. Small, 2014, 10: 4362-4370. |
| [18] |
Shi JF, Li J, Yang XQ, et al. Antitumor status analysis on the co-delivery systems regarding the active ingredients of Chinese herbs combined with chemotherapeutic drugs[J]. Acta Pharm Sin (药学学报), 2019, 54: 258-268. |
| [19] |
Houdaihed L, Evans J, Allen C. Codelivery of paclitaxel and everolimus at the optimal synergistic ratio:a promising solution for the treatment of breast cancer[J]. Mol Pharm, 2018, 15: 3672-3681. DOI:10.1021/acs.molpharmaceut.8b00217 |
| [20] |
Huang DH. Preparation of Doxorubicin Magnetic Targeting Photosensitive Liposomes and Its Application in Combined Therapy of Tumor Photothermal-chemotherapy (多柔比星磁靶向光敏脂质体的制备及其在肿瘤光热-化疗联合治疗中的应用)[D]. Zhenjiang: Jiangsu University, 2017.
|
| [21] |
Huang CZ, Hu X, Hou ZS, et al. Tailored graphene oxide-doxorubicin nanovehicles via near-infrared dye-lactobionic acid conjugates for chemo-photothermal therapy[J]. J Colloid Interface Sci, 2019, 545: 172-183. DOI:10.1016/j.jcis.2019.03.019 |
| [22] |
Li YM, Zhang H, Zhai GX. Intelligent polymeric micelles:development and application as drug delivery for docetaxel[J]. J Drug Target, 2017, 25: 285-295. DOI:10.1080/1061186X.2016.1245309 |
| [23] |
Zhang LH, Qin Y, Zhang ZM, et al. Dual pH/reduction-responsive hybrid polymeric micelles for targeted chemo-photothermal combination therapy[J]. Acta Biomater, 2018, 75: 371-385. DOI:10.1016/j.actbio.2018.05.026 |
| [24] |
Nguyen HT, Tran TH, Thapa RK, et al. Targeted co-delivery of polypyrrole and rapamycin by trastuzumab-conjugated liposomes for combined chemo-photothermal therapy[J]. Int J Pharm, 2017, 527: 61-71. DOI:10.1016/j.ijpharm.2017.05.034 |
| [25] |
Cui T, Hong J, Ding Y, et al. Research progress of polymer-modified gold nanoparticles in cancer treatment[J]. Acta Pharm Sin (药学学报), 2016, 51: 281-286. |
| [26] |
Liao JF, Li WT, Peng JR, et al. Combined cancer photothermal-chemotherapy based on doxorubicin/gold nanorod-loaded polymersomes[J]. Theranostics, 2015, 5: 345-356. DOI:10.7150/thno.10731 |
| [27] |
Cheng HH, Hu CG, Zhao Y. Graphene fiber:a new material platform for unique applications[J]. NPG Asia Mater, 2014, 6: e113. DOI:10.1038/am.2014.48 |
| [28] |
Dilbaghi N, Kaur H, Kumar R, et al. Nanoscale device for veterinay technology:trends and future prospective[J]. Adv Mater Lett, 2013, 4: 175-184. DOI:10.5185/amlett.2012.7399 |
| [29] |
Zhang M, Wang WT, Wu F, et al. Magnetic and fluorescent carbon nanotubes for dual modal imaging and photothermal and chemo-therapy of cancer cells in living mice[J]. Carbon, 2017, 123: 70-83. DOI:10.1016/j.carbon.2017.07.032 |
| [30] |
Castillo RR, Colilla M, Vallet-Regí M. Advances in mesoporous silica-based nanocarriers for co-delivery and combination therapy against cancer[J]. Expert Opin Drug Deliv, 2016, 14: 229-243. |
| [31] |
Gao ZG, Shi TY, Li YJ, et al. Mesoporous silica-coated gold nanoframes as drug delivery system for remotely controllable chemo-photothermal combination therapy[J]. Colloids Surf B Biointerfaces, 2019, 176: 230-238. DOI:10.1016/j.colsurfb.2019.01.005 |
| [32] |
Wang YT, Zhang ZH, Feng QH, et al. Construction and preliminary study of multifunctional drug delivery system based on hollow mesoporous copper sulfide nanoparticles[J]. Acta Pharm Sin (药学学报), 2019, 54: 1502-1508. |
| [33] |
Chen WS, Ouyang J, Liu H, et al. Black phosphorus nanosheet-based drug delivery system for synergistic photodynamic/photothermal/chemotherapy of cancer[J]. Adv Mater, 2017, 29: 1603864. DOI:10.1002/adma.201603864 |
| [34] |
Hu CY. Polymer Nanoparticle Delivery System for Cancer Chemotherapy-Photothermal Therapy and Immunotherapy (聚合物纳米粒递送系统用于肿瘤化疗-光热治疗和免疫制剂的研究)[D]. Beijing: Peking Union Medical College, 2018.
|
| [35] |
Zhu AJ, Miao K, Deng YB, et al. Dually pH/reduction-responsive vesicles for ultrahigh-contrast fluorescence imaging and thermo-chemotherapy-synergized tumor blation[J]. ACS Nano, 2015, 9: 7874-7885. DOI:10.1021/acsnano.5b02843 |
| [36] |
Da LY. Study on the Construction and Performance of PLGA Nano Therapeutic Agent for Tumor Visible Photothermal/Drug Synergistic Therapy (用于肿瘤可视化光热/药物协同治疗的PLGA纳米诊疗剂的构建及性能研究)[D]. Yangzhou: Yangzhou University, 2018.
|
| [37] |
Zhang RR, Su SS, Hu KL, et al. Smart micelle@polydopamine core-shell nanoparticles for highly effective chemo-photothermal combination therapy[J]. Nanoscale, 2015, 7: 19722-19731. DOI:10.1039/C5NR04828A |
| [38] |
Wang X, Wang CP, Wang XY, et al. A polydopamine nanoparticle-knotted poly(ethylene glycol) hydrogel for on-demand drug delivery and chemo-photothermal therapy[J]. Chem Mater, 2017, 29: 1370-1376. DOI:10.1021/acs.chemmater.6b05192 |
| [39] |
Zhang HH, Sun Yu, Huang R, et al. pH-sensitive prodrug conjugated polydopamine for NIR-triggered synergistic chemo-photothermal therapy[J]. Eur J Pharm Biopharm, 2018, 128: 260-271. DOI:10.1016/j.ejpb.2018.05.013 |
| [40] |
Zhang X, Liu Y, Luo L, et al. A chemo-photothermal synergetic antitumor drug delivery system:Gold nanoshell coated wedelolactone liposome[J]. Mater Sci Eng C Mater Biol Appl, 2019, 101: 505-512. DOI:10.1016/j.msec.2019.04.006 |
| [41] |
Xue X, Fang T, Yin LY, et al. Multistage delivery of CDs-DOX/ICG-loaded liposome for highly penetration and effective chemo-photothermal combination therapy[J]. Drug Deliv, 2018, 25: 1826-1839. DOI:10.1080/10717544.2018.1482975 |
| [42] |
Luo DD, Carter KA, Razi A, et al. Doxorubicin encapsulated in stealth liposomes conferred with light-triggered drug release[J]. Biomaterials, 2016, 75: 193-202. DOI:10.1016/j.biomaterials.2015.10.027 |
| [43] |
Duan WL. Preparation of DOX/IR-780-loaded Liposomes and Its Application in Combined Photothermal-Chemotherapy for Breast Cancer (载DOX/IR-780脂质体的制备及其在乳腺癌光热-化疗联合治疗中的应用)[D]. Guangzhou: Southern Medical University, 2016.
|
| [44] |
Jędrzak A, Grześkowiak BF, Coy E, et al. Dendrimer based theranostic nanostructures for combined chemo- and photothermal therapy of liver cancer cells in vitro[J]. Colloids Surf B Biointerfaces, 2019, 173: 698-708. DOI:10.1016/j.colsurfb.2018.10.045 |
| [45] |
Wang Y, Cui QY, Zhao XS, et al. Gold nanorod-based multifunctional nanocarrier for synergistic chemo-photothermal therapy in tumors[J]. RSC Advances, 2018, 8: 41454-41463. DOI:10.1039/C8RA06176A |
| [46] |
Wu J, Liu Y, Tang YX, et al. Synergistic chemo-photothermal therapy of breast cancer by mesenchymal stem cell-encapsulated yolk-shell GNR@HPMO-PTX nanospheres[J]. ACS Appl Mater Interfaces, 2016, 8: 17927-17935. DOI:10.1021/acsami.6b05677 |
| [47] |
Li GL, Chen YD, Zhang LY, et al. Facile approach to synthesize gold nanorod@polyacrylic acid/calcium phosphate yolk-shell nanoparticles for dual-mode imaging and pH/NIR-responsive drug delivery[J]. Nano-Micro Lett, 2018, 10: 7. DOI:10.1007/s40820-017-0155-3 |
| [48] |
Tang SH, Chen M, Zheng NF. Multifunctional ultrasmall Pd nanosheets for enhanced near-infrared photothermal therapy and chemotherapy of cancer[J]. Nano Res, 2015, 8: 165-174. DOI:10.1007/s12274-014-0605-x |
| [49] |
Shi JJ, Wang L, Zhang J, et al. A tumor-targeting near-infrared laser-triggered drug delivery system based on GO@Ag nanoparticles for chemo-photothermal therapy and X-ray imaging[J]. Biomaterials, 2014, 35: 5847-5861. DOI:10.1016/j.biomaterials.2014.03.042 |
| [50] |
Zhang W, Dai JM, Zhang GY, et al. Photothermal/pH dual-responsive drug delivery system of amino-terminated HBP-modified rGO and the chemo-photothermal therapy on tumor cells[J]. Nanoscale Res Lett, 2018, 13: 379. DOI:10.1186/s11671-018-2787-8 |
| [51] |
Liu W, Zhang XY, Zhou L, et al. Reduced graphene oxide (rGO) hybridized hydrogel as a near-infrared (NIR)/pH dual-responsive platform for combined chemo-photothermal therapy[J]. J Colloid Interface Sci, 2019, 536: 160-170. DOI:10.1016/j.jcis.2018.10.050 |
| [52] |
Dong X, Sun ZT, Wang XX, et al. An innovative MWCNTs/DOX/TC nanosystem for chemo-photothermal combination therapy of cancer[J]. Nanomedicine, 2017, 13: 2271-2280. DOI:10.1016/j.nano.2017.07.002 |
| [53] |
Mei CM, Wang N, Zhu XQ, et al. Photothermal-controlled nanotubes with surface charge flipping ability for precise synergistic therapy of triple-negative breast cancer[J]. Adv Funct Mater, 2018, 28: 1805225. DOI:10.1002/adfm.201805225 |
| [54] |
Pandey S, Gedda GR, Thakur M, et al. Theranostic carbon dots'clathrate-like'nanostructures for targeted photo-chemotherapy and bioimaging of cancer[J]. J Indust Engineer Chem, 2017, 56: 62-73. DOI:10.1016/j.jiec.2017.06.008 |
| [55] |
Guo XM, Li W, Luo LH, et al. External magnetic field-enhanced chemo-photothermal combination tumor therapy via iron oxide nanoparticles[J]. ACS Appl Mater Interfaces., 2017, 9: 16581-16593. DOI:10.1021/acsami.6b16513 |
| [56] |
Oh Y, Je JY, Moorthy MS, et al. pH and NIR-light-responsive magnetic iron oxide nanoparticles for mitochondria-mediated apoptotic cell death induced by chemo-photothermal therapy[J]. Int J Pharm, 2017, 531: 1-13. DOI:10.1016/j.ijpharm.2017.07.014 |
| [57] |
Gao ZF, Liu XJ, Wang YY. Facile one-pot synthesis of Fe3O4@Chitosan nanospheres for MRI and fluorescence imaging guided chemo-photothermal combinational cancer therapy[J]. Dalton Trans, 2016, 45: 19519-19528. DOI:10.1039/C6DT03897B |
| [58] |
Zhu YJ. Preparation of FeNi3 Nanoparticles and Its Application in Photothermal/Drug Therapy and MRI (FeNi3纳米粒子的制备及其在光热/药物协同治疗及核磁共振成像中的研究)[D]. Shanghai: Shanghai Normal University, 2015.
|
| [59] |
Su HL. Artemisinin Loaded with Poly Norepinephrine Functionalized Iron Hydroxide Nanoparticles for Chemotherapy and Photothermal Therapy (聚去甲肾上腺素功能化的羟基氧化铁纳米粒子负载青蒿素用于化疗与光热治疗)[D]. Xiamen: Xiamen University, 2018.
|
| [60] |
Gao ZG, Shi TY, Li YJ, et al. Mesoporous silica-coated gold nanoframes as drug delivery system for remotely controllable chemo-photothermal combination therapy[J]. Colloids Surf B Biointerfaces, 2019, 176: 230-238. DOI:10.1016/j.colsurfb.2019.01.005 |
| [61] |
Gao ZF, Liu XJ, Deng GY, et al. Fe3O4@mSiO2-FA-CuS-PEG nanocomposites for magnetic resonance imaging and targeted chemo-photothermal synergistic therapy of cancer cells[J]. Dalton Trans, 2016, 45: 13456-13465. DOI:10.1039/C6DT01714B |
| [62] |
Liu XJ, Ren QL, Fu FF, et al. CuS@mSiO2-PEG core-shell nanoparticles as a NIR light responsive drug delivery nanoplatform for efficient chemo-photothermal therapy[J]. Dalton Trans, 2015, 44: 10343-10351. DOI:10.1039/C5DT00198F |
| [63] |
Ying Y, Wang YL, Xu WH, et al. RGO@mSiO2-DOX/HA inorganic nanocomposites:preparation and pH-light dual triggered synergistic chemo-photothermal therapy[J]. Eur J Inorg Chem, 2017, 15: 2236-2246. |
| [64] |
Ren W, Iqbal MZ, Zeng L, et al. Black tiO2 based core-shell nanocomposites as doxorubicin carriers for thermal imaging guided synergistic therapy of breast cancer[J]. Nanoscale, 2017, 9: 11195-11204. DOI:10.1039/C7NR04039C |
| [65] |
Geng SN, Zhao H, Zhan GT, et al. Injectable in-situ forming hydrogels of thermosensitive polypyrrole nanoplatforms for precisely synergistic photothermal-chemo therapy[J]. ACS Appl Mater Interfaces, 2020, 12: 7995-8005. DOI:10.1021/acsami.9b22654 |
| [66] |
Zhu YH. Design of Functional Nanoparticles and Its Application in Cancer Treatment (功能化纳米颗粒的设计及其在癌症治疗中的应用)[D]. Hefei: University of Science and Technology of China, 2019.
|
 2020, Vol. 55
2020, Vol. 55


