2. 兰州大学第一医院药剂科, 甘肃 兰州 730000;
3. 甘肃省高校中(藏)药化学与质量研究省级重点实验室, 甘肃 兰州 730000
2. Department of Pharmacy, the 1st Hospital of Lanzhou University, Lanzhou 730000, China;
3. Key Laboratory of Chemistry and Quality for Traditional Chinese Medicine of Gansu Province, Lanzhou 730000, China
众所周知, 机体对药物的处置能力与药物的疗效和不良反应密切相关。现有研究普遍认为, 代谢酶和药物转运体是影响机体对药物处置能力的关键因素。代谢酶负责药物在体内的生物转化, 其与药物的活化、失活和解毒有关。其中, Ⅰ相代谢酶介导药物的氧化、还原和水解, Ⅱ相代谢酶介导结合反应。然而, 研究发现, 细胞膜限制了许多药物的跨膜转运, 尤其是水溶性或带电药物和/或其代谢物几乎不能通过磷脂膜屏障, 因此其在一定程度可限制药物的Ⅰ相代谢和Ⅱ相代谢产物的排出。近年来研究发现, 分布于细胞膜的一类介导药物跨膜转运的转运体, 其决定了这些水溶性或带电药物完成跨膜转运。而且, 研究者将转运体介导药物胞内摄取和外排的过程分别称为0相和Ⅲ相代谢(图 1)[1]。

|
Figure 1 Hepatic biotransformation process of drug. OATPs: Organic anion transporting polypeptide; P-gp: P-glycoprotein; MRP2: Multidrug resistance-associated proteins 2 |
Benet等[2, 3]根据药物的溶解度和代谢特性将927种药物进行分类, 并提出生物药剂药物处置4分类系统(biopharmaceutics drug disposition classification system, BDDCS), 其中, 强代谢的药物属于第Ⅰ类和第Ⅱ类, 而溶解度低的第Ⅱ类强代谢药物的体内过程与肠道外排转运体或肝脏的摄取与外排转运体密切相关。研究指出, 大部分药物属于Ⅱ类药物, 且预测其占新分子实体化合物数目的70%[3]。而且, 第Ⅲ和Ⅳ类少量代谢的药物亦与摄取或外排型转运体有关[2, 3]。可见, 大部分药物的体内处置过程与药物转运体和代谢酶均有关。
由此可知, 药物转运体和代谢酶均为机体处置药物的关键蛋白, 与药物的代谢消除密切相关。研究指出, 药物转运体和代谢酶在处置药物的生理活动中存在密切协作关系, 且药物转运体和代谢酶功能的变化可影响其协作处置药物的能力, 进而影响药物的疗效和不良反应[4-8]。肠和肝是药物发生代谢的主要组织, 且分布有大量的药物转运体和代谢酶, 本文综述了药物转运体和代谢酶间的协作关系对肠肝药物处置的影响。
1 药物转运体-代谢酶的相互作用对肠药物处置的影响 1.1 肠道分布的药物代谢酶和转运体肠道作为机体吸收营养物质的重要器官, 也是口服药物吸收的重要部位, 其是决定口服药物是否可被吸收进入体内的第一关卡。现有研究证实, 分布于肠上皮细胞的代谢酶及转运体与其关卡效应密切相关。肠道药物代谢酶主要分布于上皮细胞, 其活性从绒毛尖端到腺窝方向逐渐降低, 十二指肠和空肠的代谢活性高于回肠和结肠[9]。细胞色素P450 (cytochrome P450, CYP)是分布于肠道, 且介导大部分物质代谢的主要代谢酶。在人体的小肠上皮细胞中可检测到CYP1A1、CYP1B1、CYP2C、CYP2D6、CYP2E1、CYP3A4和CYP3A5的mRNAs, 其中CYP3A (CYP3A4和CYP3A5)和CYP2C9分别占了小肠CYP的80%和14%[10], 而CYP3A4可代谢临床上大于50%的药物[11]。此外, 小肠中也有Ⅱ相代谢酶存在, 主要为硫酸基转移酶(sulfotransferase, SULT) 1A和葡萄糖醛酸转移酶(uridinediphosphate glucuronosyl transferase, UGT) 1A等[9]。此外, 肠道上皮细胞也分布有大量的转运体, 根据其功能分为摄取型和外排型转运体。其中, 寡肽转运蛋白、葡萄糖转运蛋白、一元羧酸转运蛋白、有机阳离子转运蛋白、有机阴离子转运蛋白、有机阴离子转运多肽、Na+依赖性牛磺胆酸共转运多肽、Na+依赖性胆酸盐转运蛋白和氨基酸转运体等负责将内、外源性物质摄入肠上皮细胞, 而P-糖蛋白(P-glycoprotein, P-gp)、多药耐药相关蛋白和乳腺癌耐药蛋白负责将内、外源性物质再次排入肠道, 或分泌进入血液(图 2a)。
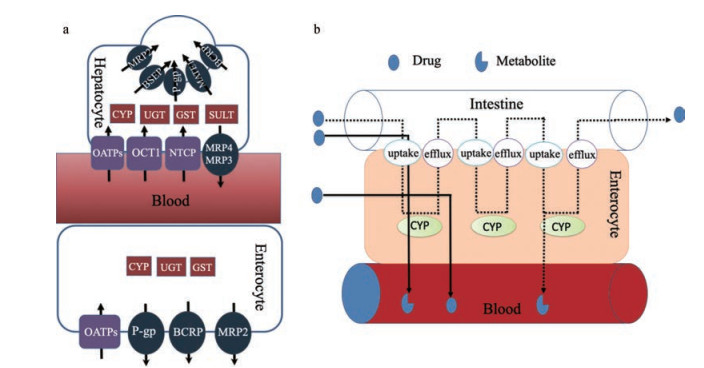
|
Figure 2 Transporters located in the enterocyte or hepatocyte (a) and schematic depiction of the cooperation between drug transporters and metabolic enzymes in intestine (b). BSEP: Bile salt export pump; MATEs: Multi drug and toxin extrusions; BCRP: Breast cancer resistance protein; CYP: Cytochrome P450; UGT: Uridinediphosphate glucuronosyl transferase; SULT: Sulfotransferase; OCTs: Organic cation transporters; NTCP: Na+-dependent taurocholate cotransporter |
研究[12, 13]指出肠道代谢酶CYP3A和P-gp分别负责外源性物质代谢和将外源性物质泵出肠上皮细胞, 可见, CYP3A和P-gp协同抵御外源性物质进入体循环。研究[12, 14, 15]发现, 采用CYP3A4和P-gp共转染Caco-2细胞的Transwell模型考察评价了P-gp和CYP3A4之间的协同作用, 结果发现环孢素作为P-gp和CYP3A4的抑制剂, 可降低K77 (P-gp和CYP3A4底物)和咪达唑仑(CYP3A4底物)的代谢提取率(extraction ratio, ER, 见公式1), 但环孢素使K77 ER值的降低程度要高于咪达唑仑(74% VS 60%), 提示除CYP3A4外, 还有其他因素(如P-gp)可影响K77的代谢, 而且, GG918作为P-gp的抑制剂, 也可使K77的ER值降低了58%, 说明GG918降低了K77在CYP3A4的暴露量(表 1)。为此, Benet等[15]提出了肠道P-gp和CYP间相互作用的假设, 如图 2b所示, 他认为药物进入肠上皮细胞, 或直接吸收进入血液; 或首次进入肠上皮细胞即被胞内的代谢酶代谢; 或被P-gp外排至肠腔, 再重吸收进入肠上皮细胞后方能被代谢, 有些药物分子甚至需要经历多次外排, 才有机会与CYP结合, 该过程提高了药物与CYP结合的机会, 可增加药物的代谢比例, 因此, 当肠道中P-gp被抑制时, 进入肠上皮细胞的药物分子增多, 但药物与CYP结合的机会将显著减少, 使药物的生物利用度增加, 但代谢比例下降。该假设也解释了GG918作为P-gp的底物使K77的ER值降低的原因。而且, Cummins等[16]采用单向肠灌流实验在大鼠体内进一步考察了P-gp和Cyp3a4之间的相互作用, 结果证实P-gp的确可影响药物在肠道的代谢。
| $ \text{ER=}\frac{\sum{{{代谢物}_{\left( 供室, 接收室, 细胞内 \right)}}}}{\sum{ {{原药}_{\left( 接收室, 细胞内 \right)}}}\ \ \ \ \ \ \ +\sum{{{代谢物}_{\left( 供室, 接收室, 细胞内 \right)}}}} $ | (1) |
| Table 1 The cooperation between P-gp and CYP3A4 on the ER. GG918: P-gp inhibitor; cyclosporine: A dual inhibitor of P-gp and CYP3A4 |
然而, Pang等[17]认为, 肠细胞中药物在代谢酶的线性代谢范围内时, P-gp的外排作用会降低药物的代谢, 而当胞内代谢酶为非线性代谢时, 药物的快速重吸收是增加药物代谢的关键。Darwich等[18]用“advanced solution, absorption, metabolism”模型模拟评价了代谢酶和转运体间的相互作用, 结果发现, CYP3A4固有清除率增加可致肠道生物利用度(fraction of drug that escapes first pass gut metabolism, FG, 肠道吸收进入肝门静脉又未被代谢的药物)显著性降低, P-gp固有清除率(0.01~100 μL·min-1)增加使肠吸收显著减少, 但大部分化合物的FG并无显著减少, 最大降低值约为6.8%。Hua等[19]用CYP3A4和P-gp过表达的Caco-2细胞考察了二者间的相互作用, 结果发现, P-gp抑制剂维拉帕米可显著增加黄皮内酰胺(CYP3A4和P-gp的底物)的代谢率, 而且, CYP3A4抑制剂酮康唑可使黄皮内酰胺的胞内代谢降低, 但使其从基底膜向顶膜侧的排出增加了约2倍, 提示CYP3A4抑制可明显影响P-gp对黄皮内酰胺的外排。此外, 肠道外排转运体与胞内Ⅱ相代谢也存在协作关系。Li等[5]发现, 抑制或敲除P-gp、BCRP和MRPs可增加细胞内山柰酚在Caco-2/TC7的浓度, 但山柰酚的葡糖醛酸化代谢产物却呈现显著降低。
总之, CYP擅长药物的代谢解毒, P-gp可将外源性药物排至肠腔, 二者协同调控肠道对药物的处置作用, 但其二者间的协作机制目前仍然存在争议, 且相关研究也较为缺乏。
2 药物转运体-代谢酶的相互作用对肝药物处置的影响 2.1 肝脏分布的药物代谢酶和转运体肝脏是药物代谢清除的主要器官之一, 其富含介导药物Ⅰ相代谢和Ⅱ相代谢的主要代谢酶, 其中参与药物代谢的Ⅰ相酶中以P450酶最为重要, 大部分药物在肝脏Ⅰ相代谢酶的作用下被氧化、还原或水解, 然后药物和/或其代谢物在Ⅱ相代谢酶的作用下与葡萄糖醛酸、甘氨酸、硫酸等内源性物质结合或经甲基化、乙酰化后随尿液或胆汁排出体外。此外, 在肝细胞膜亦分别有丰富的药物转运体, 其中分布于肝细胞基底膜侧的有机阴离子转运多肽转运体、有机阴离子转运体、有机阳离子转运体1、钠离子/牛磺胆酸共转运蛋白主要负责内、外源性物质从血液向肝细胞内的转运, 而分布于顶膜侧的转运体主要有P-糖蛋白、多药耐药相关蛋白2、乳腺癌耐药相关蛋白、胆盐输出泵及MATE1, 这些外排转运体介导多种内外源性药物的胆汁排泄(图 2a)[20]。
2.2 肝脏的药物转运体-代谢酶相互作用研究者们[1]将介导药物和/或其代谢物从血液进入肝细胞的过程称为0相代谢, 而将肝细胞内药物和/或其代谢物经转运体排入胆汁的过程称为Ⅲ相代谢。从图 2可见, 药物经摄取型转运体介导进入肝细胞后才可被代谢, 药物和/或其代谢产物又需外排型转运体介导才能排出肝细胞, 因此, 摄取型和外排型转运体分别介导的0相和Ⅲ相代谢与药物在肝细胞内的Ⅰ相和Ⅱ相代谢协同完成药物的代谢解毒。
肠道中药物从肠腔向基底膜侧转运以吸收, 而肝脏中大部分药物从基底膜侧向胆管侧膜转运以排泄, 因此, 分布于肠上皮细胞顶膜侧的P-gp主要影响肠细胞的摄取量, 而分布于肝细胞顶膜侧的P-gp主要影响肝细胞的外排量。Benet等[21]也研究了肝细胞P-gp对CYP的影响, 研究发现, 与抑制肠道P-gp可降低药物的代谢相反, 抑制肝脏外排转运体P-gp可增加药物在细胞中的量, 从而增加药物的代谢。肝脏外排转运体与胞内Ⅱ相代谢也存在协作关系。Qin等[6]研究也指出, UGT1A1介导五味子素在细胞内的葡萄糖醛酸化, BCRP和MRPs可将胞内五味子素葡萄糖醛酸代谢物排出细胞, 而抑制或敲除BCRP和MRPs的外排作用, 却可使五味子素在细胞内的葡萄糖醛酸化显著降低。Qi等[7]研究发现, 抑制BCRP后芹黄素在过表达UGT1A1 HeLa细胞中的浓度增加, 但其葡糖醛酸化代谢物也显著降低。而且, Wang等[22]提出, 抑制外排转运可引起结合物在肝细胞内蓄积, 而高浓度的结合物可激活水解酶, 将结合物水解为原药, 他们指出水解酶是外排转运体与Ⅱ相代谢酶发生相互作用的纽带。外排型转运体不仅分布于肝细胞顶膜侧, 还分布于肝脏的基底膜侧, 研究发现这些转运体亦协同影响药物的代谢排泄。如霉酚酸(mycophenolic acid, MPA)是一种免疫抑制剂, 主要在肝内代谢为苯-葡萄糖醛酸化霉酚酸(mycophenolic acid phenyl-glucuronide, MPAG), MPAG经肝细胞顶膜侧MRP2和基底膜侧的MRP3与MRP4分别介导分泌于胆汁或血液, 人肝细胞三明治培养研究发现, 环孢素对基底膜侧和顶膜侧MPRs的最大抑制作用分别为50%和80%, 当MPA与环孢素合用后, 使肝细胞内MPAG的浓度增加[10, 23, 24]。
除外排型转运体外, 研究发现摄取型转运体也可影响药物的代谢。如, HIV蛋白酶抑制剂阿扎那韦(atazanavir, ATV)经肝脏基底膜侧摄取型转运体Oatp介导进入肝细胞, 其或经MRP1泵出细胞, 或经P450代谢。Nicolaï等[25]发现, 当代谢酶被抑制后, 胞内外游离ATV浓度的比值KPu, u (KPu, u = C胞内游离ATV/C胞外游离ATV)不升反降, 作者指出当代谢酶被抑制后, 胞内ATV主经MRP泵出, 导致KPu, u值显著下降, 提示摄取型转运体并不能确保胞内浓度的蓄积, 但其在调节胞内药物浓度和代谢中具有重要的作用。西立伐他汀经分布于肝细胞基底膜侧的摄取型转运体OATP1B1介导进入肝细胞, 再进肝细胞内的CYP3A4或CYP2C8代谢为M-1和M-23, 当抑制OATP1B1后, 西立伐他汀不能进入肝细胞, 其代谢也将受限。Matsunaga等[26]指出, 摄取型转运体和代谢酶决定了肝脏的固有清除率。
可见, 物质的转运方向不同也可影响转运体与代谢酶酶间的协同关系, 而肝细胞内的药物代谢与肝摄取型和外排型转运体协同负责药物的代谢排泄。
3 结语药物代谢酶和转运体是影响药物代谢动力学的两个重要因素, 其中肠道转运体与代谢酶协同负责药物的吸收解毒, 而肝脏转运体与代谢酶协同药物的解毒排泄。近年来也有研究指出, 肠道对口服药物的代谢消除较肝脏明显[27]。而且, 研究者普遍认为, Benet等[15]提出的肠道CYP3A4和P-gp间的相互作用是肠道代谢作用强于肝脏的主要原因。然而, van Waterschoot等[28]指出, 非P-gp底物如三唑仑等, 口服后经肠道CYP3A的代谢较肝脏代谢要多, 提示CYP3A4和P-gp间协作关系并非肠代谢较肝代谢高效的主要原因。可见, 目前有关二者之间在肠或肝的协作关系仍然存在较大的争议。从上述不同研究者的数据分析, 药物代谢酶和转运体间的协作关系可能应该不是一成不变的, 其至少与组织器官的特性、药物代谢酶或转运体活性变化和药物在细胞内外的暴露量均有关。因此, 在不同的情况下, 二者间的协作关系和协作效应可能呈现出不同的结果。而且, 目前有关药物代谢酶和转运体间协作机制的研究鲜为见到, 但这部分研究对于药动学的体内研究及预测研究具有重要的意义。
目前研究转运体-代谢酶相互作用最多的是肝和肠组织, 对于脑和肾的研究相对较少。然而, 酶和转运体在组织器官中的分布具有一定的特异性, 如人体脑组织中分布较多的代谢酶主要为CYP1B1和CYP2U1, 且其分布最多的转运体为ABCG2, 而人肝脏分布最多的代谢酶为CYP2E1和CYP1B1, 转运体为ABCC2[29]。从上述研究发现, 同一对转运体因器官特异性, 转运矢量方向不同, 转运体与代谢酶间的协作效应存在差异。而且, 同一转运体与Ⅰ相代谢酶和Ⅱ相代谢酶的协作结果也不相同。但是目前研究的“转运体-代谢酶”对却极为有限, 主要为“P-gp-CYP3”、“MRP-UGTs”和“BCRP-UGTs”等[9], 且有关探究二者协作关系是否存在器官差异性的研究甚少。
目前药物转运体与代谢酶见协作关系的研究方法大部分为体外细胞实验和离体器官灌流法。因代谢酶和转运体在组织器官的广泛分布, 专属性探针工具药相对缺乏, 以及代谢酶和转运体间复杂的代偿性调控关系, 应用体内方法探讨药物转运体和代谢酶间的关系较为困难, 而组织器官的特定结构、体内循环系统中药物暴露量等因素是影响二者间协作关系的重要因素。近几年, 也有用生理基础药动学模型模拟评价二者间协作关系的相关研究。
总之, 代谢酶与转运体间的协作关系具有非特异性, 且在代谢酶与转运体活性改变的情况下可能存在复杂的网络协作关系, 明晰药物转运体与代谢酶间的协作关系及规律, 对于探究药物体内过程, 药效和不良反应具有重要的意义。
作者贡献: 周燕负责文献的查阅和整个文稿的撰写; 武新安教授对本文稿进行了指导和修改; 邓毅教授对本文稿进行了多次指导和修改。
利益冲突: 本文内容无任何利益冲突。
| [1] |
Doring B, Petzinger E. Phase 0 and phase Ⅲ transport in various organs:combined concept of phases in xenobiotic transport and metabolism[J]. Drug Metab Rev, 2014, 46: 261-282. DOI:10.3109/03602532.2014.882353 |
| [2] |
Shugarts S, Benet LZ. The role of transporters in the pharmacokinetics of orally administered drugs[J]. Pharm Res, 2009, 26: 2039-2054. DOI:10.1007/s11095-009-9924-0 |
| [3] |
Benet LZ, Broccatelli F, Oprea TI. BDDCS applied to over 900 drugs[J]. AAPS J, 2011, 13: 519-547. DOI:10.1208/s12248-011-9290-9 |
| [4] |
Zhang F, Duan Y, Xi L, et al. The influences of cholecystectomy on the circadian rhythms of bile acids as well as the enterohepatic transporters and enzymes systems in mice[J]. Chronobiol Int, 2018, 35: 673-690. DOI:10.1080/07420528.2018.1426596 |
| [5] |
Li Y, Lu L, Wang L, et al. Interplay of efflux transporters with glucuronidation and its impact on subcellular aglycone and glucuronide disposition:a case study with kaempferol[J]. Mol Pharm, 2018, 15: 5602-5614. DOI:10.1021/acs.molpharmaceut.8b00782 |
| [6] |
Qin Z, Li S, Yao Z, et al. Chemical inhibition and stable knock-down of efflux transporters leads to reduced glucuronidation of wushanicaritin in UGT1A1-overexpressing HeLa cells:the role of breast cancer resistance protein (BCRP) and multidrug resistance-associated proteins (MRPs) in the excretion of glucuronides[J]. Food Funct, 2018, 9: 1410-1423. DOI:10.1039/C7FO01298E |
| [7] |
Qi C, Fu J, Zhao H, et al. Identification of UGTs and BCRP as potential pharmacokinetic determinants of the natural flavonoid alpinetin[J]. Xenobiotica, 2019, 49: 276-283. DOI:10.1080/00498254.2018.1440657 |
| [8] |
Feltrin C, Oliveira Simoes CM. Reviewing the mechanisms of natural product-drug interactions involving efflux transporters and metabolic enzymes[J]. Chem Biol Interact, 2019, 314: 108825. DOI:10.1016/j.cbi.2019.108825 |
| [9] |
Fritz A, Busch D, Lapczuk J, et al. Expression of clinically relevant drug-metabolizing enzymes along the human intestine and their correlation to drug transporters and nuclear receptors:an intra-subject analysis[J]. Basic Clin Pharmacol Toxicol, 2019, 124: 245-255. DOI:10.1111/bcpt.13137 |
| [10] |
Xie F, Ding X, Zhang QY. An update on the role of intestinal cytochrome P450 enzymes in drug disposition[J]. Acta Pharm Sin B, 2016, 6: 374-383. DOI:10.1016/j.apsb.2016.07.012 |
| [11] |
Christians U, Schmitz V, Haschke M. Functional interactions between P-glycoprotein and CYP3A in drug metabolism[J]. Expert Opin Drug Metab Toxicol, 2005, 1: 641-654. DOI:10.1517/17425255.1.4.641 |
| [12] |
Benet LZ, Cummins CL. The drug efflux-metabolism alliance:biochemical aspects[J]. Adv Drug Deliv Rev, 2001, 50 Suppl 1: S3-S11. |
| [13] |
van Waterschoot RA, Schinkel AH. A critical analysis of the interplay between cytochrome P4503A and P-glycoprotein:recent insights from knockout and transgenic mice[J]. Pharmacol Rev, 2011, 63: 390-410. DOI:10.1124/pr.110.002584 |
| [14] |
Cummins CL, Jacobsen W, Benet LZ. Unmasking the dynamic interplay between intestinal P-glycoprotein and CYP3A4[J]. J Pharmacol Exp Ther, 2002, 300: 1036-1045. DOI:10.1124/jpet.300.3.1036 |
| [15] |
Benet LZ, Cummins CL, Wu CY. Unmasking the dynamic interplay between efflux transporters and metabolic enzymes[J]. Int J Pharm, 2004, 277: 3-9. DOI:10.1016/j.ijpharm.2002.12.002 |
| [16] |
Cummins CL, Salphati L, Reid MJ, et al. In vivo modulation of intestinal CYP3A metabolism by P-glycoprotein:studies using the rat single-pass intestinal perfusion model[J]. J Pharmacol Exp Ther, 2003, 305: 306-314. DOI:10.1124/jpet.102.044719 |
| [17] |
Pang KS. Modeling of intestinal drug absorption:roles of transporters and metabolic enzymes (for the Gillette Review Series)[J]. Drug Metab Dispos, 2003, 31: 1507-1519. DOI:10.1124/dmd.31.12.1507 |
| [18] |
Darwich AS, Neuhoff S, Jamei M, et al. Interplay of metabolism and transport in determining oral drug absorption and gut wall metabolism:a simulation assessment using the "advanced dissolution, absorption, metabolism (ADAM)" model[J]. Curr Drug Metab, 2010, 11: 716-729. DOI:10.2174/138920010794328913 |
| [19] |
Hua F, Shi MJ, Zhu XL, et al. Transport and uptake of clausenamide enantiomers in CYP3A4-transfected Caco-2 cells:an insight into the efflux-metabolism alliance[J]. Biochem Pharmacol, 2015, 98: 224-230. DOI:10.1016/j.bcp.2015.08.102 |
| [20] |
Zhang AJ, Liu KX. Drug-drug interacctions mediated by hepatic transporters[J]. World Chin J Digestol (世界华人消化杂志), 2012, 20: 2655-2660. DOI:10.11569/wcjd.v20.i28.2655 |
| [21] |
Benet LZ, Cummins CL, Wu CY. Transporter-enzyme interactions:implications for predicting drug-drug interactions from in vitro data[J]. Curr Drug Metab, 2003, 4: 393-398. DOI:10.2174/1389200033489389 |
| [22] |
Wang S, Xing H, Zhao M, et al. Recent advances in understanding of kinetic interplay between phase Ⅱ metabolism and efflux transport[J]. Curr Drug Metab, 2016, 17: 922-929. DOI:10.2174/1389200217666161128150835 |
| [23] |
Matsunaga N, Suzuki K, Nakanishi T, et al. Modeling approach for multiple transporters-mediated drug-drug interactions in sandwich-cultured human hepatocytes:effect of cyclosporin A on hepatic disposition of mycophenolic acid phenyl-glucuronide[J]. Drug Metab Pharmacokinet, 2015, 30: 142-148. DOI:10.1016/j.dmpk.2014.10.006 |
| [24] |
Norikazu M, Yukina F, Haruo I, et al. Sandwich-cultured hepatocytes for mechanistic understanding of hepatic disposition of parent drugs and metabolites by transporter-enzyme interplay[J]. Drug Metab Dispos, 2018, 46: 680-691. DOI:10.1124/dmd.117.079236 |
| [25] |
Nicolaï J, De Bruyn T, Thevelin L, et al. Transport-metabolism interplay of atazanavir in suspended rat hepatocytes[J]. Drug Metab Rev, 2016, 48: 34-35. |
| [26] |
Matsunaga N, Fukuchi Y, Imawaka H, et al. Sandwich-cultured hepatocytes for mechanistic understanding of hepatic disposition of parent drugs and metabolites by transporter-enzyme interplay[J]. Drug Metab Dispos, 2018, 46: 680-691. DOI:10.1124/dmd.117.079236 |
| [27] |
Zhang QY, Fang C, Zhang J, et al. An intestinal epithelium-specific cytochrome P450(P450) reductase-knockout mouse model:direct evidence for a role of intestinal P450s in first-pass clearance of oral nifedipine[J]. Drug Metab Dispos, 2009, 37: 651-657. DOI:10.1124/dmd.108.025429 |
| [28] |
van Waterschoot RA, Rooswinkel RW, Sparidans RW, et al. Inhibition and stimulation of intestinal and hepatic CYP3A activity:studies in humanized CYP3A4 transgenic mice using triazolam[J]. Drug Metab Dispos, 2009, 37: 2305-2313. DOI:10.1124/dmd.109.029397 |
| [29] |
Decleves X, Jacob A, Yousif S, et al. Interplay of drug metabolizing CYP450 enzymes and ABC transporters in the blood-brain barrier[J]. Curr Drug Metab, 2011, 12: 732-741. DOI:10.2174/138920011798357024 |
 2020, Vol. 55
2020, Vol. 55


