作者贡献:陆伟设计了该研究。伊庆同参与实验设计, 指导肿瘤手术切除实验。孙静文和钱余义共同完成量子点的制备, 高帅完成量子点的荧光光谱测定, 郑彬彬完成量子点的透射电镜观察, 魏国光和孙静文共同完成量子点的影像, 魏国光完成肿瘤切除手术实验。孙静文和陆伟归纳整理数据并撰写论文。
利益冲突:本文作者声明无利益冲突。
2. 复旦大学附属浦东医院盆底中心, 上海 201399
2. Pelvic Center of Pudong Hospital Affiliated to Fudan University, Shanghai 201399, China
结肠癌是消化道常见的恶性肿瘤之一。结肠镜检查是临床上结肠癌筛查的标准诊断工具[1]。然而, 由于结肠镜检查主要靠肉眼根据形态学细节进行诊断, 缺乏准确性, 特别是在慢性炎症相关的结肠癌病例中诊断更加困难[2]。此外, 在指导手术操作过程中, 仅在消化内镜下通过肉眼观察判断病灶部位, 准确性较差, 需对病灶进行标记, 如临床常采用吲哚菁绿、亚甲蓝和靛胭脂等染料标记病灶用于指导外科手术[3]。但是这些荧光染料易发生光漂白, 且大多染料的荧光发射波长位于可见光区(400~750 nm)或近红外一区(near-infrared-Ⅰ, NIR-Ⅰ, 750~900 nm), 由于组织光散射导致组织穿透深度不足, 限制了荧光成像在手术指导中的应用[4]。
近红外二区(NIR-Ⅱ, 1 000~1 700 nm)荧光具有更长的发射波长。其中, NIR-Ⅱb (1 500~1 700 nm)荧光可显著降低在穿透生物组织时的光散射及组织自发荧光的干扰[5], 达到更深的探测深度以及更高的空间分辨率[3, 5]。因此, 发展具有更深成像深度、更高空间分辨率和信噪比的NIR-Ⅱb荧光生物成像技术具有重要意义[6]。
量子点(quantum dots, QDs)是一种具有独特光学性质的纳米材料, 与一般有机染料相比, 具有量子效率高、耐光漂白性能好和发射带窄等优良的生物成像特性[3, 7]。QDs的发射波长可以通过控制其大小或组成, 在较宽的波长范围内调节[8]。因此, 制备发射波长在NIR-Ⅱb的QDs, 研究其对早期结肠癌诊断及指导手术具有潜在的临床应用价值[5]。
硫化铅(PbS) QDs发射光谱跨越整个NIR-Ⅱb, 展现出优异的体内NIR-Ⅱb成像性能[8, 9]。然而PbS QDs在各种分散介质中, 易发生表面氧化反应。为防止PbS核氧化, 文献[1, 10]报道的方法是使用稳定性材料, 如硫化镉(CdS)和硫化锌(ZnS)等, 通过阳离子交换法, 在PbS表面生成一层保护壳, 形成核壳结构的QDs。此外, 应用于生物成像的QDs通常是通过金属有机化学合成制备, 所得QDs在水中不分散[11], 需要通过对QDs表面进行包覆和修饰, 以提高量子点在水溶液中的稳定性和生物相容性[12, 13]。
本研究设计了一种基于核壳结构的PbS/CdS量子点(core/shelled lead sulfide/cadmium sulfide quantum dots, CSQDs), 发射峰为~1 550 nm的NIR-Ⅱb荧光探针。通过合成的两亲性聚合物, 油胺支链的聚丙烯酸(oleyamine-branched polyacrylic acid, OPA), 利用疏水作用与CSQDs连接, 使得CSQDs在水溶液中分散, 并进一步与末端氨基修饰的聚乙二醇(methoxy-PEG-amine, Mr ~5 k)及八臂聚乙二醇氨基(8 arm-PEG-amine, Mr ~40 k)连接[14, 15], 制备了经PEG修饰的CSQDs (PEG-CSQDs)。由于其核/壳结构和PEG层, CSQDs在生理介质中表现出良好的水稳定性。PEG-CSQDs可通过肿瘤的增强渗透与滞留效应(enhanced permeability and retention, EPR effect), 迅速在肿瘤组织富集, 肿瘤部位表现出相对明显增强的荧光, 可用于结肠癌诊断和指导手术切除。
材料与方法药品与试剂 氯化铅(lead chloride, PbCl2)、氧化铬(cadmium oxide, CdO)、升华硫(sublimed sulfur)、1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐[3-(3-dimethylaminopropyl)-1-ethylcarbodiimide hydrochloride, EDC·HCl]、吗啉乙磺酸一水合物(MES monohydrate)、聚丙烯酸(polyacrylic acid, Mr~1.8 k)、N, N-二环己基碳二亚胺(N, N-dicyclohexylcarbodiimide, DCC)、油酸、1-十八烯、N, N-二甲基甲酰胺(N, N-dimethylformamide, DMF) [阿拉丁试剂(上海)有限公司]; 油胺[萨恩化学技术(上海)有限公司]; 无水碳酸钠、无水硫酸钠(上海展云化工有限公司); methoxy-PEG-amine HCl salt (Mr ~5 k, 北京键凯科技股份有限公司); 8 arm-PEG-amine [Mr~40 k, 西宝生物科技(上海)股份有限公司]; RPMI 1640培养基、胎牛血清(fetal bovine serum, FBS)、青链霉素、胰酶(美国Hyclone公司); 三氯甲烷、正己烷、无水乙醇、1, 2-二氯乙烷(国药集团化学试剂有限公司); 超纯水为Millipore公司Milli-Q Integral 10系统制备。
细胞和动物 CT26-Luc cells (小鼠结肠癌细胞-荧光素酶标记), 购自Imanis Life Sciences公司。健康BALB/c小鼠, 雄性, SPF级, 购自上海灵畅生物科技有限公司, 许可证号: SCXK (沪) 2018-0003。动物实验经复旦大学药学院实验动物伦理委员会(IACUC)批准。
仪器 Tecnai G2-20 TWIN透射电子显微镜(美国FEI公司); 液氮制冷二维InGaAs阵列检测器(Cougar, 比利时Xenics公司); 科研级短波红外相机(SC640, 中国深圳天盈光电系统有限公司); 808 nm激光器(MDL-H-800, 长春新产业光电技术有限公司); 1 000和1 500 nm长通滤光片(美国Thorlabs公司); 稳态/瞬态荧光光谱仪(QM 40) (美国PTI公司); 马尔文Zetasizer Nano-ZS动态光散射仪(英国马尔文仪器有限公司); 德国徕卡倒置荧光显微镜[Leica DMi8-M, 徕卡显微系统(上海)贸易有限公司]。
数据分析 采用GraphPad Prism8.0软件绘制QDs的荧光光谱及粒径图, 采用Image J_v1.8.0软件进行肿瘤和正常组织的信噪比及PEG-CSQDs的生物分布定量分析。
PbS QDs的合成 升华硫(0.08 g, 5 mmol)置于二颈烧瓶中, 加入油胺溶解, 常温下真空泵脱气30 min, N2保护下, 溶液在120 ℃搅拌反应30 min, 即制得硫前体。PbCl2 (0.834 g, 3 mmol)置于二颈烧瓶中, 加入油胺, 常温下真空泵脱气, N2保护下, 升温至120 ℃, 真空泵脱气30 min后升温至140 ℃, 即制得PbCl2前体[6]。待PbCl2前体稳定在140 ℃后, 快速加入硫前体。反应30 min后, 使用等体积正己烷(-20 ℃)淬灭, 所得溶液静置, 去除下层白色沉淀。上层溶液使用等体积无水乙醇沉淀, 8 000 r·min-1离心10 min, 收集底部PbS QDs。PbS QDs在正己烷中均匀分散, 加入双倍体积油酸, 涡旋3~5 min, 除去剩余的硫, 再次通过离心收集PbS QDs[16, 17]。
CSQDs的合成 CdO (1.2 g, 9.2 mmol)置于二颈烧瓶中, 加入油酸(8 mL)、1-十八烯(20 mL), 常温下真空泵脱气, N2保护下, 加热至200 ℃, 至CdO完全溶解, 溶液澄清呈淡黄色, 降温至100 ℃, 真空泵脱气30 min。将制备的PbS QDs均匀分散在1-十八烯中, 转移至二颈瓶中, 常温下真空泵脱气约30 min后转移至CdO溶液中, 100 ℃加热搅拌反应30 min[6]。反应结束后, 使用等体积-20 ℃正己烷淬灭, 所得溶液静置10 min, 5 000 r·min-1离心10 min, 除去底部白色沉淀。所得上层溶液中加入等量无水乙醇沉淀, 8 000 r·min-1离心10 min, 收集底部沉淀, 重复两次收集沉淀即得CSQDs。
CSQDs的修饰 OPA的制备方法参照文献[18, 19]。将制得的OPA (25 mg)溶于CHCl3 (2 mL)中, 加入CSQDs (5 mg), 室温下搅拌1 h。反应结束后, 除去CHCl3, 将产物分散在50 mmol·L-1碳酸钠溶液中, 超滤管(100 kDa)离心浓缩, 加入超纯水洗2~3次。将得到的经OPA表面修饰的CSQDs (OPA-CSQDs)分散在MES缓冲液(pH 8.5, 0.01 mol·L-1), 另将methoxy-PEG-amine (15 mg)、8 arm-PEG-amine (5 mg)和EDC·HCl (10 mg)分别溶于适量的MES缓冲液中, 并按顺序依次加入QDs溶液, 室温下反应过夜。反应结束后, 将反应液转移至超滤管中浓缩, 用PBS (0.01 mol·L-1)洗涤2~3次得到最终产物PEG-CSQDs。
PbS QDs、CSQDs、OPA-CSQDs及PEG-CSQDs发射光谱测定 使用稳态/瞬态荧光光谱仪, 在808 nm激发下、1 200~1 700 nm波长内, 分别对合成的PbS QDs、CSQDs、OPA-CSQDs及PEG-CSQDs的发射光谱进行测定。
CSQDs、OPA-CSQDs及PEG-CSQDs量子效率(quantum yield, QY)测定 以IR26 (QY = 0.5%)[6]为参照, 在808 nm激发下, 测量CSQDs、OPA-CSQDs及PEG-CSQDs的量子效率。其中, IR26、CSQDs分别以1, 2-二氯乙烷、三氯甲烷为溶剂, OPA-CSQDs和PEG-CSQDs以水为溶剂, 按照公式(1)[20, 21]计算CSQDs、OPA-CSQDs及PEG-CSQDs的量子效率。
| $ {\rm{Q}}{{\rm{Y}}_{{\rm{sample}}}} = {\rm{Q}}{{\rm{Y}}_{{\rm{ref}}}}\frac{{{k_{{\rm{sample}}}}}}{{{k_{{\rm{ref}}}}}}{\left( {\frac{{{n_{{\rm{sample}}}}}}{{{n_{{\rm{ref}}}}}}} \right)^2} $ | (1) |
其中, QYsample和QYref分别代表被测样品和参照的量子效率; ksample和kref分别代表被测样品和参照的荧光积分强度随紫外吸收变化的斜率; nsample和nref分别代表被测样品和参照所用溶剂的折射率。
CSQDs及PEG-CSQDs的透射电子显微镜(TEM)观察及粒径测定 采用Tecnai G2-20 TWIN透射电子显微镜观察合成的CSQDs形态, 并用马尔文Zetasizer Nano-ZS动态光散射仪测定CSQDs及修饰后的PEG-CSQDs的粒径。
结肠癌小鼠模型的建立 CT26-Luc细胞系在含有10% FBS、100 u·mL-1青霉素、100 μg·mL-1链霉素的RPMI-1640培养基, 37 ℃、5%二氧化碳培养箱中培养。BALB/c小鼠采用1%戊巴比妥钠麻醉, 将CT26-Luc细胞(1×107 mL-1, 50 µL)接种于小鼠盲肠肠壁[21]。
结肠癌小鼠模型的体内NIR-Ⅱb荧光成像 根据文献[21]可知, 肿瘤细胞接种4天后, 在盲肠部位已形成小肿瘤。由于本研究目的是考察PEG-CSQDs探针注射后对早期结肠肿瘤的成像效果, 因此该结肠癌模型满足本实验要求。小鼠尾静脉注射PEG-CSQDs (2 mg·mL-1, 200 µL), 麻醉状态下打开腹腔, 暴露出结肠部位, 808 nm激光器照射(激光功率密度100 mW·cm-2), 发射光通过1 000和1 500 nm长通滤波片, 使用液氮制冷InGaAs相机记录小鼠肿瘤部位的荧光变化。并分别在0.5、2、4和8 h拍照, 记录肿瘤和周围肠组织荧光强弱变化。
NIR-Ⅱb荧光成像指导肿瘤切除 荷瘤小鼠尾静脉注射PEG-CSQDs (2 mg·mL-1, 200 µL), 2 h后麻醉状态下打开腹腔, 暴露出结肠部位, 进行NIR-Ⅱb荧光成像, 采用短波红外相机采集信号, 定位肿瘤并指导手术切除。对切除的肿瘤进行NIR-Ⅱb影像, 采用OCT包埋, 连续冰冻切片(8和30 μm)。分别对8 μm厚切片进行H & E染色, 对30 μm厚切片进行NIR-Ⅱb荧光成像。
PEG-CSQDs的生物分布 荷瘤小鼠尾静脉注射PEG-CSQDs (2 mg·mL-1, 200 µL), 分别于2和8 h后, 处死小鼠, 取出心、肝、脾、肺、肾、脑、肠、骨、肌肉、皮肤、肿瘤和血液, 采用短波红外相机, 拍摄NIR-Ⅱb荧光照片。采用PEG-CSQDs (40 µg·mL-1, 100 µL)作为标准参照。通过Image J进行ROI分析, 按照公式(2)计算各器官组织的摄取。
| $ {\rm{Concentration}}\;{\rm{of}}\;{\rm{drugs}}({\rm{ \mathsf{ μ} g}} \cdot {{\rm{g}}^{ - 1}}) = \frac{{\frac{{{A_{{\rm{test}}}} - {A_{{\rm{blank}}}}}}{{{A_{{\rm{control}}}} - {A_{{\rm{blank}}}}}} \times 4\;{\rm{ \mathsf{ μ} g}}}}{{{m_{{\rm{test}}}}}} $ | (2) |
其中, Atest、Ablank和Acontrol分别代表采集的组织或血液、空白和标准参照的总光子数; 标准参照中PEG-CSQDs质量为4 μg; mtest为所测组织质量(g)。
结果 1 PbS QDs发射光谱PbS QDs的合成反应温度与反应时间不同, 则QDs的发射波长和量子效率不同。由图 1所示, 因为120 ℃温度过低, 难以合成具有高荧光强度的QDs。当温度达到140 ℃时, 随着反应时间的延长, QDs发射峰向长波长方向移动。由于PbS QDs核表面与CdO进行阳离子交换反应, PbS QDs内核尺寸减小, 发射光谱将发生蓝移。因此, 欲制备发射峰在1 500~1 600 nm的CSQDs, 应选用发射峰在1 600 nm以上的PbS QDs作内核。由此确定PbS QDs的反应条件为140 ℃、30 min。
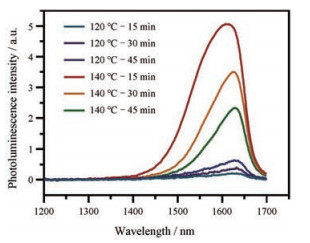
|
Figure 1 Effects of reaction temperature and reaction time on fluorescence emission spectra of lead sulfide quantum dots (PbS QDs) |
为确定所合成的CSQDs发射峰波长, 选用了不同阳离子交换反应时间。由图 2可见, 所合成的CSQDs的发射峰随反应时间延长蓝移。由此判断, Pb2+/Cd2+阳离子交换的反应温度为100 ℃、反应时间为30 min时, 合成的CSQDs发射峰在~1 500 nm。
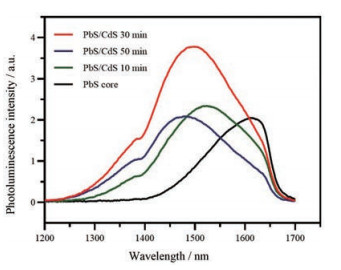
|
Figure 2 Effect of Pb2+/Cd2+ ligand-exchange reaction time on the fluorescence emission spectra of PbS QDs or CSQDs. CSQDs: Core/shelled lead sulfide/cadmium sulfide quantum dots; PbS: Lead sulfide; CdS: Cadmium sulfide |
OPA连接后CSQDs的表面性质发生改变, 使得CSQDs由脂溶性变为水溶性。如图 3所示, OPA-CSQDs和PEG-CSQDs的发射峰为~1 550 nm。与未修饰的CSQDs比较, OPA修饰导致CSQDs的发射峰向长波长方向移动。这一现象与其他结构的量子点相似, 在相转移过程中发射峰发生小幅度变化[11, 22]。
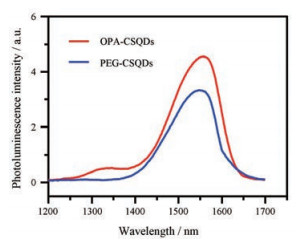
|
Figure 3 Fluorescence emission spectra of oleyamine-branched polyacrylic acid-modified CSQDs (OPA-CSQDs) and polyethylene glycol-modified CSQDs (PEG-CSQDs), respectively |
如图 4所示, 以IR26为参照, 测得CSQDs、OPA-CSQDs及PEG-CSQDs的量子效率分别为21.6%、8.3%和7.2%。结果提示, 当使用OPA表面修饰CSQDs, 使其由脂溶性转为水溶性时, CSQDs的表面结构发生改变可导致量子效率显著降低。这一现象也存在于对其他量子点的修饰[23, 24]。
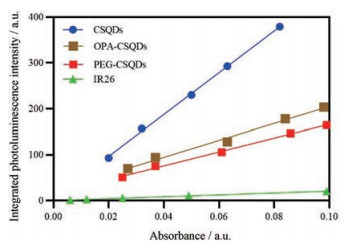
|
Figure 4 Integrated emission intensities of IR26 in 1, 2-dichloroethane, CSQDs in chloroform, OPA-CSQDs or PEG-CSQDs in water as a function of absorbance at 808 nm, respectively |
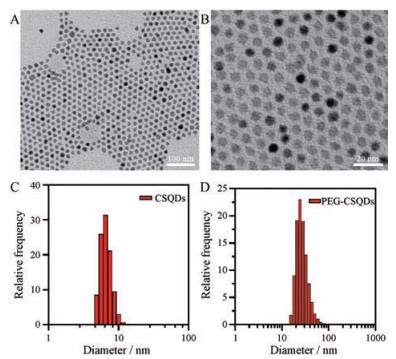
如图 5所示, 所合成的CSQDs的粒径为5.4 ± 0.4 nm, PEG修饰后的CSQDs粒径为27.9 ± 1.4 nm。
|
Figure 5 Transmission electron micrographs of CSQDs (A, B). Size-distribution histogram of CSQDs (C) and PEG-CSQDs (D), respectively |
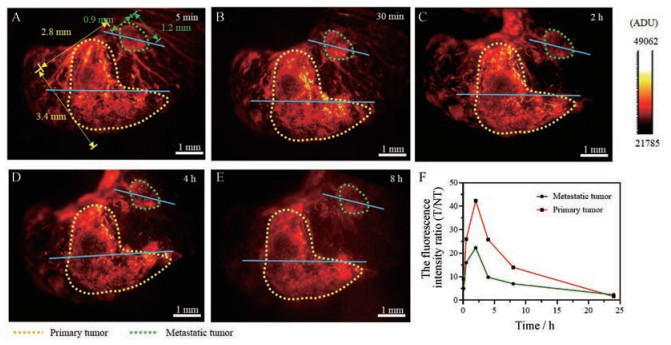
如图 6所示, 小鼠尾静脉注射PEG-CSQDs 5 min后, PEG-CSQDs由血管渗入肿瘤部位。随着时间的延长, PEG-CSQDs进一步从血管渗透蓄积于肿瘤部位。测得原位瘤的尺寸为3.4 mm×2.5 mm, 转移瘤的尺寸为1.2 mm×0.9 mm。注射后2 h, PEG-CSQDs在肿瘤部位的积累达到最高, 扣除背景信号后的原位肿瘤与周边正常组织的荧光信号强度比为42.3, 转移肿瘤与周边正常组织的荧光信号强度比为22.3。在注射后24 h, 肿瘤部位的平均荧光强度与正常组织接近。
|
Figure 6 In vivo fluorescence imaging of PEG-CSQDs in colon cancer. A-E: The NIR-Ⅱb fluorescence images were collected at 5 min, 0.5, 2, 4 and 8 h after intravenous injection, respectively; F: The fluorescence intensity ratio of tumor (T) to normal tissue (NT) over time after the intravenous injection. The fluorescence signals on the blue lines or of the background in the images were quantified. The fluorescence intensity ratio was thus calculated: (signal of tumor - signal of background) / (signal of normal tissue - signal of background) |
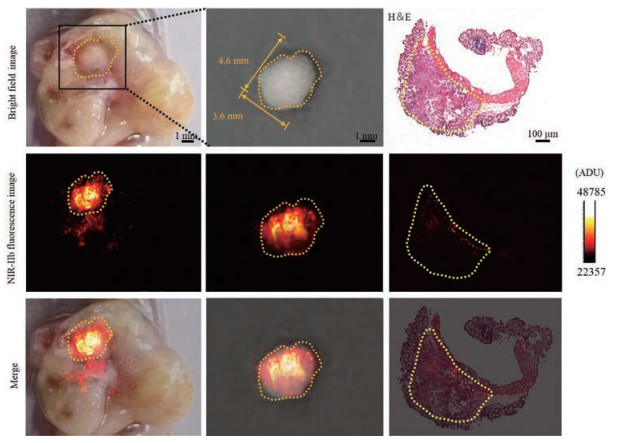
如图 7所示, 尾静脉注射2 h后PEG-CSQDs可对肿瘤的大小和位置实现完整清晰的NIR-Ⅱb荧光成像。在影像指导下切除肿瘤, NIR-Ⅱb荧光成像显示切除肿瘤的尺寸为4.6 mm×3.6 mm。切除组织冰冻切片的NIR-Ⅱb荧光显像及H & E染色结果证实PEG-CSQDs定位于肿瘤组织。
|
Figure 7 Intraoperative NIR-Ⅱb fluorescence imaging of orthotopic CT26-Luc colon tumor of mice (left column), the resected tumor under the guidance of NIR-Ⅱb fluorescence imaging (middle column), and the histologic analysis of the resected tumor (right column). Circle area represents tumor region |
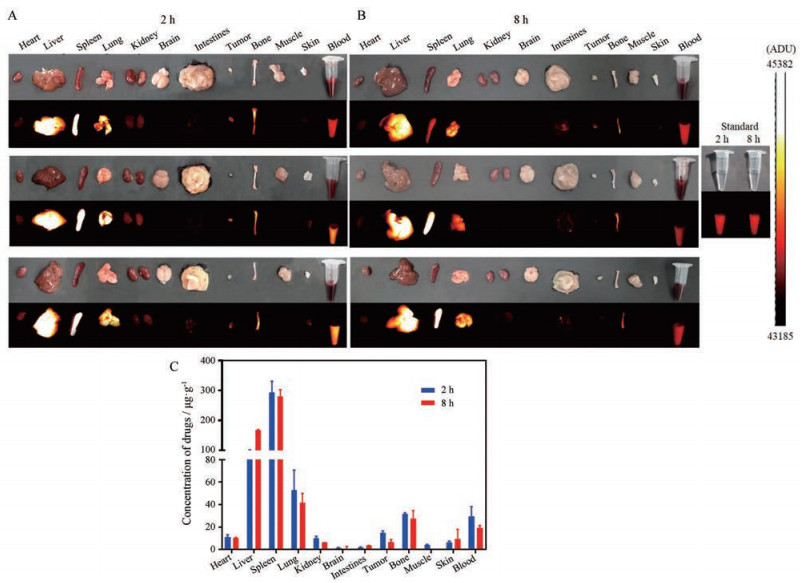
由图 8可见, 静脉注射的PEG-CSQDs在小鼠的肝脏和脾脏分布最高。注射2 h后, PEG-CSQDs在肿瘤组织中的分布是正常肠道中的(8.2 ± 0.6)倍; 肿瘤部位PEG-CSQDs蓄积在8 h时明显下降, 此比例下降为(1.9 ± 0.2)倍。这一结果证实了PEG-CSQDs在注射2 h后达到最佳的信噪比和影像效果。
|
Figure 8 Biodistribution of PEG-CSQDs in mice bearing CT26-luc orthotopic tumor at 2 h (A) and 8 h (B) after iv injection of PEG-CSQDs (2 mg·mL-1, 200 μL), respectively. The volume of each blood sample was 100 μL. Standard, 4 μg of PEG-CSQDs. Tissue distribution of the fluorescence probes was calculated based on the fluorescence intensity of tissues in the images (C). n = 3, |
本研究采用PbS为主要材料, 通过控制反应温度和时间, 调节PbS QDs的尺寸, 合成了发射峰为~1 550 nm的NIR-Ⅱb PbS QDs。通过阳离子交换反应, 将PbS外层钝化, 减少PbS核与环境的相互作用, 可获得更好的稳定性[19]。PbS QDs的发射波长与反应温度和时间相关。在一定范围内, 随反应温度提高和反应时间延长, PbS QDs核尺寸增加, 发射光谱红移。按此规律可获得不同发射波长的PbS QDs。由于CdS壳层的形成依赖于阳离子交换, 在整个反应过程中, CSQDs的整体尺寸保持不变, 随着CdS壳层厚度的增加, PbS的核尺寸减小, 使得CSQDs的发射峰蓝移。
在CSQDs合成中, 以油胺作为保护剂, 制得油溶性的CSQDs。需使用生物相容性材料对其修饰, 以使其注射后在体内环境中稳定, 而不会引发聚集[22]。本研究使用一种两亲性聚合物即OPA作为CSQDs的表面涂层。OPA与CSQDs在有机相中混合, OPA聚合物疏水尾端插入QDs表面的油酸烷基链, 通过多个烷基链之间的范德华力/疏水作用形成有序的致密结构。在此过程中, OPA聚合物骨架上丰富的羧基使得CSQDs可以在水相中分散, 并提供了下一步与PEG连接的官能团。但OPA修饰降低了CSQDs量子效率, 这是由于OPA覆盖在CSQDs表面, 改变CSQDs的表面状态, 从而导致发光效率发生变化[23, 24]。OPA修饰后, 使得CSQDs发射峰红移, 但仍满足NIR-Ⅱb成像的需求。
作者前期的研究结果显示, 与吲哚菁绿介导的NIR-Ⅰ荧光成像效果相比, NIR-Ⅱ (1 000~1 300 nm)荧光探针BPBBT的荧光成像具有低的结肠癌成像背景干扰, 克服了假阳性结果[21]。本研究的NIR-Ⅱb PEG-CSQDs与BPBBT相比, PEG-CSQDs具有更长的荧光发射波长、更深的组织荧光穿透能力、更高信噪比及更强的抗光漂白能力, 可作为一种优良的荧光探针。同时, PEG-CSQDs的量子效率是BPBBT的3倍左右, 具有更高的量子效率。
本研究采用小鼠原位结肠癌模型评价所制备的PEG-CSQDs对早期肿瘤的NIR-Ⅱb荧光成像效果。结果证明, PEG-CSQDs注射后可在肿瘤部位富集, 使得荧光明显增强, 最小可对1.2 mm×0.9 mm的转移瘤实现清晰的显像。因此, PEG-CSQDs对于结肠肿瘤, 特别是对于微小肿瘤, 具有良好的显像和定位效果, 展现出其作为一种高亮度NIR-Ⅱb荧光探针应用于结肠癌的早期诊断及手术指导的潜能。此外, 由于PEG-CSQDs的肿瘤成像机制是其通过EPR效应富集于肿瘤部位, 因此可以推断PEG-CSQDs对于除结肠癌以外其他具有EPR效应的肿瘤也会展现出良好的早期诊断和手术导航的潜力。
| [1] |
Jeong S, Song J, Lee W, et al. Cancer-microenvironment-sensitive activatable quantum dot probe in the second near-infrared window[J]. Nano Lett, 2017, 17: 1378-1386. DOI:10.1021/acs.nanolett.6b04261 |
| [2] |
Park Y, Ryu YM, Jung Y, et al. Spraying quantum dot conjugates in the colon of live animals enabled rapid and multiplex cancer diagnosis using endoscopy[J]. ACS Nano, 2014, 9: 8896-8910. |
| [3] |
Brunetti J, Riolo G, Gentile M, et al. Near-infrared quantum dots labelled with a tumor selective tetrabranched peptide for in vivo imaging[J]. J Nanobiotechnol, 2018, 16: 21-31. DOI:10.1186/s12951-018-0346-1 |
| [4] |
Cai Y, Wei Z, Song C, et al. Optical nano-agents in the second near-infrared window for biomedical applications[J]. Chem Soc Rev, 2019, 48: 22-37. DOI:10.1039/C8CS00494C |
| [5] |
Matea CT, Mocan T, Tabaran F, et al. Quantum dots in imaging, drug delivery and sensor applications[J]. Int J Nanomed, 2017, 12: 5421-5431. DOI:10.2147/IJN.S138624 |
| [6] |
Zhang MX, Yue JY, Cui R, et al. Bright quantum dots emitting at approximately 1600 nm in the NIR-Ⅱb window for deep tissue fluorescence imaging[J]. Proc Natl Acad Sci U S A, 2018, 115: 6590-6595. DOI:10.1073/pnas.1806153115 |
| [7] |
Ahmed SR, Dong JH, Yui M, et al. Quantum dots incorporated magnetic nanoparticles for imaging colon carcinoma cells[J]. J Nanobiotechnol, 2013, 11: 28-37. DOI:10.1186/1477-3155-11-28 |
| [8] |
Tsukasaki Y, Morimatsu M, Nishimura G, et al. Synthesis and optical properties of emission-tunable PbS/CdS core-shell quantum dots for in vivo fluorescence imaging in the second near-infrared window[J]. RSC Adv, 2014, 4: 41164-41171. DOI:10.1039/C4RA06098A |
| [9] |
Wang JH, Fan J, Li JC, et al. In-capillary probing of quantum dots and fluorescent protein self-assembly and displacement using forster resonance energy transfer[J]. J Sep Sci, 2017, 40: 933-939. DOI:10.1002/jssc.201600937 |
| [10] |
Huang ZY, Xu ZH, Mahboub M, et al. PbS/CdS core-shell quantum dots suppress charge transfer and enhance triplet transfer[J]. Angew Chem Int Ed Engl, 2017, 56: 16583-16587. DOI:10.1002/anie.201710224 |
| [11] |
Yong KT, Roy I, Ding H, et al. Biocompatible near-infrared quantum dots as ultrasensitive probes for long-term in vivo imaging applications[J]. Small, 2009, 5: 1997-2004. DOI:10.1002/smll.200900547 |
| [12] |
Guan XW, Guo ZP, Wang TH, et al. A pH-responsive detachable peg shielding strategy for gene delivery system in cancer therapy[J]. Biomacromolecules, 2017, 18: 1342-1349. DOI:10.1021/acs.biomac.7b00080 |
| [13] |
Ju L, Zhang GL, Zhang C, et al. Quantum dot-related genotoxicity perturbation can be attenuated by PEG encapsulation[J]. Mutat Res, 2013, 753: 54-64. DOI:10.1016/j.mrgentox.2013.01.006 |
| [14] |
Pan QB, Zhang J, Li X, et al. Preparation and in vitro evaluation of phospholipid-coated silver-graphene quantum dot multifunctional nanoparticles[J]. Acta Pharm Sin (药学学报), 2019, 54: 366-372. |
| [15] |
Ye XY, Mei L. The black phosphorus quantum dots-based photothermal effect on dendritic cells activation[J]. Acta Pharm Sin (药学学报), 2019, 54: 1297-1302. |
| [16] |
Jeong S, Jung YB, Bok S, et al. Multiplexed in vivo imaging using size-controlled quantum dots in the second near-infrared window[J]. Adv Healthc Mater, 2018. DOI:10.1002/adhm.201800695 |
| [17] |
Kong YF, Chen J, Fang HW, et al. Highly fluorescent ribonuclease-A-encapsulated lead sulfide quantum dots for ultrasensitive fluorescence in vivo imaging in the second near-infrared window[J]. Chem Mater, 2016, 28: 3041-3050. DOI:10.1021/acs.chemmater.6b00208 |
| [18] |
Zhang MX, Huang BH, Sun XY, et al. Clickable gold nanoparticles as the building block of nanobioprobes[J]. Langmuir, 2010, 26: 10171-10176. DOI:10.1021/la100315u |
| [19] |
Zhou M, Nakatani E, Gronenberg LS, et al. Peptide-labeled quantum dots for imaging GPCRs in whole cells and as single molecules[J]. Bioconjug Chem, 2007, 18: 323-332. DOI:10.1021/bc0601929 |
| [20] |
Zhao HG, Chaker M, Ma DL. Effect of CdS shell thickness on the optical properties of water-soluble, amphiphilic polymer-encapsulated PbS/CdS core/shell quantum dots[J]. J Mater Chem, 2011, 21: 17483-17491. DOI:10.1039/c1jm12864g |
| [21] |
Gao S, Wei GG, Zhang SH, et al. Albumin tailoring fluorescence and photothermal conversion effect of near-infrared-Ⅱ fluorophore with aggregation-induced emission characteristics[J]. Nat Commun, 2019, 10: 2206-2221. DOI:10.1038/s41467-019-10056-9 |
| [22] |
Taniguchi S, Sandiford L, Cooper M, et al. Hydrophobin-encapsulated quantum dots[J]. ACS Appl Mater Interfaces, 2016, 8: 4887-4893. DOI:10.1021/acsami.5b11354 |
| [23] |
Hu R, Law WC, Lin GM, et al. PEGylated phospholipid micelle-encapsulated near-infrared PbS quantum dots for in vitro and in vivo bioimaging[J]. Theranostics, 2012, 2: 723-733. DOI:10.7150/thno.4275 |
| [24] |
Drozd D, Zhang HY, Goryacheva I, et al. Silanization of quantum dots:challenges and perspectives[J]. Talanta, 2019. DOI:10.1016/j.talanta.2019.120164 |
 2020, Vol. 55
2020, Vol. 55


