作者贡献:万方劼、陈斌龙、杨林洁、张强及汪贻广参与选题及实验设计; 万方劼主要负责大部分实验的进行, 陈斌龙、杨林洁、殷晴晴、鄢月及杨晔进行指导及辅助; 万方劼负责处理分析数据及起草该文章; 万方劼、陈斌龙及汪贻广对该文章进行修改。
利益冲突:全体作者声明: ①未从任何可能存在利益冲突的组织获得财务或其他方面的支持; ②无任何其他关系或活动可能会影响所提交的科研成果。
脂质体具有增溶、减毒及高组织相容性等优势, 是纳米药物领域的研究热点[1, 2]。脂质体技术临床转化前景良好, 目前已有20多种脂质体药物被批准上市[3]。然而, 传统的薄膜法及逆向蒸发法等被动载药方法载药效率低、稳定性差、体内递送时极易出现药物“突释”, 导致严重的毒副作用[4, 5]。主动载药技术的出现显著提高了脂质体载药效率及稳定性。1986年, Bally等[6, 7]首次采用pH梯度法实现了对多柔比星高效稳定的主动包载。1995年, 采用硫酸铵梯度法载药的长循环脂质体Doxil®被FDA批准上市, 通过使药物在脂质体内部形成结晶而高效稳定包载于脂质体内腔中[8]。随后, 又出现了醋酸钙梯度法等适用于不同性质药物的主动载药方法[9, 10]。
2000年, 首个光动力抗新生血管治疗(anti-neovascular therapy, ANET)用脂质体Visudyne®被FDA批准上市, 适用于年龄相关性黄斑变性(age-related macular degeneration, AMD)[11]。光动力治疗通过使用特定波长激光及光敏剂产生单线态氧杀伤细胞, 具有低创、低毒及精准等优点[12]。Visudyne®采用反复冻融法将光敏剂维替泊芬(BPD)被动包载到脂质体脂膜上, 入血后迅速解散, 通过与载脂蛋白结合递送, 使BPD特异性蓄积至脉络膜新生血管[13, 14]。肿瘤中同样存在许多新生血管为其提供营养, 靶向破坏肿瘤新生血管, 可以显著抑制肿瘤生长[15, 16]。相比于仅靶向肿瘤实质细胞, 靶向肿瘤新生血管的治疗对肿瘤血管密度依赖性低, 普适性强, 且无不可逆耐药现象[17]。但当Visudyne®应用于肿瘤的ANET中, 存在药物包载不稳定、毒性大、代谢快及靶向能力不足等问题, 导致肿瘤难以被根除。
肿瘤血管上存在许多如磷脂酰丝氨酸等带负电荷的大分子, 并且缺乏糖蛋白涂层, 从而形成具有较大负电荷的血管内皮细胞表面[18, 19]。阳离子脂质体可通过静电吸附及高渗透长滞留效应, 将药物靶向递送到肿瘤新生血管内皮细胞[19]。也有研究发现, 正电荷修饰可增强肿瘤细胞内化, 提高药物在肿瘤中特异性蓄积量, 肿瘤新生血管及实质细胞双重靶向可显著提高治疗效果[20]。
为克服Visudyne®肿瘤治疗中的局限性, 本研究构建了一种主动包载BPD的稳定阳离子脂质体(CLL), 通过静电吸附增强其新生血管及肿瘤靶向能力以提高光动力疗效, 并对其基本性质、细胞靶向性、光动力细胞杀伤效应及体内行为进行探究。
材料与方法材料与试剂 氢化大豆磷脂(HSPC)、二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000 (DSPE-PEG2000) (美国Sigma-Aldrich公司); (2, 3-二油酰基-丙基)-三甲胺(DOTAP, 上海艾伟拓医药科技有限公司); 胆固醇、醋酸钙、曲拉通X-100 (Triton X-100) (北京百灵威科技有限公司); BPD (上海先辉医药科技有限公司); RPMI 1640培养基、F12K培养基、内皮细胞生长添加剂和肝素(ECGS/H)、0.25%含EDTA胰蛋白酶、L-谷氨酰胺、青霉素-链霉素双抗(北京中科迈晨科技有限公司); 胎牛血清(FBS, 德国PAN-Biotech公司)。
仪器 690 nm激光器(中国长春镭仕光电有限公司); 紫外-可见分光光度仪(UH5300)、荧光光谱仪(F7000) (日本HITACHI公司); 纳米粒度及Zeta电位分析仪(Zetasizer Nano ZSP, 美国Malvern公司); 流式细胞仪(CytoFLEX S, 美国Beckman Coulter公司); 共聚焦荧光显微镜(TCS-SP8, 德国Leica公司; LSM880, 德国Zeiss公司); 小动物活体成像系统(IVIS SPECTRUM, 美国Perkinelmer公司)。
细胞培养 ①人脐静脉内皮细胞株HUVEC-C购自中国医学科学院基础医学研究所, 用含有0.04 mg·mL-1 ECGS、0.1 mg·mL-1肝素、100 μg·mL-1双抗、1% L-谷氨酰胺和10% FBS的F12K培养基进行培养。细胞生长至汇合度约80%, 用0.25%含EDTA胰蛋白酶进行消化, 以1:3的传代比例进行培养; ②小鼠乳腺癌细胞株4T1购自中国医学科学院基础医学研究所, 用含有100 μg·mL-1双抗、1% L-谷氨酰胺和10% FBS的RPMI1640培养基进行培养。细胞生长至汇合度约80%, 用0.25%含EDTA胰蛋白酶进行消化, 以1:8的传代比例进行培养。
实验动物 BALB/c小白鼠(雌性, 近交系, 18~20 g), 购自北京大学医学部实验动物科学部, 许可证号: SCXK (京) 2016-0010。动物于无菌条件下饲养及进行实验操作(温度20~25 ℃, 湿度50%~60%)。动物实验均按照北京大学医学部实验动物伦理委员会及国际动物实验的指导原则进行。
脂质体的制备 采用薄膜分散法制备主动载药脂质体(liposome with drug active-loaded in lumen, LL)、主动载药阳离子脂质体(CLL)、被动载药脂质体(liposome with drug passive-loaded in membrane, ML)、被动载药阳离子脂质体(cationic liposome with drug passive-loaded in membrane, CML)及DiO标记的空白脂质体。
LL及CLL的制备 精密称取处方量(表 1)的HSPC、DSPE-PEG2000及胆固醇于茄形瓶中, 加入约10 mL三氯甲烷充分溶解。37 ℃水浴条件下减压旋蒸抽去溶剂至形成均匀薄膜。加入适量130 mmol·L-1醋酸钙水化液(冰醋酸调pH = 6.0), 于70 ℃水浴条件下水化约15 min。使用超声破碎仪对脂质体悬液进行超声至其呈现淡蓝色乳光。使用脂质体挤出器及0.1 μm孔径的聚碳酸酯膜对脂质体进行整粒。待其冷却至室温, 过Sephadex G-50凝胶柱除去游离醋酸钙, 得到空白脂质体。加入脂材总质量2%的BPD溶液(6 mg·mL-1), 于70 ℃水浴条件下载药1 h。待溶液冷却至室温, 过Sephadex G-50凝胶柱除去游离BPD, 得到LL。于70 ℃水浴条件下, 向LL溶液中加入脂材总质量15%的DOTAP乙醇溶液(50 mg·mL-1), 共同孵育30 min。待溶液冷却至室温, 过Sephadex G-50凝胶柱除去游离DOTAP, 得到CLL。
| Table 1 Formulation of cationic liposome with drug active-loaded in lumen (CLL). HSPC: Hydrogenated soybean phosphatidylcholine; Chol: Cholesterol; DSPE-PEG2000: 1, 2-Distearoyl-sn-glycero-3-phosphoethanol-amine-N-[methoxy(polyethylene glycol)-2000]; DOTAP: (2, 3-Dioleoy-loxy-propyl)-trimethylammonium |
ML及CML的制备 精密称取处方量(表 1)的HSPC、DSPE-PEG2000、胆固醇及脂材总质量2%的BPD于茄形瓶中, 加入三氯甲烷充分溶解。37 ℃减压旋蒸形成均匀薄膜。加入适量0.9% NaCl溶液, 70 ℃水化15 min。使用超声破碎仪对脂质体悬液进行超声, 并使用脂质体挤出器进行整粒, 得到ML。按照CLL制备过程进行DOTAP的插膜, 得到CML。
DiO标记的空白脂质体的制备 精密称取各脂材, 加入脂材总质量0.1%的DiO。不进行BPD包载, 其余制备步骤同上, 得到DiO标记的空白脂质体。
CLL的表征 使用紫外-可见分光光度计测定纯化前后CLL溶液中BPD浓度, 过柱前脂质体溶液中的药物浓度记为Cb, 过柱前脂质体溶液体积记为Vb, 过柱后脂质体溶液中的药物浓度记为Ca, 过柱后脂质体溶液体积记为Va。包封率(EE)计算公式如下:
| $ {\rm{EE}}\left( \% \right) = \left( {{C_{\rm{a}}} \times {V_{\rm{a}}}} \right)/\left( {{C_{\rm{b}}} \times {V_{\rm{b}}}} \right) \times 100\% $ | (1) |
使用纳米粒度及Zeta电位分析仪测定插入DOTAP前后制剂的粒径以及zeta电位的变化。采用磷钨酸负染法进行电镜样品的制备, 使用场发射透射电镜(TEM)得到制剂形态图像。
荧光开关效应 用Triton X-100完全破坏CLL, 得到解散态样品(disrupted, on-state)。用0.9% NaCl溶液同比例稀释制剂, 得到完整态样品(intact, off-state)。使用荧光光谱仪测量CLL解散及完整状态时λem = 690 nm处BPD荧光强度, 并计算荧光信号放大倍数(RF), 计算公式如下:
| $ {\rm{RF}} = {F_{{\rm{on}}}}/{F_{{\rm{off}}}} $ | (2) |
使用小动物活体成像系统对CLL解散及完整状态进行成像(λex = 675 nm, λem = 720 nm)。
单线态氧开关效应 采用电子顺磁共振(electron spin resonance, ESR)检测自由基的产生。将样品稀释于用重水配置的四甲基-4-哌啶酮(5 μmol·L-1)中, 并置于玻璃毛细管中进行检测, 每个样品扫描4遍, 每次1 min。CLL的解散态样品和完整态样品分别用690 nm激光器50 mW·cm-2进行光照, 每次光照1 min, 光照后立即取样进行检测得到相应吸收曲线。
体外稳定性 用含10% FBS的生理盐水将ML、CML、LL及CLL共4种制剂分别稀释至BPD质量浓度为5 μg·mL-1, 置于37 ℃水浴条件下进行稳定性实验。在0、2、4、16及24 h取样, 使用荧光光谱仪测量λem = 690 nm处BPD荧光强度。制剂稀释后立即测量的荧光强度, 记为F0 h; 不同时间点取样测得的荧光强度, 记为Fi h; 用Triton X-100充分破坏同浓度制剂测得的荧光强度, 记为Fon。BPD泄漏率(leakage, L)计算公式如下:
| $ L\left( \% \right) = \left( {{F_{i\;{\rm{h}}}} - {F_{0\;{\rm{h}}}}} \right)/\left( {{F_{{\rm{on}}}} - {F_{0\;{\rm{h}}}}} \right) \times 100\% $ | (3) |
流式细胞技术定量检测 将HUVEC细胞和4T1细胞分别以8×104个/孔、2×104个/孔接种于12孔板中, 孵育过夜。① DiO空白脂质体的细胞摄取: DiO标记的LL及CLL分别用完全培养基稀释至DiO质量浓度为0.25 μg·mL-1, 每孔加入500 μL, 于37 ℃孵育30 min。弃去制剂, 用磷酸盐缓冲液(PBS)清洗3次, 每孔加入250 μL胰蛋白酶进行消化。1 500 r·min-1离心3 min收集细胞, 用PBS清洗3次后, 最终用PBS重悬。过300目细胞筛形成单细胞悬液, 采用流式细胞仪检测单细胞中DiO的荧光强度(λex = 488 nm, λem = 525/ 20 nm BP)。以空白培养液处理组为细胞本底信号, 每个样品收集10 000个细胞。②载药脂质体的细胞摄取:包载BPD的LL及CLL分别用完全培养基稀释至BPD质量浓度为5 μg·mL-1, 每孔加入500 μL, 于37 ℃分别孵育5、15及30 min。后续实验操作同上, 采用流式细胞仪检测单细胞中BPD的荧光强度(λex = 638 nm, λem = 660/20 nm BP)。
共聚焦显微镜定性检测 将HUVEC细胞和4T1细胞分别接种于8孔腔室中, 孵育过夜。① DiO空白脂质体的细胞摄取: DiO标记的LL及CLL分别稀释至DiO质量浓度为0.25 μg·mL-1, 每孔加入200 μL, 于37 ℃分别孵育5、15及30 min。弃去制剂, PBS清洗3次。每孔加入5 μg·mL-1 Hoechst 33342细胞核染液200 μL, 于37 ℃孵育约15 min, 使用共聚焦显微镜进行图像采集。②载药脂质体的细胞摄取:包载BPD的LL及CLL分别稀释至BPD质量浓度为5 μg·mL-1, 后续实验操作同上。
胞内单线态氧的生成 采用本实验室设计合成的SOSG单线态氧纳米探针, 检测细胞内单线态氧的生成。将HUVEC细胞和4T1细胞分别以8×104个/孔、2×104个/孔接种于12孔板中, 孵育过夜。CLL和LL稀释至BPD质量浓度为5 μg·mL-1, 每孔加入500 μL, 于37 ℃孵育15 min。弃去制剂, 用PBS清洗3次。SOSG单线态氧纳米探针用不含FBS的培养基稀释配制, 每孔加入500 μL, 37 ℃孵育1 h, 后续流式样品处理方法同上。用690 nm激光器50 mW·cm-2对上述细胞悬液进行光照, 分别连续照射10、20、30 s及1 min。每次光照结束立即测量(FITC通道), 得到累计光照时间10、30 s及1、2 min时SOSG的荧光强度, 以SOSG荧光强度-累计光照时间作图。
MTT细胞毒性检测 将HUVEC细胞和4T1细胞分别以8 000个/孔和2 000个/孔接种于96孔板中, 孵育过夜。CLL及LL稀释至BPD质量浓度为5 μg·mL-1, 每孔加入100 μL, 37 ℃孵育15 min。弃去制剂, 用PBS清洗3次, 每孔加入100 μL无酚红完全培养基, 37 ℃孵育1 h。使用690 nm激光器光照30 s, 光照功率分别为50、100和150 mW·cm-2。光照结束后, 继续在37 ℃孵育9 h。吸去旧培养基, 加入100 μL MTT工作液继续孵育4 h。孵育结束, 加入DMSO于37 ℃避光振摇30 min。使用酶标仪检测540 nm处吸光度(A)值, 将实验组A值记为As, 对照组A值记为Ac, 空白组A值记为Ab, 细胞存活率(V)计算公式如下:
| $ V\left( \% \right) = \left( {{A_{\rm{s}}} - {A_{\rm{b}}}} \right)/\left( {{A_{\rm{c}}} - {A_{\rm{b}}}} \right)) \times 100\% $ | (4) |
乳酸脱氢酶(LDH)细胞毒性检测 给药及光照步骤同MTT法, 培养基进行热灭活处理(56 ℃, 30 min)。取各孔培养基上清液120 μL, 分别加入LDH检测工作液60 μL。室温避光振摇30 min, 使用酶标仪检测490 nm处A值, 将实验组A值记为As, 对照组A值记为Ac, 细胞完全裂解组A值记为Amax, LDH释放百分比计算公式如下:
| $ {\rm{LDH}}\left( \% \right) = \left( {{A_{\rm{s}}} - {A_{\rm{c}}}} \right)/\left( {{A_{{\rm{max}}}} - {A_{\rm{c}}}} \right) \times 100\% $ | (5) |
Calcein-AM/PI细胞染色 将HUVEC细胞及4T1细胞接种于8孔腔室中, 孵育过夜。CLL及LL稀释至BPD质量浓度为5 μg·mL-1, 每孔加入200 μL, 37 ℃孵育15 min。弃去制剂, 加入无酚红完全培养基继续孵育1 h。使用690 nm激光器50 mW·cm-2光照30 s。光照结束后继续孵育约20 min, 至使用光学显微镜可观察到光照组细胞发生皱缩。每孔加入Calcein-AM检测工作液(4 μmol·L-1) 200 μL, 37 ℃孵育30 min。吸去染液, 每孔加入PI检测工作液(2 μmol·L-1) 200 μL, 37 ℃孵育15 min。再吸去染液, 每孔加入无酚红培养基200 μL, 并立即使用共聚焦显微镜进行图像采集。
Annexin V/PI凋亡细胞检测 ①共聚焦定性检测:给药及光照步骤同Calcein-AM/PI活死细胞染色。吸去旧培养基, 加入Annexin V工作液, 室温孵育30 min。吸去染液, 加入PI工作液室温孵育10 min, 立即使用共聚焦显微镜采集图像。②流式定量测量:将HUVEC细胞及4T1细胞接种于6孔板中, 孵育过夜。给药及光照步骤同Calcein-AM/PI活死细胞染色。吸去旧培养基, 每孔加入500 μL不含EDTA的胰蛋白酶进行消化。1 500 r·min-1离心3 min收集细胞, 加入Annexin V工作液室温孵育30 min。加入PI工作液室温孵育10 min, 立即使用流式细胞仪进行检测。
药物动力学 20只BALB/c小鼠随机分为4组, 每组5只。将BPD剂量为1 mg·kg-1的CLL、LL、CML和ML制剂分别通过尾静脉注射入小鼠体内, 在给药后2、15、30 min和1、3、6、12、24 h从小鼠内眦静脉丛取血, 4 ℃条件下2 000 r·min-1离心10 min得到血浆。取上层血浆10 μL, 加入200 μL提取液提取BPD。10 000 r·min-1离心10 min, 使用荧光光谱仪对上清液中BPD含量进行测量。将2 min时样品的荧光强度作为给药后制剂血药浓度最高时的荧光强度, 计算各时间点的相对荧光强度百分比, 并以荧光强度百分比对时间进行作图。使用Das2.0软件, 采用非房室模型的统计矩方法进行拟合, 计算得到药物动力学参数。
组织分布 9只荷4T1瘤的BALB/c小鼠随机分为3组, 每组3只。将BPD剂量为1 mg·kg-1的CLL、LL和CML制剂分别通过尾静脉注射入小鼠体内, 在给药后10 min (代表 0 h)、1、3、6、12及24 h, 使用小动物活体成像系统进行图像采集(λex = 675 nm, λem = 720 nm)。24 h成像结束后, 对小鼠进行心脏灌流并解剖得到各组织器官, 使用小动物活体成像系统进行图像采集(λex = 675 nm, λem = 720 nm)。
数据分析 采用GraphPad Prism 7软件进行处理和分析, 所有数据以平均数±标准差(
按照表 1中CLL处方组成及比例精密称取脂材, 采用薄膜水化法制备脂质体。通过醋酸钙梯度法对弱酸性光敏剂BPD进行包载后, 加入DOTAP使其插入脂质体脂膜中, 制得CLL, 见合成路线1。

|
Scheme 1 Preparation of verteporfin (BPD)-loaded CLL |
使用紫外分光光度计测得包封率及载药量分别为(98.03 ± 1.81)%及(1.96 ± 0.04)%, 结果表明该主动载药法可以成功包载BPD。为避免影响主动载药过程, 选择在载药后通过后插法[21]加入DOTAP制备CLL。插入DOTAP前后, 制剂粒径均在100 nm左右, 聚合物分散指数小于0.2, 插入过程对制剂粒径无明显影响(图 1A)。插入DOTAP后, zeta电位值由约-6 mV增加到约28 mV, 表明DOTAP插入成功(图 1B)。透射电镜图进一步证明CLL的粒径较为均匀(图 1C)。
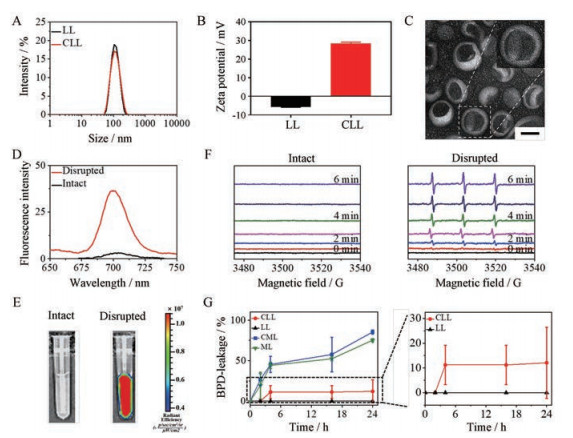
|
Figure 1 Characterization of verteprofin (BPD)-loaded liposomes. A: Size of liposome with LL and CLL; B: Zeta-potential of LL and CLL; C: TEM image of CLL. Scale bar: 50 nm; D: Fluorescence spectra of disrupted and intact CLL; E: IVIS spectrum images of disrupted and intact CLL; F: ESR absorption curve of intact and disrupted CLL with 50 mW·cm-2 690 nm laser in different time points; G: BPD leakage to time curves of CLL, LL, CML and ML in 37 ℃ saline with 10% FBS. LL: Liposome with drug active-loaded in lumen; CML: Cationic liposome with drug passive-loaded in membrane; ML: Liposome with drug passive-loaded in membrane; TEM: Transmission electron microscope; IVIS: In vivo imaging system; ESR: Electron paramagnetic resonance; FBS: Fatal bovine serum. n = 3, |
采用荧光光谱仪测得CLL荧光放大倍数约10倍, 存在荧光信号的开关效应(图 1D)。小动物活体成像结果与荧光光谱仪测得结果一致, 如图 1E所示。ESR结果表明, 当CLL结构完整时, 激光照射不会导致活性氧(reactive oxygen species, ROS)信号的产生, ROS信号为“OFF”状态; 当CLL解散时, 激光照射会导致ROS信号的产生, ROS信号为“ON”状态, ROS的产生量随光照时长增加而增加(图 1F)。荧光及ROS信号的开关效应为制剂的高效低毒递送提供保证[22, 23]。在体内血液循环中, CLL的荧光及ROS信号关闭, 可降低递送过程中的光毒性。到达靶点后荧光及ROS信号恢复, 得以发挥光动力疗效。
由体外稳定性实验可知, 相比于被动包载法, 通过主动包载法进行BPD的包载可显著减少药物的泄露率(图 1G)。阳离子脂质体(CLL及CML)药物泄露率略高于相应的非阳离子制剂组(LL及ML), 说明DOTAP的插入会对制剂稳定性有一定影响。但在24 h时CLL的药物泄露率仍低于20%, 说明其体外稳定性较好。
2 细胞摄取研究 2.1 DiO标记脂质体DiO标记空白脂质体的细胞摄取流式结果表明, HUVEC细胞及4T1细胞摄取CLL量均显著高于LL组, 证明CLL空白递送载体具有良好的血管内皮细胞靶向能力及肿瘤细胞内化增强作用(图 2A、B)。在给药剂量及测量条件一致的情况下, HUVEC细胞的CLL摄取量大约是4T1细胞的5倍, 而LL摄取量则无显著差异(荧光强度≈120)。这说明两种细胞摄取脂质体型载体的能力相近, CLL摄取量差异主要是由于HUVEC细胞表面含有更多负电荷组分导致的。HUVEC细胞的共聚焦成像结果与流式定量结果一致, 且可知DiO信号主要分布在细胞膜附近(图 2C)。一方面是由于CLL表面正电荷与HUVEC细胞膜表面负电荷静电吸附; 另一方面是由于DiO作为细胞膜标记物, 自身膜结合能力极强, 在细胞内化过程中制剂中部分DiO与细胞膜融合而滞留在膜上。
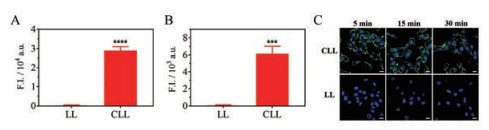
|
Figure 2 Cellular uptake of DiO-labeled liposomes. A and B: Cellular uptake of DiO-labeled LL and CLL in HUVEC cells (A) and 4T1 cells (B) after 30 min incubation measured by flow cytometry; C: Cellular uptake of DiO-labeled CLL and LL in HUVEC cells measured by confocal laser scanning microscopy. Blue: Nucleus; Green: DiO. Scale bar: 20 μm. F.I.: Fluorescence intensity. n = 3, |
载药脂质体的细胞摄取流式结果表明, 在HUVEC细胞及4T1细胞中, 各时间点CLL组BPD摄取量均高于LL组, 说明CLL可成功将BPD靶向递送至HUVEC细胞及4T1细胞(图 3A、B)。由图 3C、D可知, 随细胞摄取时间增加, CLL组与LL组BPD摄取量差异逐渐减小。这是由于细胞摄取制剂量存在饱和现象, 当CLL摄取量接近饱和时, 细胞摄取速率降低; 而此时LL摄取量未达饱和, 细胞摄取速率无明显变化。
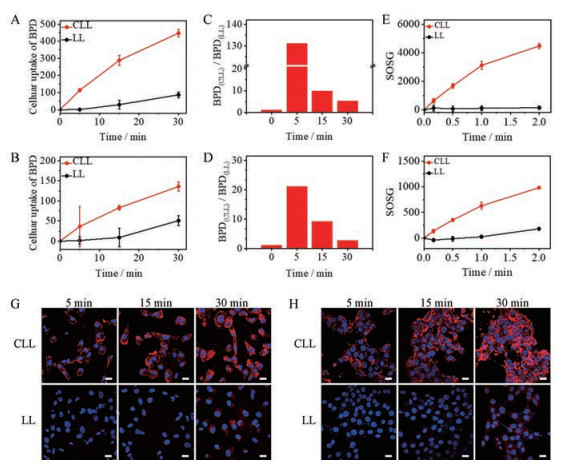
|
Figure 3 Cellular uptake of BPD-loaded (5 μg·mL-1) liposomes. A and B: Cellular uptake of BPD-loaded CLL and LL in HUVEC cells (A) and 4T1 cells (B) during 30 min incubation measured by flow cytometry; C and D: BPD mean fluorescence intensity ratio of CLL to LL in HUVEC cells (C) and 4T1 cells (D) during 30 min incubation measured by flow cytometry; E and F: Singlet oxygen yield of CLL and LL in HUVEC cells (E) and 4T1 cells (F) during 2 min irradiation measured by flow cytometry; G and H: Cellular uptake of BPD-loaded CLL and LL in HUVEC cells (G) and 4T1 cells (H) during 30 min incubation measured by confocal laser scanning microscopy. Blue: Nucleus; Red: BPD. Scale bar: 20 μm. n = 3, |
胞内单线态氧生成能力实验结果如图 3E、F所示。由该结果可知, 在HUVEC细胞及4T1细胞中, 由于制剂摄取量差异, CLL组细胞单线态氧产生量均远高于LL组。给药剂量为5 μg·mL-1条件下, 单线态氧的产生量随激光照射时间的增加而增加。在光照初始阶段, HUVEC细胞和4T1细胞中单线态氧产生量迅速增加, 增长曲线斜率大。当累计光照时间超过1 min, HUVEC细胞和4T1细胞中CLL组单线态氧增长曲线斜率明显降低, 单线态氧产生速率减慢。并且在4T1细胞中, 累计光照时间超过1 min后LL组单线态氧产生速率明显加快。光照时间30 s时CLL组与LL组单线态氧产生量差异最大, 所以最终选择30 s作为后续细胞水平光动力治疗最佳光照时长。
如图 3G、H所示, HUVEC细胞及4T1细胞共聚焦成像定性结果与流式定量结果一致。由BPD信号分布情况可知, 由于表面带有正电荷, 短时间(5 min)内CLL组BPD信号主要分布在细胞膜附近, 随摄取时间延长(30 min)细胞内BPD信号增强; 而LL组则无明显的细胞膜吸附现象。综合上述结果可知, 当细胞摄取时间为15 min时, CLL摄取量较高, 且在HUVEC细胞及4T1细胞中CLL和LL摄取量比值约10倍, 差异显著, 所以选择制剂摄取时间15 min进行后续细胞实验。
3 细胞杀伤能力研究由MTT细胞毒实验结果可知, 在HUVEC细胞和4T1细胞中, 单独光照组及单独给药组细胞存活率在80%以上, 说明激光以及制剂本身毒性较低。相同给药剂量及光照条件下, CLL组细胞存活率均低于LL组, CLL组药效更强。随激光照射功率增加, CLL组与LL组细胞存活率差异逐渐减小(图 4A)。对于4T1细胞, 150 mW·cm-2照射功率条件下CLL与LL的细胞毒性已无显著差异。相同条件下, 4T1细胞的CLL摄取量明显少于HUVEC细胞, 但其CLL组细胞存活率与HUVEC细胞相比无明显增加; 4T1细胞及HUVEC细胞的LL摄取量相近, 但在100 mW·cm-2照射功率条件下, 4T1细胞存活率约20%, HUVEC细胞存活率却有40%左右。该结果表明, 相比于HUVEC细胞, 4T1细胞对于光动力治疗更敏感。LDH细胞毒实验结果与MTT实验结果一致(图 4B)。上述实验结果显示, 50 mW·cm-2照射功率条件下CLL组与LL组间药效差异最明显, 为最佳光照功率。
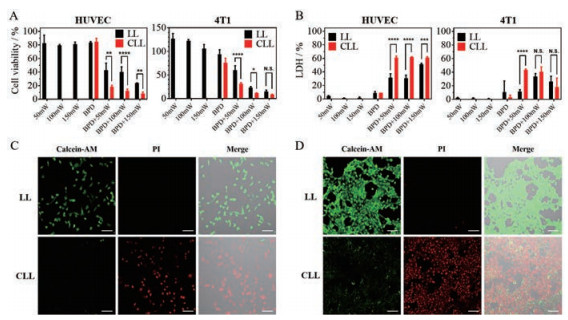
|
Figure 4 Cytotoxicity assay of CLL and LL. A: MTT assay of CLL and LL with different laser dosage in HUVEC cells and 4T1 cells; B: Lactic dehydrogenase (LDH) release assay of CLL and LL with different laser dosage in HUVEC cells and 4T1 cells; C and D: Calcein-AM/PI double stain images of CLL and LL with 50 mW·cm-2 laser in HUVEC cells (C) and 4T1 cells (D) measured by confocal laser scanning microscopy. Green: Calcein-AM; Red: PI. Scale bar: 200 μm. n = 3, |
按照给药剂量5 μg·mL-1及50 mW·cm-2光照功率照射30 s条件进行Calcein-AM/PI细胞共聚焦成像。Calcein-AM能被活细胞摄取而使活细胞标记为绿色, 而PI则只能渗透进入死细胞内呈现红色荧光, Calcein-AM/PI活死细胞共聚焦成像结果如图 4C、D所示。HUVEC细胞及4T1细胞经光动力治疗后, CLL组细胞几乎全部被PI标记而无Calcein信号, 细胞死亡率高; 而LL组细胞几乎全部被Calcein标记而无PI信号, 细胞死亡率极低。该实验证明CLL光动力治疗药效显著强于LL。
Annexin V-FITC/PI凋亡细胞共聚焦成像结果如图 5A、B所示。HUVEC细胞及4T1细胞经光动力治疗后, CLL组中大部分细胞被Annexin V-FITC及PI标记, 细胞凋亡率高; 而LL组细胞无Annexin V-FITC/PI信号, 细胞形态呈伸展梭形, 存活状态良好。该实验结果再次证明CLL药效显著强于LL。

|
Figure 5 Apoptosis assay of CLL and LL. A and B: AnnexinV-FITC/PI apoptosis images of CLL and LL with 50 mW·cm-2 laser in HUVEC cells (A) and 4T1 cells (B) measured by confocal laser scanning microscopy. Green: Annexin V-FITC; Red: PI. Scale bar: 20 μm; C: Annexin V-FITC/PI apoptotic images of PBS, LL and CLL in HUVEC cells measured by flow cytometry; D: Percentage of apoptotic cells in HUVEC cells treated with LL and CLL. n = 3, |
使用流式细胞术对处于正常存活、早期凋亡、晚期凋亡及坏死的HUVEC细胞进行定量分析, 以Annexin V-FITC及PI荧光强度为横纵坐标进行作图, 细胞分群结果如图 5C所示。其中LL区域代表存活细胞(Annexin V-/PI-), LR区域代表凋亡早期细胞(Annexin V+/PI-), UR区域代表凋亡中晚期细胞(Annexin V+/PI+), UL区域代表坏死细胞(Annexin V-/PI+)。实验结果显示, CLL组活细胞比例低于20%, 约50%细胞处于凋亡中晚期阶段, 是LL组的10倍; 约26%细胞处于早期凋亡状态, 是LL组的3倍。此外, 光动力治疗后几乎无坏死细胞出现, 说明CLL介导光动力治疗主要诱导细胞发生凋亡而非坏死。对处于凋亡早中晚期的细胞占细胞总量的百分比进行统计, 结果显示CLL组凋亡细胞约为LL组的4倍, CLL药效更佳(图 5D)。
4 体内动力学及组织分布研究CLL、LL、CML和ML的药物动力学曲线如图 6A所示。LL、CML及ML组血药浓度随时间增加不断降低, LL的降低速率最慢。CLL组血药浓度则随时间增加先迅速降低, 然后逐渐增加, 之后再次降低。这种现象有可能是由于CLL带正电荷, 注射入血后易被血管内皮细胞吸附或分布到肺部[24-26], 血液中药物浓度迅速降低。之后富集区域的CLL缓慢入血, 血药浓度出现增高现象。而LL不带正电荷, 不易富集至其他区域, 所以血药浓度随时间增加缓慢降低。CML和ML由于采用被动载药法, 药物包载不稳定, 注射入血后药物快速泄露, 游离药物被机体迅速清除。相比ML, CML由于带正电荷, 体内循环过程中易与血浆蛋白结合, 加速制剂的清除[27]。所以注射后1 h内, CML血药浓度降低更迅速。

|
Figure 6 In vivo pharmacokinetics and biodistribution of LL, CLL and CML in mice bearing 4T1 tumor. A: Pharmacokinetics curve of LL, CLL and CML with BPD dosage of 1 mg·kg-1 (n = 5, |
使用Das2.0软件计算得到制剂的血浆清除率(表 2)。结果显示主动载药的LL及CLL的血浆清除率远低于被动载药的ML及CML, 证明主动载药能提高制剂的体内稳定性。由于携带正电荷, CLL的血浆清除率略高于LL, 但在12 h时, 仍有(7.52 ± 1.57)% CLL在体内循环, 分别是此时ML [(1.96 ± 0.10)%]及CML [(1.52 ± 0.28)%]的4倍和5倍。
|
Table 2 Plasma clearance (CL) of LL, CLL, ML and CML. n = 5, |
LL、CLL及CML静脉注射后24 h内, 荷4T1瘤小鼠活体成像结果如图 6B所示。结果显示LL及CLL在肿瘤中特异性蓄积, 而CML特异性蓄积不明显且代谢更快。这说明主动载药可显著提高制剂的体内递送稳定性, 并降低其血浆清除速率。CLL注射后1 h即可在肿瘤区域观察到特异性蓄积的制剂信号, 而LL在注射后3 h才可观察到明显蓄积。这证明了CLL正电荷靶向血管及肿瘤进而更加迅速地蓄积到靶点的优势。尽管正电荷靶向增加了CLL的肿瘤蓄积速率, 但其肿瘤蓄积峰值(6 h)低于LL组蓄积峰值(12 h)。这可能是由于肿瘤外细胞基质含有可与带电粒子发生静电吸附或排斥作用的物质, 降低带电粒子扩散速率, 而中性粒子所受影响小[28]。尽管CLL迅速蓄积至肿瘤新生血管并从血管壁渗出, 但由于肿瘤外细胞基质的阻碍作用, 不能有效扩散, 使其肿瘤蓄积量降低, 分布不均匀[29]。CML组肿瘤与周围皮肤的制剂信号强度差异小, 小鼠毛发上也有制剂信号分布。这说明CML被动载药的体内稳定性差, 注射入血后大量制剂解散使得BPD信号打开, 迅速分布至小鼠全身而难以在肿瘤组织中特异性蓄积, 这也进一步证明了主动载药法对于提高制剂稳定性的重要性。
上述实验结果显示, LL的体内生物学性质优于CLL。但根据已有文献[30]报道, 非血管靶向脂质体几乎全部蓄积至肿瘤实质细胞, 血管内皮细胞上分布极少。而阳离子脂质体尽管肿瘤渗透性较弱, 但肿瘤血管靶向性显著增强, 并且扩散进入肿瘤细胞间隙的药物可被肿瘤实质细胞大量摄取, 而中性及负电性粒子则无此效果。因此, 尽管与LL相比, CLL体内清除速率更快、肿瘤蓄积总量更低, 但仍有可能达到良好疗效, 具有研究考察意义。
制剂注射后24 h离体组织活体成像结果如图 6C所示。与在体成像结果一致, LL及CLL在肿瘤中特异性蓄积, 而CML肿瘤蓄积量极少。在制剂注射后24 h, CLL在肝脏中蓄积量低于LL组, 这是由于二者肝脏蓄积量达峰值所需时间不同。CLL在注射入血后会迅速蓄积至肝脏[31], 然后从肝脏中排泄至体外, 使得24 h时肝脏中药物蓄积量减少。而LL在体内循环时间更长, 缓慢蓄积至肝脏, 24 h时肝脏中药物蓄积量反而高于CLL组。由药代动力学曲线可知, 相同时间条件下, LL组血药浓度均高于CLL组, 这也使得LL组药物在各组织中的蓄积量增加, 制剂注射后24 h时脾、肾及皮肤中LL组药物蓄积量均略高于CLL组。
对CLL组各离体组织中制剂荧光强度进行定量分析, 结果如图 6D所示。结果显示CLL在肿瘤和肝脏中蓄积最多。根据已有文献[32]报道, 血清学检测及组织病理学分析结果显示, 在常规给药剂量下阳离子脂质体对肝脏等正常组织无明显损伤, 但可能存在一定的基因毒性。CLL在心、肺和肌肉中蓄积量很少, 这有利于降低CLL对正常组织的光毒性损伤。阳离子脂质体易在肺中蓄积并引发严重的肺部炎症[25, 33], CLL在肺中的低蓄积量有利于减少肺部炎症的发生, 提高其体内安全性。
讨论本研究设计了一种稳定包载BPD的新生血管及肿瘤靶向阳离子脂质体, 采用醋酸钙梯度法对BPD进行主动包载, 并通过后插法加入DOTAP成功制备CLL。体外表征结果显示, CLL粒径分布均一, 插入DOTAP后电位增加, 体外稳定性较被动载药法明显增强, 且具有荧光及ROS信号开关现象, 有利于CLL在血液循环及正常组织中关闭光敏效应以降低光毒性。细胞摄取及药效实验结果显示, 相比于LL, 血管内皮细胞及肿瘤细胞中CLL摄取量明显增加, 药效显著增强, 证明CLL具有良好的新生血管及肿瘤靶向能力。体内药物动力学及组织分布实验结果显示, 相比于被动载药制剂, 主动载药法可显著提高制剂体内稳定性, 降低制剂血浆清除速率, 增加药物在肿瘤中的特异性蓄积量。同时, CLL在正常组织中分布少, 有利于提高其体内安全性。综上所述, 本研究成功构建了主动稳定包载BPD的阳离子脂质体用于新生血管和肿瘤靶向的光动力治疗, 克服了被动载药制剂存在的不稳定、毒性大、代谢快及特异性蓄积少等问题, 显著提高了光动力疗效。
| [1] |
Fathi S, Oyelere AK. Liposomal drug delivery systems for targeted cancer therapy:is active targeting the best choice?[J]. Future Med Chem, 2016, 8: 2091-2112. DOI:10.4155/fmc-2016-0135 |
| [2] |
Al-Jamal WT, Kostarelos K. Liposomes:from a clinically established drug delivery system to a nanoparticle platform for theranostic nanomedicine[J]. Acc Chem Res, 2011, 44: 1094-1104. DOI:10.1021/ar200105p |
| [3] |
Crommelin DJA, van Hoogevest P, Storm G. The role of liposomes in clinical nanomedicine development. What now? Now what?[J]. J Control Release, 2020, 318: 256-263. DOI:10.1016/j.jconrel.2019.12.023 |
| [4] |
Lasic DD. The mechanism of vesicle formation[J]. Biochem J, 1988, 256: 1-11. DOI:10.1042/bj2560001 |
| [5] |
Mayer LD, Hope MJ, Cullis PR, et al. Solute distributions and trapping efficiencies observed in freeze-thawed multilamellar vesicles[J]. Biochim Biophys Acta, 1985, 817: 193-196. DOI:10.1016/0005-2736(85)90084-7 |
| [6] |
Bally MB, Mayer LD, Loughrey H, et al. Dopamine accumulation in large unilamellar vesicle systems induced by transmembrane ion gradients[J]. Chem Phys Lipids, 1988, 47: 97-107. DOI:10.1016/0009-3084(88)90078-3 |
| [7] |
Mayer LD, Bally MB, Cullis PR. Uptake of adriamycin into large unilamellar vesicles in response to a pH gradient[J]. Biochim Biophys Acta, 1986, 857: 123-126. DOI:10.1016/0005-2736(86)90105-7 |
| [8] |
Barenholz Y. Doxil(R)——the first FDA-approved nano-drug:lessons learned[J]. J Control Release, 2012, 160: 117-134. DOI:10.1016/j.jconrel.2012.03.020 |
| [9] |
Clerc S, Barenholz Y. Loading of amphipathic weak acids into liposomes in response to transmembrane calcium acetate gradients[J]. Biochim Biophys Acta, 1995, 1240: 257-265. DOI:10.1016/0005-2736(95)00214-6 |
| [10] |
Young SP, Baker E, Huehns ER. Liposome entrapped desferrioxamine and iron transporting ionophores:a new approach to iron chelation therapy[J]. Br J Haematol, 1979, 41: 357-363. DOI:10.1111/j.1365-2141.1979.tb05868.x |
| [11] |
Reeves BC, Harding SP, Langham J, et al. Verteporfin photodynamic therapy for neovascular age-related macular degeneration:cohort study for the UK[J]. Health Technol Assess, 2012, 16: i-xii, 1-200. |
| [12] |
Abrahamse H, Hamblin MR. New photosensitizers for photodynamic therapy[J]. Biochem J, 2016, 473: 347-364. DOI:10.1042/BJ20150942 |
| [13] |
Ichikawa K, Takeuchi Y, Yonezawa S, et al. Antiangiogenic photodynamic therapy (PDT) using Visudyne causes effective suppression of tumor growth[J]. Cancer Lett, 2004, 205: 39-48. DOI:10.1016/j.canlet.2003.10.001 |
| [14] |
Richter AM, Waterfield E, Jain AK, et al. Liposomal delivery of a photosensitizer, benzoporphyrin derivative monoacid ring A (BPD), to tumor tissue in a mouse tumor model[J]. Photochem Photobiol, 1993, 57: 1000-1006. DOI:10.1111/j.1751-1097.1993.tb02962.x |
| [15] |
Ye J, Li Y, Hamasaki T, et al. Inhibitory effect of electrolyzed reduced water on tumor angiogenesis[J]. Biol Pharm Bull, 2008, 31: 19-26. DOI:10.1248/bpb.31.19 |
| [16] |
Folkman J. What is the evidence that tumors are angiogenesis dependent?[J]. J Natl Cancer Inst, 1990, 82: 4-7. DOI:10.1093/jnci/82.1.4 |
| [17] |
Shimizu K, Asai T, Oku N. Antineovascular therapy, a novel antiangiogenic approach[J]. Expert Opin Ther Targets, 2005, 9: 63-76. DOI:10.1517/14728222.9.1.63 |
| [18] |
Ran S, Thorpe PE. Phosphatidylserine is a marker of tumor vasculature and a potential target for cancer imaging and therapy[J]. Int J Radiat Oncol Biol Phys, 2002, 54: 1479-1484. DOI:10.1016/S0360-3016(02)03928-7 |
| [19] |
Abu Lila AS, Ishida T, Kiwada H. Targeting anticancer drugs to tumor vasculature using cationic liposomes[J]. Pharm Res, 2010, 27: 1171-1183. DOI:10.1007/s11095-010-0110-1 |
| [20] |
Abu Lila AS, Kizuki S, Doi Y, et al. Oxaliplatin encapsulated in PEG-coated cationic liposomes induces significant tumor growth suppression via a dual-targeting approach in a murine solid tumor model[J]. J Control Release, 2009, 137: 8-14. DOI:10.1016/j.jconrel.2009.02.023 |
| [21] |
Wang D, Wang T, Liu J, et al. Acid-activatable versatile micelleplexes for PD-L1 blockade-enhanced cancer photodynamic immunotherapy[J]. Nano Lett, 2016, 16: 5503-5513. DOI:10.1021/acs.nanolett.6b01994 |
| [22] |
Jiang D, Chen C, Xue Y, et al. NIR-triggered "OFF/ON" photodynamic therapy through a upper critical solution temperature block copolymer[J]. ACS Appl Mater Interfaces, 2019, 11: 37121-37129. DOI:10.1021/acsami.9b12889 |
| [23] |
Gao J, Li J, Geng WC, et al. Biomarker displacement activation:a general host-guest strategy for targeted phototheranostics in vivo[J]. J Am Chem Soc, 2018, 140: 4945-4953. DOI:10.1021/jacs.8b02331 |
| [24] |
Li S, Tseng WC, Stolz DB, et al. Dynamic changes in the characteristics of cationic lipidic vectors after exposure to mouse serum:implications for intravenous lipofection[J]. Gene Ther, 1999, 6: 585-594. DOI:10.1038/sj.gt.3300865 |
| [25] |
Simberg D, Weisman S, Talmon Y, et al. The role of organ vascularization and lipoplex-serum initial contact in intravenous murine lipofection[J]. J Biol Chem, 2003, 278: 39858-39865. DOI:10.1074/jbc.M302232200 |
| [26] |
Ishiwata H, Suzuki N, Ando S, et al. Characteristics and biodistribution of cationic liposomes and their DNA complexes[J]. J Control Release, 2000, 69: 139-148. DOI:10.1016/S0168-3659(00)00293-5 |
| [27] |
Guan J, Lu WY, Zhan CY. Plasma proteins regulating in vivo performance of liposomes[J]. Acta Pharm Sin (药学学报), 2019, 54: 2240-2250. |
| [28] |
Pluen A, Netti PA, Jain RK, et al. Diffusion of macromolecules in agarose gels:comparison of linear and globular configurations[J]. Biophys J, 1999, 77: 542-552. DOI:10.1016/S0006-3495(99)76911-0 |
| [29] |
Kim B, Han G, Toley BJ, et al. Tuning payload delivery in tumour cylindroids using gold nanoparticles[J]. Nat Nanotechnol, 2010, 5: 465-472. |
| [30] |
Campbell RB, Fukumura D, Brown EB, et al. Cationic charge determines the distribution of liposomes between the vascular and extravascular compartments of tumors[J]. Cancer Res, 2002, 62: 6831-6836. |
| [31] |
Litzinger DC, Brown JM, Wala I, et al. Fate of cationic liposomes and their complex with oligonucleotide in vivo[J]. Biochim Biophys Acta, 1996, 1281: 139-149. DOI:10.1016/0005-2736(95)00268-5 |
| [32] |
Knudsen KB, Northeved H, Kumar PE, et al. In vivo toxicity of cationic micelles and liposomes[J]. Nanomedicine, 2015, 11: 467-477. DOI:10.1016/j.nano.2014.08.004 |
| [33] |
Freimark BD, Blezinger HP, Florack VJ, et al. Cationic lipids enhance cytokine and cell influx levels in the lung following administration of plasmid:cationic lipid complexes[J]. J Immunol, 1998, 160: 4580-4586. |
 2020, Vol. 55
2020, Vol. 55


