作者贡献:梅林和苏丽娜提出研究思路, 设计研究方案; 苏丽娜、张锦勰、邓颖慧和周韵负责进行实验; 周韵和盛常福采集和分析数据。苏丽娜和张锦勰负责论文起草; 梅林负责最终版本修订。
利益冲突:所有作者声明无利益冲突。
2. 清华大学深圳国际研究生院, 广东 深圳 518055;
3. 中山大学药学院 (深圳), 广东 深圳 518107
2. Tsinghua Shenzhen International Graduate School, Shenzhen 518055, China;
3. School of Pharmaceutical Sciences(Shenzhen), Sun Yat-Sen University, Shenzhen 518107, China
前列腺癌是男性生殖系统最常见的恶性肿瘤, 其发病率在男性所有恶性肿瘤中位居第二位[1, 2]。内分泌治疗是晚期前列腺癌的主要治疗方式。但是, 传统的内分泌治疗在短期内有效, 经过治疗一段时间后往往会转变为去势抵抗前列腺癌(castration resistant prostate cancer, CRPC), 危及生命[3]。目前国内治疗CRPC的主要化疗药物是多西他赛, 可使患者生存期延长2.4个月。其他药物虽可不同程度延长患者总生存率, 但不良反应较严重, 如阿比特龙和恩杂鲁胺的耐药问题、血小板减少和中性粒细胞减少伴发热等。总之, 虽然有大量的新药已经或正在准备进入临床, 但是均存在一定的局限性, 疗效尚有待进一步验证。因此, 开发新型、有效的晚期难治性激素非依赖型前列腺癌的治疗方法已成为当前研究的热点。
近年来, 光热疗法(photothermal therapy, PTT)以其高效、微创的优点被认为是一种非常有前景的肿瘤治疗新方法[4]。光热治疗是在近红外(NIR)激光诱导下, 光热剂将吸收的光转化为热能, 并在肿瘤内产生局部热量, 进而杀伤肿瘤细胞的治疗方法。其光热处理范围易于控制, 精确度高, 对正常组织和细胞损害较小[5-7]。其中, 探索生物相容性良好的光热剂是研究在激光照射下利用热能杀伤肿瘤细胞的关键。黑磷(black phosphorus, BP)纳米片作为一种新型的二维材料, 由于其独特的电子、光学和机械性能, 以及潜在生物医学应用前景, 引起了人们的广泛关注[8]。已证明, BP在生理环境下的降解产物主要是磷酸盐和膦酸盐, 它们都是人体体内的重要成分[9]。此外, 由于黑磷具有近红外吸收能力强、光热转换效率高等优良的光学性能, 近年来已经被广泛应用于光热治疗领域[10-12]。
锌是人体必需的微量元素之一, 广泛参与体内新陈代谢活动, 具有重要的生理功能, 并具有广泛的抗癌功效[13]。前列腺是体内含锌量最高的器官[14], 前列腺上皮细胞具有聚集高浓度锌离子的功能, 而前列腺组织向前列腺癌转变过程中则逐渐失去积累锌的能力[15, 16], 由于显著的“丧失效应”, 锌在前列腺发生发展中的作用机制受到广泛关注。目前, 对锌离子抑制前列腺癌细胞的研究已经受到广泛的关注。因此, 本研究在黑磷纳米片光热治疗体系中引入锌离子, 将锌离子负载到黑磷纳米片表面, 探讨锌离子对前列腺癌进行光热治疗的增强作用, 希望能对前列腺癌的治疗提供一种新思路。
材料与方法材料 黑磷(奥地利Smart Elements公司); 二甲基亚砜(dimethyl sulfoxide, DMSO)、N-甲基吡咯烷酮(N-methypyrrolidine, NMP)、MTT (美国Sigma-Aldrich公司); 醋酸锌(zinc acetate, 美国Aladdin公司); DMEM培养基、胎牛血清(FBS)、磷酸盐缓冲液(PBS)、胰蛋白酶(美国Gibco公司); 细胞培养瓶、细胞培养皿(美国Thermo Fisher Scientific公司); 人前列腺癌PC-3细胞(美国ACTT公司)。
设备仪器 细胞超声破碎仪(美国Sonics公司); 近红外激光发射仪(西安Kaisite Electronic Technology有限公司); KQ-300GDV水浴超声仪(昆山超声设备股份有限公司); Tecnai G2 F30透射电子显微镜(TEM, 美国FEI公司); 纳米粒度及Zeta电位仪(美国Beckman Coulter公司); Leica DMIL倒置光学显微镜(德国Leica公司); Ti450热红外成像仪(美国Fluke公司); FV1000激光扫描共聚焦显微镜(日本奥林巴斯公司)。
动物 Balb/c小鼠, SPF级, 雌性, 4~6周, 体重12~15 g, 购自中山大学实验动物中心, 所有动物实验均经过清华大学深圳国际研究生院动物伦理委员会批准。
黑磷纳米片(BP NSs)的制备 将黑磷晶体10 mg加入到装有20 mL去离子的离心管中, 氩气鼓泡3 min以除去溶液中溶解的氧气, 然后置于冰水浴中用探头进行超声, 功率为600 W, 超声5 s, 间歇5 s, 连续超声8 h。超声结束后将样品3 000 r·min-1离心20 min, 去除大片的未剥离的黑磷, 再10 000 r·min-1离心20 min, 去除上清, 保留沉淀, 将样品保存于NMP中, 4 ℃保存, 以备后续使用。
BP NSs浓度的测定 采用电感耦合等离子体原子发射光谱仪测定BP NSs的浓度。取待测浓度BP NSs悬液500 μL加入去离子500 μL定容至1 mL。在上述样品中加入浓硝酸2 mL, 消化过夜, 使黑磷纳米片反应成为原子状态。然后将装有样品的玻璃小瓶开盖敞口, 放入加热套中在100 ℃下加热, 使溶液蒸发至500 μL, 再加去离子水2 mL继续蒸发, 使液体再次蒸发至500 μL。在500 μL样品加去离子水4.5 mL定容至5 mL, 将此稀释了10倍的样品用于测试。检测前需要配置梯度标准磷元素溶液用于做标准曲线。
BP-Zn的制备 将含BP NSs的NMP悬液以10 000 r·min-1离心20 min, 以去除NMP。将2 mg BP NSs重悬在4 mL去离子水中, 吹打分散均匀, 然后加入10 mg醋酸锌, 再用探头超声, 功率为600 W, 超声5 s, 间歇5 s, 超声时间3 min。室温搅拌3 h, 即可获得BP-Zn。
BP NSs和BP-Zn的表征 取BP NSs和BP-Zn各10 µL滴于铜网上, 真空干燥过夜, 然后用透射电子显微镜进行观察。取适量含BP NSs和BP-Zn的悬液, 适当稀释后用纳米粒度及Zeta电位仪测其粒径和zeta电位。
光热性质的测定 将质量浓度为100 μg·mL-1的BP NSs PBS悬液和BP-Zn PBS悬液加入到EP管中, 用1.0 W·cm-2的808 nm近红外激光进行照射, 照射时间10 min, 同时用红外热成像仪记录温度的变化, 以PBS作为对照组。
细胞培养 人前列腺癌PC-3细胞在DMEM培养基中培养, 培养基中加入10% (v/v) FBS, 青霉素(100 u·mL-1)和链霉素(100 μg·mL-1)培养环境为含5% CO2的潮湿气氛, 培养温度是37 ℃。
锌离子的细胞毒性检测 收集10 000个PC-3细胞加入到96孔板中, 过夜使细胞贴壁。然后弃去培养基, 加入含有不同Zn离子浓度的新鲜培养基, 再继续培养24或48 h后, 使用MTT法进行细胞活性检测。用PBS洗涤细胞3次, 加入MTT溶液(5 mg·mL-1) 10 μL, 继续培养4 h后, 弃去上清, 加入DMSO溶液100 μL, 以溶解底部的细胞内结晶物。轻微摇晃10 min, 在490 nm下测量样品吸光度(A)值。
BP NSs的光热毒性 收集10 000个PC-3细胞加入到96孔板中, 过夜使细胞贴壁。然后弃去培养基, 加入含不同BP NSs浓度的新鲜培养基, 继续培养4 h, 用近红外激光照射(808 nm, 1.0 W·cm-2, 10 min), 再培养12 h后用MTT法检测细胞活性。用激光照射且未加BP NSs组作为对照组。
锌离子辅助体外光热治疗 收集10 000个PC-3细胞接种到96孔板中, 过夜使细胞贴壁。细胞分为3组, 分别为BP NSs组、BP-Zn组和BP-Zn + NIR组, 共孵育24 h后, 使用MTT法检测细胞活性。对于BP-Zn + NIR组, 光照条件为1.0 W·cm-2, 时间为10 min。
动物实验 首先在免疫缺陷小鼠背侧皮下注射PC-3细胞(~106个细胞)悬液100 μL, 诱导肿瘤生长, 肿瘤的体积每两天测量1次, 肿瘤体积(V)用如下公式计算: V = d2 × D/2, 其中d和D分别代表肿瘤的最短直径和最长直径。待肿瘤体积长到100 mm3时, 随机分为3组进行肿瘤治疗, 每组3只小鼠。3组小鼠分别为PBS组、BP + NIR组和BP-Zn + NIR组。每四天尾静脉给药1次, 每只给药体积为100 μL, 给药组BP剂量为5 mg·kg-1。每次给药12 h后进行近红外光热治疗, 光照强度为1 W cm-2。肿瘤治疗两周后, 采用断颈法处死小鼠, 取出BP-Zn组小鼠的心、肝、脾、肺和肾等主要脏器, 进行组织检测。
统计学方法 用GraphPad Prism 5.0软件进行数据处理, 所有实验数据均用
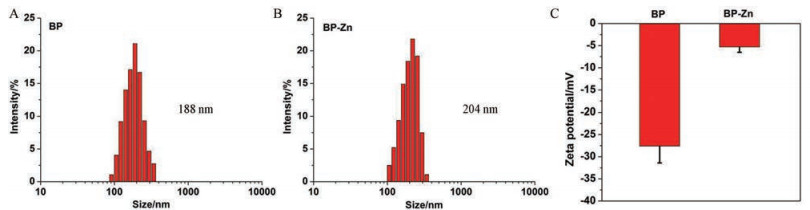
用TEM观察了BP NSs和BP-Zn的外貌形态, 如图 1A、B所示, BP NSs和BP-Zn的粒径约为200 nm左右, 对于肿瘤部位的实体瘤的高通透性和滞留(EPR)效应来说是一个理想的粒径范围。图 1C是BP-Zn的能谱仪(EDS)元素分析, 可以清晰检测到黑磷纳米片上锌元素的存在, 证明锌元素在黑磷纳米片上的成功负载。此外, BP NSs和BP-Zn的形貌并无明显差别, 说明锌离子的负载对黑磷纳米片的形貌无明显影响。用动态散射(DLS)法对BP NSs和BP-Zn的粒径和zeta电位进行分析, 结果如图 2所示。从图中可见, BP NSs的粒径在190 nm左右, 而BP-Zn的粒径略有增大, 约200 nm左右。单纯BP的zeta电位为-27.6 mV, 在负载锌离子后, BP-Zn的zeta电位大幅升高, 这是因为锌离子显示正二价, 在很大程度上中和了黑磷纳米片的负电荷, 这也说明锌离子成功负载到黑磷纳米片上。

|
Figure 1 Transmission electron microscope image of single BP NSs (A) and BP-Zn (B). Energy dispersive spectrometer (EDS) mapping of BP-Zn (C). BP NSs: Black phosphorus nanosheets; BP-Zn: Zinc ions loaded black phosphorus nanosheets |
|
Figure 2 Size distribution of BP NSs (A) and BP-Zn (B). Zeta potentials of BP NSs and BP-Zn (C). n = 3, |
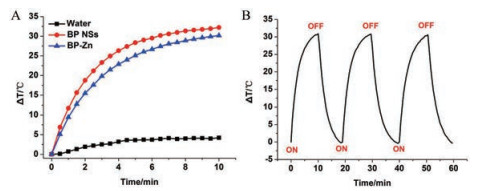
为了研究纳米粒的光热性能, 用热红外成像仪记录了不同纳米粒在近红外激光照射下温度的变化。如图 3所示, PBS组的温度变化并不明显, △T = 4.2 ℃; BP NSs和BP-Zn组都有显著的温度升高, 经过10 min激光照射后, △T可分别达到32.2 ℃和30.2 ℃。相较于BP NSs来说, BP-Zn组最终温度略有降低, 但温升30.2 ℃已完全满足杀伤肿瘤的条件。此外, 在经过3个光照循环后, BP-Zn的温度变化过程并没有发生显著变化, 这说明BP-Zn有着良好的光热稳定性。
|
Figure 3 Changes in temperature of BP NSs, BP-Zn and water under 1.0 W·cm-2 laser over 10 min (A). Heating of a suspension of the BP-Zn in water for three on/off cycles (1.0 W·cm-2) (B) |
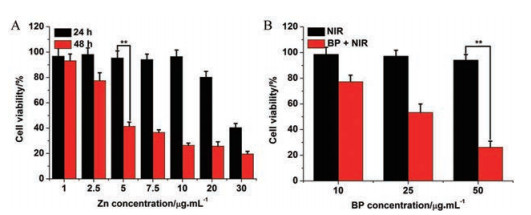
锌离子对于PC-3细胞的毒性如图 4A所示, 锌离子的细胞毒性总体呈现一个时间和浓度依赖性。当锌离子与人体前列腺癌细胞共同培养24 h后, 在质量浓度小于10 μg·mL-1时, 锌离子对癌细胞并没有明显的杀伤效果; 当质量浓度大于10 μg·mL-1, 尤其是到达30 μg·mL-1, 锌离子对癌细胞的毒性显著增大。在共孵育48 h后, 锌离子对PC-3的细胞毒性更加明显, 质量浓度为5 μg·mL-1时PC-3细胞的存活率低于50%。黑磷光热毒性的评价见图 4B。由图可见, 单纯的近红外光照射并不能有效杀伤PC-3细胞, 加入BP NSs后再进行近红外光照射, 肿瘤细胞杀伤效果非常明显。当BP质量浓度达到50 μg·mL-1时, 细胞存活率只有26%左右。这是因为BP在近红外激光照射下产生了大量热量, 使环境温度升高, 从而使癌细胞死亡。
|
Figure 4 Cell viability of PC-3 cells after incubation with various concentrations of zinc ions for different time (A); treatment with different concentrations of BP with near infrared region (NIR) laser irradiation (808 nm, 1.0 W·cm-2, 10 min) (B). n = 3, |
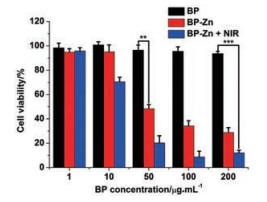
基于上述结果, 研究了锌离子和BP共同发生作用时对PC-3细胞的毒性, 见图 5。在没有近红外光照射下, BP对PC-3的细胞毒性并不明显, 在共同培养48 h后, PC-3的细胞存活率依然大于90%, 这说明BP有着非常优异的生物相容性。当PC-3与锌离子负载的BP共同孵育48 h后, 其存活率大大下降, 这是因为负载在BP上的锌离子进入了癌细胞, 进而杀伤癌细胞。在此基础上, 对BP-Zn组进行近红外光照射, 发现PC-3细胞的存活率进一步下降。对比图 4B可以发现, 在BP浓度同为50 μg·mL-1时, BP-Zn + NIR的治疗效果好于BP + NIR, 这说明光热和锌离子的联合治疗可以更有效地杀伤PC-3细胞。
|
Figure 5 In vitro cytotoxicity of BP and BP-Zn with or without NIR irradiation (808 nm, 1.0 W·cm-2, 10 min). n = 3, |
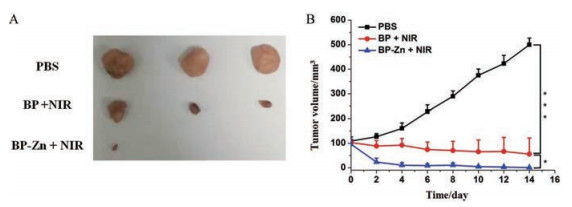
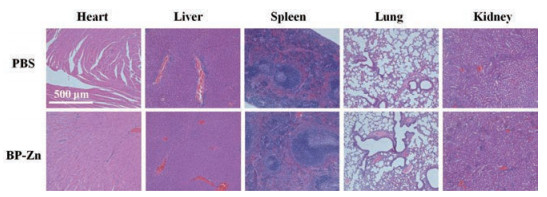
不同纳米粒的抗肿瘤效果如图 6所示。图 6A展示了解剖后的肿瘤图片; 从图 6B中可见, PBS组小鼠的肿瘤生长较为快速, PBS无明显的抑瘤作用。BP + NIR和BP-Zn + NIR均展现出优异的抗肿瘤效果, 其中BP-Zn + NIR的抗肿瘤效果要显著优于BP + NIR。肿瘤图片(图 6A)与图 6B中的结果基本相符合。这些结果说明, 锌离子和光热的联合治疗优于单纯的光热治疗, 可以更有效地抑制肿瘤的生长。PBS和BP-Zn + NIR组小鼠主要器官的组织切片见图 7, 各器官并没有显示出明显的病理变化, 进一步证明了本研究中所使用的纳米材料具有非常好的生物相容性, 这点在体内应用中具有非常重要的意义。
|
Figure 6 In vivo photothermal therapy of BP and BP-Zn. Representative photos of tumors removed from the sacrificed mice at the end of study (A). Tumor growth curves of PC-3 tumor-bearing mice administered with different therapeutic methods (B). PBS: Phosphate buffer saline. n = 3, |
|
Figure 7 Representative H & E stained images of major organs of PBS and BP-Zn groups |
前列腺癌是男性最常见的恶性肿瘤之一, 也是癌症治疗中研究的热点领域, 本研究探讨了锌离子负载的黑磷纳米片对前列腺癌的光热治疗作用。研究发现, BP-Zn的粒径分布在200 nm左右, 这个粒径范围可以在肿瘤部位发挥较好的EPR效应, 增强被动靶向效果, 从而提高疗效。在研究BP-Zn的光热特性时发现, 虽然BP-Zn的光热效果相较于BP NSs略低一些, 但仍然有较高的温升, 满足杀伤肿瘤细胞的条件。在细胞毒性实验中可以看到, 锌离子的确可以有效抑制PC-3细胞的生长, 锌离子对PC-3细胞的毒性具有时间和浓度依赖性。此外, 在相同BP浓度下, BP与锌离子联合进行光热治疗时, 其效果好于单一BP进行光热治疗。在体内实验中, BP与锌离子的联合治疗效果同样要好于单一BP的光热治疗, 再次证明BP-Zn的光热治疗方案可以更为有效地抑制前列腺癌细胞的生长。
因此, 本研究制备了锌离子负载的黑磷纳米片, 并将其应用于前列腺癌的增强型光热治疗, 希望可以为前列腺癌的治疗提供一种新的思路。
| [1] |
Wang D, Wan XC, Zhang YL, et al. A novel androgen-reduced prostate-specific lncRNA, PSLNR, inhibits prostate-cancer progression in part by regulating the p53-dependent pathway[J]. Prostate, 2019, 79: 1363-1377. DOI:10.1002/pros.23872 |
| [2] |
Heidenreich A, Bastian PJ, Bellmunt J, et al. EAU guidelines on prostate cancer. Part Ⅱ:treatment of advanced, relapsing, and castration-resistant prostate cancer[J]. Eur Urol, 2014, 65: 467-479. DOI:10.1016/j.eururo.2013.11.002 |
| [3] |
Quinn DI, Shore ND, Egawa S, et al. Immunotherapy for castration-resistant prostate cancer:progress and new paradigms[J]. Urol Oncol, 2015, 33: 245-260. DOI:10.1016/j.urolonc.2014.10.009 |
| [4] |
Liu G, Tsai HI, Zeng XW, et al. Black phosphorus nanosheets-based stable drug delivery system via drug-self-stabilization for combined photothermal and chemo cancer therapy[J]. Chem Eng J, 2019, 375: 121917. DOI:10.1016/j.cej.2019.121917 |
| [5] |
Jia QR, Li DY, Zhang Q, et al. Biomineralization synthesis of HBc-CuS nanoparticles for near-infrared light-guided photothermal therapy[J]. J Mater Sci, 2019, 54: 13255-13264. DOI:10.1007/s10853-019-03613-6 |
| [6] |
Wang L, Xu XF, Mu XG, et al. Fe-doped copper sulfide nanoparticles for in vivo magnetic resonance imaging and simultaneous photothermal therapy[J]. Nanotechnology, 2019, 30: 415010. |
| [7] |
Shan WJ, Chen RH, Zhang Q, et al. Improved stable indocyanine green (ICG)-mediated cancer optotheranostics with naturalized hepatitis B core particles[J]. Adv Mater, 2018, 30: e1707567. DOI:10.1002/adma.201707567 |
| [8] |
Wang HM, Zhong L, Liu Y, et al. A black phosphorus nanosheet-based siRNA delivery system for synergistic photothermal and gene therapy[J]. Chem Commun, 2018, 54: 3142-3145. DOI:10.1039/C8CC00931G |
| [9] |
Yang GH, Wan XJ, Gu ZP, et al. Near infrared photothermal-responsive poly(vinyl alcohol)/black phosphorus composite hydrogels with excellent on-demand drug release capacity[J]. J Mater Chem B, 2018, 6: 1622-1632. DOI:10.1039/C7TB03090H |
| [10] |
Sun ZB, Xie HH, Tang SY, et al. Ultrasmall black phosphorus quantum dots:synthesis and use as photothermal agents[J]. Angew Chem Int Ed, 2015, 54: 11526-11530. DOI:10.1002/anie.201506154 |
| [11] |
Gusmao R, Sofer Z, Pumera M. Black phosphorus rediscovered:from bulk material to monolayers[J]. Angew Chem Int Ed, 2017, 56: 8052-8072. DOI:10.1002/anie.201610512 |
| [12] |
Ye XY, Mei L. The black phosphorus quantum dots-based photothermal effect on dendritic cells activation[J]. Acta Pharm Sin (药学学报), 2019, 54: 1297-1302. |
| [13] |
Counago RM, Ween MP, Begg SL, et al. Imperfect coordination chemistry facilitates metal ion release in the Psa permease[J]. Nat Chem Biol, 2014, 10: 35-41. DOI:10.1038/nchembio.1382 |
| [14] |
Yang N, Zhao B, Rasul A, et al. PIAS1-modulated Smad2/4 complex activation is involved in zinc-induced cancer cell apoptosis[J]. Cell Death Dis, 2013, 4: e811. DOI:10.1038/cddis.2013.333 |
| [15] |
To PK, Do MH, Cho YS, et al. Zinc inhibits expression of androgen receptor to suppress growth of prostate cancer cells[J]. Int J Mol Sci, 2018, 19: 3062. DOI:10.3390/ijms19103062 |
| [16] |
Kolenko V, Teper E, Kutikov A, et al. Zinc and zinc transporters in prostate carcinogenesis[J]. Nat Rev Urol, 2013, 10: 219-226. DOI:10.1038/nrurol.2013.43 |
 2020, Vol. 55
2020, Vol. 55


