作者贡献:沈寿茂是本文的第一作者, 负责柳珊瑚化学成分的分离鉴定, 文献的调研整理及初稿的撰写; 郭跃伟是本文的共同通讯作者, 负责实验设计和把关, 稿件修改等工作; 李序文是本文的最后通讯作者, 负责实验设计和把关, 核磁谱图的分析、论文框架的构建及稿件修改等工作。
利益冲突:本文的研究内容无任何利益冲突。
2. 南京中医药大学新中药学院, 江苏 南京 210023
2. School of Chinese Materia Medica, Nanjing University of Chinese Medicine, Nanjing 210023, China
柳珊瑚俗称海扇或海鞭, 隶属于八放珊瑚亚纲(Octocorallia)柳珊瑚目(Gorgonacea), 广泛分布于中国南海海域[1]。柳珊瑚富含二萜、甾体、脂肪酸等代谢产物, 是海洋天然产物的重要来源[2-4]。Briarane型二萜主要来源于柳珊瑚, 生源上是西松烷型二萜的C-3和C-8环化的代谢产物[5], 结构上具有6/10的双环体系, 以高度氧化、C-6上常连接1个氯原子为特征。部分briarane型二萜具有良好的抗炎[6, 7]、细胞毒[8]、防污[9]、拒食[10]等生物活性。自从第一个briarane型二萜(briarein A[11])被分离鉴定后, 每年均有新颖的briarane型二萜从柳珊瑚中被发现, 目前累计数量已超过400个[5, 12, 13], 此外, 近年关于briarane型二萜被成功合成的报道屡见不鲜[14, 15], 可见briarane型二萜一直是药物化学家和药理学家的研究热点之一。
本课题组长期致力于海洋生物活性物质的研究, 已经从Junceella、Muricella、Menella、Acanthogorgia等属的柳珊瑚中发现了大量的活性天然产物[16-19], 尤其是萜类和甾体类化合物。前期, 本组从采自中国海南省小东海海域的J. fragilis Ridley (Ellisellidae)中发现了两个新briarane型二萜[16], 丰富了briarane型二萜的数量。为进一步研究Junceella属柳珊瑚的化学成分, 寻找具有生物活性及药用价值的海洋天然产物以合理开发利用我国的海洋生物资源, 本文首次对采自中国南海西瑁岛海域的脆灯芯柳珊瑚J. fragilis的化学成分进行探索。从J. fragilis的丙酮提取物中分离获得6个化合物(图 1), 其中化合物1是一个新briarane型二萜。本文主要报道新化合物的分离和结构鉴定, 以及所有化合物的波谱数据和生物活性测试结果。
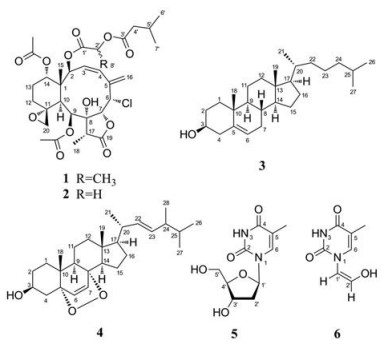
|
Figure 1 The structures of compounds 1-6 |
根据理化性质和波谱数据分析, 已知化合物分别鉴定为fragilide D (2)[20]、胆甾醇(3)[21]、过氧化麦角甾醇(4)[21]、2'-脱氧胸腺嘧啶核苷(5)[22]和cis-thyminenol (6)[23] (图 1)。
化合物1, 无色油状, HR-ESI-MS显示1的准分子离子峰[M+Na]+ m/z 677.234 8 (计算值677.233 5), 确定1的分子式为C32H43O12Cl, 不饱和度Ω = 11。IR吸收峰提示1可能含有羟基(3 464 cm-1)、γ-内酯(1 783 cm-1)和酯羰基(1 739 cm-1)。综合分析13C NMR谱(表 1)、DEPT谱和HSQC谱, 发现化合物1含有32个碳信号, 包括5个羰基(δC 175.0, 172.6, 170.4, 170.0, 169.6)、1个sp2杂化的季碳(δC 137.1)、3个sp3杂化的季碳、2个sp2杂化的叔碳(δC 130.0, 128.7)、9个sp3杂化的叔碳(含5个被氧化的碳δC 78.7, 74.4, 72.8, 69.8, 68.7和1个连氯原子的碳δC 62.0)、1个sp2杂化的仲碳(δC 117.1)、4个sp3杂化的仲碳(含1个被氧化的碳δC 50.7)和7个甲基。经过与文献数据仔细对比, 发现化合物1与同时分离的briarane型二萜fragilide D (2)[20]的1D NMR数据非常相似, 区别主要发生在C-2'位及其邻位碳、氢原子的化学位移。事实上, 化合物1的C-2'的化学位移[δH 5.03 (1H, q, J = 7.0 Hz), δC 68.7 (d)]比化合物2的[δH 4.58 (1H, d, J = 16.0 Hz, H-2'a), 4.49 (1H, d, J = 16.0 Hz, H-2'b); δC 60.8 (t)]明显向低场位移, 而化合物1又多了一个明显的甲基信号[δH 1.47 (3H, d, J = 7.0 Hz), δC 16.8 (q)], 结合1的相对分子质量比化合物2的大14, 说明位于化合物2 C-2'位的一个氢原子被化合物1的甲基取代。从H-8' [δH 1.47 (3H, d, J = 7.0 Hz)]到C-2' [δC 68.7 (d)]和C-1' [δC 169.6 (s)]的清晰HMBC远程相关信号(图 2)证明了以上推论, 且确定CH3-8'连接在C-2'位。因此, 化合物1的平面结构如图 1所示。
| Table 1 The 1H (500 MHz) and 13C NMR (125 MHz) data of compound 1 in CDCl3 |
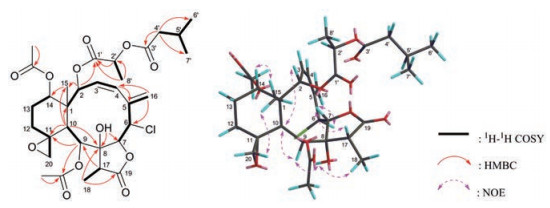
|
Figure 2 The 1H-1H COSY, HMBC and NOESY correlations of compound 1 |
化合物1的相对构型是基于碳原子的化学位移和NOESY谱来推断的。Sung课题组[24]曾报道:若C-11和C-20位碳原子的化学位移分别在δC 55~61和47~52, 则11, 20-环氧基团的11位氧处于α方向, C-11为R构型, 且六元环为椅式构象。根据该经验规则, 判断化合物1 (C-11 δC 59.6; C-20 δC 50.7)六元椅式环上C-11为R*构型。在NOESY谱中(图 2), 明显的H-15与H-14/H-20相关, 说明H-14、H-15和H-20处于β位。H-10与H3-15之间未见NOE相关, 提示六元环与十元环有可能反式稠合, H-10为α构型, 而该证据也在以往研究报道中被利用进行类似briarane型化合物[12, 20]的构型确定。此外, 从生源上来看, 这类化合物的六元环与十元环也均为反式稠合。H-10与H-2/H-9相关、H-9与OH-8相关以及OH-8与H-18相关, 确定H-2、OH-8、H-9、H-10和CH3-18在同一平面, 均为α构型; 清晰的H-7与H-6/H-17相关, 说明H-6、H-7和H-17在同一平面, 并确定为β构型。但是, 化合物1的C-2'处于超长的侧链上, 没有充足的证据证明C-2'的构型。综上分析, 化合物1母核的相对构型与共同发现的化合物2完全一致, 确定为1R*, 2S*, 3Z, 6S*, 7R*, 8R*, 9S*, 10S*, 11R*, 14S*, 17R*, 并将1命名为fragilide Y。
考虑到一些briarane型二萜具有良好的抗炎或细胞毒活性, 对化合物1~6分别进行了抗炎及细胞毒的活性测试。遗憾的是, 生物活性结果表明:化合物1~6在20 µmol·L-1浓度下对脂多糖(LPS)诱导巨噬细胞炎症均未表现明显的抑制作用, 在50 µmol·L-1浓度下对肿瘤细胞A549 (肺癌)、HT-29 (结肠癌)、SNU-398 (肝癌)和Capan-1 (胰腺癌)的生长也未表现明显的抑制活性。
结论通过首次对中国南海西瑁岛脆灯芯柳珊瑚J. fragilis的化学成分研究, 从J. fragilis丙酮浸膏中分离得到6个化合物, 包括2个briarane型二萜、2个甾醇和2个核苷类化合物, 其中化合物1是一个新briarane型二萜。尽管上述化合物均未表现明显的抗炎及细胞毒活性, 其他与其化学生态学相关的生物活性如抗菌、抗病毒以及拒食活性需要进一步的研究。上述研究结果丰富了中国南海柳珊瑚J. fragilis的化学成分多样性, 为柳珊瑚的生物活性物质的探索提供一定的参考。
实验部分Perkin-Elmer 241MC旋光测定仪(PerkinElmer, Fremont, 美国); Nicolet iS5红外光谱仪(Thermo Scientific, Waltham, 美国); JASCO J-815圆二色谱仪(JASCO, 日本); Bruker AVANCE Ⅲ 400、500或600核磁共振仪(Bruker Biospin AG, Fällanden德国), 以TMS信号作为参照; Agilent G6520 Q-TOF高分辨质谱仪(Agilent, 美国); Agilent 1260高效液相色谱仪(Agilent, 美国), Agilent Eclipse XDB-C18半制备色谱柱(5 µm, 9.4 mm×250 mm); 薄板硅胶板GF254和柱色谱用硅胶(200~300目, 300~400目, 青岛海洋化工有限公司, 中国); Sephadex LH-20凝胶(Amersham Pharmacia Biotech, 瑞典); 色谱纯试剂(DiKMA, 美国), 其他有机溶剂均为分析纯, 购自国药集团化学试剂有限公司。
生物样品脆灯芯柳珊瑚Junceella fragilis Ridley于2019年5月采集于中国南海西瑁岛海域, 种属由海南大学李秀保教授鉴定, 标本保存在中国科学院上海药物研究所新药研究国家重点实验室(编号19-XD-26)。
1 提取与分离将冷冻的J. fragilis (干重量1.4 kg)切碎, 用丙酮超声提取3次, 每次30 min, 合并提取液减压浓缩后, 将丙酮浸膏悬浮于1 L水中, 分别用等体积的乙醚和正丁醇各萃取3次, 收集萃取液分别减压浓缩后得到深棕色的乙醚相浸膏36.0 g和棕色的正丁醇相浸膏2.4 g。
乙醚相浸膏(19.8 g)经硅胶(200~300目)柱色谱, 石油醚-乙醚(20:1→10:1→5:1→3:1→1:1→1:3→0:1)梯度洗脱, 分为9个组分Frs.A~J。Fr.C组分(2.4 g)经Sephadex HL-20凝胶柱色谱(石油醚-二氯甲烷-甲醇2:1:1)分离, 得到化合物3 (989.1 mg)。Fr.F组分(0.6 g)先后经Sephadex HL-20凝胶柱色谱(石油醚-二氯甲烷-甲醇2:1:1)和硅胶(300~400目)柱色谱(二氯甲烷-乙醚20:1→10:1→5:1→3:1), 得化合物4 (12.1 mg)。Fr.I组分(410.0 mg)经Sephadex HL-20凝胶柱色谱(石油醚-二氯甲烷-甲醇2:1:1), 被分为8个亚组分I1~I8。I5和I6经半制备HPLC, 分别以90%或70%甲醇-水等度洗脱(3.0 mL·min-1)得化合物1 (3.0 mg, tR = 4.7 min)和化合物2 (9.0 mg, tR = 17.5 min)。正丁醇浸膏(2.4 g)经Sephadex HL-20凝胶柱色谱, 以甲醇洗脱, 得到3个组分Frs.A~C。Fr.B组分经半制备HPLC, 以甲醇-水(25:75, 3.0 mL·min-1)洗脱得化合物5 (5.5 mg); Fr.C组分析出沉淀, 即化合物6 (12.0 mg)。
2 结构鉴定化合物1 无色油状物, [α]D20 -93.7 (c 0.12, CHCl3); HR-ESI-MS [M+Na]+ m/z: 677.234 8 (Calcd. 677.233 5), 分子式C32H43O12Cl; IR (νmax) 3 464、2 923、2 851、1 783、1 739、1 372、1 219、1 096、1 040、1 019、957 cm-1; UV (CH3CN) λmax (log ε) 205.0 (2.70)、220.5 (2.58) nm; ECD [CH3CN, λ (Δε), c 1.3 mmol·L-1]: 205.0 (-6.05)、220.5 (-8.05) nm。1H NMR (500 MHz, CDCl3)和13C NMR (125 MHz, CDCl3)数据见表 1。
化合物2 白色无定形粉末, mp 102~103 ℃; [α]D20 -71.5 (c 0.40, CHCl3); ESI-MS [M+Na]+ m/z: 663, 分子式C31H41O12Cl。1H NMR (400 MHz, CDCl3)和13C NMR (125 MHz, CDCl3)数据与文献[20]报道的一致, 故鉴定化合物2为fragilide D。
化合物3 白色针晶, mp 148~149 ℃; EI-MS [M]+ m/z: 386, 分子式C27H46O。1H NMR (400 MHz, CDCl3)数据与文献[21]报道的一致; 与对照品进行共薄层色谱分析, 以石油醚-乙醚(1:1)展开, Rf = 0.5, 故鉴定化合物3为胆甾醇。
化合物4 白色无定形粉末, mp 170~171 ℃; EI-MS [M]+ m/z: 428, 分子式C28H44O3。1H NMR (400 MHz, CDCl3)和13C NMR (125 MHz, CDCl3)数据与文献[21]报道的一致, 故鉴定化合物4为过氧化麦角甾醇。
化合物5 白色无定形粉末, ESI-MS [M+H]+ m/z: 243, 分子式C10H14N2O5。1H NMR (400 MHz, CD3OD)数据与文献[22]报道的一致, 并结合与对照品进行共薄层色谱分析, 故鉴定化合物5为2'-脱氧胸腺嘧啶核苷。
化合物6 白色无定形粉末, ESI-MS [M+H]+ m/z: 169, 分子式C7H8N2O3。1H NMR (400 MHz, DMSO-d6)和13C NMR (150 MHz, DMSO-d6)数据与文献[23]报道的一致, 故鉴定化合物6为cis-thyminenol。
3 生物活性测试采用脂多糖(LPS, Sigma公司)刺激巨噬细胞, 激活细胞内TLR等信号通路, 诱导细胞内的炎症反应。RAW264.7小鼠巨噬细胞系来自中国药科大学新药筛选中心。96/48孔板点板, 待细胞密度为50%~60%左右提前给药3 h, 100 ng·mL-1 LPS作用2 h, 随后收集细胞上清, 通过ELISA试剂盒检测细胞上清中TNF-α蛋白的表达水平来评价化合物1~6的抗炎作用药效。
采用sulforhodamine B (SRB; Sigma, St.Louis, MO)法, 以长春新碱(VCR)为阳性对照, 测试化合物1~6对A549 (肺癌)、HT-29 (结肠癌)、SNU-398 (肝癌)和Capan-1 (胰腺癌) 4种细胞株的体外增殖的抑制作用。4种细胞株均购自美国标准菌库(ATCC, Manassas, VA, USA)。供试化合物实验采取最终最高浓度50 µmol·L-1, 5倍稀释, 5个梯度, 阳性对照VCR采取最终最高浓度10 000 nmol·L-1或1 000 nmol·L-1, 10倍稀释, 5个梯度, 处理72 h。
| [1] |
Huang ZG. Species and Distribution of Marine Life in China (中国海洋生物种类与分布)[M]. Beijing: Ocean Press, 2008.
|
| [2] |
Wu YC, Su JH, Chou TT, et al. Natural product chemistry of gorgonian corals of genus Junceella-part Ⅱ[J]. Mar Drugs, 2011, 9: 2773-2792. DOI:10.3390/md9122773 |
| [3] |
Chung HM, Wang YC, Tseng CC, et al. Natural product chemistry of gorgonian corals of genus Junceella-part Ⅲ[J]. Mar Drugs, 2018, 16: 339. DOI:10.3390/md16090339 |
| [4] |
Guo YW, Gavagnin M, Mollo E, et al. Three new butenolide lipids from the Caribbean gorgonian Pterogorgia anceps[J]. J Nat Prod, 1999, 62: 1194-1196. DOI:10.1021/np9901231 |
| [5] |
Su YD, Su JH, Hwang TL, et al. Briarane diterpenoids isolated from octocorals between 2014 and 2016[J]. Mar Drugs, 2017, 15: 44. DOI:10.3390/md15020044 |
| [6] |
Huynh TH, Fang LS, Chen YH, et al. Briarenols I-K, new anti-inflammatory 8, 17-epoxybriaranes from the octocoral Briareum excavatum (briareidae)[J]. Molecules, 2020, 25: 1405. DOI:10.3390/molecules25061405 |
| [7] |
Su YD, Wu TY, Wen ZH, et al. Briarenolides U-Y, new anti-inflammatory briarane diterpenoids from an octocoral Briareum sp. (Briareidae)[J]. Mar Drugs, 2015, 13: 7138-7149. DOI:10.3390/md13127060 |
| [8] |
Liu YH, Lin XP, Yang B, et al. Cytotoxic briarane-type diterpenoids[M]//Kim SK. Marine Pharmacognosy: Trends and Application. Boca Raton: CRC Press, 2012: 53-64.
|
| [9] |
Sun JF, Han Z, Zhou XF, et al. Antifouling briarane type diterpenoids from South China Sea gorgonians Dichotella gemmacea[J]. Tetrahedron, 2013, 69: 871-880. DOI:10.1016/j.tet.2012.10.102 |
| [10] |
Qi SH, Zhang S, Qian PY, et al. Antifeedant and antifouling briaranes from the South China Sea gorgonian Junceella juncea[J]. Chem Nat Compd, 2009, 45: 49-54. DOI:10.1007/s10600-009-9255-8 |
| [11] |
Burks JE, Vander HD, Chang CY, et al. The crystal and molecular structure of briarein A, a diterpenoid from the gorgonian Briareum asbestinum[J]. Acta Crystallogr B, 1977, B33: 704-709. |
| [12] |
Cheng W, Ji M, Li XD, et al. Fragilolides A-Q, norditerpenoid and briarane diterpenoids from the gorgonian coral Junceella fragilis[J]. Tetrahedron, 2017, 73: 2518-2528. DOI:10.1016/j.tet.2017.03.037 |
| [13] |
Chen YY, Fang LS, Chen YH, et al. New 8-hydroxybriaranes from the gorgonian coral Junceella fragilis (Ellisellidae)[J]. Mar Drugs, 2019, 17: 534. DOI:10.3390/md17090534 |
| [14] |
Moon NG, Harned AM. A concise synthetic route to the stereotetrad core of the briarane diterpenoids[J]. Org Lett, 2015, 17: 2218-2221. DOI:10.1021/acs.orglett.5b00816 |
| [15] |
Crimmins MT, Zhang Y, Williams PS. Approach to the synthesis of briarane diterpenes through a dianionic claisen rearrangement and ring-closing metathesis[J]. Org Lett, 2017, 19: 3907-3910. DOI:10.1021/acs.orglett.7b01806 |
| [16] |
Zhang W, Guo YW, Mollo E, et al. Junceellonoids A and B, two new briarane diterpenoids from the Chinese gorgonian Junceella fragilis Ridley[J]. Helv Chim Acta, 2004, 87: 2341-2345. DOI:10.1002/hlca.200490209 |
| [17] |
Zhang W, Huang H, Ding Y, et al. Three new polyoxygenated steroids from two species of the South China Sea gorgonian Muricella flexuosa and Menella verrucosa Brundin[J]. Helv Chim Acta, 2006, 89: 813-820. DOI:10.1002/hlca.200690073 |
| [18] |
Zhang W, Guo YW, Mollo E, et al. Acanthovagasteroids A-D, four new 19-hydroxylated steroids from the South China Sea gorgonian Acanthogorgia vagae Aurivillius[J]. J Nat Prod, 2004, 67: 2083-2085. DOI:10.1021/np049859a |
| [19] |
Yin FZ, Yang M, Li SW, et al. Two new hydroperoxy steroids from the South China Sea gorgonian Rumphella sp.[J]. Steroids, 2020, 155: 108558. DOI:10.1016/j.steroids.2019.108558 |
| [20] |
Sung PJ, Pai CH, Su YD, et al. New 8-hydroxybriarane diterpenoids from the gorgonians Junceella juncea and Junceella fragilis (Ellisellidae)[J]. Tetrahedron, 2008, 64: 4224-4232. DOI:10.1016/j.tet.2008.02.086 |
| [21] |
Liang LF, Li YF, Zheng TT, et al. Chemical constituents from South China Sea soft coral Sinularia sp.[J]. Chin Tradit Herb Drugs (中草药), 2017, 48: 868-873. |
| [22] |
Ouyang MA. A new adenosyl-alkaloid from Ostrea rivularis[J]. Nat Prod Res, 2006, 20: 79-83. DOI:10.1080/14786410500061207 |
| [23] |
Wang B, Lin YC, Chen YN, et al. Two new thyminenol derivatives from the marine sponge Haliclona sp.[J]. Nat Prod Commun, 2014, 9: 471-472. |
| [24] |
Sheu JH, Chen YP, Hwang TL, et al. Junceellolides J-L, 11, 20-epoxybriaranes from the gorgonian coral Junceella fragilis[J]. J Nat Prod, 2006, 69: 269-273. DOI:10.1021/np058077u |
 2020, Vol. 55
2020, Vol. 55


