作者贡献:王玉青:负责提出研究思路, 设计研究方案, 进行实验, 撰写文章初稿; 高玥、韦荣、李让:负责进行实验; 黄佩敏、黄春容:负责采集和数据分析; 张超、陶移文:负责论文初稿修改; 张建业:负责论文初稿修改和最终版本修订。
利益冲突:本论文所有作者声明不存在利益冲突关系。
乳腺癌已成为全球女性新发癌症中发病率最高的癌症, 2018年全球癌症数据显示女性乳腺癌的发病率高达24.2%[1]。据我国国家癌症中心数据显示, 中国乳腺癌发病率和死亡率总体呈上升趋势, 且逐渐向年轻人群发展[2, 3]。目前临床上对于乳腺癌的治疗方法多为手术治疗, 并结合化疗、放疗、靶向治疗和中药辅助治疗等多种方式。但随着治疗的推进, 现有药物和治疗方法会出现耐药和预后效果差的问题。因此, 利用我国丰富的中草药资源库寻找新型治疗药物, 一直都是治疗乳腺癌研究的热点。
小白菊内酯(parthenolide, PTL)是从艾菊、小白菊和观光木等药用植物中提取分离到的一种倍半萜内脂类化合物[4], 具有抗炎、调节免疫、治疗头痛和风湿等功效[5]。近年来发现, PTL对多种实体瘤具有抗癌活性, 如乳腺癌、非小细胞肺癌、胰腺癌和宫颈癌等[6-8]。研究表明, PTL能够通过NF-κB等通路阻滞细胞周期、诱导肿瘤细胞凋亡等过程。c-myc是与多种恶性肿瘤发展相关的原癌基因之一, 在c-myc基因的P1启动子区域有一段特殊的序列, 它可以折叠形成G-四链体结构[9]。研究表明, 化学小分子可以通过结合并稳定此G-四链体结构, 抑制原癌基因c-myc的转录和表达, 从而抑制肿瘤细胞的增殖[10, 11]。目前, 研究者对PTL影响c-myc基因的表达情况研究较少, 且很少报道PTL抑制肿瘤细胞增殖的分子靶标。
本文主要通过一系列实验表明, 小白菊内酯通过稳定原癌基因c-myc G-四链体, 抑制乳腺癌细胞的增殖和迁移, 并探讨了其可能的作用机制。
材料与方法材料与试剂 PTL (纯度 > 98%), 南京春秋生物工程有限公司; 寡核苷酸和DNA引物, 生工生物工程(上海)股份有限公司; MTT, 广州威佳生物科技有限公司; DMEM高糖培养基, 杭州吉诺生物医药技术有限公司; psiCHECK2质粒来自于中山大学黄志纾课题组; 胎牛血清, 浙江天杭生物科技股份有限公司; c-myc蛋白单克隆抗体(rabbit)、β-actin蛋白单克隆抗体(rabbit)和辣根过氧化物酶标记抗rabbit二抗, Cell Signaling Technology公司。
细胞株及细胞培养 人乳腺癌MCF-7细胞购自中国科学院上海生命科学研究院细胞库, 细胞用含有10%胎牛血清和1%青霉素-链霉素的DMEM高糖培养基培养, 培养环境为37 ℃、含5%的二氧化碳的饱和湿度细胞培养箱。当细胞在培养皿中生长融合度达到80%后, 用胰蛋白酶溶液处理, 进行传代培养。
表面等离子体共振(SPR)检测PTL与G-四链体的结合能力 参照文献[12]方法, 将生物素标记的c-myc G-四链体DNA (biotin-pu22, DNA序列见表 1)标记在已经标记了链霉亲和素的芯片上, 将含有浓度为0、0.63、1.25、2.5、5、10、20、40 μmol·L-1 PTL的缓冲液流过芯片, 持续400 s, 待PTL与DNA结合后, 再用SPR缓冲液流过芯片, 持续300 s。每两次测试之间用1 mol·L-1 KCl溶液再生芯片。信号采集后, 用仪器自带软件拟合PTL与DNA的结合能力。
| Table 1 Oligomer sequence and primer used in the experiment |
荧光共振能量转移(FRET)熔解实验检测G-四链体的稳定能力 参照文献[11, 12]方法, 将荧光标记的DNA F22T (DNA序列见表 1)用10 mmol·L-1 Tris-HCl缓冲溶液稀释至1 μmol·L-1, 95 ℃加热10 min后, 使体系缓慢降至室温。将PTL与退火后的DNA混合均匀后, PTL的终浓度分别为0和1 μmol·L-1, DNA的终浓度为0.2 μmol·L-1, 4 ℃孵育12 h。将样品转移至PCR管, 使用实时荧光定量PCR仪进行实验, 实验过程中温度由37 ℃逐渐升高至95 ℃, 每1 min升高1 ℃, 设置激发波长为470 nm, 发射光谱检测530 nm处的荧光强度。实验结束后, 用GraphPad Prism 5.0作图并拟合DNA的熔解温度Tm值, 并计算ΔTm值。
MTT比色法检测PTL对细胞增殖的影响 将对数生长期的MCF-7细胞接种于96孔板中, 接种密度为每孔4 000个, 放置在37 ℃、5%的CO2细胞培养箱中培养24 h使细胞完全贴壁后, 弃去上清, 加入溶解有终浓度为0、2.5、5、10、20和40 μmol·L-1的PTL细胞培养液, 于37 ℃、5%的CO2细胞培养箱中分别培养24、48和72 h。向每孔中加入MTT (2.5 mg·mL-1)溶液20 μL, 继续放入37 ℃培养箱4 h, 随后弃去上清, 加入DMSO (每孔100 μL), 用酶标仪测定570 nm处的吸光度值, 并用GraphPad Prism 5.0软件处理数据。PTL对细胞增殖的抑制率= (1-APTL组/A空白组)×100%。
逆转录PCR实验(RT-PCR)检测相关基因的转录 将对数生长期的MCF-7细胞接种于6孔板中, 接种密度为20万/孔, 放置在37 ℃、5%的CO2细胞培养箱中培养24 h使细胞完全贴壁后, 加入溶解有终浓度为0、5、10和20 μmol·L-1的PTL细胞培养液, 于37 ℃、5%的CO2细胞培养箱中培养6 h。收集细胞样品, 用RNA小量提取试剂盒提取细胞RNA, 按文献方法将RNA逆转录为cDNA[10], 将cDNA进行PCR反应, 引物序列见表 1 (β-actin-S、β-actin-A、c-myc-S、c-myc-A), PCR程序为: 94 ℃ 10 min; 94 ℃ 1 min, 58 ℃退火30 s, 72 ℃延伸1 min (30个循环); 70 ℃ 10 min, 最后至4 ℃。再将PCR产物进行琼脂糖凝胶电泳后拍照, 用QuantityOne软件对实验结果进行分析。
蛋白免疫印迹法(Western blot)检测相关蛋白的表达 将对数生长期的MCF-7细胞接种于6孔板中, 接种密度为20万/孔, 放置在37 ℃、5%的CO2细胞培养箱中培养24 h使细胞完全贴壁后, 加入溶解有终浓度为0、5、10和20 μmol·L-1的PTL细胞培养液, 于37 ℃、5%的CO2细胞培养箱中培养48 h。随后收集细胞, 加入蛋白裂解液, 提取细胞总蛋白, 并使用BCA蛋白检测试剂盒测定蛋白浓度后, 制备蛋白样品。按文献[11]方法将蛋白样品进行免疫印迹实验, 得到各蛋白的免疫印迹条带。以β-actin蛋白条带作为参照。
双荧光素酶报告基因法检测PTL对c-myc G-四链体的影响 将对数生长期的MCF-7细胞接种于96孔板中, 接种密度为5 000个/孔, 在37 ℃、5%的CO2细胞培养箱中培养24 h, 将含有pGL-c-myc-WT或pGL-c-myc-MU的双荧光素酶重组psiCHECK2质粒[10]转染到细胞中。将PTL与转染后的细胞进行孵育培养24 h后, 洗涤细胞, 用双荧光素酶报告基因试剂盒检测荧光素酶表达的相对活性, 使用GraphPad Prism 5.0软件进行数据处理。
划痕法检测细胞的迁移 将对数生长期的MCF-7细胞接种于6孔板中, 在37 ℃、5%的CO2细胞培养箱中使细胞融合率达到80%后, 移液器吸头对培养板底部均匀划痕, 无血清培养液洗涤细胞。用无血清细胞培养液饥饿培养24 h, 随后在6孔板中加入溶解有终浓度为0和10 μmol·L-1的PTL无血清细胞培养液, 继续放置于37 ℃、5%的CO2细胞培养箱中培养, 在培养0、24、48和72 h后, 用显微镜对划痕处拍照。
统计学分析 数据均以
通过SPR实验测定不同浓度的PTL对G-四链体DNA的结合情况, 结果表明(图 1), PTL对c-myc G-四链体DNA的结合常数KD为13.1 μmol·L-1, 说明PTL对c-myc G-四链体有较好的结合能力。

|
Figure 1 The binding ability of parthenolide (PTL) and c-myc G-quadruplex DNA by surface plasmon resonance |
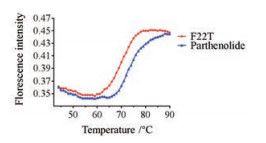
通过FRET熔解实验测定荧光标记的寡核苷酸G-四链体序列F22T空白组和经过PTL稳定之后的F22T, 随着温度逐渐增加的熔解曲线。实验结果表明(图 2), F22T空白组DNA的解链温度Tm值为69.2 ℃, PTL稳定后的F22T解链Tm值为74.3 ℃, 说明PTL对c-myc G-四链体有一定的热力学稳定能力, ΔTm值为5.1 ℃。
|
Figure 2 The melting curves of G-quadruplex by fluorescence resonance energy transfer melting assays |
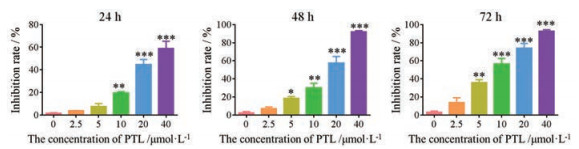
与对照组相比, PTL对体外培养的MCF-7细胞的增殖具有抑制作用, 且随着浓度的增加和作用时间的延长, 抑制作用越明显。MTT实验结果表明, PTL作用24、48和72 h后对MCF-7细胞增殖的半数抑制浓度(half maximal inhibitory concentration, IC50)分别为21.3、14.5和9.1 μmol·L-1, 见图 3。
|
Figure 3 The inhibiting ability of PTL with different concentrations and time on breast cancer MCF-7 cells. n = 3, |
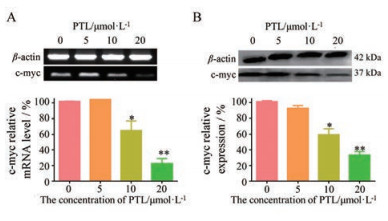
在对MCF-7细胞系进行的RT-PCR实验结果表明, 与空白对照组相比, c-myc基因的转录水平随着PTL作用浓度的增加而降低, 见图 4A; Western blot实验表明, 随着PTL作用浓度的增加, c-myc蛋白的表达水平降低, 见图 4B。表明PTL可能是通过稳定原癌基因c-myc启动子区域的G-四链体结构, 进而抑制c-myc基因的转录和表达的。
|
Figure 4 Effects of PTL on the c-myc transcription and expression in MCF-7 cells. A: The mRNA level of β-actin and c-myc in MCF-7 treated by PTL; B: The expression level of β-actin and c-myc in MCF-7 treated by PTL. n = 3, |
双荧光素酶报告基因实验表明, 与空白对照组相比, 作用于c-myc启动子G-四链体形成序列的pGL-c-myc-WT重组质粒后, PTL使萤火虫荧光素酶与海肾荧光素酶的荧光比值降低; 而作用于G-四链体形成序列的突变序列pGL-c-myc-MU重组质粒后, 对照组与PTL组荧光比值基本不变, 见图 5。以上结果说明, PTL是通过作用于c-myc启动子的G-四链体结构产生生物活性的。

|
Figure 5 Effects of PTL on c-myc promoter G-quadruplex via dual luciferase reporter assays. n = 3, |
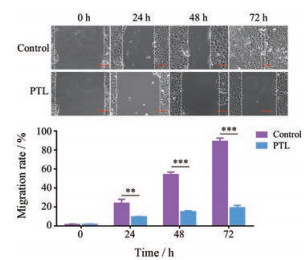
在细胞划痕实验中, 空白对照组和PTL处理组, 分别在0、24、48和72 h拍照记录划痕大小, 并观察细胞迁移情况。实验结果如图 6所示, 空白对照组MCF-7细胞随着时间的延长, 因为细胞迁移, 划痕逐渐愈合, 在72 h后划痕基本愈合消失。10 μmol·L-1的PTL作用于MCF-7细胞后, 划痕的愈合速度减慢, 在72 h后仍有较大划痕没有愈合, 说明PTL有效地抑制了MCF-7细胞的迁移。
|
Figure 6 The migration of MCF-7 cells after treated by PTL 24, 48 or 72 h. Scale bar: 100 μm. n = 3, |
乳腺癌作为危害全世界女性健康的恶性肿瘤之一, 尽管人们采取了多种治疗手段, 其死亡率依然居高不下, 如何提高乳腺癌治疗的临床疗效是亟需解决的重要课题。目前常用的治疗手段是手术治疗和化疗, 它能够在一定程度延长患者的生存期, 但预后较差, 总体治疗效果一般[1]。近年来人们不断尝试乳腺癌治疗的研究[13, 14], 但化学靶向药物的毒副作用较大, 纳米药物应用程度差强人意。我国中草药资源丰富, 在对肿瘤的治疗中已发现, 中草药中富含的独特的化合物骨架是多种抗肿瘤先导化合物的来源, 如雷公藤甲素和厚朴酚等[15, 16]。PTL作为天然产物来源的活性小分子, 在对肿瘤有较好的抑制作用的同时, 其对人体正常细胞的毒副作用较弱, 具有较好的发展潜力。
c-myc基因是myc基因家族的重要成员之一, 它所编码的蛋白质称为c-myc蛋白, 主要参与调控细胞的增殖、分化、凋亡、生存、黏附以及细胞大小等多种重要的细胞生物学功能。研究表明, c-myc的转录活化作用主要通过促进细胞周期, 刺激细胞生长和代谢, 在组织修复重建和肿瘤的发生发展中起到关键性作用[17, 18]。多个研究报道表明, 通过稳定c-myc基因启动子区域的G-四链体结构, 可以抑制c-myc基因的转录和表达, 是抑制癌细胞增殖的有效手段[10, 19, 20]。
多种研究表明, 肿瘤的迁移和转移与原癌基因c-myc密切相关。c-myc在移植瘤模型中可以促进乳腺癌细胞发生脑转移[21]。表观遗传调控基因JMJD6可以与c-myc基因协同作用, 诱导肿瘤的发生、增强肿瘤的转化和转移[22]。细胞转移的调节因子LPCAT1通过靶向c-myc基因转录, 上调PI3K/AKT/myc信号通路, 促进了肺腺癌的脑转移[23]。转录阳性辅助因子4 (PC4)通过c-myc介导的Warburg效应促进了乳腺癌的增殖和转移[24]。氧化低密度脂蛋白受体1 (OLR1)通过诱导c-myc基因表达和HMGA2转录, 增强胰腺癌细胞迁移[25]。由此说明, 通过特定的方法影响c-myc基因的转录表达, 可以影响肿瘤细胞的转移。
综上所述, PTL能通过结合并稳定c-myc基因启动子区域的G-四链体结构, 影响原癌基因c-myc的转录和表达水平, 进而抑制乳腺癌MCF-7细胞系的增殖和迁移水平。此研究结果为PTL发展为一个新型的靶向G-四链体的抗乳腺癌药物, 提供了新的实验依据。关于PTL抑制乳腺癌细胞增殖的c-myc下游信号通路有待进一步的研究与探讨。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68: 394-424. DOI:10.3322/caac.21492 |
| [2] |
Chen W, Sun K, Zhang R, et al. Cancer incidence and mortality in China, 2014[J]. Chin J Cancer Res, 2018, 30: 1-12. DOI:10.21147/j.issn.1000-9604.2018.01.01 |
| [3] |
Chen WQ, Zheng RS, Baade P, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66: 115-132. DOI:10.3322/caac.21338 |
| [4] |
Aleksander O, Grażyna A, Anna WP. Air-borne dermatitis from Chrysanthemum——case report with a discussion of diagnostic procedures and therapy[J]. Ann Agric Environ Med, 2014, 21: 531-533. DOI:10.5604/12321966.1120596 |
| [5] |
Tsai TY, Chan P, Gong CL, et al. Parthenolide-induced cytotoxicity in H9c2 cardiomyoblasts involves oxidative stress[J]. Acta Cardiol Sin, 2015, 31: 33-41. |
| [6] |
Li X, Kong L, Yang Q, et al. Parthenolide inhibits ubiquitin-specific peptidase 7(USP7), Wnt signaling, and colorectal cancer cell growth[J]. J Biol Chem, 2020, 295: 3576-3589. DOI:10.1074/jbc.RA119.011396 |
| [7] |
Freund RRA, Gobrecht P, Fischer D, et al. Advances in chemistry and bioactivity of parthenolide[J]. Nat Prod Rep, 2020, 37: 541-565. DOI:10.1039/C9NP00049F |
| [8] |
Lin M, Bi H, Yan Y, et al. Parthenolide suppresses non-small cell lung cancer GLC-82 cells growth via B-Raf/MAPK/Erk pathway[J]. Oncotarget, 2017, 8: 23436-23447. DOI:10.18632/oncotarget.15584 |
| [9] |
Brooks TA, Kendrick S, Hurley L. Making sense of G-quadruplex and i-motif functions in oncogene promoters[J]. FEBS J, 2010, 277: 3459-3469. DOI:10.1111/j.1742-4658.2010.07759.x |
| [10] |
Zeng DY, Kuang GT, Wang SK, et al. Discovery of novel 11-triazole substituted benzofuro[3, 2-b]quinolone derivatives as c-myc G-quadruplex specific stabilizers via click chemistry[J]. J Med Chem, 2017, 60: 5407-5423. |
| [11] |
Shan C, Yan JW, Wang YQ, et al. Design, synthesis, and evaluation of isaindigotone derivatives to downregulate c-myc transcription via disrupting the interaction of NM23-H2 with G-quadruplex[J]. J Med Chem, 2017, 60: 1292-1308. |
| [12] |
Guo QL, Su HF, Wang N, et al. Synthesis and evaluation of 7-substituted-5, 6-dihydrobenzo[c]acridine derivatives as new c-KIT promoter G-quadruplex binding ligands[J]. Eur J Med Chem, 2017, 130: 458-471. DOI:10.1016/j.ejmech.2017.02.051 |
| [13] |
Mei D, Chen BL, He B, et al. Actively priming autophagic cell death with novel transferrin receptor-targeted nanomedicine for synergistic chemotherapy against breast cancer[J]. Acta Pharm Sin B, 2019, 9: 1061-1077. DOI:10.1016/j.apsb.2019.03.006 |
| [14] |
Pallabita C, Prashanth KBN, Sheema K, et al. Development of polyvinylpyrrolidone/paclitaxel self-assemblies for breast cancer[J]. Acta Pharm Sin B, 2018, 8: 602-614. DOI:10.1016/j.apsb.2017.10.004 |
| [15] |
Dai X, Li RZ, Jiang ZB, et al. Honokiol inhibits proliferation, invasion and induces apoptosis through targeting lyn kinase in human lung adenocarcinoma cells[J]. Front Pharmacol, 2018, 9: 558. DOI:10.3389/fphar.2018.00558 |
| [16] |
Feng JJ, Rao MJ, Wang M, et al. Triptolide suppresses pancreatic cancer cell proliferation by inhibiting hedgehog signaling pathway activity[J]. Sci China Life Sci, 2019, 62: 1409-1412. DOI:10.1007/s11427-018-9477-3 |
| [17] |
Meyer N, Penn LZ. Reflecting on 25 years with Myc[J]. Nat Rev Cancer, 2008, 8: 976-990. DOI:10.1038/nrc2231 |
| [18] |
Soucek L, Whitfield J, Martins CP, et al. Modelling Myc inhibition as a cancer therapy[J]. Nature, 2008, 455: 679. DOI:10.1038/nature07260 |
| [19] |
Hu MH, Wang YQ, Yu ZY, et al. Discovery of a new four-leaf clover-like ligand as a potent c-Myc transcription inhibitor specifically targeting the promoter G-quadruplex[J]. J Med Chem, 2018, 61: 2447-2459. |
| [20] |
Wang YQ, Huang ZL, Chen SB, et al. Design, synthesis, and evaluation of new selective NM23-H2 binders as c-Myc transcription inhibitors via disruption of the NM23-H2/G-quadruplex interaction[J]. J Med Chem, 2017, 60: 6924-6941. |
| [21] |
Lee HY, Cha J, Kim SK, et al. c-MYC drives breast cancer metastasis to the brain, but promotes synthetic lethality with TRAIL[J]. Mol Cancer Res, 2019, 17: 544-554. DOI:10.1158/1541-7786.MCR-18-0630 |
| [22] |
Aprelikova O, Chen K, Touny LHE, et al. The epigenetic modifier JMJD6 is amplified in mammary tumors and cooperates with c-Myc to enhance cellular transformation, tumor progression, and metastasis[J]. Clin Epigenetics, 2016, 8: 38. DOI:10.1186/s13148-016-0205-6 |
| [23] |
Wei C, Dong X, Lu H, et al. LPCAT1 promotes brain metastasis of lung adenocarcinoma by up-regulating PI3K/AKT/Myc pathway[J]. J Exp Clin Cancer Res, 2019, 38: 95. DOI:10.1186/s13046-019-1092-4 |
| [24] |
Luo P, Zhang C, Liao F, et al. Transcriptional positive cofactor 4 promotes breast cancer proliferation and metastasis through c-Myc mediated Warburg effect[J]. Cell Commun Signal, 2019, 17: 36. DOI:10.1186/s12964-019-0348-0 |
| [25] |
Yang G, Xiong GB, Feng MY, et al. OLR1 promotes pancreatic cancer metastasis via increased c-Myc expression and transcription of HMGA2[J]. Mol Cancer Res, 2020, 18: 685-697. DOI:10.1158/1541-7786.MCR-19-0718 |
 2020, Vol. 55
2020, Vol. 55


