作者贡献:张炜系本实验的设计者, 指导文章的写作; 马欢欢、朱晓悫、郭文燕、郝杰和靳保花为实验的执行者, 参与数据采集、数据分析和文章撰写。全体作者都阅读并同意最终的文本。
利益冲突:本研究和任何组织和个人均没有利益冲突。
局部麻醉药(local anaesthetics)简称局麻药, 是一类能够可逆性地阻滞神经轴突内冲动的传导, 使局部组织感觉尤其是痛觉暂时消失的药物。临床上常用于表面麻醉、浸润麻醉、硬膜外麻醉和蛛网膜下腔麻醉等。布比卡因是一种长效酰胺类局麻药, 由于其化学性质稳定, 作用效果持续时间长, 因此在临床上广泛应用[1]。然而布比卡因等局麻药有严重不良反应, 尤其是其心脏和神经毒性, 如心脏骤停、肌肉抽搐和癫痫等。研究发现, 布比卡因引起中枢神经系统(central nervous system, CNS)毒性的血药浓度更低[2-5]。而且, 与其他几种常用的局麻药相比, 布比卡因产生的毒性作用最为严重[6]。但是目前布比卡因引起中枢神经系统毒副作用的机制尚不明确。
星形胶质细胞是哺乳动物脑内分布最多的细胞, 具有复杂的结构和多种功能, 在CNS损伤后可被大量激活。星形胶质细胞具有调节突触功能和神经递质水平、组成血脑屏障、释放营养因子和炎症因子等功能[7-9]。在哺乳动物中谷氨酸是CNS内主要的兴奋性神经递质, 其介导的兴奋性信号传导可以影响哺乳动物的学习、记忆和认知等功能[10, 11]。星形胶质细胞主要通过代谢型谷氨酸受体与三磷酸肌醇(inositol triphosphate, IP3)相偶联诱发星形胶质细胞内钙库的释放, 引起胞内游离Ca2+ ([Ca2+]i)升高。代谢型谷氨酸受体(mGluRs)根据其序列同源性、信号转导机制和激动剂选择性分为3组: Ⅰ组mGluRs包括mGluR1和mGluR5; Ⅱ组包括mGluR2和mGluR3; Ⅲ组包括mGluR4、mGluR6、mGluR7和mGluR8。海马胶质细胞上表达丰富的mGluR5受体[12]。研究显示, 布比卡因的CNS毒性很可能与神经细胞[Ca2+]i有关[13, 14]。本课题组前期研究发现, 布比卡因对大鼠海马神经元的毒性作用(增强谷氨酸诱导的神经元[Ca2+]i升高)可能源于其对星形胶质细胞[Ca2+]i的直接抑制作用, 且从0~300 μmol·L-1浓度依赖性抑制谷氨酸诱导的星形胶质细胞[Ca2+]i升高[15]。然而布比卡因对谷氨酸诱导的星形胶质细胞[Ca2+]i升高的抑制作用机制是否与mGluR5受体相关并不十分清楚。本文以原代培养的大鼠海马星形胶质细胞为研究对象, 利用钙离子成像和免疫荧光技术, 在原代海马神经元和星形胶质细胞共同培养状态下, 探讨布比卡因对谷氨酸诱导的海马星形胶质细胞[Ca2+]i升高的抑制作用及相关机制。
材料与方法实验动物 成年Sprague Dawley清洁级孕鼠, 体重控制在250~300 g, 动物许可证号: SCXK (冀) 2018-004。由河北医科大学实验动物中心提供。大鼠饲养于动物实验室内, 室温调节至(23 ± 1) ℃, 相对湿度为(50 ± 5) %, 明暗交替各12 h (光照时间为8:00~20:00)。动物能够自由觅食、饮水。实验过程经河北医科大学实验动物福利伦理委员会批准。
主要试剂与药物 Neurobasal培养基、DMEM培养基、HBSS平衡盐溶液、Hibernate-E培养基、Fura-2 AM、胎牛血清(FBS)、磷酸缓冲盐溶液(PBS)、B-27及丙酮酸钠购自美国Gibco公司; 羊抗小鼠二抗和羊抗兔二抗购自美国Jackson公司; NeuN抗体购自美国Abcam公司; Accutase购于美国Millipore公司; DNase购于日本TaKaRa公司; 封片液和羊血清购自北京索莱宝公司; GFAP抗体购于上海Arigo biolaboratories公司; 盐酸布比卡因购于日本TCI公司; 2-甲基-6-(苯乙炔)吡啶盐酸盐[2-methyl-6-(2-phenylethynyl)-pyridine, MPEP]、(RS)-3, 5-二羟基苯基甘氨酸[(RS)-3, 5-dihydroxyphenylglycine, DHPG]及2-氯-5羟苯基甘氨酸钠盐[(RS)-2-chloro-5-hydroxyphenylglycine sodium salt, CHPG]购于英国TOCRIS公司。
仪器 DMI3000B型荧光显微镜、共聚焦显微镜(德国Leica公司); FV1200型荧光显微镜(日本OLYMPUS公司); ALA-VM8灌流系统(美国ALA公司); VAPRO 5600型渗透压仪(美国Wescor公司); CP213型电子天平(美国Ohaus公司); MS104S型电子天平、FE20型pH仪(瑞士Mettler Toledo公司); Nanopure纯水仪(美国Thermo Fisher公司); MLS-3020型高压蒸汽消毒锅(日本SANYO公司)。
细胞外液的制备 钙成像细胞外液成分为145 mmol·L-1 NaCl、3 mmol·L-1 KCl、2 mmol·L-1 MgCl2、2 mmol·L-1 CaCl2、10 mmol·L-1 HEPES和10 mmol·L-1葡萄糖。用1 mol·L-1 NaOH调pH至7.4。最后使用真空泵和0.22 μm微孔滤膜抽滤, 随后测定渗透压于(300 ± 20) mmol·kg-1内, 即可用于药品的配制与钙成像实验。
胎鼠海马、胶质神经细胞的培养 选取孕期为第18~20天的SD大鼠的胎鼠, 按照实验室前期建立的神经、胶质细胞培养方法获取海马细胞悬液[16]。细胞悬液过筛后, 以每平方厘米2.5×104个的细胞密度将单细胞悬液移入含有经多聚赖氨酸包被过的玻璃爬片的24孔板内。细胞培养在含10% FBS的DMEM培养基中, 培养于37 ℃、5% CO2的细胞培养箱内。海马神经细胞混合培养: 4 h后, 更换为新鲜的化学成分确定的培养基(chemically defined medium, CDM)生长培养基, 此后每3天进行半量更换新鲜的CDM。海马星形胶质细胞单独培养:当天不用更换培养基, 之后每天全量更换新鲜的含10% FBS的DMEM, 3天后将培养基更换为纯的DMEM培养基, 依旧每天全量换液。海马神经元单独培养: 4 h后, 更换为新鲜的CDM生长培养基, 并于第3天更换为含有5-氟尿嘧啶(10 μmol·L-1)的CDM培养基, 再过3天后全量更换新鲜CDM培养基, 此后每3天进行半量更换CDM培养基。
免疫荧光染色 选取显微镜下观察生长状态良好的培养7~10天的原代海马神经细胞爬片, 用PBS漂洗3次, 4%多聚甲醛固定15 min后, PBS洗3次, 3% BSA + 0.3% Triton X-100打孔液在37 ℃恒温箱中对细胞进行打孔(60 min), 完成后恢复至室温, 用吸水纸吸干打孔液, 滴加50%山羊血清, 室温封闭30 min。封闭完成后用吸水纸吸干封闭液, 加一抗(神经元用NeuN抗体标记, 星形胶质细胞用GFAP抗体标记, 并分别与mGluR5抗体进行共标记)于4 ℃冰箱孵育24 h, 次日用PBS洗3次后, 加入荧光二抗(神经元细胞和星形胶质细胞用山羊抗小鼠的荧光二抗, mGluR5用山羊抗兔的荧光二抗), 避光37 ℃孵育90 min, PBS漂洗3次, 滴加DAPI, 避光室温孵育10 min, PBS浸洗3次后, 用含抗荧光淬灭剂的封片液进行封片。激光共聚焦显微镜下观察并采集图像。
钙离子成像技术 将培养7~10天的原代海马神经细胞浸在含2 μmol·L-1 Fura-2 AM染料的细胞外液中, 全程避光, 37 ℃孵育15 min后即可用于实验。控制室温于(23 ± 1) ℃。将孵育过Fura-2荧光染料的细胞爬片置于显微镜记录浴槽中, 细胞外液灌流速度为2 mL·min-1, 洗去细胞爬片上多余的染料后, 应用莱卡DMI3000B显微镜进行钙离子成像实验。以340 nm和380 nm波长激发细胞内Fura-2信号, 选择1次每秒的频率进行信号采集。最终, 得到的结果以340 nm与380 nm信号的比值[R(340/380 nm)]表示。钙离子信号峰值参数通过公式计算: R峰值(340/380 nm) = R峰高值(340/380 nm) - R基线值(340/380 nm)。
统计学分析 数据的统计描述以
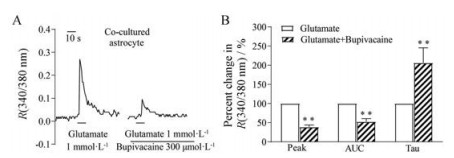
在神经元和星形胶质细胞共同培养的状态下, 给予1 mmol·L-1谷氨酸(10 s), 可引起星形胶质细胞[Ca2+]i升高。用300 μmol·L-1布比卡因孵育5 min[15], 然后再次给予1 mmol·L-1谷氨酸(10 s)诱发星形胶质细胞[Ca2+]i升高, 布比卡因孵育后两次谷氨酸诱导产生的[Ca2+]i升高反应强度具有显著性差异(P < 0.01)。1 mmol·L-1谷氨酸第二次给药产生的[Ca2+]i峰高及曲线下面积(area under the curve, AUC)较首次反应显著降低(图 1A、B), R峰值(340/380 nm)由孵育布比卡因前的0.27 ± 0.07下降至0.09 ± 0.11, 降低了67% (n = 10, P < 0.01); AUC由2.19 ± 1.13降低至1.02 ± 1.45, 降低了53%;而星形胶质细胞[Ca2+]i升高后恢复至基线水平的Tau值受布比卡因影响显著减慢, 由5.88 ± 1.68 s上升至12.40 ± 9.88 s (图 1A、B)。
|
Figure 1 Effects of bupivacaine on the glutamate-induced [Ca2+]i elevation of astrocytes in the co-cultured system. A: 300 μmol·L-1 bupivacaine preincubation 5 min significantly inhibited glutamate-induced [Ca2+]i elevation in astrocytes representative trace; B: Percent changes in peak, area under the curve (AUC) and Tau value. Cells were exposed to 1 mmol·L-1 glutamate for 10 s. |
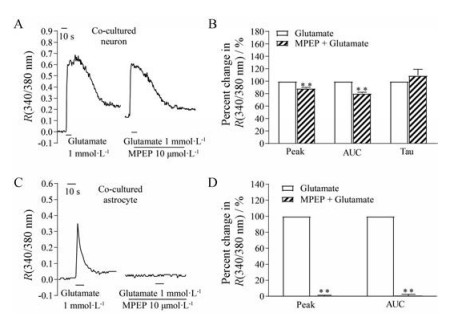
神经元和星形胶质细胞共培养状态下, 给予1 mmol·L-1的谷氨酸(10 s), 可引起神经元和星形胶质细胞[Ca2+]i升高。对于共同培养状态下的神经元, MPEP (10 μmol·L-1)孵育5 min后, 可降低1 mmol·L-1谷氨酸诱发的神经元[Ca2+]i的升高, 神经元细胞[Ca2+]i的R峰值(340/380 nm)由孵育MPEP前的0.69 ± 0.19下降至0.61 ± 0.17, 降低了11.6% (P < 0.01), RAUC(340/380 nm)值由孵育前的42.82 ± 11.95降低至34.93 ± 10.58, 降低了18.4% (P < 0.01), 而Tau值前后无显著性改变(n = 35, 图 2A、B)。然而, MPEP (10 μmol·L-1)可完全抑制1 mmol·L-1谷氨酸(10 s)介导的星形胶质细胞[Ca2+]i升高的反应, R峰值(340/380 nm)由0.35 ± 0.07降低至0, 抑制率为100% (n = 22, 图 2C、D, P < 0.01)。
|
Figure 2 Effects of MPEP on the glutamate-induced [Ca2+]i increase of neurons and astrocytes in the co-cultured system. 10 μmol·L-1 MPEP preincubation (5 min) suppressed the glutamate-induced [Ca2+]i elevation in neurons in co-cultured system (A: A representative trace; B: Percent changes in peak, AUC and Tau value, n = 35). The increase of [Ca2+]i induced by glutamate was completely abolished by MPEP in astrocytes (C: A representative trace; D: Percent changes in peak, AUC and Tau value, n = 22). Cells were exposed to 1 mmol·L-1 glutamate for 10 s. |
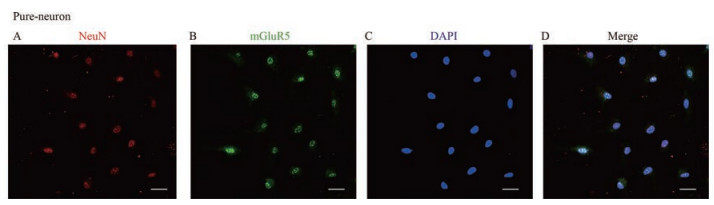
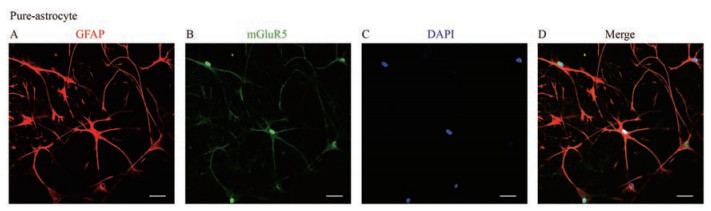
激光共聚焦照片显示, mGluR5可分别与NeuN和GFAP抗体共同表达于同一位置, 表明神经元和星形胶质细胞均表达mGluR5受体(图 3、4)。其中, 图 3是神经元单独培养, 应用神经元标记物Anti-NeuN和Anti-mGluR5共同标记。图 4是纯星形胶质细胞单独培养, 应用星形胶质细胞标记物Anti-GFAP与Anti-mGluR5共同标记。细胞核使用DAPI进行复染标记, 呈蓝色荧光。
|
Figure 3 Neuron staining with metabotropic glutamate receptor 5 (mGluR5) in neuron. A-C: Representative images show the neuron immunostained with NeuN (red), mGluR5 (green), DAPI (blue). D was merged by the other three. Scale bar: 25 μm |
|
Figure 4 Astrocytes staining with mGluR5 in pure-astrocytes system. A-C: Representative images show the astrocytes immunostained with GFAP (red), mGluR5 (green), DAPI (blue). D was merged by the other three. Scale bar: 25 μm |
在原代海马神经元和星形胶质细胞共培养的状态下, 持续给予50 μmol·L-1的DHPG (10 s), 可诱导星形胶质细胞[Ca2+]i显著升高, 达峰后随药物洗脱星形胶质细胞的[Ca2+]i可自主恢复至基线水平, 星形胶质细胞[Ca2+]i的R峰值(340/380 nm) = 0.40 ± 0.10 (n = 26, 图 5A、B)。首次给药结束后, 细胞外液持续冲洗5 min, 再次给予50 μmol·L-1的DHPG (持续10 s), 仍可引起星形胶质细胞[Ca2+]i显著上升, R峰值(340/380 nm) = 0.39 ± 0.11 (图 5A、B)。然而, 共培养状态下给予50 μmol·L-1 DHPG (持续10 s)仅可诱导少数神经元细胞[Ca2+]i的微小变化, 绝大多数神经元不能被DHPG诱导产生细胞[Ca2+]i升高。

|
Figure 5 Effect of bupivacaine on the DHPG-induced [Ca2+]i changes of astrocytes in the co-cultured system. 50 μmol·L-1 DHPG (10 s) induced elevation of [Ca2+]i in astrocytes (A: A representative trace; B: Percent changes in peak, AUC and Tau value, n = 26) in primary cultured hippocampal astrocyte. |
300 μmol·L-1布比卡因(孵育5 min)可明显抑制50 μmol·L-1 DHPG (10 s)介导的星形胶质细胞[Ca2+]i升高的反应, 其中, 37例细胞[Ca2+]i的R峰值和RAUC下降至0;剩余3例被部分抑制, R峰值分别降低至67%、61%和56%, RAUC分别降低至21%、53%和29%。细胞[Ca2+]i的R峰值由孵育DHPG前的0.40 ± 0.09降至0.02 ± 0.07, RAUC由3.60 ± 1.76降至0.17 ± 0.61 (n = 40, 图 5C、D, P < 0.01)。
5 布比卡因对mGluR5受体特异性激动剂CHPG诱导混合培养海马神经细胞[Ca2+]i变化的影响在神经元和星形胶质细胞共培养状态下, 给予1 mmol·L-1 CHPG (20 s), 可诱导星形胶质细胞[Ca2+]i从基线水平显著升高, 达峰后星形胶质细胞的[Ca2+]i可自主恢复至基线水平, R峰值(340/380 nm)为0.34 ± 0.06 (n = 16, 图 6A、B)。初次给药结束后, 仍用细胞外液冲洗5 min, 然后再次给予1 mmol·L-1 CHPG持续刺激20 s, 仍然可以引起星形胶质细胞[Ca2+]i显著上升, R峰值(340/380 nm)为0.34 ± 0.07 (图 6A、B), 前后两次没有显著性差异。并且1 mmol·L-1 CHPG (20 s)不能引起共培养状态下神经元细胞[Ca2+]i的升高。
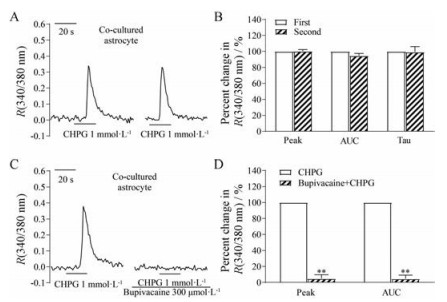
|
Figure 6 Effect of bupivacaine on the CHPG-induced [Ca2+]i changes of astrocyte in the co-cultured system. Stimulation with 1 mmol·L-1 CHPG for 20 s induced elevation of [Ca2+]i in astrocytes (A: A representative trace; B: Percent changes in peak, AUC and Tau value, n = 16) in co-cultured primary hippocampal neurons with astrocyte systems. |
300 μmol·L-1布比卡因孵育(5 min)混合培养状态下星形胶质细胞, 可明显抑制1 mmol·L-1 CHPG (持续给药20 s)诱导的细胞[Ca2+]i升高, 其中, 11例细胞[Ca2+]i 340 nm与380 nm信号的比值下降至0;仅1例被部分抑制, R峰值降低了58%, RAUC降低了55%。细胞[Ca2+]i的R峰值由孵育布比卡因前的0.40 ± 0.05降至0.02 ± 0.06, RAUC由2.82 ± 0.90降至0.11 ± 0.38 (n = 12, 图 6C、D, P < 0.01)。实验结束后细胞外液冲洗, 再次给予1 mmol·L-1 CHPG, 仍然可以引起星形胶质细胞[Ca2+]i升高。
6 布比卡因对共培养状态下CHPG诱导的海马星形胶质细胞[Ca2+]i升高的量效关系研究上述研究表明, 在海马神经元和星形胶质细胞共培养下, 300 μmol·L-1布比卡因可显著抑制CHPG诱导的星形胶质细胞[Ca2+]i升高。应用不同浓度布比卡因(10、30、100和300 μmol·L-1)检测其对CHPG诱发星形胶质细胞[Ca2+]i的影响发现, 布比卡因可浓度依赖性地抑制CHPG诱导的星形胶质细胞[Ca2+]i升高。根据峰值和曲线下面积分别计算布比卡因对CHPG引起星形胶质细胞[Ca2+]i升高的抑制作用, IC50分别为99.77和103.6 μmol·L-1 (图 7)。
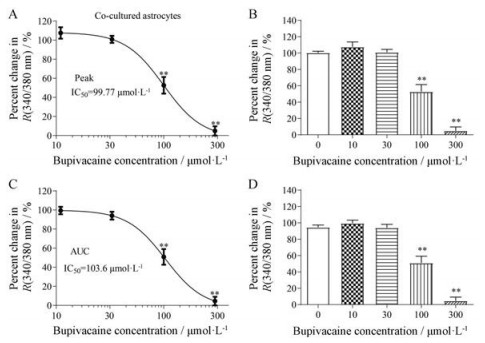
|
Figure 7 The concentration-effect curves of bupivacaine inhibiting on the CHPG-induced elevation in astrocytes. Preincubation with bupivacaine (10, 30, 100, and 300 μmol·L-1 for 5 min, n = 10, 14, 20 and 12, respectively) inhibited CHPG-induced [Ca2+]i elevation in astrocytes. A: Inhibitory curves of bupivacaine on peak; B: Percent changes in peak; C: Inhibitory curves of bupivacaine on AUC; D: Percent changes in AUC. Cells were exposed to 1 mmol·L-1 CHPG for 20 s. |
布比卡因属长效酰胺类局麻药, 脂溶性高, 作用效果强, 是临床常用的局部麻醉药。但布比卡因可产生如心脏骤停和惊厥等不同程度的心血管系统的抑制作用和神经毒性作用, 1/3患者使用时可出现短暂的神经症状, 且CNS的毒性作用的发生往往早于心脏毒性[2, 3, 17, 18]。本课题组前期研究发现, 布比卡因可以直接作用于星形胶质细胞, 降低谷氨酸介导的星形胶质细胞的[Ca2+]i升高, 增强谷氨酸诱发的神经元的[Ca2+]i升高[15]。
谷氨酸是中枢神经系统重要的神经递质, 同时也是胶质细胞信息传递的分子, 谷氨酸通过作用于谷氨酸受体进行信息传递。研究表明, 胶质细胞和神经元相似, 既表达离子型谷氨酸受体也表达代谢型谷氨酸受体, 而胶质细胞上代谢型谷氨酸受体的表达更为丰富。如mGluR5受体在大鼠海马体的神经元及星形胶质细胞上都有表达[19, 20]。本研究也发现mGluR5受体在神经元和星形胶质细胞上均有大量的表达, 尤其在星形胶质细胞上mGluR5受体的表达遍布整个星形胶质细胞, 与GFAP的染色完全吻合。
本课题组前期的研究表明, 布比卡因能够抑制谷氨酸诱导的星型胶质细胞[Ca2+]i的升高[15]。在共同培养的原代大鼠海马神经元和星形胶质细胞中, 1 mmol·L-1谷氨酸可诱导神经元和星形胶质细胞[Ca2+]i水平的显著升高。给予300 μmol·L-1布比卡因能够显著抑制谷氨酸诱导的星形胶质细胞[Ca2+]i升高的反应。在神经元和星形胶质细胞共培养状态下, 10 μmol·L-1 mGluR5受体拮抗剂MPEP可以显著降低谷氨酸诱发的神经元和星形胶质细胞内钙的升高, 但对两种细胞内钙抑制的程度不一致, 神经元仅抑制10%~20%, 而星形胶质细胞[Ca2+]i升高的反应几乎完全被抑制, 表明胶质细胞上谷氨酸引起的内钙变化主要由代谢型谷氨酸受体所诱发, 而神经元上则主要由离子型谷氨酸受体所诱发的。因此, 布比卡因降低谷氨酸诱导的星形胶质细胞[Ca2+]i升高的反应可能与代谢型谷氨酸受体有关。为验证以上的猜想, 本研究用mGluRs (mGluR1/5)受体激动剂DHPG和CHPG刺激星形胶质细胞, 发现DHPG和CHPG都能够诱发星形胶质细胞内钙增加, 表明代谢型谷氨酸受体参与谷氨酸介导的星形胶质细胞的钙振荡。布比卡因可抑制DHPG和CHPG诱发的星形胶质细胞[Ca2+]i升高, 表明mGluR5受体参与了布比卡因抑制谷氨酸诱导的星形胶质细胞[Ca2+]i升高的反应, 并且布比卡因抑制CHPG诱发的星形胶质细胞[Ca2+]i升高的IC50约为100 μmol·L-1, 此浓度和布比卡因临床应用出现毒性反应时的血药浓度基本一致。表明布比卡因临床应用时所引发的毒性反应, 与其通过星形胶质细胞上的mGluR5受体抑制谷氨酸诱发的星形胶质细胞[Ca2+]i升高密切相关。综上所述, 本研究为布比卡因的神经毒性作用机制研究提供了一定的补充, 并为布比卡因等其他具有神经毒性反应的局麻药物的作用机制及临床治疗研究提供新的参考依据。
| [1] |
Ruetsch YA, Boni T, Borgeat A. From cocaine to ropivacaine:the history of local anesthetic drugs[J]. Curr Top Med Chem, 2001, 1: 175-182. DOI:10.2174/1568026013395335 |
| [2] |
Kato J, Konishi J, Yoshida H, et al. Cauda equina syndrome following combined spinal and epidural anesthesia:a case report[J]. Can J Anaesth, 2011, 58: 638-641. DOI:10.1007/s12630-011-9505-7 |
| [3] |
Killeen T, Kamat A, Walsh D, et al. Severe adhesive arachnoiditis resulting in progressive paraplegia following obstetric spinal anaesthesia:a case report and review[J]. Anaesthesia, 2012, 67: 1386-1394. DOI:10.1111/anae.12017 |
| [4] |
Karaca O, Pinar HU, Dogan R. Total spinal block, bupivacaine toxicity or else under epidural anaesthesia?[J]. Agri, 2017, 29: 149-150. |
| [5] |
Moore PA, Hersh EV. Local anesthetics:pharmacology and toxicity[J]. Dent Clin North Am, 2010, 54: 587-599. DOI:10.1016/j.cden.2010.06.015 |
| [6] |
Malet A, Faure MO, Deletage N, et al. The comparative cytotoxic effects of different local anesthetics on a human neuroblastoma cell line[J]. Anesth Analg, 2015, 120: 589-596. DOI:10.1213/ANE.0000000000000562 |
| [7] |
Crosby KM, Murphy-Royal C, Wilson SA, et al. Cholecystokinin switches the plasticity of GABA synapses in the dorsomedial hypothalamus via astrocytic ATP release[J]. J Neurosci, 2018, 38: 8515-8525. DOI:10.1523/JNEUROSCI.0569-18.2018 |
| [8] |
Umpierre AD, West PJ, White JA, et al. Conditional knock-out of mGluR5 from astrocytes during epilepsy development impairs high-frequency glutamate uptake[J]. J Neurosci, 2019, 39: 727-742. DOI:10.1523/JNEUROSCI.1148-18.2018 |
| [9] |
Xing P, Ma K, Li L, et al. The protection effect and mechanism of hyperbaric oxygen therapy in rat brain with traumatic injury[J]. Acta Cir Bras, 2018, 33: 341-353. DOI:10.1590/s0102-865020180040000006 |
| [10] |
Kono M, Kakegawa W, Yoshida K, et al. Interneuronal NMDA receptors regulate long-term depression and motor learning in the cerebellum[J]. J Physiol, 2019, 597: 903-920. DOI:10.1113/JP276794 |
| [11] |
Gasparini CF, Sutherland HG, Haupt LM, et al. Genetic analysis of GRIA2 and GRIA4 genes in migraine[J]. Headache, 2014, 54: 303-312. DOI:10.1111/head.12234 |
| [12] |
Vanzulli I, Butt AM. mGluR5 protect astrocytes from ischemic damage in postnatal CNS white matter[J]. Cell Calcium, 2015, 58: 423-430. DOI:10.1016/j.ceca.2015.06.010 |
| [13] |
Johnson ME, Saenz JA, DaSilva AD, et al. Effect of local anesthetic on neuronal cytoplasmic calcium and plasma membrane lysis (necrosis) in a cell culture model[J]. Anesthesiology, 2002, 97: 1466-1476. DOI:10.1097/00000542-200212000-00019 |
| [14] |
Arai Y, Kondo T, Tanabe K, et al. Enhancement of hyperthermia-induced apoptosis by local anesthetics on human histiocytic lymphoma U937 cells[J]. J Biol Chem, 2002, 277: 18986-18993. DOI:10.1074/jbc.M108084200 |
| [15] |
Xing Y, Zhang N, Zhang W, et al. Bupivacaine indirectly potentiates glutamate-induced intracellular calcium signaling in rat hippocampal neurons by impairing mitochondrial function in cocultured astrocytes[J]. Anesthesiology, 2018, 128: 539-554. DOI:10.1097/ALN.0000000000002003 |
| [16] |
Zhang N, Xiong WW, Xing Y, et al. Culture method of rat fetal hippocampal neurons and astrocytes[J]. Acta Neuropharmacologica (神经药理学报), 2017, 7: 24-28. |
| [17] |
Albright GA. Cardiac arrest following regional anesthesia with etidocaine or bupivacaine[J]. Anesthesiology, 1979, 51: 285-287. DOI:10.1097/00000542-197910000-00001 |
| [18] |
Liu P, Feldman HS, Covino BM, et al. Acute cardiovascular toxicity of intravenous amide local anesthetics in anesthetized ventilated dogs[J]. Anesth Analg, 1982, 61: 317-322. |
| [19] |
Abe T, Sugihara H, Nawa H, et al. Molecular characterization of a novel metabotropic glutamate receptor mGluR5 coupled to inositol phosphate/Ca2+ signal transduction[J]. J Biol Chem, 1992, 267: 13361-13368. |
| [20] |
Wang JW, Wang HD. Research progress of metabolic glutamate receptor 5 in glial cells[J]. Chin J Neurosurg Dis Res (中华神经外科疾病研究杂志), 2013, 12: 470-471. |
 2020, Vol. 55
2020, Vol. 55


