作者贡献:王雪凝是本文的第一作者, 负责撰写并修订了原稿; 孔建强为本文的通讯作者, 负责论文的选题以及稿件的修改。所有作者阅读并核查了最终的稿件。
利益冲突:本文的研究内容无任何利益冲突。
葛根素(puerarin)也叫大豆苷元-8-C-葡萄糖苷(daidzein-8-C-glucoside, 图 1), 是一种分离自中药葛根的异黄酮类化合物[1]。目前, 葛根素注射液已被开发上市, 临床上常用于治疗冠心病、心绞痛和突发性耳聋[2-4]等疾病。此外, 葛根素还具有保护神经系统、修复肝损伤等功能, 因此也被用于糖尿病及其并发症、阿尔茨海默症、酒精性肝损伤[5-7]等疾病的联合用药。但随着临床应用范围的扩大, 葛根素所导致的不良反应也逐渐被报道, 包括药物致热、变态反应和溶血等[8], 这些不良反应的产生大多与葛根素溶解性差、生物利用度低有关。为了改善葛根素的溶解性和生物利用度, 研究人员采用化学和生物的方法对葛根素进行结构修饰, 获得了一系列葛根素衍生物。本论文对近年来利用生物催化合成葛根素衍生物的研究进行了分析和总结, 并对相关领域的发展前景进行了展望。
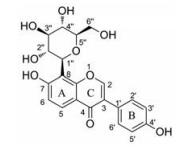
|
Figure 1 Chemical structure of puerarin |
作为重要的黄酮类化合物之一, 葛根素具有独特的理化性质。受C环吡喃羰基的立体阻碍影响, 葛根素分子易形成较大的共轭体系, 在空间上趋于平面, 故其晶体刚性较强[9]。此外, 7位和4'位上的酚羟基有利于氢键的形成, 从而进一步增强了分子间作用力。这些结构特性导致葛根素水溶性和脂溶性均较差。为了达到标准的注射浓度, 临床上常通过加入聚乙烯吡咯烷酮(PVP)或高浓度丙二醇促进葛根素的溶解, 但这些助溶剂的使用大大增加了患者致敏风险[10], 导致不良反应发生率升高。另一方面, 葛根素较低的生物利用度也限制了其剂型的多样性发展。现有的片剂、胶囊剂和丸剂的胃肠道吸收性较差, 大部分以药物原形排出体内, 疗效不佳。而仅仅靠高剂量给药来提高生物利用度, 结果往往适得其反, 导致不良反应凸显[11]。
众所周知, 药物与生物靶分子相互作用产生疗效, 药效与药物分子的大小、结构、溶解度等性质息息相关。因此, 基于葛根素临床应用中所面临的问题, 越来越多的研究者采用不同的方法对葛根素进行结构修饰, 以期获得溶解度和生物利用度得到显著改善的葛根素衍生物。由葛根素分子结构式可知, 吡喃葡萄糖以C-糖苷键的形式连接于大豆苷元(daidzein)的C8, 其C6''羟基符合糖化学研究中易修饰的规律。在大豆苷元C4'和C7上各有一个化学性质较为活泼的酚羟基, 由于C4'羟基不受糖基空间位阻的影响, 所以普遍认为其活泼性强于C7羟基[12]。此外, 大豆苷元B环上的C3'与C5'因受到C4'羟基的活化作用影响, 也可被作为修饰位点。因此, 葛根素的结构改造主要集中于上述位点。
2 生物催化化学合成和生物催化是葛根素衍生物的主要合成方式。化学合成大多步骤繁琐, 催化条件苛刻, 产率不佳且环境污染性较强。相比之下, 以生物酶为催化剂的生物转化具有选择性高、作用条件温和等优势, 往往产率较高、环境友好。此外, 日益发展的生物技术大大提高了工具酶的重复利用性和催化效率, 为全新生物酶的创造提供了机会。因此, 生物催化常常被认为是绿色环保且具有可持续发展前景的[13], 将对葛根素衍生物的临床转化提供便捷。到目前为止, 利用微生物细胞和游离酶对葛根素进行的结构修饰已取得较大进展, 越来越多具有高溶解度和高生物活性的衍生物被开发出来, 如酰基化葛根素、糖基化葛根素以及羟基化葛根素(表 1)[14-35]。
| Table 1 A literature survey of enzyme-catalyzed puerarin derivatives synthesis. *When the reaction has more than one product, following activities are corresponding to the compound with* |
酰化修饰可提高黄酮类化合物的亲脂性, 影响黄酮类化合物抵达自由基攻击位置的能力, 并调节其与蛋白质、酶和特定细胞之间的相互作用[36], 进而改善其抗氧化[37, 38]、抗炎[39]等药理活性。脂溶性的提高还可以加快药物渗透细胞的速度, 使其在较短的时间内发挥药效。同时, 酯基的缓慢水解也可以延长药物释放时间, 维持血药浓度, 弥补体内半衰期短的缺点。
酰化修饰对葛根素原药性质产生一定的影响。通过化学手段已获得四乙酰、五乙酰、六乙酰葛根素酯, 它们的口服生物利用度分别为葛根素的2.24、1.67和1.15倍[40]。其中四乙酰葛根素展示出较好的抗氧化生物活性, 对治疗类风湿性关节炎具有潜在的应用价值[41]。数据表明, 随着乙酰基修饰数量的升高, 酰基化葛根素的生物利用度反而降低。由此推测, 葛根素的生物利用度可能与乙酰基数量呈负相关或抛物线型关系。因此, 有必要进一步探究乙酰化修饰对其口服生物利用度的影响, 寻找最佳修饰位点和数量。由于位点专一性差, 化学合成一般产生多位点酰基化的葛根素。而酶法合成具有位点特异性, 能选择性地形成单乙酰化的葛根素。因此, 基于酶法合成的生物催化被广泛用于葛根素的单位点酰基化, 其修饰位点主要集中在葡萄糖基的6''位醇羟基上。
2.1.1 脂肪酸酰化黄酮糖苷的酶促酰化可通过两种方式实现, 一种是以脂肪酸为酰基供体的直接酯化反应, 另一种是以脂肪酸酯为酰基供体的转酯作用[42]。酰基化葛根素大多是通过脂肪酶介导的转酯作用合成的。
在非水相条件下, 脂肪酶凭借高度耐受有机溶剂的性质被广泛用于酯化、转酯、酯交换等催化反应中。脂肪酶B (Candida antarctica lipase B)是一种没有界面接触效应的脂肪酶, 能够在单相溶媒介质中高效反应[43], 可以通过商业途径获取(商品名为Novozym 435)。该酶已被用于黄酮、甾体、三萜皂苷[44-46]等多种天然产物的酰化, 当底物为葛根素时, 可产生多种脂肪链长度不一的葛根素酯。
2005年, Teng等[14]以醋酸乙烯酯、癸酸乙烯酯及肉桂酸乙烯酯为酰基供体, 利用固定化脂肪酶Novozym 435实现了葛根素的酰化, 得到相应产物葛根素-6''-O-乙酸酯、葛根素-6''-O-癸酸酯以及葛根素-6''-O-肉桂酸酯。这是关于单位点葛根素脂肪酸衍生物的首次报道。
进一步的研究表明, Novozym 435具有更广泛的供体宽泛性, 供体脂肪酸链长最高可达14个碳原子, 至少能产生8种不同的酰化产物(图 2)[15]。Novozym 435对短链酰基供体(C2~C6)的转化率均可达95%以上。随着酰基供体链长的增加, 其转化效率总体上呈明显下降趋势。此外, 固定化脂肪酶Lipozyme IMTL和Lipozyme IMRM对丙酰化葛根素的转化效率也可达98%以上, 仅略低于相同催化条件下的Novozym 435 (99.5%)[16]。
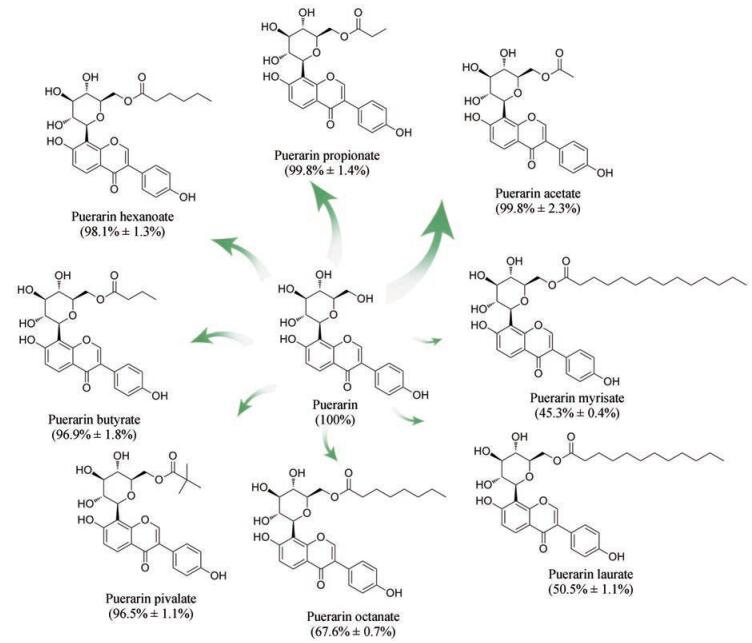
|
Figure 2 Novozym 435-mediated acylation of puerarin with different acyl donors. Acyl donors including: vinyl acetate (C2), vinyl propanoate (C3), vinyl butyrate (C4), vinyl pivalate (C5), vinyl hexanoate (C6), vinyl octanate (C8), vinyl laurate (C12), vinyl myrisate (C14) |
除了固定化形式, 含脂肪酶的全细胞也常用于葛根素的酰化。全细胞催化剂廉价、易得, 能够简化纯酶制备的步骤并降低催化成本。反应过程中, 细胞对酶的天然保护作用降低了其对pH、反应介质等外界环境的敏感程度, 且生物酶对菌体自身辅因子的利用也可大大提升全细胞转化效率[47]。因此, 越来越多可用于葛根素酰基化的生物催化剂被筛选获得。
Li等[17]对一系列高产脂肪酶的菌株进行比较, 发现米曲霉(Aspergillus oryzae GIM 3.4826)具有较高的催化活力。在四氢呋喃(THF)反应溶剂中, 全细胞形式的米曲霉即便被重复利用了3次, 对葛根素丙酸酯(puerarin propionate)的转化率仍保持在80%以上(图 3)。以不同链长的脂肪酸酯为酰基供体, 同样得到了一系列葛根素葡萄糖基6''位取代的脂肪酸衍生物, 产物的区域选择性大于98%。用2-甲基四氢呋喃(2-Me-THF)代替THF, 其转化效率和区域选择性仅略微降低, 该绿色溶剂的使用大大降低了脂肪酶催化过程中的污染风险。进一步的研究表明, 葛根素酯的脂溶性随着酰基供体的链长增长、分子量增大而逐渐增强, 但抗氧化活性有所下降。考虑到高效、无毒、可降解、可放大、可重复使用的反应特性, 该全细胞生物催化法是一种很有前途的转化策略, 有望达到工业化目的。
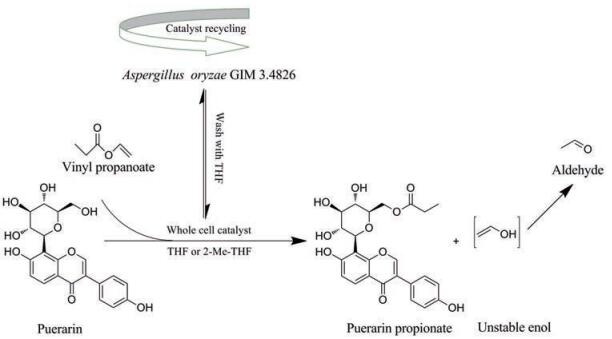
|
Figure 3 The whole-cell catalyzed transesterification of puerarin with vinyl propanoate. THF: Tetrahydrofuran; 2-Me-THF: 2-Methyl tetrahydrofuran |
此外, Ding等[18]从丝状真菌、放线菌、细菌等多种微生物中, 筛选到一株具有酰化功能的红球菌(Rhodococcus sp. AS 4.1147)。它也能将葛根素转化为葛根素-6''-O-乙酸酯(puerarin-6''-O-acetate) (图 4a), 转化效率为22.2%。

|
Figure 4 The whole-cell mediated C6" esterification of puerarin. a: Biotransformation of puerarin to puerarin-6''-O-acetate by Rhodococcus sp. AS 4.1147; b: Biotransformation of puerarin to puerarin-6''-O-phosphate by Bacillus cereus NT02 |
引入磷酸基团可改变分子极性和分子间键合特性。在制药工业中, 磷酸酯是常见的前药形式之一, 可增加药物的水溶性和生物利用度[48]。这种前药设计的优势主要在于, 经人体内磷酸酯酶的水解作用, 前药可被迅速降解为原药而发挥药效, 且由于个体差异而导致的人体药代动力学不佳的现象较为少见。化学合成已证明, 对葛根素母核上7、4'位羟基分别进行单磷酸化与双磷酸化[49], 将极大提高葛根素对肿瘤细胞生长的抑制活性[50], 这对其他位点修饰的葛根素磷酸酯具有一定的借鉴意义。
2012年, Yu等[19]从葛根生长的土壤中, 分离得到一株蜡样芽胞杆菌(Bacillus cereus NT02)。该菌株的静息细胞可将葛根素转化为葛根素-6''-O-磷酸酯(puerarin-6''-O-phosphate) (图 4b), 其清除自由基能力和水溶性分别提升至原来的25倍和85.4倍。在葛根素初始浓度为0.4 g·L-1的磷酸盐缓冲液中, 该反应的终转化率为27%。
2.2 糖基化-提高水溶性改善黄酮类化合物理化性质的方法之一是使其与糖分子结合, 形成相应的糖苷[51, 52]。糖基化对苷元的溶解度、稳定性和生物活性均产生影响。葛根素的糖基化可降低原药在不同位置的分子平面度, 从而增加水溶性。目前, 生物催化介导的葛根素糖基化主要发生在葡萄糖基C6''、C3''、C4''位醇羟基以及大豆苷元C7位活泼酚羟基上, 其修饰基团具有多样性特点, 包括葡萄糖、麦芽糖、异麦芽糖、果糖及多聚果糖等。
2.2.1 修饰位点的多样化葡萄糖基6''位羟基是葛根素易修饰位点之一, 在体外酶促反应中, 已产生多个葛根素6''位糖基化衍生物。2004年, Li等[20]发现来源于嗜热脂肪芽孢杆菌(Bacillus stearothermophilus)的麦芽糖淀粉酶(BSMA)和芽孢杆菌属(Bacillus sp.)的环糊精葡聚糖转移酶(BSCGTase)均具有糖基化葛根素的功能, 这是关于体外酶法合成葛根素糖苷的首次报道。相比之下, BSCGTase催化形成的糖苷产物水溶性较差, 因此并未对该反应进行后续研究。BSMA可对葛根素的6''位羟基进行单糖和双糖修饰, 得到终产物α-D-葡萄糖-(1→6)-葛根素(α-D-glucosyl-(1→6)-puerarin) (图 5 a-P1)和α-D-麦芽糖-(1→6)-葛根素(α-D-maltosyl-(1→6)-puerarin) (图 5 a-P2), 它们的水溶性分别是葛根素的14倍和168倍。但这两种糖苷是否保留葛根素的生物活性尚不清楚。进而, Chung等[53]根据异黄酮染料木苷(genistin)及其糖苷的抗氧化机制研究结果, 推测葛根素及其糖苷也能够上调抗氧化基因并影响胆固醇代谢途径中关键基因的表达。在此设想上, 他们将上述两种水溶性葛根素糖苷等摩尔混合, 研究其对HepG2细胞和C57 BL/6J小鼠的药理作用[22], 实验结果证实了上述猜想。这种生物活性可能是通过多种机制共同作用的, 包括增加低密度脂蛋白的摄取、减少胆固醇的生物合成、促进胆固醇的降解。此外, 在体内外毒理学实验中, 该糖基化衍生物未表现出明显的毒性, 且对药物致突变性具有保护作用(降低41%)[23]。
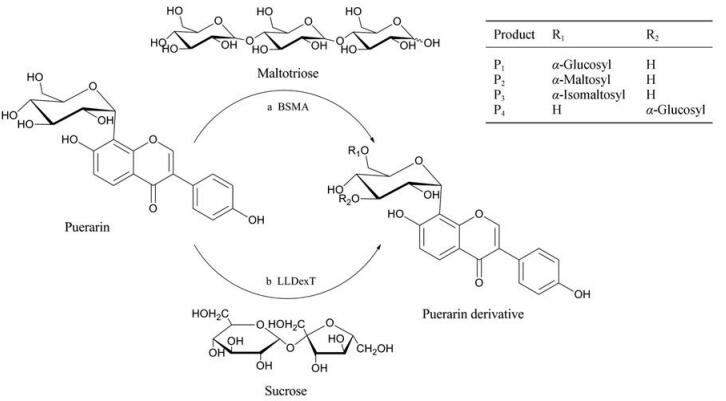
|
Figure 5 Enzyme-catalyzed C6" and C3" glycosylation of puerarin. a: BSMA-catalyzed puerarin derivatives containing α-D-glucosyl-(1→6)-puerarin (P1), α-D-maltosyl-(1→6)-puerarin (P2), α-D-glucosyl-(1→3)-puerarin (P4); b: LLDexT-catalyzed puerarin derivatives containing α-D-glucosyl-(1→6)-puerarin (P1), α-D-isomaltosyl-(1→6)-puerarin (P3) |
另外, Ko等[24]分别测试了来源于明串珠菌属(Leuconostoc)和链球菌属(Streptococcus)的葡聚糖蔗糖酶(DexT), 其中乳明串珠菌(Leuconostoc lactis EG001)中的葡聚糖蔗糖酶(LLDexT)展现出最优的转化性能。除6''位葡萄糖衍生物, LLDexT还能催化产生α-D-异麦芽糖-(1→6)-葛根素(α-D-isomaltosyl-(1→6)-puerarin) (图 5 b-P3), 展示了较强的葛根素6''位糖基修饰能力。糖分子结构的不同导致葛根素糖苷的水溶性产生较大的差异, 葛根素6''位异麦芽糖苷的水溶性可达原药的202倍, 而6''位羟基被葡萄糖取代的葛根素衍生物的水溶性仅增长了15倍, 这为糖残基数量可能决定原药水溶性的观点提供了一定的依据。
葛根素的3''位羟基也是糖基化修饰位点之一。除了大肠杆菌(Escherichia coli K-12)以外, 枯草芽孢杆菌(Bacillus subtilis)、黑曲霉(Aspergillus niger)等也被广泛用作生产食品级生物酶的宿主细胞[54]。Choi等[21]以枯草芽孢杆菌为表达宿主, 利用枯草芽孢杆菌(B. subtilis NA64) α-淀粉酶(amyR2)的内源启动子进行诱导表达, 从单位体积发酵液中获得了更多BSMA纯酶。体外转糖反应中, 除了6''位葡萄糖、麦芽糖葛根素衍生物, 还能产生少量的3''位葛根素葡萄糖苷(α-D-glucosyl-(1→3)-puerarin) (图 5 a-P4)。以BSMA粗酶为催化剂, 当糖基供体为麦芽糖糊精时, 底物与糖苷产物的相对转化率之比为, 葛根素: α-D-麦芽糖-(1→6)-葛根素: α-D-葡萄糖-(1→6)-葛根素: α-D-葡萄糖-(1→3)-葛根素约等于49:26:18:7。采用包括凝胶渗透色谱法在内的两步法对产物进行纯化, 3 g葛根素可得到1.7 g转化产物, 净回收率约为36%, 其中葡萄糖苷转化产物与麦芽糖苷转化产物的比例接近1:1。
同样的, 葛根素4''位也可被糖基化修饰。2008年, Huang等[28]将葛根素与三甘露糖乙酰氨基葡萄糖噁唑啉按1:2的比例混合于磷酸盐缓冲液中, 利用原玻璃蝇节杆菌(Arthrobactor protophormiae)中的endo-β-N-乙酰氨基葡糖苷酶(Endo-A)向葛根素4''羟基上引入了四聚糖(puerarin GlcNAc-derivative) (图 6 a), 转化率约为60%。人体内N-糖蛋白可以作为凝集素, 靶向细胞表面的特异性受体, 参与许多重要的生物学过程[55]。因此, N-聚糖的引入除了提高溶解度, 也可能实现葛根素对特定细胞的靶向作用, 从而改善其药理性质。
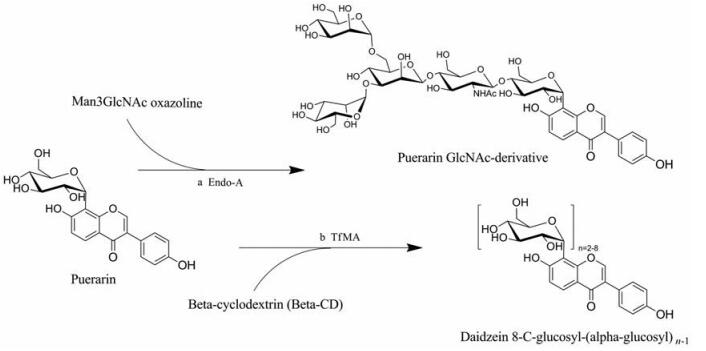
|
Figure 6 Emzyme-assisted C4" glycosylation of puerarin. a: Endo-A-catalyzed bioformation from puerar into puerarin GlcNAc-derivative; b: TfMA-catalyzed bioformation from puerar into puerarin glucosides (n = 2-8) |
与上述典型的细菌α-糖基转移酶不同的是, 来源于古细菌下垂热丝菌(Thermofilum pendens)的麦芽糖淀粉酶(TfMA)可在高温下执行催化功能, 且具有粘度低、微生物污染风险小、反应速率高的优势[56]。Li等[29]以β-环糊精为糖基供体, 获得了7种糖链长度不同的葛根素糖苷(daidzein 8-C-glucosyl-(α-glucosyl)n-1) (图 6 b)。通过对还原能力和自由基清除能力的测试, 综合评估了它们的抗氧化能力。尽管葛根素糖基化衍生物的这两项指标均略低于葛根素, 但总体上仍能保持原来的抗氧化活性。
另外, 葛根素糖基化也能发生在大豆苷元C7位的酚羟基上。Jiang等[31]发现, 氧化微杆菌(Microbacterium oxydans CGMCC 1788)的静息细胞能以蔗糖、麦芽糖或麦芽三糖为糖基供体, 对葛根素7位上的酚羟基进行O-糖基化, 并得到两种葛根素糖苷:葛根素-7-O-葡萄糖苷(puerarin-7-O-glucoside)和葛根素-7-O-异麦芽糖苷(puerarin-7-O-isomaltoside) (图 7 a), 其水溶性分别是天然葛根素的18倍和100倍左右。显然, 葛根素上的葡萄糖残基数量很大程度上决定了葛根素衍生物的水溶性。结合Li等[20]和Ko等[24]的研究结果, 可以看出相同的糖残基连接于不同位点对葛根素水溶性的影响也是截然不同的。在体内药代动力学实验中, 上述两种化合物与母体葛根素一样, 具有血管舒张作用。其中葛根素-7-O-葡萄糖苷的血药浓度更高, 平均停留时间更长, 有望成为治疗心血管疾病的新型药物。
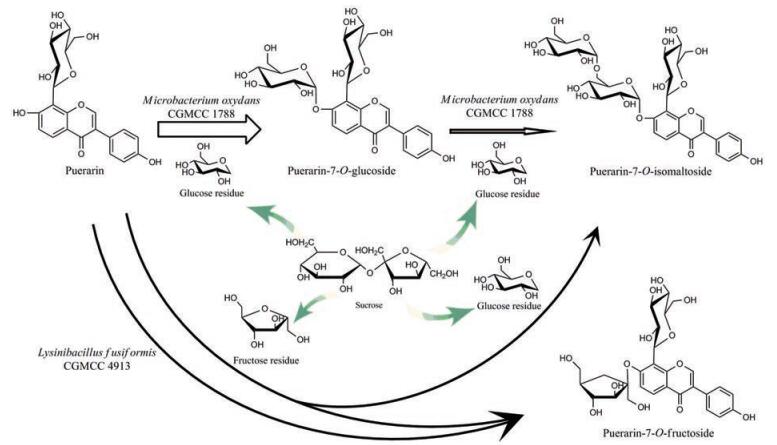
|
Figure 7 The whole-cell catalyzed C7 glycosylation towards puerarin (sucrose as a sugar donor). a: Bioformation of puerarin catalyzed by Microbacterium oxydans CGMCC 1788; b: Bioformation of puerarin catalyzed by Lysinibacillus fusiformis CGMCC 4913 |
上述实验结果对葛根素糖苷衍生物有了进一步的扩充, 为提高糖基化转化效率奠定了基础。
2.2.2 耐有机溶剂生物催化剂的筛选葛根素较低的水溶解性限制了反应效率, 用有机溶剂代替水介质进行酶促反应不仅能够增加葛根素的溶解度, 还能抑制依赖水的不良反应发生。但纯有机溶剂常常使酶失活或抑制微生物生长, 因此, 增强生物催化剂的溶剂耐受性是提高产物转化率的重要手段。迄今为止, 有3种策略可以显著提高工具酶和全细胞的溶剂耐受性: ①筛选能耐受有机溶剂的菌株或酶; ②通过酶工程技术改造现有生物催化剂, 使其具有溶剂耐受性; ③调整催化反应体系, 增加底物溶解性[57]。
Wang等[32]从当地土壤中分离得到一株梭形赖氨酸芽孢杆菌(Lysinibacillus fusiformis CGMCC 4913), 该菌株能催化葛根素形成葛根素-7-O-果糖苷(puerarin-7-O-fructoside) (图 7 b)。其溶解度可达到28.9 g·L-1, 抗氧化活性也有所改善。该反应还能产生少量的葛根素-7-O-异麦芽糖苷(puerarin-7-O-isomaltoside) (图 7 b), 但转化率极低。实验中所尝试的4种糖供体中, 蔗糖催化效果最好, 其次为麦芽糖, 而葡萄糖和果糖则无法被利用。此外, 最重要的是, L. fusiformis CGMCC 4913还可以在有机溶剂中生存。最佳条件下, 加入10%的乙醇后, 葛根素的转化效率提高了2倍, 48 h后可达到(97.6 ± 2.3) %。随后, Liu等[58]深入探索了碳源、氮源、pH对菌株生长和底物转化效率的影响。结果表明, 该菌株在pH = 7的LB培养基中生长状态良好, 对葛根素具有较高的催化活性。菌株培养条件的优化降低了葛根素-7-O-果糖苷生产过程的经济成本, 进一步为其工业化奠定基础。
2013年, Wu等[25]成功从烟节杆菌(Arthrobacter nicotianae XM6)中获得了高度耐受有机溶剂的β-果糖苷酶。该酶在10%~25% DMSO和10%~20%甲醇中仍具有较高的活性和稳定性, 可催化葛根素形成β-D-果糖基-(2→6)-葛根素(monofructosyl puerarin)和β-D-二果糖-(2→6)-葛根素(multifructosyl puerarin (n= 2)) (图 8), 产率最高可达99%。在25% DMSO溶剂体系中, 以110.4 g·L-1葛根素为原料, 可高效合成111.3 g·L-1葛根素单果糖苷和35.6 g·L-1葛根素二聚果糖苷。亲水性有机溶剂不仅提高了转化效率, 还能影响催化产物的比例。随着溶剂浓度的改变, 该反应的主产物由葛根素多聚果糖苷向葛根素单聚果糖苷发生转变。此外, 作为糖苷酶, 催化过程中该β-果糖苷酶几乎不具备水解糖苷产物的功能, 这也是目标化合物得率较高的原因之一。
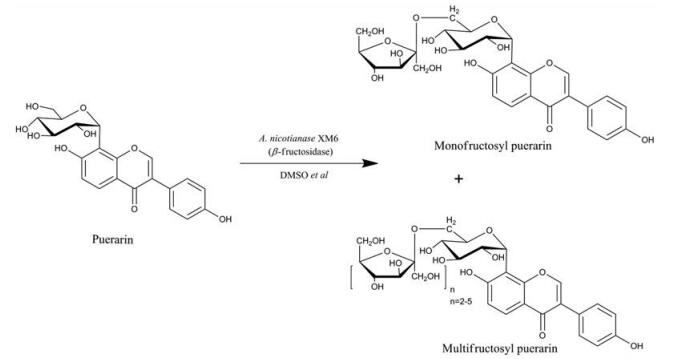
|
Figure 8 Generation of monofructosyl and multifructosyl puerarin via hydrophilic organic solvents tolerated bacterial strain of Arthrobacter nicotianae XM6 |
除上述β-果糖苷酶的体外糖基化之外, 该酶的催化形式和反应环境也被进一步探讨。He等[26]利用A. nicotianae XM6细胞在非水相环境中对葛根素进行生物催化, 如二甲基亚砜、二甲酰胺、乙腈、甲醇、丙酮、乙醇等有机溶剂, 其转化产物的糖基修饰基团最多可达五聚果糖链(multifructosyl puerarin (n = 2~5)) (图 8)。当底物浓度超过100 mg·mL-1时, 该反应的转化率仍然可达到70%。在多项体内外药理学实验中, 葛根素单果糖苷均具有较好的药代动力学行为, 已被证明对急性心肌缺血的潜在治疗作用优于葛根素。此外, 该化合物对乳腺癌细胞MDA-MB-23和人慢粒白血病细胞株K562的增殖也具有明显的抑制作用, 表明其具有潜在的抗肿瘤应用价值。无论是利用A. nicotianae XM6菌株的全细胞催化还是β-果糖苷酶的体外糖基化, 均具有极高的转化效率, 使其在工业化、低成本、大规模的生产过程中占有极大的优势。
此外, 部分可耐受有机溶剂的糖基转移酶已受到专利保护, 该类酶的挖掘和改造将是生物催化的一大热门方向, 为药用天然产物的高效修饰提供一条有效途径。
He等[59]成功获得来源于阿氏节杆菌(Arthrobacter arilaitensis NJEM01)的Fru6葡萄糖苷酶及其突变体, 并将其应用于水相和非水相环境中葛根素糖苷的制备。尽管非水相环境中的葛根素糖苷转化率略低于水相, 但也可达90%以上。
Zhang等[30]发现半乳糖基转移酶可以将UDP-半乳糖上的半乳糖基转移到葛根素糖基的4''位羟基上, 形成α-D-半乳糖-(1→4)-葛根素。其水溶性是葛根素的12倍, 对血管平滑肌的舒张作用也优于葛根素。
2.2.3 其他技术的应用静息状态下, 由于受到化合物溶解度和细胞膜屏障的限制, 微生物全细胞转化往往效率低、反应时间长、副产物多。而粗酶催化虽可促进酶和底物之间的直接互动、缩短反应周期、提高反应效率, 但产物的分离纯化和生物酶的回收又比较困难。因此, 为了提高反应的高效性与简洁性, 还常常需要借助一些外部手段对纯酶或微生物细胞进行前处理, 比如, 促使化合物自由进出细胞的渗透化技术、提高生物酶重复利用性的固定化技术等。
全细胞生物转化常需要借助细胞膜上的主动运输而进行, 但低渗透性会阻碍物质的进出[60]。因此, 为了进一步提高葛根素衍生物的产率, Yu等[61]利用经40%乙醇渗透化处理过的M. oxydans CGMCC 1788细胞对葛根素糖苷进行制备, 尽管该方法并未对转化率产生明显影响, 但反应后却出现了新的产物。经质谱与核磁鉴定, 确证了主产物由原来的葛根素-7-O-葡萄糖苷转变为葛根素-7-O-果糖苷。使用未经渗透化处理过的细胞进行重复催化, 可观察到产物的比例发生变化。因此, 发生该现象的主要原因可能是由于葛根素-7-O-果糖苷极性较大, 在透性化细胞中, 更易从胞内向培养基扩散, 而浓度梯度差同时又正向促进了胞内葛根素-7-O-果糖苷的生成。目前, 已有众多文献报道渗透剂可提高产量, 增强稳定性, 并增加辅因子的供应量[62, 63]。但该实验首次证明了渗透作用可导致反应方向发生改变, 产生新的化合物, 这一发现使科研人员对细胞渗透化处理有了更深层的认识。
Liu等[64]以DEAE-52纤维素为载体, 固定化吸附了从M. oxydans CGMCC 1788中提取的糖苷酶。相比于含有相同酶量的细菌细胞, 葛根素在固定化酶的作用下, 糖苷的摩尔转化率可达53.3%, 成功提高至24倍以上。经10次重复使用后, 固定化葛根素糖苷酶的活性依旧保持在初始的88%。
葛根素糖基化产物的结构大多具有相似性, 使得目标产物的分离相对困难。因此, 加强分离手段也是提高得率的一大关键环节。由于利用普通的AB-8大孔树脂色谱柱无法从反应混合物中直接分离得到葛根素-7-O-葡萄糖苷, 因此一种超长双柱色谱系统被建立[65]。在普通色谱柱外加入超弹性加固型PVC柱后, 通过增加理论塔板数来提高色谱分离效率, 葛根素-7-O-葡萄糖苷的回收率可高达88.1%。此外, Wu等[66]还建立了快速逆流色谱方法(HSCCC法), 为葛根素苷类化合物的有效分离提供了新途径。针对A. nicotianae XM6体外催化所获得的葛根素糖苷混合物, 在正丁醇-乙酸-水相分离体系中, 鉴定出的产物除了已报道的单果糖苷和双果糖苷衍生物[25], 还有葛根素三果糖苷和四果糖苷, 分离纯度均在97%以上。新产物的发现也进一步补充了β-果糖苷酶的催化功能。
包合物形式对药物分子的溶解度、溶出度等方面具有重要影响。环糊精以其独特的首尾连接方式, 形成了内疏水、外亲水的分子结构, 这将有利于对尺寸合适的客分子执行包合作用。来源于水管致黑栖热菌(Thermus scotoductus)的4-α-葡聚糖转移酶(TSαGT)已被证实可将染料木苷的糖基化衍生物转化为相应的包合物[67], 但不能直接识别葛根素[20]。他们推测TSαGT对C-糖苷键可能缺乏敏感度, 但能特异性识别异黄酮苷的O-糖苷键。进一步的实验结果证实了上述推测。以直链淀粉为糖基供体, 在BSMA和TSαGT的连续催化下, 可获得葛根素-环糊精包合物。对其连续催化机制进行深入研究, 发现BSMA的产物中, α-D-麦芽糖-(1→6)-葛根素可作为TSαGT的底物被进一步延长和环化, 而α-D-葡萄糖-(1→6)-葛根素则不被利用。结合对染料木苷包合物的结构分析, TSαGT所识别的异黄酮苷底物中均含有以O-糖苷键相连的麦芽糖残基, 该结构特征可是TSαGT催化包合物形成的必要条件。环糊精包埋的葛根素与糖基化葛根素一样, 在提高水溶性和冷藏稳定性方面具有广泛的应用价值, 可被肠道内多种具有糖基水解活性的酶消化, 其生物利用度可能与糖基化葛根素保持一致[27]。
糖基化修饰极大地增强了葛根素水溶性是毋庸置疑的, 然而目前发现的生物酶与菌株均通过取代羟基形成O-糖苷键。这使得药物分子中的羟基数量减少, 可能会导致葛根素衍生物抗氧化活性的下降。据报道, 7位羟基被氧糖苷取代将极大影响黄酮类化合物的抗氧化活性, 初步实验也已证明葛根素7-O-葡萄糖苷的抗氧化活性较葛根素有所下降[68]。其原因可能是由于糖基取代基的立体效应会阻止药物抗氧化基团与自由基之间的充分接触, 使得活性自由基的反应加剧[69, 70]。糖基取代类型及修饰位点的不同均将对药物分子产生巨大的影响, 因此研究人员应该理性分析葛根素糖苷的理化性质。
2.3 羟基化-增强抗氧化活性自由基和活性氧与体内众多疾病的发生息息相关, 包括癌症、动脉粥样硬化、膜损伤等。黄酮类化合物因具有良好的清除超氧阴离子、羟基自由基和过氧自由基能力而被广泛研究。近年来, 在食品添加剂和抗氧化剂研究领域中, 为了提高黄酮类化合物的抗氧化活性, 越来越多的研究者通过微生物手段对其进行羟基化修饰。从结构入手, 黄酮母核上的2, 3-双键与4位羰基所形成的共轭体系极大影响着黄酮类化合物的抗氧化活性。同时, 许多研究人员指出, A环和B环上的羟基数量也与黄酮类化合物抗氧化活性关系密切[71, 72]。在众多具有高抗氧化活性的酚类化合物中, 邻二羟基是它们最重要的活性结构特征, 其他结构在增强或降低活性方面只起到修正作用[73]。目前, 已发现葛根中的天然有效成分——3'-羟基葛根素能够清除脂质过氧化过程中的自由基, 其B环中的3'位和4'位羟基可以构成邻苯二酚结构, 可能在抗氧化活性中起到了重要作用[74]。
研究发现, 一系列丝状真菌可对葛根素进行羟基化修饰, 其中哈茨木霉(Trichoderma harzianum CGMCC 1523)[33]、粘帚霉NT-01 (Gliocladium sp.)[34]、融粘帚霉菌(Glioclodium deliguescens AS3.3987) [35]均能将葛根素转化为3'-羟基葛根素(3'-hydroxypuerarin) (图 9)。在葛根素浓度为0.6 g·L-1的最佳条件下, T. harzianum CGMCC 1523静息菌丝对葛根素的转化率约为41%。经DPPH自由基清除体系测定, 3'-羟基葛根素的活性是葛根素的20倍, 溶解度也提高至原药的1.3倍。
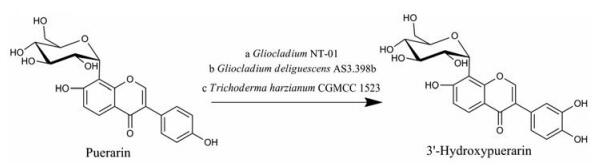
|
Figure 9 C3' hydroxylation of puerarin catalyzed by Gliocladium NT-01 (a), Glioclodium deliguescens AS3.3987 (b) or Trichoderma harzianum CGMCCI523 (c) |
除了识别葛根素, T. harzianum CGMCC 1523还能作用于葛根素糖苷的3'位羟基[68], 催化葛根素-7-O-果糖苷(puerarin-7-O-fructoside)形成3'-羟基葛根素-7-O-果糖苷(3'-hydroxypuerarin-7-O-fructoside) (图 10)。然而, 对于葛根素-7-O-葡萄糖苷, T. harzianum CGMCC 1523却先将其水解为葛根素进而生成3'-羟基葛根素。这些结果表明, T. harzianum CGMCC 1523是一个底物谱较宽泛的全细胞催化剂。对上述化合物的自由基清除活性进行检测, 以期探索出原药修饰对其生理活性影响的规律。其中, 3'-羟基葛根素清除自由基的活性比葛根素高约3.9倍, 而3'羟基葛根素-7-O-果糖苷的自由基清除活性比3'-羟基葛根素略低, 但却是葛根素-7-O-果糖苷的2.2倍。此外, 葛根素-7-O-葡萄糖苷的自由基清除活性减弱至原来的1/2, 而葛根素-7-O-果糖苷却增加了约1.5倍。从上述实验结果可以看出, 3'和4'位羟基所形成的邻苯二酚结构的确能够提升葛根素及其糖苷的抗氧化活性, 但葛根素7位羟基的取代仍需要谨慎分析, 以免抑制其自身生物活性。
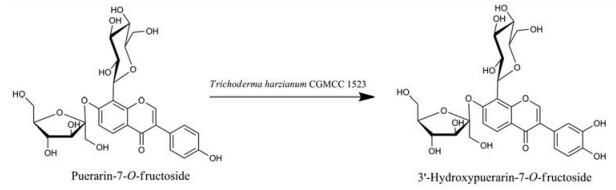
|
Figure 10 The whole-cell mediated C3' hydroxylation towards 3'-hydroxypuerarin-7-O-fructoside |
葛根素药效明确, 药理活性多样, 临床应用广泛, 但较低的溶解性和生物利用度也限制了其药效的发挥。由于天然产物糖苷的复杂结构, 化学全合成遇到了诸多问题。生物催化以其独有的位点专一性、环境友好性解决了化学合成中的难题。以化学合成的葛根素衍生物为参考, 对修饰基团、位点结构与药效之间的关系进行总结, 将对选择性筛选、改造生物酶和催化菌株具有指导性意义。
化学合成葛根素衍生物可以获得修饰基团多样的酯类前药, 如葛根素醋酸酯[40]、磷酸酯[49]、琥珀酸酯[75]、磺酸酯[76]和硝酸酯[77]等。然而, 生物催化修饰葛根素的酯化基团较单一, 主要以不同链长的脂肪酸酯为主, 其供体的丰富性仍有待拓宽。生物催化剂也主要局限于脂肪酶, 脂肪酶在非水相介质中主要以脂肪酸酯为供体, 反应常伴随着副产物乙醛的产生。因此, 这种方法存在污染环境的风险, 需要额外考虑废气转化、循环利用等方面的问题。针对葛根素酰化现状, 清洁酰基供体的寻找、具有酯化功能的生物酶与菌株的挖掘均是值得探索的方向。
葛根素的糖基化不仅筛选出多种生物催化剂, 还着眼于探索糖基供体的多样化、催化剂的溶剂耐受性、工具酶的高效利用和检测手段的优化。葛根素糖基化衍生物的水溶性和抗氧化活性等生理活性受到较多关注, 但关于体内代谢的深入探讨较少。研究表明黄酮糖苷中的糖分子类型影响它们的吸收和分布, 并在一定程度上影响它们的代谢[78, 79]。因此在对葛根素衍生物进行活性检测同时, 也应关注不同葛根素糖苷衍生物的体内药代动力学特征。
葛根素羟基化数量、位点与抗氧化活性具有极大关联。天然活性成分3'-羟基葛根素的活性筛选为生物催化提供了目标产物, 已被证实抗氧化活性较葛根素明显提高, 但含量较低。生物催化为该天然产物的合成提供新途径。
以葛根素为出发点, 纵观以染料木苷元、大豆苷元、黄豆苷元及其苷类为代表的整个异黄酮家族, “植物雌激素”已成为其生物活性的重要标志。异黄酮一直被认为是黄酮类化合物中的一个独特分支, 其结构特性决定了自身溶解度低、生物利用度差的特性。吸电子基团的存在、酚羟基的低亲核性使得异黄酮很难通过化学方法进行结构修饰, 生物催化在异黄酮衍生物的合成中具有独特的优势。目前, 生物法介导的糖基化仍是改善异黄酮溶解度的最主要的手段。此外, 与葛根素的酰化修饰相同, 来源于南极假丝酵母的脂肪酶也是黄酮类化合物最常用的酰化修饰酶。但是这种脂肪酶需要以糖基化的黄酮作为底物, 而另一种来源于洋葱假单胞菌(Pseudomonas cepacea)的脂肪酶(PCL)可同时酰化黄酮化合物的苷元和糖基基团。如若能够寻找到与PCL具有类似功能的酶, 并将其应用至异黄酮的酰化修饰, 可弥补生物催化异黄酮苷元酰化修饰的空白。此外, 通过生物转化对异黄酮进行的羟基化、水解等, 也有助于获得一系列新的分子探针和药物先导物。目前, 大多数关于异黄酮的生物催化研究仍处于较浅的层次, 缺乏相关的体内活性数据, 其转化机制、催化规律也尚待研究。纵观全局, 绝大多数的研究仍处于实验室水平, 缺乏工业化报道。因此, 需针对上述问题进行有目的地探索, 从而促进生物技术在异黄酮结构修饰中的应用。
酶法介导的葛根素衍生物的合成主要通过全细胞的方式进行, 具体起催化作用的工具酶的纯化仍是一个需要深入探索的方向。纯酶的结构鉴定和定向进化可提高工具酶的催化效率, 为生物催化葛根素衍生物的合成奠定基础。
此外, 对已知的葛根素修饰工具酶的催化机制进行深入研究, 将有利于后续的蛋白改造等工作。与代谢工程、合成生物学技术相结合, 借助葛根中发现的C-糖基转移酶[80], 将有望构建一条葛根素衍生物从头合成途径。
目前葛根素的生物催化相关报道还是较少, 主要是由于葛根素的水溶性低限制了转化产率的提高。而近年来, 细胞渗透技术、非水相酶催化技术、代谢工程技术的发展, 将为葛根素衍生物的研究提供新的途径。此外, 无论是化学法还是生物法, 大多属于非理性设计, 目前仍主要以葛根素衍生物的药理学及其药效学为导向, 尚未报道明确的构效关系。随着药物信息学的发展, 在计算机技术的辅助设计下, 相信葛根素的修饰研究将更加合理、快捷。
| [1] |
Shibata S, Murakami T, Nishikawa Y, et al. The constituents of pueraria root[J]. Chem Pharm Bull, 1959, 7: 134-136. DOI:10.1248/cpb.7.134 |
| [2] |
Gao Z, Wei B, Qian C. Puerarin injection for treatment of unstable angina pectoris:a meta-analysis and systematic review[J]. Int J Clin Exp Med, 2015, 8: 14577-14594. |
| [3] |
Luo ZK, Liu Y, Li HM. A clinical efficacy and safety study on coronary heart disease and angina treatment with puerarin injection[J]. Chin J Epidemiol (中华流行病学杂志), 2012, 33: 614-616. |
| [4] |
Liu JM, Ma L, He WP. Therapeutic effect of puerarin therapy on sudden deafness[J]. Acad J First Med Coll PLA (第一军医大学学报), 2002, 22: 1044-1045. |
| [5] |
Chen X, Yu J, Shi J. Management of diabetes mellitus with puerarin, a natural isoflavone from Pueraria lobata[J]. Am J Chin Med, 2018, 46: 1771-1789. DOI:10.1142/S0192415X18500891 |
| [6] |
Zhang H, Liu Y, Lao M, et al. Puerarin protects Alzheimer's disease neuronal cybrids from oxidant-stress induced apoptosis by inhibiting pro-death signaling pathways[J]. Exp Gerontol, 2011, 46: 30-37. |
| [7] |
Zhao M, Du YQ, Yuan L, et al. Protective effect of puerarin on acute alcoholic liver injury[J]. Am J Chin Med, 2010, 38: 241-249. DOI:10.1142/S0192415X10007816 |
| [8] |
Xu TY, Du BX. Analysis of 169 cases of adverse reactions induced by puerarin injection[J]. Pract Pharm Clin Rem (实用药物与临床), 2007, 10: 230-231. |
| [9] |
Lv YQ, Tan TW. Modeling and prediction of the mixed-mode retention mechanisms for puerarin and its analogues on n-octylamine modified poly (glycidyl methacrylate-co-ethylene glycol dimethacrylate) monoliths[J]. Process Biochem, 2009, 44: 1225-1230. DOI:10.1016/j.procbio.2009.06.021 |
| [10] |
Hou SZ, Li G, Liang YM, et al. Experimental study on in-vitro hemolytic effect of puerarin injection[J]. Tradit Chin Drug Res Clin Pharmacol (中药新药与临床药理), 2011, 22: 289-291. |
| [11] |
Li XY, Zhang MF, Zhao Y, et al. Comparison of pharmacokinetics between different doses of puerarin in rats[J]. J China Med Univ (中国医科大学学报), 2009, 38: 885-887. |
| [12] |
Wu J, Gao X, Zhang Y, et al. Progress in structural modification of puerarin[J]. Chin J Pharmacov (中国药物警戒), 2011, 8: 741-743. |
| [13] |
Xu P, Hua DL, Ma CQ. Microbial transformation of propenylbenzenes for natural flavour production[J]. Trends Biotechnol, 2007, 25: 571-576. DOI:10.1016/j.tibtech.2007.08.011 |
| [14] |
Teng RW, Bui TKA, McManus D, et al. Regioselective acylation of several polyhydroxylated natural compounds by Candida antarctica lipase B[J]. Biocatal Biotransform, 2005, 23: 109-116. DOI:10.1080/1024220500132508 |
| [15] |
Yuan TT. Biocatalytic Synthesis and Physiological Activities of Puerarin Esters (生物催化葛根素脂肪酸酯合成及其生理活性研究)[D]. Guangzhou: South China University of Technology, 2018.
|
| [16] |
Yuan TT, Li XT, Yuan K. Enzymatic preparation of puerarin ester derivatives[J]. Mod Food Sci Technol (现代食品科技), 2018, 34: 116-122. |
| [17] |
Li XT, Yuan TT, Xu HX, et al. Whole-cell catalytic synthesis of puerarin monoesters and analysis of their antioxidant activities[J]. J Agric Food Chem, 2018, 67: 299-307. |
| [18] |
Ding YG, Zhang DW, Liu SM, et al. Selective acetylation of puerarin by Rhodococcus sp.[J]. J Chin Pharm Sci, 2012, 21: 269-272. |
| [19] |
Yu LJ, Gao F, Yang LP, et al. Biotransformation of puerarin into puerarin-6″-O-phosphate by Bacillus cereus[J]. J Ind Microbiol Biotechnol, 2012, 39: 299-305. DOI:10.1007/s10295-011-1031-7 |
| [20] |
Li D, Park SH, Shim JH, et al. In vitro enzymatic modification of puerarin to puerarin glycosides by maltogenic amylase[J]. Carbohydr Res, 2004, 339: 2789-2797. DOI:10.1016/j.carres.2004.09.017 |
| [21] |
Choi CH, Kim SH, Jang JH, et al. Enzymatic synthesis of glycosylated puerarin using maltogenic amylase from Bacillus stearothermophilus expressed in Bacillus subtilis[J]. J Sci Food Agric, 2010, 90: 1179-1184. DOI:10.1002/jsfa.3945 |
| [22] |
Chung MJ, Sung NJ, Park CS, et al. Antioxidative and hypocholesterolemic activities of water-soluble puerarin glycosides in HepG2 cells and in C57 BL/6J mice[J]. Eur J Pharmacol, 2008, 578: 159-170. DOI:10.1016/j.ejphar.2007.09.036 |
| [23] |
Chung HJ, Chung MJ, Houng S, et al. Toxicological evaluation of the isoflavone puerarin and its glycosides[J]. Eur Food Res Technol, 2009, 230: 145-153. DOI:10.1007/s00217-009-1156-3 |
| [24] |
Ko J, Ryu YB, Park T, et al. Enzymatic synthesis of puerarin glucosides using Leuconostoc dextransucrase[J]. J Microbiol Biotechnol, 2012, 22: 1224-1229. DOI:10.4014/jmb.1202.02007 |
| [25] |
Wu XM, Chu JL, Wu B, et al. An efficient novel glycosylation of flavonoid by β-fructosidase resistant to hydrophilic organic solvents[J]. Bioresour Technol, 2013, 129: 659-662. DOI:10.1016/j.biortech.2012.12.041 |
| [26] |
He BF, Wu XM, Chu JL, et al. Fructose glycosylation puerarin, preparation method and application thereof: CN, 201110119350.6[P]. 2012-05-09.
|
| [27] |
Choi CH, Kim JW, Park CS, et al. Enzymatic biosynthesis of a puerarin-cycloamylose inclusion complex by 4-α-glucanotransferase and maltogenic amylase[J]. Biocatal Biotransform, 2010, 28: 209-214. DOI:10.3109/10242421003754538 |
| [28] |
Huang W, Ochiai H, Zhang X, et al. Introducing N-glycans into natural products through a chemoenzymatic approach[J]. Carbohydr Res, 2008, 343: 2903-2913. DOI:10.1016/j.carres.2008.08.033 |
| [29] |
Li X, Li D, Park SH, et al. Identification and antioxidative properties of transglycosylated puerarins synthesised by an archaeal maltogenic amylase[J]. Food Chem, 2011, 124: 603-608. DOI:10.1016/j.foodchem.2010.06.082 |
| [30] |
Zhang LW, Ma XF, Wang P. Method for modifying flavonoid glycoside compounds with galactosy transferase: CN, 200910068855.7[P]. 2009-11-11.
|
| [31] |
Jiang JR, Yuan S, Ding JF, et al. Conversion of puerarin into its 7-O-glycoside derivatives by Microbacterium oxydans (CGMCC 1788) to improve its water solubility and pharmacokinetic properties[J]. Appl Microbiol Biotechnol, 2008, 81: 647-657. DOI:10.1007/s00253-008-1683-z |
| [32] |
Wang SY, Liu GY, Zhang W, et al. Efficient glycosylation of puerarin by an organic solvent-tolerant strain of Lysinibacillus fusiformis[J]. Enzyme Microb Tech, 2014, 57: 42-47. DOI:10.1016/j.enzmictec.2014.01.009 |
| [33] |
Ye H, Yuan S, Cong XD. Biotransformation of puerarin into 3'-hydroxypuerarin by Trichoderma harzianum NJ01[J]. Enzyme Microb Technol, 2007, 40: 594-597. DOI:10.1016/j.enzmictec.2006.05.016 |
| [34] |
Yang LP, Xu L, Zhu XY, et al. Screening and identification of a fungal strain functioning in hydroxylation of puerarin[J]. Acta Microbiol Sin (微生物学报), 2009, 49: 1571-1575. |
| [35] |
Yang LP, Cui ZC, Gao F, et al. Biotransformation of puerarin into 3'-hydroxypuerarin by Glioclodium deliguescens[J]. Ind Microbiol (工业微生物), 2011, 41: 47-50. |
| [36] |
Katsoura MH, Polydera AC, Tsironis L, et al. Use of ionic liquids as media for the biocatalytic preparation of flavonoid derivatives with antioxidant potency[J]. J Biotechnol, 2006, 123: 491-503. DOI:10.1016/j.jbiotec.2005.12.022 |
| [37] |
Mellou F, Lazari D, Skaltsa H, et al. Biocatalytic preparation of acylated derivatives of flavonoid glycosides enhances their antioxidant and antimicrobial activity[J]. J Biotechnol, 2005, 116: 295-304. DOI:10.1016/j.jbiotec.2004.12.002 |
| [38] |
Lue BM, Nielsen NS, Jacobsen C, et al. Antioxidant properties of modified rutin esters by DPPH, reducing power, iron chelation and human low density lipoprotein assays[J]. Food Chem, 2010, 123: 221-230. DOI:10.1016/j.foodchem.2010.04.009 |
| [39] |
Hoang TK, Huynh TK, Nguyen T. Synthesis, characterization, anti-inflammatory and anti-proliferative activity against MCF-7 cells of O-alkyl and O-acyl flavonoid derivatives[J]. Bioorg Chem, 2015, 63: 45-52. DOI:10.1016/j.bioorg.2015.09.005 |
| [40] |
Zhang Y, Zhang GY, Li YM, et al. Research on synthesis and bioavailability of puerarin acetyl derivatives[J]. Nat Prod Res Dev (天然产物研究与开发), 2010, 22: 73-76. |
| [41] |
Xiao C, Li J, Dong XX, et al. Anti-oxidative and TNF-α suppressive activities of puerarin derivative (4AC) in RAW264.7 cells and collagen-induced arthritic rats[J]. Eur J Pharmacol, 2011, 666: 242-250. DOI:10.1016/j.ejphar.2011.05.061 |
| [42] |
Chebil L, Humeau C, Falcimaigne A, et al. Enzymatic acylation of flavonoids[J]. Process Biochem, 2006, 41: 2237-2251. DOI:10.1016/j.procbio.2006.05.027 |
| [43] |
Davis BG, Boyer V. Biocatalysis and enzymes in organic synthesis[J]. Nat Prod Rep, 2001, 18: 618-640. DOI:10.1039/b003667f |
| [44] |
Teng RW, Ang C, McManus D, et al. Regioselective acylation of ginsenosides by Novozyme 435 to generate molecular diversity[J]. Helv Chim Acta, 2004, 87: 1860-1872. DOI:10.1002/hlca.200490165 |
| [45] |
Yu B, Xing GW, Hui YZ, et al. Lipase-catalyzed regioselective acylation of diosgenyl saponins[J]. Tetrahedron Lett, 2001, 42: 5513-5516. DOI:10.1016/S0040-4039(01)01051-6 |
| [46] |
Kontogianni A, Skouridou V, Sereti V, et al. Lipase-catalyzed esterification of rutin and naringin with fatty acids of medium carbon chain[J]. J Mol Catal B Enzym, 2003, 21: 59-62. DOI:10.1016/S1381-1177(02)00139-X |
| [47] |
Aarthy M, Saravanan P, Gowthaman MK, et al. Enzymatic transesterification for production of biodiesel using yeast lipases:an overview[J]. Chem Eng Res Des, 2014, 92: 1591-1601. |
| [48] |
Jones S, Selitsianos D, Thompson KJ, et al. An improved method for Lewis acid catalyzed phosphoryl transfer with Ti(t-BuO)4[J]. J Org Chem, 2003, 68: 5211-5216. DOI:10.1021/jo034331g |
| [49] |
Yuan JW, Chen XF, Qu LB, et al. A novel conformation investigation on newly synthesized compound of diethyl puerarin-7-yl phosphate[J]. Chin J Struct Chem (结构化学), 2006, 25: 78-84. DOI:10.1360/cjcp2006.19(5).463.6 |
| [50] |
Yuan JW. Study on the Phosphated Structure Modification and Character of Puerarin (葛根素的磷酰化结构改造和性质研究)[D]. Zhengzhou: Zhengzhou University, 2006.
|
| [51] |
Tronina T, Bartmańska A, Milczarek M, et al. Antioxidant and antiproliferative activity of glycosides obtained by biotransformation of xanthohumol[J]. Bioorg Med Chem Lett, 2013, 23: 1957-1960. DOI:10.1016/j.bmcl.2013.02.031 |
| [52] |
Kumar S, Pandey AK. Chemistry and biological activities of flavonoids:an overview[J]. Sci World J, 2013, 2013: 1-16. DOI:10.1155/2013/162750 |
| [53] |
Chung MJ, Kang AY, Lee KM, et al. Water-soluble genistin glycoside isoflavones up-regulate antioxidant metallothionein expression and scavenge free radicals[J]. J Agric Food Chem, 2006, 54: 3819-3826. DOI:10.1021/jf060510y |
| [54] |
Olempska-Beer ZS, Merker RI, Ditto MD, et al. Food-processing enzymes from recombinant microorganisms-a review[J]. Regul Toxicol Pharmacol, 2006, 45: 144-158. DOI:10.1016/j.yrtph.2006.05.001 |
| [55] |
Dube DH, Bertozzi CR. Glycans in cancer and inflammation-potential for therapeutics and diagnostics[J]. Nat Rev Drug Discov, 2005, 4: 477-488. DOI:10.1038/nrd1751 |
| [56] |
Li X, Li D, Yin Y, et al. Characterization of a recombinant amylolytic enzyme of hyperthermophilic archaeon Thermofilum pendens with extremely thermostable maltogenic amylase activity[J]. Appl Microbiol Biotechnol, 2010, 85: 1821-1830. DOI:10.1007/s00253-009-2190-6 |
| [57] |
Stepankova V, Bidmanova S, Koudelakova T, et al. Strategies for stabilization of enzymes in organic solvents[J]. ACS Catal, 2013, 3: 2823-2836. DOI:10.1021/cs400684x |
| [58] |
Liu GY, Wang SY, Yuan S. The impact of carbon, nitrogen source as well as pH value on the growth and biotransformation activity of Lysinibacillus fusiformis CGMCC 4913, an organic solvent-tolerant glycosylation of puerarin producing strain organic[J]. J Nanjing Norm Univ, Nat Sci Ed (南京师大学报自然科学版), 2016, 39: 61-65. |
| [59] |
He BF, Wang R, Wu XM, et al. Organic solvent-tolerant glycosidase Fru6, its mutant and its applications: CN, 201210185733.8[P]. 2012-06-06.
|
| [60] |
van der Werf MJ, van den Tweel WJ, Hartmans S. Screening for microorganisms producing D-malate from maleate[J]. Appl Environ Microbiol, 1992, 58: 2854-2860. DOI:10.1128/AEM.58.9.2854-2860.1992 |
| [61] |
Yu CG, Xu HD, Huang GD, et al. Permeabilization of Microbacterium oxylans shifts the conversion of puerarin from puerarin-7-O-glucoside to puerarin-7-O-fructoside[J]. Appl Microbiol Biotechnol, 2010, 86: 863-870. DOI:10.1007/s00253-009-2341-9 |
| [62] |
Ni Y, Reye J, Chen RR. Lpp deletion as a permeabilization method[J]. Biotechnol Bioeng, 2007, 97: 1347-1356. DOI:10.1002/bit.21375 |
| [63] |
Chen RR. Permeability issues in whole-cell bioprocesses and cellular membrane engineering[J]. Appl Microbiol Biotechnol, 2007, 74: 730-738. DOI:10.1007/s00253-006-0811-x |
| [64] |
Liu GY, Sun L, Wu XX, et al. Immobilization of puerarin glycosidase from Microbacterium oxydans CGMCC 1788 increases puerarin transformation efficiency[J]. Braz J Chem Eng, 2014, 31: 325-333. DOI:10.1590/0104-6632.20140312s00002768 |
| [65] |
Zhu SC, Xu HD, Yu CG, et al. Preparation of a super-long two column chromatography system and its application in separating glycosylated puerarin[J]. Biomed Chromatogr, 2009, 23: 1344-1349. DOI:10.1002/bmc.1259 |
| [66] |
Wu XM, Chu JL, Xu TT, et al. Isolation, identification and pharmacokinetic analysis of fructosyl puerarins from enzymatic glycosylation[J]. J Chromatogr B, 2013, 935: 70-74. DOI:10.1016/j.jchromb.2013.07.012 |
| [67] |
Li D, Roh SA, Shim JH, et al. Glycosylation of genistin into soluble inclusion complex form of cyclic glucans by enzymatic modification[J]. J Agric Food Chem, 2005, 53: 6516-6524. DOI:10.1021/jf050732g |
| [68] |
Liu GY, Sun L, Wang SY, et al. Hydroxylation modification and free radical scavenging activity of puerarin-7-O-fructoside[J]. Folia Microbiol, 2011, 56: 305-311. DOI:10.1007/s12223-011-0052-y |
| [69] |
Cholbi MR, Paya M, Alcaraz MJ. Inhibitory effects of phenolic compounds on CCl4-induced microsomal lipid peroxidation[J]. Experientia, 1991, 47: 195-199. |
| [70] |
Mora A, Paya M, Rios JL, et al. Structure-activity relationships of polymethoxyflavones and other flavonoids as inhibitors of non-enzymic lipid peroxidation[J]. Biochem Pharmacol, 1990, 40: 793-797. DOI:10.1016/0006-2952(90)90317-E |
| [71] |
Miyake Y, Minato K, Fukumoto S, et al. New potent antioxidative hydroxyflavanones produced with Aspergillus saitoi from flavanone glycoside in citrus fruit[J]. Biosci Biotechnol Biochem, 2003, 67: 1443-1450. DOI:10.1271/bbb.67.1443 |
| [72] |
Sadeghipour M, Terreux R, Phipps J. Flavonoids and tyrosine nitration:structure-activity relationship correlation with enthalpy of formation[J]. Toxicol In Vitro, 2005, 19: 155-165. DOI:10.1016/j.tiv.2004.06.009 |
| [73] |
Cai YZ, Sun M, Xing J, et al. Structure-radical scavenging activity relationships of phenolic compounds from traditional Chinese medicinal plants[J]. Life Sci, 2006, 78: 2872-2888. DOI:10.1016/j.lfs.2005.11.004 |
| [74] |
Sato T, Kawamoto A, Tamura A, et al. Mechanism of antioxidant action of pueraria glycoside (PG)-1(an isoflavonoid) and mangiferin (a xanthonoid)[J]. Chem Pharm Bull, 1992, 40: 721-724. DOI:10.1248/cpb.40.721 |
| [75] |
Hao Y. Study on Preparation and Physi-chemical Properties of Puerarin Succinate (葛根素琥珀酸酯的制备及相关理化特性研究)[D]. Chongqing: Chongqing University, 2007.
|
| [76] |
Zhang PP. Study on Synthesis and Physi-chemical Properties of Sulfonic Acid Sodium Puerarin (磺酸钠葛根素的合成及其相关理化性质的研究)[D]. Chongqing: Chongqing University, 2007. http://cdmd.cnki.com.cn/article/cdmd-10611-2007180405.htm
|
| [77] |
Liu ZJ, Li MY, He XH, et al. Design and synthesis of NO releasing puerarin derivatives[J]. Chin J Med Chem (中国药物化学杂志), 2008, 18: 335-339. |
| [78] |
Kottra G, Daniel H. Flavonoid glycosides are not transported by the human Na+/glucose transporter when expressed in Xenopus laevis Oocytes, but effectively inhibit electrogenic glucose uptake[J]. J Pharmacol Exp Ther, 2007, 322: 829-835. DOI:10.1124/jpet.107.124040 |
| [79] |
Chang Q, Zuo Z, Chow MSS, et al. Difference in absorption of the two structurally similar flavonoid glycosides, hyperoside and isoquercitrin, in rats[J]. Eur J Pharm Biopharm, 2005, 59: 549-555. |
| [80] |
Wang X, Li CF, Zhou C, et al. Molecular characterization of the C-glucosylation for puerarin biosynthesis in Pueraria lobata[J]. Plant J, 2017, 90: 535-546. DOI:10.1111/tpj.13510 |
 2020, Vol. 55
2020, Vol. 55


