作者贡献:姚晟瑜完成文献分析并撰写手稿, 樊星砚协助查阅文献和准备手稿, 江宽和胡杨参与文章构思和文献筛选, 魏刚、甘勇和陆伟跃拟定文章框架并对文章进行修改润色。
利益冲突:文章内容无利益冲突。
2. 中国科学院上海药物研究所, 上海 201203;
3. 复旦大学中西医结合研究所, 上海 200040;
4. 上海市免疫治疗工程研究中心, 上海 201203
2. Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China;
3. The Institutes of Integrative Medicine of Fudan University, Shanghai 200040, China;
4. Shanghai Engineering Re-search Center of ImmunoTherapeutics, Shanghai 201203, China
糖尿病是一种严重的代谢性疾病, 因患者体内胰岛素分泌不足、胰岛素抵抗或其他原因引起血糖调节功能受损, 临床表现为眼、肾、心脏、血管和神经等组织慢性病变和功能减退, 病情严重时可导致眼病、截肢、心血管疾病、肾功能衰竭、心力衰竭甚至死亡。过去几十年中, 糖尿病的患病率呈上升趋势。国际糖尿病联合会的最新数据表明[1], 全球已有至少4.63亿糖尿病患者, 其中我国糖尿病患者人数最多, 达到1.16亿。2019年, 约有420万患者死于糖尿病或其并发症。据世界卫生组织预测, 到2030年, 糖尿病将成为全球第七大死亡原因。
Ⅰ型糖尿病是以胰岛β细胞破坏为特征的自身免疫性疾病, 表现为胰岛素绝对缺乏, 是糖尿病的主要亚型。胰岛素自1922年由胰腺中提取得到, 目前仍是治疗Ⅰ型糖尿病的主要药物, 需通过皮下注射给药。常规胰岛素皮下注射的作用时长为4~8 h, 需要反复注射, 而且容易产生低血糖、感染发炎和注射部位脂肪堆积等不良反应[2, 3], 同时也存在患者依从性差、难以克服针头恐惧等问题, 更加降低了患者按时用药的积极性。为了降低注射给药频率, 经过氨基酸序列改造的长效胰岛素, 如地特胰岛素和甘精胰岛素, 可维持16~24 h的血糖稳定, 每日只需注射1次。但是大剂量给药伴随着低血糖的风险; 德谷胰岛素作用时间长达42 h, 夜间低血糖发生率显著降低; 胰岛素泵可以实现更加稳定持续的血糖控制, 大大减少低血糖的发生率, 但是这种装置价格昂贵, 需要专业人员指导使用。Ⅱ型糖尿病是因胰岛素分泌相对不足或胰岛素抵抗而造成的血糖代谢紊乱。临床治疗以口服降糖药为主, 包括双胍类、磺脲类、噻唑烷二酮类、苯甲酸衍生物类、α-葡萄糖苷酶抑制剂、胰高血糖素样肽(glucagon-like peptide-1, GLP-1)类似物和二肽基肽酶(dipeptidyl peptidase 4, DDP-4)抑制剂等药物。Ⅱ型糖尿病晚期患者也需要胰岛素控制血糖水平[4]。因此, 胰岛素在糖尿病治疗过程中的作用至关重要。
相比于皮下注射, 非侵入性治疗更容易被患者接受, 但目前胰岛素的非注射途径给药技术大多仍处于研究阶段。鼻腔具有血管丰富的优势, 然而鼻黏膜上的蛋白水解酶及纤毛的快速清除功能可降低鼻腔给药的生物利用度[5]。舌下和口腔中蛋白水解酶含量较低, 但是亲水性药物本身黏膜渗透能力弱, 也易受唾液分泌的影响。鉴于口腔黏膜较厚, 舌下黏膜较薄, 渗透促进剂可以改善胰岛素的舌下吸收[6]。胰岛素颊喷雾剂Oral-lynTM处方中含有表面活性剂, 可在口腔部位被吸收, 已在美国、欧洲、加拿大和厄瓜多尔被批准用于治疗Ⅰ型和Ⅱ型糖尿病, 目前正处于Ⅲ期临床评价[7]。直肠无消化酶, 且经此途径给药可以避免肝脏首过效应, 也是蛋白多肽类药物比较理想的给药部位。除此之外, 胰岛素肺部给药也是研究热点。肺部毛细血管丰富, 有利于肽类吸收。胰岛素相对分子质量小于6 000, 可以穿过肺泡上皮进入全身循环[8]。但是肺部给药剂量不准确, 长期给药也可能造成肺功能损伤。2006年辉瑞公司研发的胰岛素肺部吸入制剂Exubera®因外观笨重, 具有潜在的致癌风险, 上市不到2年即迅速撤市[9]。MannKind公司研发的Afrezza®制剂克服了吸入剂携带不便的问题, 但使用过程中要求患者定期检测肺功能[10], 仍无法替代传统的治疗手段。
口服给药服用方便, 患者依从性高, 是最广泛使用和最容易接受的药物递送方式。但是胃肠道严苛的酶环境和pH环境限制了胰岛素的口服吸收。2019年, 诺和诺德公司研发的索马鲁肽片剂Rybelsus®经FDA批准成功上市, 可用于改善Ⅱ型糖尿病患者的血糖控制。索马鲁肽作为GLP-1的脂溶性衍生物, 在吸收促进剂N-[8-(2-羟基苯甲酰)氨基辛酸钠]的作用下可以实现胃部吸收, 但是其生物利用度也仅有1%[11]。胰岛素作为亲水性的多肽分子, 要实现口服吸收更是困难重重。故本文综述了胃肠道中存在的吸收屏障, 以及克服这些阻碍提高胰岛素口服生物利用度的策略, 并对这些创新技术与材料的安全性及应用前景进行分析, 以探讨胰岛素口服给药的可行性。
1 胰岛素分泌及作用模式肝脏在葡萄糖代谢过程中起主要作用, 具有调节葡萄糖摄取、储存与释放的功能。胰岛素可以直接作用于肝脏。正常生理情况下, 摄入碳水化合物后, 胰岛β细胞分泌胰岛素。胰腺分泌胰岛素的波动很大, 但经过门静脉进入肝脏和体循环后, 胰岛素水平渐趋平稳。约50%门静脉胰岛素被肝脏截留[12]。由于肝脏毛细血管孔隙率高, 门静脉胰岛素可以迅速与肝脏受体结合并产生细胞内信号, 继而刺激肝脏摄取葡萄糖、储存糖原并抑制肝葡萄糖生成(hepatic glucose production, HGP)。
此外, 胰岛素还可以间接作用于脂肪组织、胰腺和大脑。外周胰岛素可以抑制胰高血糖素分泌, 并通过抑制脂肪分解降低循环系统中的游离脂肪酸和甘油水平, 从而降低HGP。该作用可持续1 h, 而门静脉输注胰岛素仅在15 min内发挥作用, 这是因为胰岛素可以迅速经门静脉至肝细胞受体, 却无法在脂肪组织中快速转运, 导致抑制脂肪分解过程及降低胰高血糖素作用延迟。因此, 门静脉胰岛素对肝脏的直接作用在HGP控制中占主导地位, 而且发生在其间接作用影响之前。只有在直接作用存在缺陷的情况下, 间接作用才会成为决定性因素[13]。
2 口服胰岛素生理意义在正常人体内, 肝脏胰岛素浓度比大脑、脂肪或其他组织高2.5~3倍。外周输注胰岛素会人为地改变胰岛素的分布, 导致肝脏胰岛素水平低于动脉, 从而逆转肝脏和外周组织之间的正常胰岛素梯度[14], 如图 1。由此引起的非肝组织过度胰岛素化和肝脏胰岛素化不足可导致代谢功能障碍, 包括胰岛素抵抗、体重增加、体脂分布和脂质代谢的改变等, 也伴随着低血糖的风险[15]。因此, 可以利用肝脏的直接作用来避免代谢功能障碍, 例如设计口服胰岛素或肝靶向胰岛素。肝脏还具有控制胰岛素降解的自我调节机制, 即随着胰岛素浓度的波动而改变胰岛素的代谢率。肝细胞介导99%以上的胰岛素降解, 主要发生在细胞内和细胞膜上。细胞膜上的胰岛素降解系统能够调节可供内化的结合胰岛素比例。故通过口服胰岛素模拟生理条件下胰岛素的分泌过程可以更好地调节外周胰岛素浓度, 减少低血糖发生率[16]。
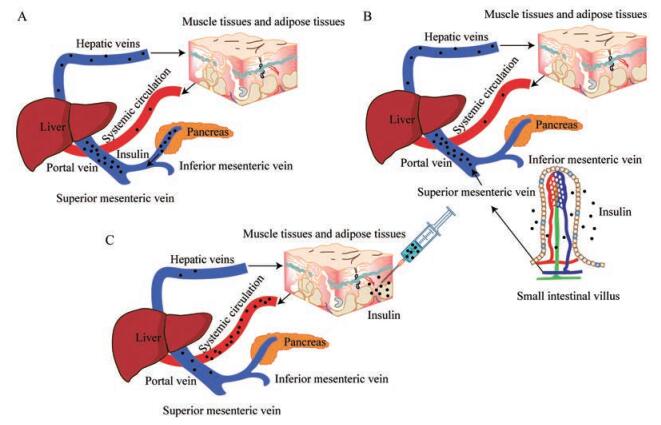
|
Figure 1 Schematic of endogenous insulin secretion (A), absorption of insulin via oral administration (B) and subcutaneous administration(C) |
胃肠道作为消化系统的一部分, 负责将蛋白质、脂肪和糖类等物质消化为结构简单的小分子物质后吸收。为了保证口服有效, 胰岛素在到达全身循环之前, 必须通过胃肠道并保持其完整的结构和构象。但是胃肠道内存在三道阻碍药物吸收的屏障, 即化学屏障、酶屏障和渗透屏障。蛋白多肽类药物分子量大、亲水性强、易被胃肠道酶降解且跨膜转运率低, 因而大多口服生物利用度极低[17]。
3.1 化学屏障胃肠道的pH值变化范围广。禁食状态下, 胃内pH约为1.55, 小肠近端为6.72, 小肠末端为7.5, 盲肠为6.05, 右结肠为5.88, 左结肠为6.12。因此, 弱酸性药物在胃内更容易吸收, 而弱碱性药物更易在小肠吸收。强酸环境下, 大部分蛋白多肽类药物发生质子化或因三级结构被破坏而变性失活。高度质子化的蛋白多肽水溶性大大增强, 更难透过亲脂溶性的上皮细胞膜被吸收。研究表明, 在不同pH值环境中, 颗粒组成成分(如多糖、蛋白质或脂类)的质子化状态发生改变, 会导致纳米粒解离, 从而使生物活性物质产生突释和降解[18]。胃排空时间约为2.5 h。为了防止药物在胃内被提前降解, 制剂表面往往会进行肠溶包衣。常用的肠溶性聚合物包括邻苯二甲酸醋酸纤维素、甲基丙烯酸共聚物(如Eudragit®)和羟丙甲基纤维素邻苯二甲酸酯等[19]。
3.2 酶屏障酶屏障由胃和肠道酶系统组成。胃内含有胃脂肪酶和胃蛋白酶。胃蛋白酶和盐酸可以将蛋白质水解成多肽, 大约能分解食物中10%蛋白质。存在吸收促进剂情况下, 胃也可以是多肽类药物(如索马鲁肽)的良好吸收部位。一般来说, 小肠是药物吸收的主要部位, 主要是因为其吸收表面积大且毛细血管丰富。多肽在肠腔被酶进一步水解成氨基酸。肠腔分泌的蛋白水解酶主要包括胰蛋白酶、α凝乳蛋白酶、胰肽酶E和羧肽酶等。黏膜结合酶包括氨基肽酶、羧肽酶、DDP-4和内肽酶等。小肠中蛋白水解酶活性比其他肠段高, 主要分布于刷状缘。除此之外, 上皮细胞内的胞浆酶也会降解多肽。
为了提高蛋白多肽类药物的口服生物利用度, 制剂中可以添加蛋白酶抑制剂(图 2a), 如抑肽酶、大豆胰蛋白酶抑制剂、甘氨胆酸钠、杆菌肽、卡莫司他、亮肽素和抑氨肽酶素B等。蛋白酶抑制剂可能导致蛋白质消化不良和胰腺肥大。研究表明, 生豆粉中的蛋白酶抑制剂会通过提高胆囊收缩素(胰腺分泌刺激剂)的水平引起胰腺肥大。
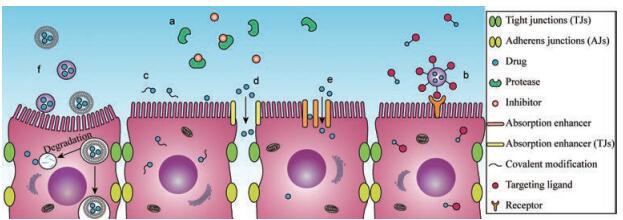
|
Figure 2 Schematic of various strategies for insulin to permeate across the epithelial barrier of gastrointestinal tract. Protease inhibitors (a), receptor-mediated transport (b), structural modification (c), promotion of paracellular pathway transport (d), promotion of transcellular pathway transport (e), drug delivery vehicles (f) |
肠道的渗透屏障包括上皮屏障和黏膜屏障。肠道细胞大致可以分为4类:上皮细胞、杯状细胞、潘氏细胞和M细胞。上皮细胞数量最多, 负责吸收营养物质。肠上皮由单层柱状上皮细胞构成, 相邻细胞顶端有连接复合体, 包括紧密连接(tight junctions, TJs)和黏着连接(adherens junctions, AJs)[20]。其中TJs由紧密连接蛋白和闭锁蛋白等组成, 仅限小于15 Å (约相当于相对分子质量3 500)的亲水性小分子通过[21]。杯状细胞数量第二丰富, 可以产生黏液, 构成黏膜屏障。黏液降低了药物的扩散能力, 不利于其进入上皮细胞。由于黏蛋白带负电, 亲水性和近电中性的粒子更易穿透黏液屏障, 而带正电的粒子更容易被黏液捕获。由于带正电、疏水性药物更易与带负电的上皮细胞作用。这两种屏障对药物和粒子的理化性质要求互相矛盾, 增大了药物递送的难度。潘氏细胞数量较少, 可以分泌抗菌肽杀灭细菌。M细胞摄取抗原和微生物后, 将其呈递给黏膜中的免疫系统。因此, M细胞具有黏附并转运大分子、颗粒物和微生物的能力。
营养物质的胃肠道吸收可以通过细胞通路转运或细胞旁路转运。细胞通路转运是大部分药物吸收的主要途径。药物可以借助其自身的脂溶性或通过受体介导方式(图 2b)进行细胞通路转运, 也可以经肠上皮细胞、潘氏细胞和M细胞介导内吞。细胞旁路转运可以使小分子水溶性药物穿过细胞间隙进入体循环。胰岛素亲水性强且分子量大, 无法直接被胃肠道吸收。吸收促进剂, 如脂肪酸衍生物、胆盐、表面活性剂和阳离子螯合剂等, 可以打开TJs或促进跨细胞转运, 进而改善药物对肠上皮细胞的渗透性。研究表明, 带负电的粒子可以引起TJs相关蛋白表达下调[22]。去除胞外Ca2+能使紧密连接蛋白失去鳌合的离子, 扰乱肌动蛋白, 从而打开TJs[20]。但是, 作为保护肌体免受病原体和毒素侵害的自然防御机制, TJs受到破坏后可能会对机体产生潜在的不利影响[23]。此外, 使用吸收促进剂也可能对胃肠道黏膜造成不可逆的损害。
4 胰岛素口服给药系统改善胰岛素在消化道中的稳定性并促进肠道上皮转运可以提高其口服生物利用度。在过去的10年中, 人们主要从以下3个方面展开对胰岛素口服给药的探索: ①胰岛素的化学结构修饰, 如图 2c; ②寻找安全高效的吸收促进剂, 如图 2d、e; ③设计研发新型给药系统, 如图 2f。
4.1 化学结构修饰将胰岛素与配体或聚合物材料偶联, 可改善其理化性质和跨膜转运能力。例如, 胰岛素与低分子量鱼精蛋白共价连接可显著改善肠黏膜层和上皮细胞的通透性[24], 胰岛素-胆酸共价偶联物可借助回肠胆盐转运蛋白被小肠吸收, 胰岛素原与转铁蛋白形成的融合蛋白具有口服吸收、肝靶向激活和降糖作用持久等优点[25]。但是, 共价修饰可能会影响胰岛素的生物活性。研究表明, 胰岛素B1位的苯丙氨酸残基与胆红素连接可以引起长期的低血糖反应, 但是B29位的赖氨酸被修饰时并无降糖效果[26]。将胰岛素与聚乙二醇(polyethylene glycol, PEG)共价连接, 可以提高胰岛素的酶稳定性, 避免其在肠道内快速降解。此外, 胰岛素也可以与纳米载体结合。PEG化的羟基磷灰石纳米粒表面共价修饰胰岛素, 载药量高, 体内外均未发现显著毒性, 有利于长期使用[27]。
4.2 吸收促进剂吸收促进剂被广泛应用于生物医学, 以改善治疗药物跨生物屏障转运的能力。一些表面活性剂, 如蔗糖月桂酸酯[28]、Labrasol®ALF[29]和十二烷基硫酸钠(sodium dodecyl sulfate, SDS)[30]等, 可用于药物的口服递送, 但是需要控制剂量以避免肠道损伤。含有SDS的明胶胶囊在肠道内形成气泡膜包载胰岛素, 可以将糖尿病大鼠口服相对生物利用度由6.7%提升至20.8%。脂肪酸类化合物作为吸收促进剂应用广泛, 其中具有代表性的为己酸钠(C10)[31], 但是中链脂肪酸以浓度和时间依赖的方式引起细胞毒性。因此, 有研究将中链脂肪酸(C12)与多聚精氨酸(Rn)偶联形成脂肽, 并进一步与谷赖胰岛素制成复合物, 以期降低中链脂肪酸的给药剂量。通过调节谷赖胰岛素与脂肽比例可以得到带有不同表面电荷的复合物, 并证明带正电荷的C12-R6和带负电荷的C12-R4均可显著改善药物的跨膜转运能力[32]。
巯基聚合物及离子液体可以增强蛋白多肽药物的酶稳定性, 并发挥促进渗透作用。其中, 巯基聚合物因本身不被吸收进入全身循环, 因而具有较好的安全性[33]。离子液体经大鼠空肠给药, 低剂量胰岛素(3~10 U·kg-1)即可显著降低血糖水平, 相对生物利用度可达51%, 其肠溶胶囊(10 U·kg-1)在12 h内使血糖下降高达45%[34]。
多肽类吸收促进剂具有更好的生物相容性, 大体上可分为3大类型:第1种类型为具有促进跨细胞转运功能的穿膜肽(cell-penetrating peptides, CPPs), 主要通过与细胞膜相互作用促进细胞摄取, 包括蛋白转导域来源的天然多肽(如penetratin[35]、TAT[36]、transportan等)、两亲性多肽(如MPG、Pep-1、MAP和SAP等)及阳离子多肽(如寡聚精氨酸R8)。CPPs可通过多种方式促进治疗药物的吸收, 包括修饰在纳米制剂表面[37]、直接与治疗药物通过共价键偶联[38]或非共价键结合。例如, 含有L和D型penetratin的胰岛素溶液, 分别在回肠和结肠部位表现出最佳的吸收效果[39]。疏水性修饰的R8衍生物(硬脂酸-R8偶联物)促进吸收能力提高, 与胰岛素形成的复合物可以包载在类脂囊泡中, 进一步提高胰岛素在肠道中的稳定性[40]; 第2种类型的多肽类吸收促进剂可以增加细胞旁路转运。这一类多肽主要源自TJs相关蛋白或毒素, 可以与TJs相互作用, 能够瞬时打开TJs。封闭带毒素(zonula occludens toxin, ZOT)是霍乱弧菌编码的第2个毒素。ZOT修饰的功能化纳米载体可以调节紧密连接的完整性, 而未经修饰的纳米载体则不具有该功能[41]。此外, 肠上皮细胞可以通过肌球蛋白轻链蛋白(myosin light chain, MLC)的可逆磷酸化动态地打开和关闭TJs结构。激活肌球蛋白轻链磷酸酶(myosin light chain phosphatase, MLCP)可使MLC去磷酸化, 从而关闭TJs。由全D型氨基酸构成的PIP多肽被设计用于抑制MLCP功能。对于半径 < 23Å或带正电荷的溶质, PIP 640肽具有更强的促细胞旁路渗透能力[42]。研究表明, 将20 mmol·L-1 PIP 640与30 U·kg-1胰岛素混合进行小肠内注射, 1 h后正常大鼠血糖降低至原来的50%[43]; 第3种类型的多肽类吸收促进剂为靶向肽, 可以修饰在纳米载体上, 直接将大分子物质运输到特定的组织或细胞中。CSKSSDYQC (CSK)肽可以特异性识别杯状细胞[44]。据报道, 一些配体, 如凝集素[45]和CKSTHPLSC肽[46], 以肠道M细胞为靶点。然而, M细胞仅占肠道细胞很少一部分, 而且靶向肽多用于增强M细胞对疫苗的摄取能力, 应用有限。靶向配体FQSIYPpIK (FQS)修饰的纳米粒与肠上皮细胞表达的整合素αvβ3受体特异性相互作用, 可显著促进细胞摄取。FQS修饰的纳米粒经口服给药显著降低了糖尿病大鼠的血糖, 提高相对生物利用度至7.58%[47]。
4.3 新型给药系统 4.3.1 无机纳米载体许多无机纳米载体如金纳米粒、磷酸锆(ZrP)纳米粒和二氧化硅纳米粒等可被应用于口服给药系统。与有机材料相比, 这些无机材料在胃肠道的酸性条件下和酶环境中稳定性更好。ZrP具有层状结构, 可嵌入胰岛素形成复合物, 其表面涂覆TiO2能提高包封率并延缓释放[48]。此外, 天然抗氧化剂能有效抑制氧化应激, 从而抑制糖尿病的进一步发展。一些植物提取物, 如改良的苹果多糖, 可以将氯金酸还原成金纳米粒, 并用于胰岛素的口服给药[49]。用生物金纳米粒治疗糖尿病动物可使胰岛素水平升高, 血糖降低至正常水平[50]。
二氧化硅具有生物相容性和惰性, 经美国食品药品监督管理局批准可应用于生物医学和食品领域。二氧化硅纳米粒(silicon nanoparticles, SiNP)可以通过吸附或交联的方法载胰岛素, 如在L-精氨酸和氯化锌存在条件下, 胰岛素可以自组装形成内核, 并与二氧化硅交联形成SiNP。值得注意的是, 胰岛素内核并不以SiNP的形式被上皮细胞摄取, 而是在L-精氨酸的渗透促进作用下穿过肠道上皮[51]。SiNP表面还可以包被黏膜黏附性材料, 如海藻酸钠或壳聚糖[52]。但是有研究发现, 以秀丽隐杆线虫作为模型生物, 纳米二氧化硅会损害肠道对寡肽的吸收[53]。介孔碳纳米球[54]或介孔二氧化硅纳米粒(mesoporous silica nanoparticle, MSN)比表面积高, 在吸附药物的同时可以穿透上皮细胞膜。但是MSN存在突释的可能, 可以通过调整孔径[55]、表面包覆树枝状大分子或pH响应性材料来改善释放行为。经pH敏感材料包衣的MSN, 给药剂量为15 U·kg-1胰岛素时, 可将新西兰兔的口服相对生物利用度显著提高至73.1%[56]。树枝状MSN也可以用于包载胰岛素, 其孔径可控(6~20 nm), 粒径(50~100 nm)小到足以通过肠上皮屏障[57]。
4.3.2 聚合物纳米载体制备聚合物纳米载体所用的材料可大致分为天然聚合物和人工合成聚合物。除了提高胰岛素的口服生物利用度外, 聚合物材料还可以保护胰岛素免受胃肠道酶的降解。此外, 纳米载体具有高比表面积、体积比及高迁移率的特点, 更易与细胞膜表面发生相互作用而通过吸收屏障[58]。
4.3.2.1 天然聚合物纳米载体在天然聚合物中, 多糖(壳聚糖、葡聚糖和海藻酸盐)及蛋白质(明胶)常被用于胰岛素的口服递送[59]。这类材料具有亲水、无毒、生物相容性好和可降解的优势, 在纳米载体的制备中应用广泛。其中, 明胶易得、价廉, 表面还有大量易于与靶向配体偶联的官能团[60], 但其亲水性导致药物负载较少。
4.3.2.1.1 壳聚糖壳聚糖是一种线性多糖, 由甲壳素脱乙酰化而来, 可生物降解、无毒, 价格低廉, 在医药和化妆品配方领域获得了广泛的认可[61]。带正电的壳聚糖与黏膜之间存在静电相互作用, 这使得壳聚糖纳米粒具有良好的黏膜黏附性能, 巯基化可以进一步增强其黏膜滞留能力[62]。此外, 壳聚糖还具有打开TJs的特性, 能改善纳米粒的上皮细胞吸收。
在胃内酸性pH条件下, 壳聚糖的氨基发生质子化使得壳聚糖溶解, 易导致纳米粒突释; 在中性条件下, 壳聚糖溶解度降低。维生素B12与壳聚糖连接后, 可以延缓纳米粒在胃内降解并改善壳聚糖在近中性pH条件下的溶解度。而且维生素B12还可以与胃黏膜细胞分泌的一种糖蛋白内因子(intrinsic factor, IF)结合, 结合物可与回肠微绒毛上的维生素B12-IF受体相互作用, 介导纳米粒在回肠的高效、快速吸收[63]。溶胀的黏蛋白也可以减少壳聚糖在酸性环境下的暴露。研究表明, 利用蜗牛黏蛋白与壳聚糖的相互作用制备得到的载胰岛素纳米粒具有pH敏感性。在pH 1.2的酸性条件下, 纳米粒孵育4 h仅释放10%胰岛素, pH 7.4条件下孵育相同时间释放量约50%。含50 U·kg-1胰岛素的纳米粒口服后可以降低40%血糖, 效果持续至12 h[64]。
N-三甲基壳聚糖氯化物(N-trimethyl chitosan, TMC)是壳聚糖的季铵衍生物, 在中性条件下荷正电且具有良好的溶解度, 其促进渗透作用也被保留, 打开TJs的能力强于壳聚糖[65]。但是TMC的正电性会影响纳米粒穿透黏液的能力, 故可以制备电荷翻转纳米粒。纳米粒表面包裹亲水性分子, 在通过黏液层时亲水性分子开始解离, 并在上皮细胞表面暴露出正电核心以促进细胞转运。含有50 U·kg-1胰岛素的TMC纳米粒表面涂覆N-(2-羟丙基)甲基丙烯酰胺聚合物亲水涂层后, 表面电荷变负值, 给药后糖尿病大鼠相对生物利用度由3.09%提高至8.56%[66]。利用材料之间的静电相互作用构建的聚电解质纳米复合物(polyelectrolyte complexes, PECs)也可以促进黏液渗透。苯丙氨酸修饰的壳聚糖可以与SDS形成酶稳定较好的PECs, 由0.6% SDS包被的PECs对健康大鼠的药理相对生物利用度为5.8%, 治疗时间可达9 h[67]。两亲性的十二胺接枝聚谷氨酸共聚物可以形成载胰岛素胶束, 并与杯状细胞靶向肽CSK修饰的TMC发生静电作用, 自组装形成PECs, 以50 U·kg-1胰岛素的剂量灌胃给药后相对生物利用度为7.05%[68]。此外, 小肠上还存在寡肽转运蛋白PepT1和PepT2, 可特异性转运含2~4个氨基酸的寡肽。偶联二聚甘氨酸的TMC纳米粒可使血糖水平降低约50%, 并相对生物利用度达到17.19%[69]。
大部分研究很少考虑纳米粒入胞后从基底侧进入血液循环的过程。受体(如转铁蛋白受体、维生素B12受体、凝集素受体和新生儿Fc受体等)介导的纳米粒入胞过程并不涉及胞内转运及基底侧释放。纳米粒在被胞吞后会进入内涵体, 并沿着微管成熟为溶酶体, 最终被酶降解。回肠胆汁酸结合蛋白是一种胞质蛋白, 参与胆汁酸的重吸收, 在胆汁酸的肝肠循环中发挥重要作用。有研究在壳聚糖纳米粒表面修饰脱氧胆酸, 并用多聚谷氨酸提高纳米粒稳定性。该纳米粒可成功逃避内涵体和溶酶体, 并转运至基底侧, 然后进入血液循环[70]。
4.3.2.1.2 海藻酸盐海藻酸盐来源于海生褐藻, 具有高黏度和凝胶特性, 可以改善胰岛素敏感性, 减轻慢性炎症, 并减少氧化应激, 同时还是外排蛋白(P-糖蛋白)的有效抑制剂[71]。海藻酸盐在近中性和碱性条件下溶解, 与Ca2+络合可形成凝胶[72], 但在酸性条件下以水不溶性海藻酸的形式存在。该原理被广泛应用于海藻酸钠纳米粒或凝胶的制备。但是单纯的载胰岛素海藻酸钠凝胶具有较大的孔隙, 并不能避免胃内酶及胃液对胰岛素的降解, 可以添加氢氧化镁作为抑酸剂提高胰岛素的稳定性[73]。另外, 海藻酸钠与壳聚糖之间存在强烈静电作用。表面包覆壳聚糖可以提高海藻酸盐纳米粒的小肠上皮细胞摄取率。由于胰岛素二聚体能够与C肽片段(EAEDLQGVE)形成可逆的复合物, 壳聚糖/海藻酸钠纳米粒包载含有50 U·kg-1胰岛素的上述复合物不仅具有肠溶特性, 而且可以使胰岛素快速吸收。糖尿病大鼠口服该纳米粒后血糖降低55%, 相对生物利用度显著提高, 达到15.62%[74]。用阳离子化的β-环糊精替换C肽片段后, 纳米粒的pH敏感性仍然保留, 在人工胃液中孵育2 h仅能释放不到5%胰岛素[75]。
除了静电作用外, 还可以利用海藻酸衍生物的某些其他特性介导胰岛素的胃肠道吸收。研究表明, 海藻酸与胆固醇、维生素B12结合后具有两亲性, 可以自组装形成载胰岛素的纳米粒[76]。该纳米粒具有良好的细胞摄取及肠道滞留能力, 胰岛素给药剂量为50 U·kg-1时可使Ⅰ型糖尿病大鼠的血糖在12 h内持续降低至初始水平的46%。
4.3.2.1.3 葡聚糖葡聚糖是一种天然的水溶性多糖, 具有胃肠道黏附作用。与PEG相比, 葡聚糖分子中有更多的羟基, 可以进行广泛的化学修饰。研究表明, 包载胰岛素的海藻酸盐/硫酸葡聚糖纳米粒, 经过壳聚糖和白蛋白双重包衣后, 表现出pH敏感性、黏膜黏附性以及与肠细胞之间很强的相互作用[77]。这主要是因为白蛋白涂层可以阻止蛋白酶进入纳米粒内部, 提高纳米粒在酸性环境和肠道环境中的稳定性[78]。
4.3.2.2 人工合成聚合物纳米载体人工合成的聚合物具有良好的生物相容性和可生物降解性, 主要包括聚己内酯、聚乳酸-羟基乙酸共聚物[poly(lactic-co-glycolic acid), PLGA]和聚乳酸(polylactic acid, PLA)。这类聚合物形成的纳米粒形状更易控制, 缓释效果也比天然聚合物纳米粒更佳。
PLGA纳米粒能有效保护蛋白不受胃肠道酶影响, 而且可以经M细胞的派氏结吸收。但PLGA纳米粒通常带负电, 与细胞膜的相互作用弱, 可以在其表面包覆正电性材料(如TMC)以增强黏膜滞留能力和促进细胞内化[79]。PLGA的疏水性限制了亲水性药物的包封效率。有研究尝试将PLGA与亲水性聚合物组合以解决这一问题。例如, 葡聚糖与PLGA嵌段共聚物可自组装形成聚合物囊泡, 内水相包载胰岛素, 给药剂量为100 U·kg-1时相对生物利用度可达到9.77%[80]。将胰岛素制成复合物也可以改善其在纳米粒中的包封率。研究表明, 采用疏水离子对技术可以将亲水性胰岛素包封到电性相反的疏水性共聚物中, 并获得更高的包封率。但是油酸和胰岛素复合物被包裹至PLGA纳米粒中会出现突释现象。用有机喷雾干燥法将纳米粒用肠溶材料Eudragit®FS 30D包衣, 制成复合微胶囊可以抑制胰岛素的突释。Eudragit®FS 30D在pH > 7的环境中成盐, 最终在结肠全部溶解。复合微胶囊的包封率为94.5%, 20 U·kg-1胰岛素可以使得糖尿病大鼠血糖在12 h内降低约35%, 其药理相对生物利用度为15.6%[81]。将油酸和Eudragit®FS 30D分别替换为功能性脱氧胆酸钠和pH敏感的羟丙甲基纤维素邻苯二甲酸酯也能显著提高复合微胶囊的药理相对生物利用度(16.1%)[82]。维生素E聚乙二醇琥珀酸酯作为乳化剂与PLGA、胰岛素和PEG制成纳米粒, 以20 U·kg-1胰岛素剂量经口服给药后, 可显著降低糖尿病大鼠的胆固醇、尿素、肌酐和谷丙转氨酶水平。给药12 h后, 大鼠血糖可以降至初始水平的1/3[83]。
为了改善肠道上皮细胞对纳米粒的吸收效果, 可以对PLGA进行化学修饰, 如与CPPs[84]或配体连接。小肠可以逆浓度梯度转运L型氨基酸, 因此L型缬氨酸修饰可以显著提高PLGA纳米粒的肠道吸收[85]。但是CPPs修饰导致纳米粒表面带正电, 不利于黏膜扩散。研究者利用肠碱性磷酸酶(intestinal alkaline phosphatase, IAP)水解单磷脂实现去磷酸化的原理, 将IAP底物磷酸丝氨酸和CPP同时修饰在载胰岛素的PLGA纳米粒表面, 使纳米粒在穿过黏液过程中脱去磷酸暴露出表面的正电荷。但是这种纳米粒表面CPPs的酶稳定性仍需进一步考察。这也可能是其生物利用度(5.96% ± 0.93%)有待提高的原因之一[86]。
4.3.3 脂质纳米载体基于脂质材料的纳米载体具有良好的生物相容性和安全性, 可用于改善蛋白多肽类药物的胃肠道稳定性, 特别是脂质体和固态脂质纳米粒用于胰岛素口服递送的研究较多。
4.3.3.1 脂质体脂质体与细胞膜有相似结构, 被广泛作为多肽药物的载体。脂质体本身并不是非常适合口服给药的剂型, 其处方中含有磷脂和胆固醇, 在胃肠道中并不稳定。为了实现脂质体口服给药, 可以将胆盐加入脂质双分子层中, 制备成含胆盐的脂质体。脂质体包载可有效提高胰岛素的稳定性。研究表明, 在模拟胃液和肠液中孵育4 h后, 脂质体包载的胰岛素分别剩余60%和80%, 而游离胰岛素在0.5 h内已完全降解[87]。脂质体中的膜稳定剂胆固醇也可以由植物甾醇代替。含麦角甾醇的脂质体保护胰岛素的能力与含甘胆酸钠脂质体相似, 优于含胆固醇脂质体[88]。脱氧胆酸与壳聚糖偶联物修饰在脂质体表面所形成的纳米载体还具有溶酶体逃逸能力, 进一步提高胰岛素在细胞层面的稳定性[89]。
普通脂质体包载胰岛素的包封率较低, 一般在30%左右。利用阳离子脂质体与胰岛素的静电相互作用可以将胰岛素包封率提高至75%。这种脂质体表面可以用硫酸软骨素与牛磺胆酸结合物包裹, 借助肠道上皮细胞顶端钠依赖性胆汁酸转运体介导肠道吸收和淋巴转运, 口服20 U·kg-1胰岛素的剂量, 相对生物利用度约为34%[90]。
脂质体要成功克服黏液屏障, 往往需要合适的相变温度和表面电荷。脂质体的相变温度接近37 ℃时, 其在体内易变形为椭球形, 从而能够穿透黏液层, 到达上皮细胞被摄取[91]。阳离子脂质体表面可以包裹牛血清白蛋白形成蛋白冠, 进一步提高黏液穿透能力。空肠肠腔内注射该脂质体对I型糖尿病大鼠有显著的降血糖作用, 口服相对生物利用度为11.9%[92]。脂质体也可以包载在肠溶材料(如Eudragit® S100)中进一步改善其胃肠道释放行为[93], 同时克服化学屏障导致的胰岛素降解。
4.3.3.2 固态脂质纳米粒固态脂质纳米粒(solid lipid nanoparticles, SLNs)是微乳液、微球、脂质体和聚合物纳米粒等载体的替代品, 可以包载亲脂性和亲水性药物, 易于大规模制造。SLNs由水、固态脂质(通常为甘油三酯、硬脂酸、硬蜡和甾醇等)和乳化剂(磷脂或非离子型表面活性剂)组成。脂质基质具有保护蛋白药物免受胃酸和酶降解的能力以及生物黏附特性。采用聚乙烯醇作为水相二级乳化剂时, SLNs稳定性提高[94]。然而, SLNs的疏水性通常导致蛋白多肽包封率较低, 将亲水性增稠剂(如丙二醇)加入到处方中, 可以将胰岛素的包封率由20.4%提升至54.5%[95]。
SLNs优先通过肠道淋巴系统进行转运, 还可以促进肠上皮细胞摄取。SLNs共载胰岛素与吸收促进剂可以进一步辅助胰岛素克服肠道上皮屏障。例如, D型penetratin更有助于提高胰岛素稳定性, 但促进胰岛素口服吸收的能力却不如L型penetratin[96]。SLNs中可以加入内涵体逃逸剂来避免胰岛素在细胞内降解。从流感病毒外壳中提取的血凝素-2 (hemagglutinin 2, HA2)衍生肽无致病性, 而且可以在内涵体酸性环境下发生质子化引起构象改变, 破坏晚期内涵体膜, 避免胰岛素被溶酶体降解。由含有内涵体逃逸剂HA2肽的脂质外壳包裹50 U·kg-1胰岛素构成的SLNs, 其相对生物利用度为5.47%, 药理相对生物利用度为7.32%[97]。这种SLNs需要避免胃酸降解, 因此灌胃给药前需要先服用碳酸氢钠平衡胃内pH值。
4.3.4 微球微球具有许多优点, 如比表面积大、吸收重现性好、提高药物溶解度、可实现定点给药和降低毒副作用等。微球有助于减少蛋白药物与胃肠道内容物的接触和相互作用。为了提高胰岛素口服吸收, 微球中可以加入表面活性剂或蛋白酶抑制剂。
通过正负离子静电沉积技术可以使聚乙烯硫酸根负离子和带正电的胰岛素在空白PLA微球表面反复沉积形成多层包裹, 从而制得表面载胰岛素的PLA微球。改变包裹的层数可以调节微球的载药量。这种微球具有pH敏感性和剂量依赖性降糖作用。当微球内胰岛素含量为300 U·kg-1时, 血糖最低降至初始值的1/2[98]。采用W/O/W复乳溶剂蒸发法, 以肠溶性Eudragit® S100为涂层材料, 聚乙烯醇为稳定剂, 可以制备含抑肽酶和胰岛素的微球[99]。经过处方优化的微球在pH 1.2时可防止胃降解, 在pH 7.4时可在结肠部位缓慢释放胰岛素[100]。有报道[101]以液体石蜡和丙酮为原料, 以Eudragit® RL100和硬脂酸镁为液滴稳定剂, 并用正己烷固化制备微球。Eudragit® RL100含有季铵基团, 可改善胰岛素对肠道上皮的渗透性。这种胰岛素微球粒径为14.20~19.80 μm, 载药效率为74.55%~75.90%, 具有pH敏感性和黏膜黏附性。
阿拉伯木聚糖(arabinoxylans, AX)内含有阿魏酸残基, 无需有机溶剂参与, 只经酶催化即可共价交联形成粒径约320 μm的载胰岛素微球。AX微球能最大限度地减少胰岛素在上消化道中的损失, 保持肠道中较高的胰岛素含量。剂量为50 U·kg-1胰岛素的微球可以被结肠菌丛降解, 从而在结肠部位释放胰岛素, 使血糖降低70%[102]。
4.3.5 微生物微生物也可以作为口服药物载体。酵母可以打开肠道上皮细胞之间的紧密连接, 通过M细胞介导内吞进入淋巴循环和血液循环。吸附50 U·kg-1胰岛素的酵母, 表面被海藻酸盐凝胶包衣后, 胃肠道稳定性增强, 口服2 h后血糖可以降至42%[103]。粘红酵母在敲除胸苷酸合成酶后不再增殖, 再用磷酸胆碱胞苷酰转移酶对其进行修饰, 可以提高细胞内脂肪酸和磷脂含量, 成为活细胞脂质体。糖尿病小鼠灌胃给予携带胰岛素的重组菌株后降糖效果显著, 而且胰岛素主要分布于肝、肾部位[104]。
5 胰岛素口服给药的风险胰岛素受体(insulin receptor, IR)是一种酪氨酸激酶蛋白, 由两个胞外亚单位(α亚基)和两个跨膜亚单位(β亚基)构成的四聚体。胰岛素与α亚单位结合后, 激活β亚单位的酪氨酸激酶, 引起细胞代谢、存活和生长相关的细胞内蛋白磷酸化。IR和胰岛素样生长因子-1受体(insulin-like growth factor 1 receptor, IGF-1R)在配体结合位点, 以及酪氨酸激酶与底物募集域, 均显示出一定程度的同源性。这两种受体均可结合胰岛素、胰岛素样生长因子(IGF-1、IGF-2), 但是亲和力存在差异。IR具有两种结构不同的亚型: IR-A (胎儿亚型)和IR-B (成熟亚型)[105]。IR-B主要介导代谢效应, 表达于肝脏、脂肪和肌肉中, 与胰岛素亲和力高, 而与IGF-1和IGF-2亲和力低。IR-A主要介导有丝分裂, 在胚胎和胎儿组织、中枢神经系统、造血细胞和癌细胞中表达, 与胰岛素、IGF-2亲和力高。IR可以分别由IR-A或IR-B构成同二聚体, 也可以由IR-A/IR-B杂交形成异二聚体。此外, IR还可以与IGF-1R形成杂交受体。基质癌和上皮癌细胞都能局部产生IGF-2, 可以与IR-A高度亲和, 从而促进癌细胞增殖[106]。
目前的研究发现胰岛素或其促分泌剂的使用与癌症的进展密切相关。高水平的胰岛素和IGF-1与结肠癌发病风险增加有关[107]。结肠癌细胞表面有IR和IGF-1R[108]。IGF-1R及其配体IGF-1失调在结肠癌的发生和发展中起重要作用[109]。IR在一些恶性肿瘤中主要起促进有丝分裂的作用而非代谢作用。细胞水平的实验结果表明, 胰岛素可诱导人结肠癌HCT-116细胞[110]、HT-29细胞[111]的增殖和转移。因此大肠癌的进展可能与胰岛素诱导有关。而当上皮细胞缺失IR时, 放疗后结肠上皮细胞的凋亡加速[112]。在IR-A与IR-B比值增加的大肠癌标本中, 这两种IR亚型高表达, 其表达量甚至高于表皮生长因子受体。
作为一种生长促进剂, 长期口服高剂量胰岛素制剂有可能引起肠黏膜有丝分裂的改变[113]。因此胰岛素口服制剂开发过程中应当控制给药剂量, 并对制剂的长期安全性进行有效、全面的评估。
6 临床研究进展受限于胃肠道严苛的吸收环境, 胰岛素的口服制剂研发始终进展缓慢。到目前为止, 仅有肝靶向胰岛素脂质体(hepatic-directed vesicle insulin, HDV-I)胶囊进入了Ⅲ期临床。HDV-I粒径小于150 nm, 同时携载胰岛素、肝靶向分子和生物素磷脂酰乙醇胺[114]。
另外一些制剂通过加入吸收促进剂提高胰岛素的口服生物利用度, 但是改善效果有限。诺和诺德公司开发的口服胰岛素(OI338GT)利用胃肠道渗透增强技术[115], 采用胰岛素类似物与吸收促进剂组合的策略以改善血糖控制, 效果与皮下注射甘精胰岛素接近。但是产品生物利用度不高, 导致给药剂量过大, 目前止步于临床Ⅱ期。Biocon公司开发的口服胰岛素Tregopil (原名IN-105)处方中含有通过短链PEG与己酸基偶联的胰岛素衍生物, 其酶稳定性及水溶性更佳[116]。该产品的临床试验由2010年开始, 目前仍处于Ⅱ期临床研究。ORMD-0801肠溶胶囊包含胰岛素、蛋白酶抑制剂和有助于小肠转运的吸收促进剂, 其临床Ⅱb期效果显著, 配合皮下注射胰岛素, 耐受性好, 可持续有效降低血糖[117]。ORMD-0801肠溶胶囊的安全性研究已于2019年在中国启动。
Oshadi Drug Administration公司在2010年申请了胰岛素口服制剂专利。该制剂中包含二氧化硅纳米粒、多糖和胰岛素的油溶液, 用其包载胰岛素、胰岛素原、C肽所制成的产品目前处于临床Ⅱ期招募中。Bows Pharmaceuticals AG公司研制的ORA2胶囊用葡聚糖基质携载胰岛素, 可以延长胃肠道滞留时间, 目前处于临床Ⅱ期[118]。
7 展望胰岛素作为糖尿病的主要治疗药物, 其最理想和最方便的给药途径是口服给药。目前大量研究通过化学修饰、加入吸收促进剂或借助纳米载体的方式口服递送胰岛素。其中纳米载体可以打开上皮细胞之间的紧密连接, 或利用穿膜肽、其他配体介导跨膜转运, 改善胰岛素的胃肠道吸收。为了同时促进纳米载体穿透黏液层及肠道上皮细胞转运, 一些仿病毒的电荷翻转纳米载体应运而生。pH敏感性材料也赋予了给药系统克服胃内化学屏障的能力, 使胰岛素可以定位在肠内释放。
但是很多基础研究还存在数据不完整的现象, 比如缺少相对生物利用度及长期给药的肠道毒性。仅用细胞水平的研究或药理相对生物利用度并不足以体现胰岛素的口服吸收过程。因为血糖水平的下降与实验者的技术、动物的生理状态及给药方式紧密相关。现有的数据表明, 目前大部分研究对胰岛素口服生物利用度的提高效果仍然有限, 大部分仍处于20%以下。胰岛素的利用率太低会影响相关技术的转化及使用价值。另外, 口服胰岛素的动物模型大多需要禁食过夜以排除食物的影响, 而实际上食物对胃肠道的排空时间、微环境的影响很大, 会干扰药物的吸收。因此受到食物影响的制剂每日口服时间及次数受限, 必须与皮下注射胰岛素配合使用。对于使用吸收促进剂、人工聚合物纳米粒或无机纳米粒的制剂来说, 长期给药的肠道安全性评价非常必要。单次给药后的肠道切片结果并不足以保证制剂对肠黏膜无害, 也无法证明聚合物材料或无机材料可以被安全地代谢。肠道中IR受体的存在更是使制剂中的胰岛素有诱发大肠癌的可能。这种风险需要长期观察才可消除。未来还需要临床研究来验证口服胰岛素制剂的长期降血糖作用和安全性。尽管困难重重, 伴随着新材料和新技术的不断涌现, 以及第一个口服索马鲁肽产品的成功上市, 或许不久将迎来突破胰岛素口服给药困境的曙光。
| [1] |
International Diabetes Federation. IDF Diabetes Atlas[M]. 9th ed. Brussels: International Diabetes Federation, 2019.
|
| [2] |
McNeilly AD, McCrimmon RJ. Impaired hypoglycaemia awareness in type 1 diabetes:lessons from the lab[J]. Diabetologia, 2018, 61: 743-750. DOI:10.1007/s00125-018-4548-8 |
| [3] |
Barola A, Tiwari P, Bhansali A, et al. Insulin-related lipohypertrophy:lipogenic action or tissue trauma?[J]. Front Endocrinol, 2018, 9: 638. DOI:10.3389/fendo.2018.00638 |
| [4] |
Yeh HC, Brown TT, Maruthur N, et al. Comparative effectiveness and safety of methods of insulin delivery and glucose monitoring for diabetes mellitus:a systematic review and meta-analysis[J]. Ann Intern Med, 2012, 157: 336-347. DOI:10.7326/0003-4819-157-5-201209040-00508 |
| [5] |
du Plessis LH, Kotze AF, Junginger HE. Nasal and rectal delivery of insulin with chitosan and N-trimethyl chitosan chloride[J]. Drug Deliv, 2010, 17: 399-407. DOI:10.3109/10717541003762888 |
| [6] |
Patil NH, Devarajan PV. Insulin-loaded alginic acid nanoparticles for sublingual delivery[J]. Drug Deliv, 2016, 23: 429-436. DOI:10.3109/10717544.2014.916769 |
| [7] |
Morales JO, Brayden DJ. Buccal delivery of small molecules and biologics:of mucoadhesive polymers, films, and nanoparticles[J]. Curr Opin Pharmacol, 2017, 36: 22-28. DOI:10.1016/j.coph.2017.07.011 |
| [8] |
Zhang Y, Zhu J, Tang Y, et al. The preparation and application of pulmonary surfactant nanoparticles as absorption enhancers in insulin dry powder delivery[J]. Drug Dev Ind Pharm, 2009, 35: 1059-1065. DOI:10.1080/03639040902769628 |
| [9] |
Heinemann L. The failure of exubera:are we beating a dead horse?[J]. J Diabetes Sci Technol, 2008, 2: 518-529. DOI:10.1177/193229680800200325 |
| [10] |
Goldberg T, Wong E. Afrezza (insulin human) inhalation powder:a new inhaled insulin for the management of type-1 or type-2 diabetes mellitus[J]. P T, 2015, 40: 735-741. |
| [11] |
Buckley ST, Baekdal TA, Vegge A, et al. Transcellular stomach absorption of a derivatized glucagon-like peptide-1 receptor agonist[J]. Sci Transl Med, 2018, 10: eaar7047. DOI:10.1126/scitranslmed.aar7047 |
| [12] |
Asare-Bediako I, Paszkiewicz RL, Kim SP, et al. Assessment of hepatic insulin extraction from in vivo surrogate methods of insulin clearance measurement[J]. Am J Physiol Endocrinol Metab, 2018, 315: E605-E612. DOI:10.1152/ajpendo.00344.2017 |
| [13] |
Titchenell PM, Lazar MA, Birnbaum MJ. Unraveling the regulation of hepatic metabolism by insulin[J]. Trends Endocrinol Metab, 2017, 28: 497-505. DOI:10.1016/j.tem.2017.03.003 |
| [14] |
Farmer TD, Jenkins EC, O'Brien TP, et al. Comparison of the physiological relevance of systemic vs portal insulin delivery to evaluate whole body glucose flux during an insulin clamp[J]. Am J Physiol Endocrinol Metab, 2015, 308: E206-E222. DOI:10.1152/ajpendo.00406.2014 |
| [15] |
Ben Abdelkrim A, Fathallah N, Omri M, et al. Insulin-induced lipodystrophy and interest of insulin injection ports[J]. Therapie, 2019, 74: 680-682. DOI:10.1016/j.therap.2019.04.002 |
| [16] |
Wong CY, Martinez J, Dass CR. Oral delivery of insulin for treatment of diabetes:status quo, challenges and opportunities[J]. J Pharm Pharmacol, 2016, 68: 1093-1108. DOI:10.1111/jphp.12607 |
| [17] |
Li C, Wang J, Wang Y, et al. Recent progress in drug delivery[J]. Acta Pharm Sin B, 2019, 9: 1145-1162. DOI:10.1016/j.apsb.2019.08.003 |
| [18] |
Wang T, Xue J, Hu Q, et al. Preparation of lipid nanoparticles with high loading capacity and exceptional gastrointestinal stability for potential oral delivery applications[J]. J Colloid Interface Sci, 2017, 507: 119-130. DOI:10.1016/j.jcis.2017.07.090 |
| [19] |
Maderuelo C, Lanao JM, Zarzuelo A. Enteric coating of oral solid dosage forms as a tool to improve drug bioavailability[J]. Eur J Pharm Sci, 2019, 138: 105019. DOI:10.1016/j.ejps.2019.105019 |
| [20] |
Chen XY, Butt AM, Mohd Amin MCI. Enhanced paracellular delivery of vaccine by hydrogel microparticles-mediated reversible tight junction opening for effective oral immunization[J]. J Control Release, 2019, 311-312: 50-64. DOI:10.1016/j.jconrel.2019.08.031 |
| [21] |
Salama NN, Eddington ND, Fasano A. Tight junction modulation and its relationship to drug delivery[J]. Adv Drug Deliv Rev, 2006, 58: 15-28. DOI:10.1016/j.addr.2006.01.003 |
| [22] |
Wang J, Kong M, Zhou ZJ, et al. Mechanism of surface charge triggered intestinal epithelial tight junction opening upon chitosan nanoparticles for insulin oral delivery[J]. Carbohyd Polym, 2017, 157: 596-602. DOI:10.1016/j.carbpol.2016.10.021 |
| [23] |
Ramesan RM, Sharma CP. Recent advances in the oral delivery of insulin[J]. Recent Pat Drug Deliv Formul, 2014, 8: 155-159. DOI:10.2174/1872211308666140527143407 |
| [24] |
Sheng J, He H, Han L, et al. Enhancing insulin oral absorption by using mucoadhesive nanoparticles loaded with LMWP-linked insulin conjugates[J]. J Control Release, 2016, 233: 181-190. DOI:10.1016/j.jconrel.2016.05.015 |
| [25] |
Chen YS, Zaro JL, Zhang D, et al. Characterization and oral delivery of proinsulin-transferrin fusion protein expressed using Express Tec[J]. Int J Mol Sci, 2018, 19: 378. DOI:10.3390/ijms19020378 |
| [26] |
McGinn BJ, Morrison JD. Investigations into the absorption of insulin and insulin derivatives from the small intestine of the anaesthetised rat[J]. J Control Release, 2016, 232: 120-130. DOI:10.1016/j.jconrel.2016.04.002 |
| [27] |
Zhang Y, Zhang L, Ban Q, et al. Preparation and characterization of hydroxyapatite nanoparticles carrying insulin and gallic acid for insulin oral delivery[J]. Nanomedicine, 2018, 14: 353-364. DOI:10.1016/j.nano.2017.11.012 |
| [28] |
McCartney F, Rosa M, Brayden DJ. Evaluation of sucrose laurate as an intestinal permeation enhancer for macromolecules:ex vivo and in vivo studies[J]. Pharmaceutics, 2019, 11: 565. DOI:10.3390/pharmaceutics11110565 |
| [29] |
McCartney F, Jannin V, Chevrier S, et al. Labrasol(R) is an efficacious intestinal permeation enhancer across rat intestine:ex vivo and in vivo rat studies[J]. J Control Release, 2019, 310: 115-126. DOI:10.1016/j.jconrel.2019.08.008 |
| [30] |
Lin PY, Chuang EY, Chiu YH, et al. Safety and efficacy of self-assembling bubble carriers stabilized with sodium dodecyl sulfate for oral delivery of therapeutic proteins[J]. J Control Release, 2017, 259: 168-175. DOI:10.1016/j.jconrel.2016.12.018 |
| [31] |
Jorgensen JR, Yu F, Venkatasubramanian R, et al. In vitro, ex vivo and in vivo evaluation of microcontainers for oral delivery of insulin[J]. Pharmaceutics, 2020, 12: 48. DOI:10.3390/pharmaceutics12010048 |
| [32] |
Garcia J, Fernandez-Blanco A, Teixido M, et al. d-Polyarginine lipopeptides as intestinal permeation enhancers[J]. ChemMedChem, 2018, 13: 2045-2052. DOI:10.1002/cmdc.201800428 |
| [33] |
Zhang Y, Zhou S, Deng F, et al. The function and mechanism of preactivated thiomers in triggering epithelial tight junctions opening[J]. Eur J Pharm Biopharm, 2018, 133: 188-199. DOI:10.1016/j.ejpb.2018.10.014 |
| [34] |
Banerjee A, Ibsen K, Brown T, et al. Ionic liquids for oral insulin delivery[J]. Proc Natl Acad Sci U S A, 2018, 115: 7296-7301. DOI:10.1073/pnas.1722338115 |
| [35] |
Kamei N, Shigei C, Hasegawa R, et al. Exploration of the key factors for optimizing the in vivo oral delivery of insulin by using a noncovalent strategy with cell-penetrating peptides[J]. Biol Pharm Bull, 2018, 41: 239-246. DOI:10.1248/bpb.b17-00798 |
| [36] |
Chen S, Guo F, Deng T, et al. Eudragit S100-coated chitosan nanoparticles co-loading Tat for enhanced oral colon absorption of insulin[J]. AAPS PharmSciTech, 2017, 18: 1277-1287. DOI:10.1208/s12249-016-0594-z |
| [37] |
Guo F, Zhang M, Gao Y, et al. Modified nanoparticles with cell-penetrating peptide and amphipathic chitosan derivative for enhanced oral colon absorption of insulin:preparation and evaluation[J]. Drug Deliv, 2016, 23: 2003-2014. DOI:10.3109/10717544.2015.1048489 |
| [38] |
Kuroda Y, Kato-Kogoe N, Tasaki E, et al. Suppressive effect of membrane-permeable peptides derived from autophosphorylation sites of the IGF-1 receptor on breast cancer cells[J]. Eur J Pharmacol, 2015, 765: 24-33. DOI:10.1016/j.ejphar.2015.08.004 |
| [39] |
Khafagy ES, Iwamae R, Kamei N, et al. Region-dependent role of cell-penetrating peptides in insulin absorption across the rat small intestinal membrane[J]. AAPS J, 2015, 17: 1427-1437. DOI:10.1208/s12248-015-9804-y |
| [40] |
Niu Z, Samaridou E, Jaumain E, et al. PEG-PGA enveloped octaarginine-peptide nanocomplexes:an oral peptide delivery strategy[J]. J Control Release, 2018, 276: 125-139. DOI:10.1016/j.jconrel.2018.03.004 |
| [41] |
Lee JH, Sahu A, Choi WI, et al. ZOT-derived peptide and chitosan functionalized nanocarrier for oral delivery of protein drug[J]. Biomaterials, 2016, 103: 160-169. DOI:10.1016/j.biomaterials.2016.06.059 |
| [42] |
Almansour K, Taverner A, Turner JR, et al. An intestinal paracellular pathway biased toward positively-charged macromolecules[J]. J Control Release, 2018, 288: 111-125. DOI:10.1016/j.jconrel.2018.09.003 |
| [43] |
Taverner A, Dondi R, Almansour K, et al. Enhanced paracellular transport of insulin can be achieved via transient induction of myosin light chain phosphorylation[J]. J Control Release, 2015, 210: 189-197. DOI:10.1016/j.jconrel.2015.05.270 |
| [44] |
Zhang J, Zhu X, Jin Y, et al. Mechanism study of cellular uptake and tight junction opening mediated by goblet cell-specific trimethyl chitosan nanoparticles[J]. Mol Pharm, 2014, 11: 1520-1532. DOI:10.1021/mp400685v |
| [45] |
Grigoras AG. Polymer-lipid hybrid systems used as carriers for insulin delivery[J]. Nanomedicine, 2017, 13: 2425-2437. DOI:10.1016/j.nano.2017.08.005 |
| [46] |
Urrutia-Baca VH, Gomez-Flores R, De La Garza-Ramos MA, et al. Immunoinformatics approach to design a novel epitope-based oral vaccine against Helicobacter pylori[J]. J Comput Biol, 2019, 26: 1177-1190. DOI:10.1089/cmb.2019.0062 |
| [47] |
Liu C, Shan W, Liu M, et al. A novel ligand conjugated nanoparticles for oral insulin delivery[J]. Drug Deliv, 2016, 23: 2015-2025. DOI:10.3109/10717544.2015.1058433 |
| [48] |
Safari M, Kamari Y, Ghiaci M, et al. Synthesis and characterization of insulin/zirconium phosphate@TiO2 hybrid composites for enhanced oral insulin delivery applications[J]. Drug Dev Ind Pharm, 2017, 43: 862-870. DOI:10.1080/03639045.2016.1220573 |
| [49] |
Kumari Y, Singh SK, Kumar R, et al. Modified apple polysaccharide capped gold nanoparticles for oral delivery of insulin[J]. Int J Biol Macromol, 2020, 149: 976-988. DOI:10.1016/j.ijbiomac.2020.01.302 |
| [50] |
Sengani M, Devi Rajeswari V. Identification of potential antioxidant indices by biogenic gold nanoparticles in hyperglycemic Wistar rats[J]. Environ Toxicol Pharmacol, 2017, 50: 11-19. DOI:10.1016/j.etap.2017.01.007 |
| [51] |
Hristov D, McCartney F, Beirne J, et al. Silica-coated nanoparticles with a core of zinc, L-arginine, and a peptide designed for oral delivery[J]. ACS Appl Mater Interfaces, 2020, 12: 1257-1269. DOI:10.1021/acsami.9b16104 |
| [52] |
Andreani T, Miziara L, Lorenzon EN, et al. Effect of mucoadhesive polymers on the in vitro performance of insulin-loaded silica nanoparticles:interactions with mucin and biomembrane models[J]. Eur J Pharm Biopharm, 2015, 93: 118-126. DOI:10.1016/j.ejpb.2015.03.027 |
| [53] |
Piechulek A, Berwanger LC, von Mikecz A. Silica nanoparticles disrupt OPT-2/PEP-2-dependent trafficking of nutrient peptides in the intestinal epithelium[J]. Nanotoxicology, 2019, 13: 1133-1148. DOI:10.1080/17435390.2019.1643048 |
| [54] |
Huang W, Xie H, Tian Y, et al. Controlled growth of N-doped and large mesoporous carbon spheres with adjustable litchi-like surface and particle size as a giant guest molecule carrier[J]. ACS Appl Mater Interfaces, 2018, 10: 20073-20084. DOI:10.1021/acsami.8b02040 |
| [55] |
He Y, Wang M, Zhang H, et al. Protective properties of mesocellular silica foams against aggregation and enzymatic hydrolysis of loaded proteins for oral protein delivery[J]. J Colloid Interface Sci, 2020, 560: 690-700. DOI:10.1016/j.jcis.2019.10.118 |
| [56] |
Guha A, Biswas N, Bhattacharjee K, et al. pH responsive cylindrical MSN for oral delivery of insulin-design, fabrication and evaluation[J]. Drug Deliv, 2016, 23: 3552-3561. DOI:10.1080/10717544.2016.1209796 |
| [57] |
Juere E, Caillard R, Marko D, et al. Smart protein-based formulation of dendritic mesoporous silica nanoparticles:toward oral delivery of insulin[J]. Chemistry, 2020, 26: 5195-5199. DOI:10.1002/chem.202000773 |
| [58] |
Salatin S, Yari Khosroushahi A. Overviews on the cellular uptake mechanism of polysaccharide colloidal nanoparticles[J]. J Cell Mol Med, 2017, 21: 1668-1686. DOI:10.1111/jcmm.13110 |
| [59] |
Bahman F, Greish K, Taurin S. Nanotechnology in insulin delivery for management of diabetes[J]. Pharm Nanotechnol, 2019, 7: 113-128. DOI:10.2174/2211738507666190321110721 |
| [60] |
Tseng CL, Wang TW, Dong GC, et al. Development of gelatin nanoparticles with biotinylated EGF conjugation for lung cancer targeting[J]. Biomaterials, 2007, 28: 3996-4005. DOI:10.1016/j.biomaterials.2007.05.006 |
| [61] |
Makhlof A, Tozuka Y, Takeuchi H. Design and evaluation of novel pH-sensitive chitosan nanoparticles for oral insulin delivery[J]. Eur J Pharm Sci, 2011, 42: 445-451. DOI:10.1016/j.ejps.2010.12.007 |
| [62] |
Sudhakar S, Chandran SV, Selvamurugan N, et al. Biodistribution and pharmacokinetics of thiolated chitosan nanoparticles for oral delivery of insulin in vivo[J]. Int J Biol Macromol, 2020, 150: 281-288. DOI:10.1016/j.ijbiomac.2020.02.079 |
| [63] |
Verma A, Sharma S, Gupta PK, et al. Vitamin B12 functionalized layer by layer calcium phosphate nanoparticles:a mucoadhesive and pH responsive carrier for improved oral delivery of insulin[J]. Acta Biomater, 2016, 31: 288-300. DOI:10.1016/j.actbio.2015.12.017 |
| [64] |
Mumuni MA, Kenechukwu FC, Ofokansi KC, et al. Insulin-loaded mucoadhesive nanoparticles based on mucin-chitosan complexes for oral delivery and diabetes treatment[J]. Carbohydr Polym, 2020, 229: 115506. DOI:10.1016/j.carbpol.2019.115506 |
| [65] |
Zhou MY, Wang TR, Hu QB, et al. Low density lipoprotein/pectin complex nanogels as potential oral delivery vehicles for curcumin[J]. Food Hydrocolloids, 2016, 57: 20-29. DOI:10.1016/j.foodhyd.2016.01.010 |
| [66] |
Liu M, Zhang J, Zhu X, et al. Efficient mucus permeation and tight junction opening by dissociable "mucus-inert" agent coated trimethyl chitosan nanoparticles for oral insulin delivery[J]. J Control Release, 2016, 222: 67-77. DOI:10.1016/j.jconrel.2015.12.008 |
| [67] |
Liu C, Xu H, Sun Y, et al. Design of virus-mimicking polyelectrolyte complexes for enhanced oral insulin delivery[J]. J Pharm Sci, 2019, 108: 3408-3415. DOI:10.1016/j.xphs.2019.05.034 |
| [68] |
Zhang P, Xu Y, Zhu X, et al. Goblet cell targeting nanoparticle containing drug-loaded micelle cores for oral delivery of insulin[J]. Int J Pharm, 2015, 496: 993-1005. DOI:10.1016/j.ijpharm.2015.10.078 |
| [69] |
Jafary Omid N, Bahari Javan N, Dehpour AR, et al. In-vitro and in-vivo cytotoxicity and efficacy evaluation of novel glycyl-glycine and alanyl-alanine conjugates of chitosan and trimethyl chitosan nano-particles as carriers for oral insulin delivery[J]. Int J Pharm, 2018, 535: 293-307. DOI:10.1016/j.ijpharm.2017.11.020 |
| [70] |
Fan W, Xia D, Zhu Q, et al. Functional nanoparticles exploit the bile acid pathway to overcome multiple barriers of the intestinal epithelium for oral insulin delivery[J]. Biomaterials, 2018, 151: 13-23. DOI:10.1016/j.biomaterials.2017.10.022 |
| [71] |
Malhaire H, Gimel JC, Roger E, et al. How to design the surface of peptide-loaded nanoparticles for efficient oral bioavailability?[J]. Adv Drug Deliv Rev, 2016, 106: 320-336. DOI:10.1016/j.addr.2016.03.011 |
| [72] |
Alfatama M, Lim LY, Wong TW. Alginate-C18 conjugate nanoparticles loaded in tripolyphosphate-cross-linked chitosan-oleic acid conjugate-coated calcium alginate beads as oral insulin carrier[J]. Mol Pharm, 2018, 15: 3369-3382. DOI:10.1021/acs.molpharmaceut.8b00391 |
| [73] |
Sun Q, Zhang Z, Zhang R, et al. Development of functional or medical foods for oral administration of insulin for diabetes treatment:gastroprotective edible microgels[J]. J Agric Food Chem, 2018, 66: 4820-4826. DOI:10.1021/acs.jafc.8b00233 |
| [74] |
Chen X, Ren Y, Feng Y, et al. Cp1-11 peptide/insulin complex loaded pH-responsive nanoparticles with enhanced oral bioactivity[J]. Int J Pharm, 2019, 562: 23-30. DOI:10.1016/j.ijpharm.2019.03.020 |
| [75] |
Mansourpour M, Mahjub R, Amini M, et al. Development of acid-resistant alginate/trimethyl chitosan nanoparticles containing cationic beta-cyclodextrin polymers for insulin oral delivery[J]. AAPS PharmSciTech, 2015, 16: 952-962. DOI:10.1208/s12249-014-0282-9 |
| [76] |
Long LL, Lai MH, Mao XH, et al. Investigation of vitamin B12-modified amphiphilic sodium alginate derivatives for enhancing the oral delivery efficacy of peptide drugs[J]. Int J Nanomedicine, 2019, 14: 7743-7758. DOI:10.2147/IJN.S218944 |
| [77] |
Lopes M, Shrestha N, Correia A, et al. Dual chitosan/albumin-coated alginate/dextran sulfate nanoparticles for enhanced oral delivery of insulin[J]. J Control Release, 2016, 232: 29-41. DOI:10.1016/j.jconrel.2016.04.012 |
| [78] |
Lopes M, Aniceto D, Abrantes M, et al. In vivo biodistribution of antihyperglycemic biopolymer-based nanoparticles for the treatment of type 1 and type 2 diabetes[J]. Eur J Pharm Biopharm, 2017, 113: 88-96. DOI:10.1016/j.ejpb.2016.11.037 |
| [79] |
Sheng J, Han L, Qin J, et al. N-Trimethyl chitosan chloride-coated PLGA nanoparticles overcoming multiple barriers to oral insulin absorption[J]. ACS Appl Mater Interfaces, 2015, 7: 15430-15441. DOI:10.1021/acsami.5b03555 |
| [80] |
Alibolandi M, Alabdollah F, Sadeghi F, et al. Dextran-b-poly(lactide-co-glycolide) polymersome for oral delivery of insulin:in vitro and in vivo evaluation[J]. J Control Release, 2016, 227: 58-70. DOI:10.1016/j.jconrel.2016.02.031 |
| [81] |
Sun S, Liang N, Yamamoto H, et al. pH-sensitive poly(lactide-co-glycolide) nanoparticle composite microcapsules for oral delivery of insulin[J]. Int J Nanomedicine, 2015, 10: 3489-3498. |
| [82] |
Sun S, Liang N, Gong X, et al. Multifunctional composite microcapsules for oral delivery of insulin[J]. Int J Mol Sci, 2016, 18: 54. DOI:10.3390/ijms18010054 |
| [83] |
Malathi S, Nandhakumar P, Pandiyan V, et al. Novel PLGA-based nanoparticles for the oral delivery of insulin[J]. Int J Nanomedicine, 2015, 10: 2207-2218. |
| [84] |
Zhu S, Chen S, Gao Y, et al. Enhanced oral bioavailability of insulin using PLGA nanoparticles co-modified with cell-penetrating peptides and Engrailed secretion peptide (Sec)[J]. Drug Deliv, 2016, 23: 1980-1991. DOI:10.3109/10717544.2015.1043472 |
| [85] |
Jain A, Jain SK. L-Valine appended PLGA nanoparticles for oral insulin delivery[J]. Acta Diabetol, 2015, 52: 663-676. DOI:10.1007/s00592-015-0714-3 |
| [86] |
Wu J, Zheng Y, Liu M, et al. Biomimeticviruslike and charge reversible nanoparticles to sequentially overcome mucus and epithelial barriers for oral insulin delivery[J]. ACS Appl Mater Interfaces, 2018, 10: 9916-9928. DOI:10.1021/acsami.7b16524 |
| [87] |
He H, Lu Y, Qi J, et al. Biomimetic thiamine- and niacin-decorated liposomes for enhanced oral delivery of insulin[J]. Acta Pharm Sin B, 2018, 8: 97-105. DOI:10.1016/j.apsb.2017.11.007 |
| [88] |
Cui M, Wu W, Hovgaard L, et al. Liposomes containing cholesterol analogues of botanical origin as drug delivery systems to enhance the oral absorption of insulin[J]. Int J Pharm, 2015, 489: 277-284. DOI:10.1016/j.ijpharm.2015.05.006 |
| [89] |
Wu SW, Bin W, Tu BY, et al. A delivery system for oral administration of proteins/peptides through bile acid transport channels[J]. J Pharm Sci, 2019, 108: 2143-2152. DOI:10.1016/j.xphs.2019.01.027 |
| [90] |
Kim KS, Kwag DS, Hwang HS, et al. Immense insulin intestinal uptake and lymphatic transport using bile acid conjugated partially uncapped liposome[J]. Mol Pharm, 2018, 15: 4756-4763. DOI:10.1021/acs.molpharmaceut.8b00708 |
| [91] |
Yu M, Song W, Tian F, et al. Temperature- and rigidity-mediated rapid transport of lipid nanovesicles in hydrogels[J]. Proc Natl Acad Sci U S A, 2019, 116: 5362-5369. DOI:10.1073/pnas.1818924116 |
| [92] |
Wang A, Yang T, Fan W, et al. Protein corona liposomes achieve efficient oral insulin delivery by overcoming mucus and epithelial barriers[J]. Adv Healthc Mater, 2019, 8: e1801123. DOI:10.1002/adhm.201801123 |
| [93] |
Sharma S, Jyoti K, Sinha R, et al. Protamine coated proliposomes of recombinant human insulin encased in Eudragit S100 coated capsule offered improved peptide delivery and permeation across Caco-2 cells[J]. Mater Sci Eng C Mater Biol Appl, 2016, 67: 378-385. DOI:10.1016/j.msec.2016.05.010 |
| [94] |
Ansari MJ, Anwer MK, Jamil S, et al. Enhanced oral bioavailability of insulin-loaded solid lipid nanoparticles:pharmacokinetic bioavailability of insulin-loaded solid lipid nanoparticles in diabetic rats[J]. Drug Deliv, 2016, 23: 1972-1979. |
| [95] |
Boushra M, Tous S, Fetih G, et al. Development and evaluation of viscosity-enhanced nanocarrier (VEN) for oral insulin delivery[J]. Int J Pharm, 2016, 511: 462-472. DOI:10.1016/j.ijpharm.2016.07.016 |
| [96] |
Alsulays BB, Anwer MK, Soliman GA, et al. Impact of penetratin stereochemistry on the oral bioavailability of insulin-loaded solid lipid nanoparticles[J]. Int J Nanomedicine, 2019, 14: 9127-9138. DOI:10.2147/IJN.S225086 |
| [97] |
Xu Y, Zheng Y, Wu L, et al. Novel solid lipid nanoparticle with endosomal escape function for oral delivery of insulin[J]. ACS Appl Mater Interfaces, 2018, 10: 9315-9324. DOI:10.1021/acsami.8b00507 |
| [98] |
Zhang H, Wang W, Li H, et al. Microspheres for the oral delivery of insulin:preparation, evaluation and hypoglycaemic effect in streptozotocin-induced diabetic rats[J]. Drug Dev Ind Pharm, 2018, 44: 109-115. DOI:10.1080/03639045.2017.1386197 |
| [99] |
Agrawal GR, Wakte P, Shelke S. Formulation, physicochemical characterization and in vitro evaluation of human insulin-loaded microspheres as potential oral carrier[J]. Prog Biomater, 2017, 6: 125-136. DOI:10.1007/s40204-017-0072-z |
| [100] |
Agrawal G, Wakte P, Shelke S. Formulation optimization of human insulin loaded microspheres for controlled oral delivery using response surface methodology[J]. Endocr Metab Immune Disord Drug Targets, 2017, 17: 149-165. |
| [101] |
Kenechukwu FC, Momoh MA. Formulation, characterization and evaluation of the effect of polymer concentration on the release behavior of insulin-loaded Eudragit®-entrapped mucoadhesive microspheres[J]. Int J Pharm Investig, 2016, 6: 69-77. DOI:10.4103/2230-973X.177806 |
| [102] |
Martinez-Lopez AL, Carvajal-Millan E, Sotelo-Cruz N, et al. Enzymatically cross-linked arabinoxylan microspheres as oral insulin delivery system[J]. Int J Biol Macromol, 2019, 126: 952-959. DOI:10.1016/j.ijbiomac.2018.12.192 |
| [103] |
Sabu C, Raghav D, Jijith US, et al. Bioinspired oral insulin delivery system using yeast microcapsules[J]. Mater Sci Engineer C Materr Biol Appl, 2019, 103: 109753. DOI:10.1016/j.msec.2019.109753 |
| [104] |
Fei Z, Li S, Wang J, et al. Rhodotorulaglutinis as a living cell liposome to deliver polypeptide drugs in vivo[J]. Drug Deliv, 2019, 26: 51-62. DOI:10.1080/10717544.2018.1551439 |
| [105] |
Flannery CA, Saleh FL, Choe GH, et al. Differential expression of IR-A, IR-B and IGF-1R in endometrial physiology and distinct signature in adenocarcinoma[J]. J Clin Endocrinol Metab, 2016, 101: 2883-2891. DOI:10.1210/jc.2016-1795 |
| [106] |
Vella V, Milluzzo A, Scalisi NM, et al. Insulin receptor isoforms in cancer[J]. Int J Mol Sci, 2018, 19: 3615. DOI:10.3390/ijms19113615 |
| [107] |
Chang CH, Lin JW, Wu LC, et al. Oral insulin secretagogues, insulin, and cancer risk in type 2 diabetes mellitus[J]. J Clin Endocrinol Metab, 2012, 97: E1170-E1175. DOI:10.1210/jc.2012-1162 |
| [108] |
Brown JC, Rickels MR, Troxel AB, et al. Dose-response effects of exercise on insulin among colon cancer survivors[J]. Endocr Relat Cancer, 2018, 25: 11-19. DOI:10.1530/ERC-17-0377 |
| [109] |
Han L, Zhang GF, Cheng YH, et al. Correlations of insulin-like growth factor I and insulin-like growth factor I receptor with the clinicopathological features and prognosis of patients with colon cancer[J]. Jpn J Clin Oncol, 2016, 46: 1127-1134. |
| [110] |
Lu CC, Chu PY, Hsia SM, et al. Insulin induction instigates cell proliferation and metastasis in human colorectal cancer cells[J]. Int J Oncol, 2017, 50: 736-744. DOI:10.3892/ijo.2017.3844 |
| [111] |
Chen X, Liang H, Song Q, et al. Insulin promotes progression of colon cancer by upregulation of ACAT1[J]. Lipids Health Dis, 2018, 17: 122. DOI:10.1186/s12944-018-0773-x |
| [112] |
Li C, Xu MM, Wang K, et al. Macrophage polarization and meta-inflammation[J]. Transl Res, 2018, 191: 29-44. DOI:10.1016/j.trsl.2017.10.004 |
| [113] |
Gedawy A, Martinez J, Al-Salami H, et al. Oral insulin delivery:existing barriers and current counter-strategies[J]. J Pharm Pharmacol, 2018, 70: 197-213. DOI:10.1111/jphp.12852 |
| [114] |
Geho WB, Geho HC, Lau JR, et al. Hepatic-directed vesicle insulin:a review of formulation development and preclinical evaluation[J]. J Diabetes Sci Technol, 2009, 3: 1451-1459. DOI:10.1177/193229680900300627 |
| [115] |
Fonte P, Araújo F, Reis S, et al. Oral insulin delivery:how far are we?[J]. J Diabetes Sci Technol, 2013, 7: 520-531. DOI:10.1177/193229681300700228 |
| [116] |
Khedkar A, Lebovitz H, Fleming A, et al. Impact of insulin tregopil and its permeation enhancer on pharmacokinetics of metformin in healthy volunteers:randomized, open-label, placebo-controlled, crossover study[J]. Clin Transl Sci, 2019, 12: 276-282. DOI:10.1111/cts.12609 |
| [117] |
Eldor R, Arbit E, Corcos A, et al. Glucose-reducing effect of the ORMD-0801 oral insulin preparation in patients with uncontrolled type 1 diabetes:a pilot study[J]. PLoS One, 2013, 8: e59524. DOI:10.1371/journal.pone.0059524 |
| [118] |
Easa N, Alany RG, Carew M, et al. A review of non-invasive insulin delivery systems for diabetes therapy in clinical trials over the past decade[J]. Drug Discov Today, 2019, 24: 440-451. DOI:10.1016/j.drudis.2018.11.010 |
 2020, Vol. 55
2020, Vol. 55


