作者贡献:简敬一撰写了主体内容; 陈辉煌和洪其生撰写了部分内容; 王侣欢撰写了部分内容并提供了部分材料; 赵瑜梅辅助撰写并提供了部分材料; 李磊提供了部分材料; 张婷婷和周海波做了辅助修改; 江正瑾对整篇文章进行了构思并做了主要修改。
利益冲突:无任何利益冲突。
2. 暨南大学华侨医院康复科, 广东 广州 510630
2. Rehabilitation Department of the First Affiliated Hospital of Jinan University, Guangzhou 510630, China
天然产物是自然界生物在长久进化过程中经自然选择所保留下来的次生代谢物, 其来源十分广泛, 包括动物、植物、海洋生物、微生物等。由于其具有高度生物多样性及化学结构复杂性, 如何从海量复杂多样的化合物中筛选出具有潜在药物活性的成分一直是天然产物研究的热点与难点[1]。随着现代科学技术的发展, 尤其是高效液相色谱与紫外、荧光、质谱等结构、活性检测仪器的联用, 复杂体系中活性成分的筛选技术取得了很大进展[2]。本文对以液相色谱为平台发展出的柱前、柱上和柱后3种药物活性筛选模式, 包括超滤、磁性微球垂钓、细胞膜色谱、细胞膜亲和色谱、固定化酶、在线生物测定及微馏分活性评价等进行了综述, 以期为天然产物研究提供技术支持。
1 柱前配体垂钓柱前筛选模式是指基于配体-受体结合理论, 将作用靶点酶或受体与天然产物进行共同孵育, 直接从复杂体系中快速准确地垂钓出能与受体作用的潜在活性成分, 并将其分离收集, 而后经进一步的活性测试和结构解析, 筛选出具有成药活性的单体化合物。典型的柱前配体垂钓技术有超滤法和磁性微球垂钓法等, 本文将以这两种技术为例说明其技术特点及相关应用。
1.1 超滤法早期的超滤技术主要应用于配体-蛋白热力学和动力学参数研究中, 近年开始应用于天然产物提取物中活性成分的筛选。超滤质谱联用技术最早由van Breemen等[3]提出, 目的是从复杂体系中筛选出能和目标受体结合的潜在化合物。如图 1所示, 超滤法以生物膜作为分离介质, 分子量不同的生物大分子和样品中的小分子可被间隔于膜两侧实现分离。将天然产物提取物与靶蛋白在一定条件下共孵育, 其中与靶蛋白有结合作用的成分则与之形成蛋白-配体复合物; 接着采用超滤膜对孵育液进行离心处理, 此时未与靶蛋白结合的自由小分子将会透过超滤膜, 实现与靶蛋白及蛋白-配体复合物分离的目的; 后续利用有机溶剂或者改变pH使靶蛋白变性, 使蛋白-配体复合物解离, 并经LC-MS对小分子进行分析鉴定[4-6]。

|
Figure 1 Flow chart of ultrafiltration |
超滤法有off-line和on-line两种操作模式。在off-line模式中, 超滤室与LC-MS平台相对独立, 超滤得到的样品经手动进样进入LC-MS系统进行分离分析。Xiao等[7]运用off-line超滤-HPLC-MS模式, 以变性脂肪酶作为对照排除假阳性, 从五苓散、泽泻、小柴胡和小陷胸4种降血脂药中快速筛选出了包括2-羟基十七烷-1, 2, 3-三羧酸(2-hydroxy-heptadecane-1, 2, 3-tricarboxylic acid)和十五烷-2反, 9顺-二烯-12, 14-二炔酸(2-羟基异丁基)酰胺[pentadeca-2t, 9c-dien-12, 14-diynoic acid (2-hydroxyisobutyl)amide]在内的总共16个潜在的脂肪酶抑制剂。Zhao等[8]构建了off-line超滤-HPLC-ESI-Q-TOF/MS活性筛选平台并应用于乙酰胆碱酯酶抑制剂的筛选, 从黄连根提取物中筛选并鉴定出巴马汀、黄连碱和小檗碱等5种具有乙酰胆碱酯酶抑制活性的化合物。Wang等[9]利用相似的off-line超滤-LC-PDA-ESI-MS平台从卷柏中筛选黄嘌呤氧化酶抑制剂, 并运用高效逆流色谱法(HPCCC)分离并纯化得到了两个潜在抑制剂。而on-line模式利用脉冲超滤(pulsed ultrafiltration, PUF)将超滤室直接与LC-MS平台连接, 超滤得到的样品可直接进行在线定性定量分析[10]。Beverly等[11]利用on-line模式超滤活性筛选平台从加标的细菌发酵液提取物中快速筛选富集得到了碳酸酐酶抑制剂乙氧唑酰胺, 实验流程仅耗时5 min。Liu等[12]针对更年期综合征, 应用on-line超滤模式, 从红三叶草、越橘和啤酒花中筛选得到了三羟基异黄酮、异黄酮和芒柄花黄素等潜在的雌激素受体抑制剂。
超滤法能有效富集分离与靶蛋白有结合的配体, 操作简便且成本较低, 通过与液相和质谱等技术联用可实现潜在活性成分的快速分离鉴定。但该方法仍存在一些缺点:超滤法中由于非特异性吸附造成的假阳性结果, 一般需通过失活靶蛋白组或血清蛋白替换组的平行对照实验来排除; 此外, 超滤法筛选主要基于靶蛋白和配体之间的亲和作用, 因此仅仅评估配体对靶蛋白的亲和力, 无法直接反映其生物活性。
1.2 磁性微球垂钓法磁性微球一般是以Fe3O4为内核, 经有机聚合物包裹, 再经表面修饰而成的复合材料[13]。除了具备机械强度高、耐酸碱及易于生物改性等优势外, 纳米级别的磁性微球具有出众的超顺磁性, 使其成为天然产物活性化合物筛选中备受青睐的固体载体。磁性微球垂钓法就是以表面经功能化基团修饰的磁性纳米材料作为载体, 将靶蛋白、酶或受体等通过共价键合的方式固定在活化后的磁性纳米材料上, 然后用于复杂体系中相应配体的垂钓[14-16]。该法通常包含孵育、分离、解离及分析这4个步骤[14, 17], 如图 2所示, 天然产物提取物首先与固定有靶蛋白的磁性微球共孵育, 其中有亲和力的配体化合物与靶蛋白结合形成磁珠-蛋白-配体复合物, 通过磁分离, 复合物与未结合的其他小分子分离, 而保留在磁性微球上的配体成分经缓冲液及有机溶剂依次洗脱、收集、结构鉴定, 最终筛选得到与靶蛋白结合的化合物信息。磁性微球制备简单、比表面积大、悬浮稳定性好且易于修饰, 对低浓度和低亲和力的化合物具有高灵敏度是该方法的突出优势[18, 19]。此外, 其特有的磁性使其表面固定的蛋白易与反应体系分离, 从而提高蛋白的重复使用率, 降低筛选成本。

|
Figure 2 Flow chart of magnetic beads based ligand fishing |
磁性微球垂钓法能够灵活地与多种生化分析技术联用, 筛选活性化合物的同时进行成分鉴定。Li等[20]将磁性微球垂钓法结合HPLC和MS, 从人面果提取物中分离鉴定得到了3种潜在的α淀粉酶抑制剂。Zhao等[21]在HPLC-MS/MS分离分析平台的基础上, 利用磁性微球垂钓法从金银花提取物中筛选出4种潜在的神经氨酸酶抑制剂, 从延胡索提取物中筛选出7种潜在的单胺氧化酶A抑制剂[22]。de Moraes等[23]通过系统性制备、表征和优化, 将朊病毒蛋白结合到磁珠上, 再结合UPLC-ESI-MS/MS平台, 从已知复杂体系中找到了抗朊病毒(PrPC)配体, 并且验证了该技术应用于朊病毒蛋白配体筛选的可行性。Singh等[17]首先利用α葡萄糖苷酶修饰的磁珠从青藤提取物中垂钓潜在的α葡萄糖糖苷酶抑制剂, 再结合HPLC-HRMS-SPE-NMR分离分析和结构鉴定平台, 得到4种潜在的抑制剂并发现了6种新的烷基间苯二酚糖苷类化合物。磁性微球垂钓法基于配体和靶蛋白之间的亲和作用, 因此也存在非特异性吸附和难以直接评估配体生物活性的问题。使用失活靶蛋白修饰的磁珠作为空白对照, 可以很大程度排除非特异性吸附引起的假阳性结果。
2 柱上特殊修饰柱上筛选模式是指以经表面修饰的色谱分离材料为载体, 通过共价或吸附等方式将靶蛋白固定在其表面上, 并以此作为色谱系统的固定相, 利用化合物与固定相表面靶蛋白间的特异性亲和作用, 从而将目标化合物从复杂体系中分离出来。
2.1 细胞膜色谱和细胞膜亲和色谱细胞膜色谱法是由He等[24]建立的一种基于生物色谱的集活性筛选、检测与化合物的分析鉴定于一体的筛选技术。该方法将表面含有众多受体的活性组织或细胞破碎, 离心得到细胞膜后使其固定在活化硅胶的表面, 制成细胞膜固定相, 天然产物提取物跟随流动相进入色谱柱, 与固定相上的细胞膜受体发生相互作用。在此过程中, 与特定细胞膜受体有特异性结合的成分会表现出特异性的保留行为[25, 26]。Wang等[27, 28]制备的SH-SY5Y细胞膜被用于研究复方白葛胶囊成分对血管舒张的影响, 结果表明欧前胡素和异欧前胡素能有效放松大脑基底动脉和肠系膜动脉。另一款固定了A431细胞系细胞膜的色谱柱, 被应用于表皮生长因子受体拮抗剂的识别, 最终从苦参根中筛选出苦参碱和氧化苦参碱两个新的拮抗剂。
相较于细胞膜色谱法, 细胞膜亲和色谱制备的不同点在于其使用模拟细胞膜环境的固定相基质(immobilized artificial monolayer stationary phase)制备得到的固定化人工膜(immobilized artificial membrane, IAM)[25]。Maciuk等[29]在一项来源于人表皮鳞状细胞的细胞膜亲和色谱的应用中, 从苦参中筛选出了苦参素和苦参碱作为表皮生长因子受体的激动剂。值得一提的是, Habicht等[30]在研究神经胶质瘤(glioblastoma multiforme)的工作中, 使用人LN-229细胞系分别制备了细胞膜亲和色谱柱与细胞核膜亲和色谱柱, 并进行了表征和测试, 证明核膜也能为该技术所运用。
细胞膜色谱和细胞膜亲和色谱中常用的分析方法有前沿色谱法和Missing Peak色谱法。前沿色谱法利用色谱图像中突变与平台交替出现表示组分开始与蛋白特异性结合或者结合到达饱和状态, 其中突变曲线的拐点与配体浓度相关, 而配体的保留时间则与其亲和力相关[31, 32]。Missing Peak色谱法使用非转染的细胞系制备固定相作为阴性对照, 阴性对照所得的指纹图谱会有个别峰在实验组所得的指纹图谱中消失, 这个消失的峰即对应了具有亲和力的化合物。
细胞膜色谱法和细胞膜亲和色谱法具有色谱分离和受体识别的双重特性, 适用于进行复杂体系中活性成分筛选及药物与细胞膜受体相互作用研究。在固定相的制备过程中, 为了保持边界脂质的完整性, 确保蛋白活性, 膜蛋白的固定通常以物理吸附为主。其模拟的生物膜环境能最佳还原蛋白真实活性, 能够直接识别有亲和力的配体, 并且通过后续的分析方法, 一定程度上得到化合物活性大小的数据。但其分析过程中要求的流动相的高水相比例, 限制了可分析的天然产物极性。
2.2 固定化酶固定化酶是指通过吸附、包埋、共价键合、交联及微束等物理或化学方法, 将酶限定在水不溶性载体上并保持其生物催化功能的技术手段[33, 34], 该技术在天然产物活性筛选中被广泛应用。固定化酶与天然产物提取物中化合物发生相互作用, 具有亲和力的成分保留在固定相上实现与未结合成分的在线分离, 后经解吸附及液相质谱分离鉴定等步骤, 可快速高效地获取天然产物中活性成分的信息。酶经固定化, 其理化性质会有一定的变化, 与游离酶相比, 其稳定性通常会增高, 目前认为是因为限制了酶的空间伸展而避免了活性结构域的形变或破坏, 同时限制了酶之间相互作用而引起的自身降解。此外其pH耐受范围也会较游离酶变宽, 这主要得益于载体本身的荷电性。与游离酶体系相比, 固定化酶体系操作更为简便, 易与反应体系分离, 在重复利用得以实现的同时最大化降低甚至消除了酶引起的体系污染, 提高了方法的重现性和稳定性[33-35]。
Jonker等[36]结合动态蛋白亲和DPAC-SPE (层析-固相萃取)平台筛选和鉴定了复杂混合物中雌激素受体α的配体。Peng等[37]将嘌呤氧化酶固定在硅胶颗粒表面上, 制备成填充色谱材料, 将其作为一维生物色谱, 发挥其亲和固相萃取的功能, 通过与二维液相-质谱(2D-LC-MS)联用, 实现了天然产物中嘌呤氧化酶抑制剂的快速分离分析, 该方法简便高效且特异性强。Wang等[38]首次将乙酰胆碱酯酶固定在整体聚合物色谱柱上, 并结合LC-MS构建了在线的乙酰胆碱酯酶抑制剂的活性筛选平台。固定有乙酰胆碱酯酶的整体柱用于筛选天然产物提取物中有亲和力的成分; 而阴性对照组使用未固定乙酰胆碱酯酶的相同整体柱进行平行实验, 用于排除非特异性吸附的干扰。实验从延胡索中筛选出黄连碱、小檗碱、延胡索乙素等8种对乙酰胆碱酯酶表现有亲和力的成分, 并在体外实验中测试了8种成分对乙酰胆碱酯酶的抑制活性。然而与细胞膜(亲和)色谱相同, 固定化酶在实现在线筛选的同时, 为保证酶的生物活性对流动相水相比例有较高的要求, 从分子极性上限制了可应用的天然产物范围。
3 柱后生物测定法柱后的生物测定法是从复杂体系中筛选活性化合物的一种强力手段, 利用色谱柱对天然产物提取物进行分离。在分流阀的作用下, 色谱柱后流出液根据实验需求分成不同的流路, 一部分直接进入质谱进行在线的结构鉴定, 另一部分可在反应环中进行充分的生物反应后进入检测器, 即在线生物测定法; 或将柱后流出液进行在线收集, 而后进行离线的活性测试, 即微馏分活性评价法。
3.1 在线生物测定法在线生物测定法将化学分离[39]和生化监测实现在线同步, 从而可同时进行活性评估与成分鉴定[40, 41]。Potterat等[39]在该领域进行了大量研究, 如图 3所示, 该方法的设计思路如下:经HPLC分离的天然产物提取物样品通过分流, 让其中一条通路进入质谱检测器进行分子鉴定。在另一条通路中先加入靶蛋白, 于第一反应圈中使样品与靶蛋白进行孵育。样品与靶蛋白出圈后, 加入靶蛋白的特异性底物或配体, 底物或配体于第二反应圈中与靶蛋白进行孵育, 反应得到的产物随着通路被送往紫外、质谱或荧光检测器等进行监测。当没有样品与靶蛋白在第一反应圈孵育或者样品分离后的无活性成分与靶蛋白孵育后, 后续产物监测的信号输出保持恒定; 当分离所得的活性化合物在第一反应圈与靶蛋白孵育后, 蛋白活性受到影响, 该影响最终体现为产物信号检测的变化——升高或降低。最终将MS的结果与生物活性检测的结果进行对照, 可以发现影响酶活性的成分, 并且根据生物活性检测信号变化的大小, 可以一定程度反映样品的活性大小。

|
Figure 3 Flow chart of on-line bioassay-guided screening |
van Elswijk等[41]以牛奶为样品, 血管紧张素转化酶为靶蛋白, 发现了12种血管张素转化酶的抑制剂。更进一步, 将该模式与流式细胞仪联用, 可以实现从天然产物中筛选细胞级别样本的靶标。Otvos等[42]的一项细胞级别的筛选实验中, 在线生物测定法成功运用于人类SH-SY5Y细胞系上乙酰胆碱受体活性化合物的筛选。在线生物测定法所体现的自动化是目前活性筛选技术研究追求的共同目标之一, 但其仍然存在很多局限:在线生物测定平台搭建往往比较复杂, 连接原本独立的各个模块常存在困难; 基于HPLC的在线生物测定, 为了保证蛋白乃至细胞的生物活性, 有机流动相的使用也受到了限制。
3.2 微馏分活性评价法如图 4所示, 微馏分活性评价法[43, 44]核心是经HPLC分离的天然产物提取物在分流后, 一部分进入质谱检测器获得化合物的结构信息, 而另一部分则通过微馏分收集系统收集到多孔板中, 待溶剂挥发后, 选择合适的缓冲液向多孔板中加入靶蛋白和相应的配体, 监测生化反应的信号, 完成离线的生物活性检测。最终将质谱的结果与生物活性检测的结果进行对照, 可以发现影响酶活性的成分。相比于在线生物测定法, 离线的微馏分活性评价法虽自动化程度相对较低, 但其稳定性和准确性却可相对提高, 避免了在线模式下有机相的存在对靶蛋白生物活性的影响, 也能更灵活地与更多活性检测技术联用。
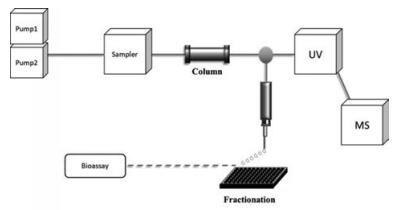
|
Figure 4 Flow chart of bioassay-guided fractionation |
为了更进一步提高筛选效率和分辨率, Mladic等[45]以微馏分活性评价法为基础系统发展改进出了Nanofractionation的高分辨率筛选系统。采用384微孔板将每个微孔的体积降低到微升级别, 使得每个微孔的成分复杂程度大大降低。到目前为止, 该课题组使用Nanofractionation技术已经成功从MK-7123代谢产物中筛选出趋化因子受体CXCR1和CXCR2的配体并充分分析了两种受体的不同表现; 从VUF11211代谢产物中筛选出了CXCR3的配体[46]; 从蘑菇中筛选出了乙酰胆碱受体的配体[47]以及从蛇毒中筛选出了凝血酶与Xa因子的抑制剂[48]。微馏分活性评价法可根据实验需求灵活地与多种技术联用, 如高分辨质谱、拉曼光谱等, 适应性十分广泛。相比在线活性测定法, 微馏分活性评价法同样可以根据生物活性检测的信号变化程度反映样品活性大小, 且更易于建立, 具备更广的适用性。但是即便是目前的微升级别, 也对靶蛋白和配体的用量要求较大, 不利于珍稀样本的活性筛选, 进一步微型化是该技术的发展方向之一。
4 结论以天然产物为重要来源的新药开发离不开药物活性筛选技术的支持, 更快、更灵敏、更准确和更高通量的药物活性筛选技术始终是研究者的追求目标。从成本、难度、结果等方面考虑, 以上介绍的技术在复杂体系活性成分筛选中各自具备其独特的优势与局限, 因而其各自的适用范围也不尽相同(表 1)。柱前配体垂钓技术更利于从天然产物复杂体系中快速分离和富集靶蛋白的亲和配体, 但非特异性吸附导致的假阳性需设置对照组排除, 此外由于分离和生物活性测试不同步, 筛选分离后还需提纯单体进行潜在配体的生物活性验证, 显著增加了实验成本和操作复杂程度。柱上特殊修饰法自动化程度较高, 且利于模拟靶蛋白的真实生物环境, 但这也限制了实际应用中色谱分离条件的选择, 此外, 该方法也无法避免后续的生物活性测试步骤。柱后生物测定法可同步进行活性筛选和活性评估, 其中在线生物测定法的自动化程度最高, 但平台搭建复杂且应用难度较高; 微馏分活性评价法部分牺牲了系统的自动化程度, 增加了可结合的活性检测技术种类, 从而降低了平台搭建和应用的难度, 拓展了样本应用的范围。筛选天然产物中的活性成分, 应根据实际需求选择合适的技术或组合。为了突破现有方法的局限与发展新的技术, 需要不断地结合实践, 总结归纳现有经验并进行改进和创新。
| Table 1 List of LC-based methods for screening active compounds from natural products |
| [1] |
Wolfender JL, Marti G, Thomas A, et al. Current approaches and challenges for the metabolite profiling of complex natural extracts[J]. J Chromatogr A, 2015, 1382: 136-164. DOI:10.1016/j.chroma.2014.10.091 |
| [2] |
Newman DJ, Cragg GM. Natural products as sources of new drugs over the 30 years from 1981 to 2010[J]. J Nat Prod, 2012, 75: 311-335. DOI:10.1021/np200906s |
| [3] |
van Breemen RB, Huang CR, Nikolic D. Pulsed ultrafiltration mass spectrometry: a new method for screening combinatorial libraries[J]. Anal Chem, 1997, 69: 2159-2164. DOI:10.1021/ac970132j |
| [4] |
Yang ZZ, Zhang YF, Sun LJ, et al. An ultrafiltration high-performance liquid chromatography coupled with diode array detector and mass spectrometry approach for screening and characterising tyrosinase inhibitors from mulberry leaves[J]. Anal Chim Acta, 2012, 719: 87-95. DOI:10.1016/j.aca.2012.01.018 |
| [5] |
Choi Y, Jennihov K, Nam SJ, et al. Screening natural products for inhibitors of quinone reductase-2 using ultrafiltration LC-MS[J]. Anal Chem, 2011, 83: 1048-1052. DOI:10.1021/ac1028424 |
| [6] |
Mulabagal V, Calderon AI. Development of an ultrafiltration-liquid chromatography/mass spectrometry (UF-LC/MS) based ligand-binding assay and an LC/MS based functional assay for mycobacterium tuberculosis shikimate kinase[J]. Anal Chem, 2010, 82: 3616-3621. DOI:10.1021/ac902849g |
| [7] |
Xiao S, Yu R, Ai N, et al. Rapid screening natural-origin lipase inhibitors from hypolipidemic decoctions by ultrafiltration combined with liquid chromatography-mass spectrometry[J]. J Pharm Biomed Anal, 2015, 104: 67-74. DOI:10.1016/j.jpba.2014.11.022 |
| [8] |
Zhao HQ, Zhou SD, Zhang MM, et al. An in vitro AChE inhibition assay combined with UF-HPLC-ESI-Q-TOF/MS approach for screening and characterizing of AChE inhibitors from roots of Coptis chinensis Franch[J]. J Pharm Biomed Anal, 2016, 120: 235-240. DOI:10.1016/j.jpba.2015.12.025 |
| [9] |
Wang J, Liu S, Ma B, et al. Rapid screening and detection of XOD inhibitors from S. tamariscina by ultrafiltration LC-PDA-ESI-MS combined with HPCCC[J]. Anal Bioanal Chem, 2014, 406: 7379-7387. DOI:10.1007/s00216-014-8132-x |
| [10] |
Johnson BM, Nikolic D, van Breemen RB. Applications of pulsed ultrafiltration-mass spectrometry[J]. Mass Spectrom Rev, 2002, 21: 76-86. DOI:10.1002/mas.10020 |
| [11] |
Beverly MB, West P, Julian RK. Evaluation of a micro volume pulsed ultrafiltration cell for screening ligands in non-covalent complexes[J]. Comb Chem High Throughput Screen, 2002, 5: 65-73. DOI:10.2174/1386207023330606 |
| [12] |
Liu JH, Burdette J, Xu HY, et al. Evaluation of estrogenic activity of plant extracts for the potential treatment of menopausal symptoms[J]. J Agric Food Chem, 2001, 49: 2472-2479. DOI:10.1021/jf0014157 |
| [13] |
Marszall MP, Moaddel R, Kole S, et al. Ligand and protein fishing with heat shock protein 90 coated magnetic beads[J]. Anal Chem, 2008, 80: 7571-7575. DOI:10.1021/ac801153h |
| [14] |
Moaddel R, Marszall MP, Bighi F, et al. Automated ligand fishing using human serum albumin-coated magnetic beads[J]. Anal Chem, 2007, 79: 5414-5417. DOI:10.1021/ac070268+ |
| [15] |
Yasuda M, Wilson DR, Fugmann SD, et al. Synthesis and characterization of SIRT6 protein coated magnetic beads:identification of a novel inhibitor of SIRT6 deacetylase from medicinal plant extracts[J]. Anal Chem, 2011, 83: 7400-7407. DOI:10.1021/ac201403y |
| [16] |
Vanzolini KL, Jiang ZJ, Zhang XQ, et al. Acetylcholinesterase immobilized capillary reactors coupled to protein coated magnetic beads:a new tool for plant extract ligand screening[J]. Talanta, 2013, 116: 647-652. DOI:10.1016/j.talanta.2013.07.046 |
| [17] |
Singh N, Ravichandran S, Spelman K, et al. The identification of a novel SIRT6 modulator from Trigonella foenum-graecum using ligand fishing with protein coated magnetic beads[J]. J Chromatogr B, 2014, 968: 105-111. DOI:10.1016/j.jchromb.2014.03.016 |
| [18] |
Jonker N, Kretschmer A, Kool J, et al. Online magnetic bead dynamic protein-affinity selection coupled to LC-MS for the screening of pharmacologically active compounds[J]. Anal Chem, 2009, 81: 4263-4270. DOI:10.1021/ac9000755 |
| [19] |
Wubshet SG, Brighente IM, Moaddel R, et al. Magnetic ligand fishing as a targeting tool for HPLC-HRMS-SPE-NMR:alpha-glucosidase inhibitory ligands and alkylresorcinol glycosides from Eugenia catharinae[J]. J Nat Prod, 2015, 78: 2657-2665. DOI:10.1021/acs.jnatprod.5b00603 |
| [20] |
Li Y, Chen Y, Xiao C, et al. Rapid screening and identification of alpha-amylase inhibitors from Garcinia xanthochymus using enzyme-immobilized magnetic nanoparticles coupled with HPLC and MS[J]. J Chromatogr B, 2014, 960: 166-173. DOI:10.1016/j.jchromb.2014.04.041 |
| [21] |
Zhao YM, Wang LH, Luo SF, et al. Magnetic beads-based neuraminidase enzyme microreactor as a drug discovery tool for screening inhibitors from compound libraries and fishing ligands from natural products[J]. J Chromatogr A, 2018, 1568: 123-130. DOI:10.1016/j.chroma.2018.07.031 |
| [22] |
Zhang YY, Wang QQ, Liu RJ, et al. Rapid screening and identification of monoamine oxidase-A inhibitors from Corydalis Rhizome using enzyme-immobilized magnetic beads based method[J]. J Chromatogr A, 2019, 1592: 1-8. DOI:10.1016/j.chroma.2019.01.062 |
| [23] |
de Moraes MC, Santos JB, dos Anjos DM, et al. Prion protein-coated magnetic beads:synthesis, characterization and development of a new ligands screening method[J]. J Chromatogr A, 2015, 1379: 1-8. DOI:10.1016/j.chroma.2014.12.014 |
| [24] |
He LC, Wang SC, Geng XD. Coating and fusing cell membranes onto a silica surface and their chromatographic characteristics[J]. Chromatographia, 2001, 54: 71-76. DOI:10.1007/BF02491836 |
| [25] |
Moaddel R, Wainer IW. The preparation and development of cellular membrane affinity chromatography columns[J]. Nat Protoc, 2009, 4: 197-205. DOI:10.1038/nprot.2008.225 |
| [26] |
Moaddel R, Cloix JF, Gozen E, et al. Multiple receptor liquid chromatographic stationary phases:the co-immobilization of nicotinic receptors, γ-amino-butyric acid receptors, and N-methyl D-aspartate receptors[J]. Pharm Res, 2002, 19: 104-107. DOI:10.1023/A:1013619802766 |
| [27] |
Wang YJ, Zhang YM, Ma WN, et al. The vasodilatation effects of four active components in baige capsule and the potential mechanism of them with the NMDA receptor[J]. Curr Pharm Anal, 2015, 11: 173-179. DOI:10.2174/1573412911666150106235124 |
| [28] |
Wang S, Sun M, Zhang Y, et al. A new A431/cell membrane chromatography and online high performance liquid chromatography/mass spectrometry method for screening epidermal growth factor receptor antagonists from Radix Sophorae Flavescentis[J]. J Chromatogr A, 2010, 1217: 5246-5252. DOI:10.1016/j.chroma.2010.06.037 |
| [29] |
Maciuk A, Moaddel R, Haginaka J, et al. Screening of tobacco smoke condensate for nicotinic acetylcholine receptor ligands using cellular membrane affinity chromatography columns and missing peak chromatography[J]. J Pharm Biomed Anal, 2008, 48: 238-246. DOI:10.1016/j.jpba.2007.11.024 |
| [30] |
Habicht KL, Frazier C, Singh N, et al. The synthesis and characterization of a nuclear membrane affinity chromatography column for the study of human breast cancer resistant protein (BCRP) using nuclear membranes obtained from the LN-229 cells[J]. J Pharm Biomed Anal, 2013, 72: 159-162. DOI:10.1016/j.jpba.2012.10.001 |
| [31] |
Ng ESM, Chan NWC, Lewis DF, et al. Frontal affinity chromatography-mass spectrometry[J]. Nat Protoc, 2007, 2: 1907-1917. DOI:10.1038/nprot.2007.262 |
| [32] |
Singh N, Ravichandran S, Norton DD, et al. Synthesis and characterization of a SIRT6 open tubular column:predicting deacetylation activity using frontal chromatography[J]. Anal Biochem, 2013, 436: 78-83. DOI:10.1016/j.ab.2013.01.018 |
| [33] |
Sheldon RA, van Pelt S. Enzyme immobilisation in biocatalysis:why, what and how[J]. Chem Soc Rev, 2013, 42: 6223-6235. DOI:10.1039/C3CS60075K |
| [34] |
Hanefeld U, Gardossi L, Magner E. Understanding enzyme immobilisation[J]. Chem Soc Rev, 2009, 38: 453-468. DOI:10.1039/B711564B |
| [35] |
Zucca P, Sanjust E. Inorganic materials as supports for covalent enzyme immobilization:methods and mechanisms[J]. Molecules, 2014, 19: 14139-14194. DOI:10.3390/molecules190914139 |
| [36] |
Jonker N, Kool J, Krabbe JG, et al. Screening of protein-ligand interactions using dynamic protein-affinity chromatography solid-phase extraction-liquid chromatography-mass spectrometry[J]. J Chromatogr A, 2008, 1205: 71-77. DOI:10.1016/j.chroma.2008.07.089 |
| [37] |
Peng MJ, Shi SY, Chen L, et al. Online coupling solid-phase ligand-fishing with high-performance liquid chromatography-diode array detector-tandem mass spectrometry for rapid screening and identification of xanthine oxidase inhibitors in natural products[J]. Anal Bioanal Chem, 2016, 408: 6693-6701. DOI:10.1007/s00216-016-9784-5 |
| [38] |
Wang LH, Zhao YM, Zhang YY, et al. Online screening of acetylcholinesterase inhibitors in natural products using monolith-based immobilized capillary enzyme reactors combined with liquid chromatography-mass spectrometry[J]. J Chromatogr A, 2018, 1563: 135-143. DOI:10.1016/j.chroma.2018.05.069 |
| [39] |
Potterat O, Hamburger M. Concepts and technologies for tracking bioactive compounds in natural product extracts:generation of libraries, and hyphenation of analytical processes with bioassays[J]. Nat Prod Rep, 2013, 30: 546-564. DOI:10.1039/c3np20094a |
| [40] |
Lakayan D, Haselberg R, Niessen WMA, et al. On-line coupling of surface plasmon resonance optical sensing to size-exclusion chromatography for affinity assessment of antibody samples[J]. J Chromatogr A, 2016, 1452: 81-88. DOI:10.1016/j.chroma.2016.05.033 |
| [41] |
van Elswijk DA, Diefenbach O, van der Berg S, et al. Rapid detection and identification of angiotensin-converting enzyme inhibitors by on-line liquid chromatography-biochemical detection, coupled to electrospray mass spectrometry[J]. J Chromatogr A, 2003, 1020: 45-58. DOI:10.1016/j.chroma.2003.08.055 |
| [42] |
Otvos RA, van Nierop P, Niessen WMA, et al. Development of an online cell-based bioactivity screening method by coupling liquid chromatography to flow cytometry with parallel mass spectrometry[J]. Anal Chem, 2016, 88: 4825-4832. DOI:10.1021/acs.analchem.6b00455 |
| [43] |
Booij P, Vethaak AD, Leonards PEG, et al. Identification of photosynthesis inhibitors of pelagic marine algae using 96-well plate microfractionation for enhanced throughput in effect-directed analysis[J]. Environ Sci Technol, 2014, 48: 8003-8011. DOI:10.1021/es405428t |
| [44] |
Kool J, Giera M, Irth H, et al. Advances in mass spectrometry-based post-column bioaffinity profiling of mixtures[J]. Anal Bioanal Chem, 2011, 399: 2655-2668. DOI:10.1007/s00216-010-4406-0 |
| [45] |
Mladic M, Scholten DJ, Niessen WMA, et al. At-line coupling of LC-MS to bioaffinity and selectivity assessment for metabolic profiling of ligands towards chemokine receptors CXCR1 and CXCR2[J]. J Chromatogr B, 2015, 1002: 42-53. DOI:10.1016/j.jchromb.2015.08.004 |
| [46] |
Mladic M, Scholten DJ, Wijtmans M, et al. Metabolic profiling of ligands for the chemokine receptor CXCR3 by liquid chromatography-mass spectrometry coupled to bioaffinity assessment[J]. Anal Bioanal Chem, 2015, 407: 7067-7081. DOI:10.1007/s00216-015-8867-z |
| [47] |
Otvos RA, Mladic M, Arias-Alpizar G, et al. At-line cellular screening methodology for bioactives in mixtures targeting the 7-nicotinic acetylcholine receptor[J]. J Biomol Screen, 2016, 21: 459-467. DOI:10.1177/1087057115625307 |
| [48] |
Mladic M, Zietek BM, Iyer JK, et al. At-line nanofractionation with parallel mass spectrometry and bioactivity assessment for the rapid screening of thrombin and factor Xa inhibitors in snake venoms[J]. Toxicon, 2016, 110: 79-89. DOI:10.1016/j.toxicon.2015.12.008 |
 2020, Vol. 55
2020, Vol. 55


