作者贡献:燕攀负责论文的撰写与修改; 李森和贾帅龙负责部分内容的撰写与学术方面的修改; 杜支凤负责论文的修改与指导; 姜宏梁负责论文的修改及提供经费等支持。
利益冲突:作者声明没有竞争性经济利益冲突。
2. 华中科技大学同济医学院附属协和医院, 湖北 武汉 430030
2. Union Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, China
中药是中国传统中药的统称, 经过数千年的医疗实践和发展, 在世界医药学领域中自成体系。由于大多中药不良反应小, 使得中药研究逐渐成为当今热点。然而, 中药植化成分复杂多样, 其药效物质基础的研究俨然为一个“黑箱”体系。另外, 中药药效具有“多成分, 多靶标”的特点, 因此中药药效物质基础的研究以及质量控制方法的建立和完善已经成为阻碍中药现代化的难题[1]。
随着分析仪器的快速发展, 液质联用技术的出现为中药研究带来了巨大的机遇。LC-MS/MS已逐步成为复杂样品定性与定量分析的主要手段, 将液相色谱优异的分离性能与质谱高灵敏度、高选择性的特点相结合, 能够获得丰富的结构信息, 从而建立快速、高效的分析方法[2]。中药复杂的植化成分导致分离提纯难度大, 采用LC-MS/MS技术则无需繁琐复杂的样品前处理过程。通过质谱检测器能够获得大量结构信息, 结合已知化合物对照品的质谱裂解规律, 能够对未知化合物进行定性分析。
目前, 中药化学成分研究常借助于对对照品的二级或多级质谱碎片离子进行分析。其中, 高分辨质谱由于具有灵敏度高、扫描速度快和质量范围宽等优点, 已被广泛应用于中药植化成分的快速鉴定[3]。目前高分辨质谱主要有傅立叶变换离子回旋共振质谱(Fourier transform ion cyclotron resonance, FT-ICR)、飞行时间质谱(time-of-flight, TOF)、四级杆串联飞行时间质谱(quadrupole time-of-flight, QTOF)和线性离子阱串联静电场轨道阱质谱(linear ion trap quadrupole-Orbitrap, LTQ-Orbitrap)等。相对于高分辨质谱, 常见的低分辨质谱包括离子阱质谱(ion trap, IT)、三重四级杆质谱(triple quadrupole, QQQ)以及结合前两种质谱优点的三重四级杆线性离子阱质谱(triple quadrupole linear ion trap, QTRAP)[4]。虽然低分辨质谱的扫描速度与分辨率不及高分辨质谱, 但QTRAP特有的“杆-阱”扫描模式, 如增强型全扫描(enhanced mass scan, EMS)、增强子离子扫描(enhanced product ion, EPI)、多反应监测扫描(multiple reaction monitoring, MRM)、多离子监测扫描(multiple ion monitoring, MIM)和前体离子扫描(precursor ion scan, PREC)等, 在鉴定复杂基质中的微量成分与痕量成分方面具有独特的优势[5]。另外, 除了在低分辨质谱数据处理中常用到的提取离子流色谱法(extracted ion chromatogram, EIC)、中性丢失过滤法(neutral loss filter, NLF)、产物离子过滤法(product ion filter, PIF)外, 高分辨质谱特有的质量亏损过滤法(mass defect filter, MDF)、同位素过滤法(isotope pattern filter, IPF)和背景扣除(background subtraction, BS)等数据处理方法也常被用于中药复杂体系及其代谢产物的研究[6, 7]。
近年来LC-MS/MS技术已被应用于各种中药成分的研究, 各种新的研究方法和策略不断被提出。这些研究方法首先制备植化成分对照品, 并运用二级质谱研究其特征碎片离子, 总结不同亚型的裂解规律。随后, 通过高分辨质谱获得中药提取物中各化合物的精确分子量, 结合不同质谱技术及扫描模式得到的信息, 借助特征碎片离子对中药的主要及微量成分进行全面的表征。本文对目前中药植化成分研究的各种方法与策略进行了综述, 以期为相关研究提供借鉴。
1 基于高分辨液质联用技术的分析策略紫草素类与紫草呋喃类化合物作为药用紫草的主要成分, 具有抗菌、抗炎和抗氧化等多种药理活性[8, 9]。为了评价药用紫草资源品质和药效物质基础, 应寻找有效的方法来全面表征紫草素类与紫草呋喃类化合物。Liao等[10]提出一种基于超高效液相色谱串联四级杆飞行时间质谱(UHPLC-QTOF-MS/MS)技术的紫草素类与紫草呋喃类化合物定性分析方法, 系统地鉴定了紫草中该类化合物。首先, 由于紫草素类以萘醌环为基本骨架, 而紫草呋喃类化合物含有呋喃连苯二酚骨架, 并均有不同的异己烯侧链。如图 1所示, 依据结构将化合物划分为Moiety A和Moiety B两部分。其次, 紫草素和紫草呋喃类化合物的二级质谱具有相似的质谱裂解行为。所以, 依据Moiety A的诊断离子及其特征碎片离子将该类化合物划分紫草素亚型Ⅰ~Ⅴ和紫草呋喃亚型Ⅰ~Ⅱ, 并结合Moiety B的互补离子完成化合物的鉴定。例如, 保留时间为14.11 min的某个化合物, 前体离子提示其分子式为C19H20O7, 诊断离子和特征离子符合Moiety A中紫草素化合物亚型Ⅴ的特征。同时, Moiety B部分羧基负离子m/z为59.016 7, 提示该化合物含有乙酰基。因此, 该紫草素类化合物被暂定为1/4-methoxylithospermidin C。最终, 采用上述“两步法”的数据挖掘策略, 58种紫草素类与紫草呋喃类化合物被成功鉴定, 其中32种为首次报道。该数据挖掘策略为药用紫草资源品质评价和开发利用提供了重要的研究基础。
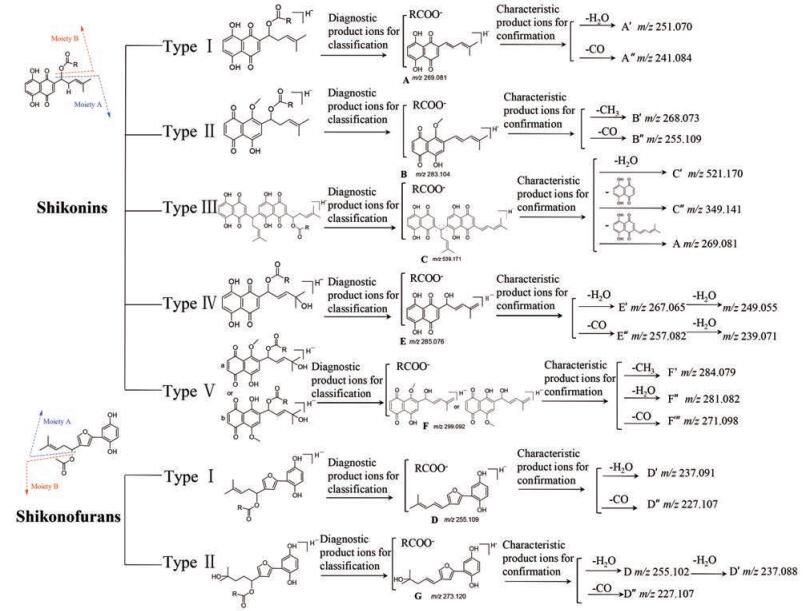
|
Figure 1 Subtypes of shikonins and shikonofurans and their corresponding diagnostic ions[10] |
锦灯笼为茄科酸浆植物Physalis alkekengi L. var. franchetii (Mast.) Makino的灯笼状宿萼, 其主要活性成分为酸浆苦素类化合物。酸浆苦素类化合物基本骨架结构为13, 14-裂环-16, 24-环麦角甾烷[11]。Huang等[12]基于UHPLC-QTOF-MS/MS技术, 建立一种新颖的“三步”数据挖掘策略, 用于快速发现、鉴定酸浆苦素类化合物。第一步, 将酸浆苦素骨架划分为Moiety A和B。在数据挖掘过程中, 利用Moiety B产生的诊断离子m/z 71.012 8或m/z 73.028 4来筛选酸浆苦素, 进而区分C-25和C-27之间的结合模式; 第二步, 通过Moiety A的诊断离子将酸浆苦素分为Ⅰ~Ⅴ类; 第三步, 确定它们的亚型, 并通过从H2O、CO、CO2、CH3OH和HCl的中性丢失获得各自的特征离子来表征其化学结构。例如, 通过m/z为71.012 8的诊断离子, 筛选出前体离子为509.180 6的化合物, 因此该化合物的分子式为C28H30O9。Moiety B产生的诊断离子m/z 73.028 4的出现, 提示该化合物C-25为一个甲基。然后, 通过Moiety A产生的诊断离子m/z 133.064 8和m/z 121.064 8, 将该化合物划分为Type III型酸浆苦素类化合物。最后, 通过中性丢失的特征离子补充鉴定, 该化合物暂定为physalin R。结果显示, 通过数据挖掘策略从锦灯笼中共鉴定出46种酸浆苦素, 其中20种为新发现的酸浆苦素。该研究为锦灯笼不同部位及其他酸浆属植物种类的快速发现奠定了基础, 并为锦灯笼原料药的质量控制提供了科学依据。
石蒜属(Lycoris Herb.)是石蒜科(Amaryllidaceae)东亚特有属, 富含多种类型的生物碱类成分。这些生物碱类成分具有抗肿瘤、抗炎和抗心血管疾病等药理活性, 具有极高的研究价值[13]。目前, 该属植物所含的生物碱类成分研究有待完善。Li等[14]首次建立了基于UHPLC-QTOF-MS/MS技术的石蒜科生物碱定性分析方法。首先, 通过UHPLC-QTOF-MS/MS研究对照品的质谱裂解规律, 从TOF-MS和TOF-MS/MS获取保留时间和母离子及子离子的精确分子量信息。基于对照品的结构特征和裂解规律, 石蒜碱型生物碱可以划分为4个亚型。Subtype L1的C环和D环没有双键, 且C-3和C-3a间无氧桥; Subtype L2的C-3与C-3a间有双键; Subtype L3的C-3a和C-4间有一个双键, 且C-1、C-2和C-3有取代基; Subtype L4, C环和D环没有双键, C-3和C-3a间存在氧桥。其次, 运用数据挖掘策略快速鉴定石蒜碱类生物碱, 包括3个关键步骤: ①使用不同亚型中出现较多且质荷比恒定的特征离子以筛选候选化合物; ②通过特定的诊断离子对筛选出的候选化合物进行亚型的归属和表征; ③通过中性丢失H2O、CH3OH、HCHO、CO、CH4、CH3COOH、甲基自由基和甲氧基自由基等产生的碎片离子对结构进行合理化。例如, 过滤特征离子149.059 8 (L1a)得到某候选化合物, 其保留时间为19.72 min, 精确分子量为332.149 2, 推断该化合物分子式为C18H21NO5。由于同时观测到诊断离子L1b、L1c和L1d, 该化合物确定为Subtype L1亚型。分子离子中性丢失CH3COOH, 暗示该化合物结构中有乙酰氧基。最终, 结合对照品的裂解行为推断该化合物为1-acetoxydihydrolycorine。结果显示, 通过该策略共鉴定出37种石蒜科生物碱, 其中16种为未经报道的新化合物。研究中所建立的定性分析策略为石蒜属植物的质量控制与评价奠定了基础。
姜黄(Curcuma longa L.)作为一种药食同源中药, 主要活性成分为姜黄素类化合物[15]。目前, 大多数研究者主要集中于姜黄素、去甲氧基姜黄素和双去甲氧基姜黄素的鉴定和定量, 缺少系统研究具有潜在活性的微量姜黄素类化合物。姜黄素类化合物的结构由两侧的芳环及中间的庚烷或戊烷骨架组成, 为典型的二苯基庚烷类结构。Jia等[16]基于UHPLC-QTOF-MS/MS技术, 提出一种对姜黄中的姜黄素类化合物进行全面表征的策略, 并归纳了不同骨架类型的姜黄素在正负离子模式下的质谱裂解规律。首先, 基于一种类型的芳基能够在特定类型的姜黄素类化合物中发现, 其他类型的芳基也可能存在于这类姜黄素类化合物中的假设, 依据划分的骨架和芳基类型对潜在的姜黄素类化合物结构进行预测; 其次, 通过提取相应的正、负模式下的前体离子来验证预测的化合物是否存在于样品中。根据化合物前体离子、特定的产物离子和相应的保留时间等信息, 并结合本团队之前对已知姜黄素类化合物裂解规律的研究[17, 18], 对姜黄素类化合物的结构进行了全面表征和合理化。最后, 排除同位素峰导致的假阳性结果。通过该研究方法和策略, 共检测到89个姜黄素类化合物, 其中16个为新检测的姜黄素类化合物。
中药泽泻(Alismatis Rhizoma)是泽泻科植物泽泻的干燥块茎, 其主要活性成分为泽泻三萜类化合物[19, 20]。这类化合物属于四环三萜类结构, 结构主要为环戊烷并多氢菲母核, 其C-17连接一个含8个碳原子的侧链。Li等[21]基于UHPLC-QTOF-MS/MS技术, 建立了一种全面表征泽泻三萜类成分的方法。首先, 通过对泽泻三萜类化合物对照品的质谱裂解规律研究, 总结其诊断离子, 该类化合物依据结构特点划分为3种亚型。如图 2所示, 泽泻Ⅰ型以alisol A 24-acetate为代表, 包含常规的四元环和侧链。泽泻Ⅱ型相对于Ⅰ型, 其C-16为羰基取代, 如alisol C 23-acetate。泽泻Ⅲ型以alisol F 24-acetate为代表, C-16和C-23位因羟基脱水呈现出与Ⅰ、Ⅱ型差异较大含氧五元环结构。然后, 运用QTOF-MS/MS的全扫模式和Peak View软件的Fragment Filter功能, 通过特征离子和中性丢失碎片过滤出3种类型的三萜类化合物。值得注意的是, 羟基的数目可以由中性丢失H2O来确定, 而丢失60 Da则被用于判断乙酰基的存在。最后, 根据精确分子量、碎片离子和保留时间信息, 对含有特征离子的各类泽泻三萜化合物进行确认。以化合物16-oxo-22-hydroxy-alisol A的鉴定过程(图 3)[22]为例, 通过诊断离子m/z 353.246 5筛选得到Ⅱ型化合物, 其分子离子峰m/z 521.345 8经过中性丢失4个H2O形成子离子, 其m/z为449.311 0;基峰m/z 413.270 2则由分子离子峰的C-23与C-24位断裂脱去90 Da, 母核11位的羟基脱水形成。该结构再次中性丢失一个H2O形成子离子, 即m/z 395.256 6。结合保留时间和其他碎片信息可以确定该化合物为16-oxo-22-hydroxy-alisol A。通过该策略, 共有80个泽泻三萜类化合物被成功鉴定, 其中包含14种新泽泻三萜化合物, 为泽泻降脂药效物质基础和质量控制奠定了基础。
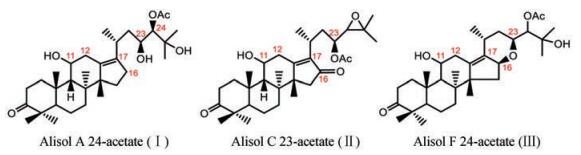
|
Figure 2 Representative compounds of type I, II and III triterpenoids in Alismatis rhizome |
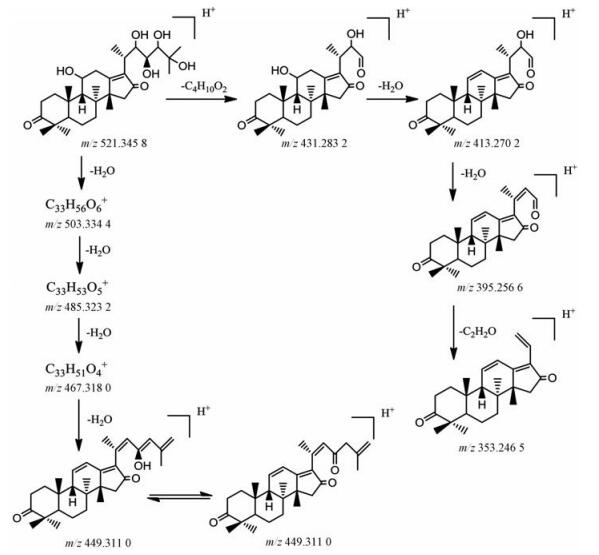
|
图 3 The proposed fragmentation pathway of 16-oxo-22-hydroxy-alisol A in ESI-QTOF-MS/MS[22] |
预知子为木通科植物Akebia quinata (Thunb.) Decne.、A. trifoliata (Thunb.) Koidz.和A. trifoliata (Thunb.) Koidz. var. australis (Diels) Rehd.的干燥果实, 具有疏肝理气、活血止痛的功效[23]。Ma等[24]提出一种基于UPLC-QTOF-MS技术的“四步过滤”策略, 用于全面分析预知子的主要化学成分。该策略由如下四步构成: ①通过前体离子和加合离子获得化合物的精确质量数, 以推断候选化合物的分子式; ②利用诊断离子对化合物进行分类, 划分为Ⅰ~Ⅸ共9种三萜皂苷和mono-CQA、di-CQA两种绿原酸类化合物; ③特征离子过滤(CIF)被用于确定取代基的位置和糖链数目; ④基于中性丢失(NL), 进一步确定了三萜皂苷中单糖的类型和糖链的组成, 同时确定绿原酸的结构。以化合物79的鉴定过程为例, 化合物79包含苷元诊断离子m/z 439.321 0, 归属为Ⅰ型三萜皂苷。由于[M+HCOO]-和[M-H]-分别为m/z 763.427 5和717.422 0, 从而推断出其分子式为C40H62O11。通过146 Da和132 Da的中性丢失产生的碎片离子571.363 3和439.321 0, 推断出糖链结合在C-3位。经过上述四步策略, 化合物79被鉴定为akebonoic acid-3-O-Ara-Rha-28-oic acid。该研究通过对照品的裂解规律、诊断离子、特征产物离子和中性丢失, 建立了“四步”过滤策略, 并从预知子提取物中共鉴定出94种化合物, 其中包含85种三萜皂苷和9种绿原酸类似物。
艾叶(Folium Artemisiae Argyi)具有抗菌、抗病毒、抗氧化、保肝利胆、止血及抗凝血、抗过敏、免疫调节和抗癌等药理作用[25]。Ren等[26]基于超高效液相色谱-四级杆-静电场轨道阱联用(UPLC-Q-Orbitrap-MS/MS)技术, 提出了一种结合氮原子规则过滤(NRF)、MDF、诊断碎片离子过滤(DFIF)和NLF, 以确定复杂样品中微量组分的策略。通过该策略能够从原始的UPLC-HRMS数据中去除不相关或干扰的离子, 并尽可能保留感兴趣组分的质谱信息, 以提高数据处理效率。对于艾叶提取物, 采用该策略能够快速检测和鉴定其中的绿原酸类似物和甲氧基黄酮类化合物。第一步, 利用MZmine软件对原始的UHPLC-MS数据进行处理, 提取full-MS扫描产生的母离子; 第二步, 根据氮原子规则剔除与目标化合物m/z不一致的母离子。甲氧基黄酮化合物和绿原酸类似物不含氮原子, 则其[M-H]-的质量数应当为奇数; 第三步, 通过MDF筛选出母离子。MDF可以有效滤除质量亏损值落在预定质量亏损窗口之外的母离子; 第四步, 使用NLF和DFIF进一步筛选余下的母离子。由于甲氧基黄酮能够丢失甲基自由基, 因此中性丢失(15 Da)被用于检测甲氧基黄酮类化合物。另外, 绿原酸类似物基本骨架为奎宁酸(quinic acid), 因此可以利用碎片诊断离子[quinic acid-H]-m/z 191.055 2筛选绿原酸类似物。该研究通过整合各种过滤方法, 从艾叶提取物中成功筛选并鉴定出16个甲氧基黄酮类化合物和55个绿原酸类似物。
2 基于整合液质联用技术的分析策略LC-MS/MS由于其独特的优势, 已经成为中药复杂体系定性、定量分析的主要手段之一[27]。高/低分辨质谱都在复杂样品分析中得到了广泛应用。然而, 对应的非靶向和靶向扫描模式各有其优缺点。低分辨质谱具有多种特有的扫描模式, 灵敏度高、选择性好, 对微量成分检测具有一定的优势, 但无法提供化合物精确质量数。高分辨质谱具有分辨率高, 质量范围宽, 能同时测定前体离子和子离子的精确质量等优点, 但缺少靶标性扫描模式, 对微量成分的检测不如前者[28]。因此, 通过组合优势互补的高/低分辨质谱鉴定中药活性成分具有极大的优势。
野核桃(Juglans cathayensis Dode)为胡桃科胡桃属植物, 分布在我国西北、西南等地[29], 其主要药效成分为萘醌类化合物。为了系统评价野核桃萘醌类化合物的药效物质基础, Gan等[30]基于LC-MS/MS技术, 提出一种系统鉴定野核桃中萘醌类成分的“四步法”。该策略如图 4所示, 第一步, 总结10个萘醌类化合物对照品的质谱裂解规律, 并通过诊断离子对萘醌胺和萘醌苷类化合物进行快速筛选和分类; 第二步, 采用特定前体离子的MIM-EPI技术对靶标性萘醌类化合物进行鉴定。MIM-EPI模式在靶标性分析时灵敏度和特异性较低, 但能够在Q1和Q3监测相同离子, 无需提前获取化合物的裂解规律, 在监测二级信息未知的靶标化合物方面有着独特优势; 第三步, 为了系统、全面地鉴定萘醌类化合物, 比较了QTRAP-MS/MS不同扫描模式, 如EMS-EPI、不同扫描范围stepwise MIM-EPI和PREC-EPI在分析痕量化合物中的特点。对于化合物全扫描分析, 宽质量范围的stepwise MIM-EPI比EMS-EPI灵敏度和特异性要高。由于循环时间与监测的MIM离子对数目会影响低含量化合物的检测, 采用分段stepwise MIM-EPI相较于宽范围模式能提高复杂样品中低含量化合物的检测能力。另外, PREC-EPI对于具有相同结构片段的化合物检测有很高的灵敏度; 第四步, 通过QTOF-MS/MS的精确质量数和MS/MS谱图, 对萘醌类化合物进行结构合理化和确认。最终, 从野核桃中共鉴定出48种萘醌类化合物, 其中包含24种新化合物。

|
Figure 4 Systematic analysis of naphthoquinones in Juglans cathayensis dode using integrated LC-MS/MS[30] |
Terpecurcumins是近年来从姜黄中发现的一类新型萜烯共轭姜黄素类化合物。Qiao等[31]以姜黄中萜烯共轭姜黄素类化合物为例, 提出一种多重中性丢失/前体离子(NL/PRE)扫描结合结构识别和统计分析的策略(MNPSS), 用于该类化合物的快速鉴定和新结构的发现。利用QqQ-MS和orbitrap-MS分析18种对照品的MS/MS谱图, 并依据萜烯单元与姜黄素类化合物单元的结合方式, 对照品的结构被划分为4类, 包括COC、CC、DA和MC。通过总结对照品的特征碎片离子发现, 12种中性丢失/前体离子(NL/PRE)被用于鉴定该类化合物。靶标性数据挖掘能够快速识别该类化合物, 主要步骤为: ①在full-MS模式下筛选出潜在化合物, 得到对应的母离子信息; ②利用QqQ-MS具有较高灵敏度的中性丢失/前体离子(NL/PRE)扫描模式, 获得对应中性丢失/前体离子(NL/PRE)的提取离子流图; ③记录12组中性丢失/前体离子(NL/PRE)扫描的每个色谱峰; ④通过比较中性丢失/前体离子(NL/PRE)扫描谱图和对照品来识别化合物结构; ⑤利用HRMS和MS/MS确认化合物的结构信息。以m/z 601的化合物为例, 提取离子流图中共检测到18种化合物。由于这些化合物中性丢失/前体离子(NL/PRE)扫描的响应各不相同, 为初步的结构表征创造了条件。化合物406、412、501和514使用的前体扫描离子为m/z 366, 表明它们为含有姜黄素类化合物结构的COC型。化合物445、450、460、471能中性丢失218 Da, 则属于CC型。类似地, 通过中性丢失220 Da判断化合物534、601和614可能属于DA型。化合物398和465能中性丢失194 Da, 表明它们属于MC/CC型。同时, HRMS和MS/MS提示除614和619分子式为C37H46O7外, 其他16个化合物分子式为C36H42O8。化合物501、460和601与对照品具有相似的中性丢失/前体离子(NL/PRE)和MS/MS谱图, 因此501、460和601的倍半萜烯单元可能衍生自α-turmerone和intermedin B。类似的, 18个化合物中大部分被初步表征。通过该靶标性分析策略, 在姜黄提取物中共检测出846种terpecurcumins。在非靶标性分析中, 总流离子图中每个化合物被视作观测值, 其对应的12组NL/PRE响应值作为变量。由于相同结构类型的化合物具有相似的NL/PRE谱图。因此, 可以采用主成分分析(PCA)将NL/PRE扫描模式中相似的数据点分别归为COC、CC、DA和MC组, 而主成分图中离群值所代表的化合物很容易被发现, 被视为潜在的新化合物。
3 基于液质联用技术的中药质量控制及药效物质基础研究姜黄在中国的诸多省份均有分布, 其中以四川产姜黄品质最佳。然而, 不同产地的姜黄素类活性成分的含量存在明显差异, 市售的其他省份的姜黄常被误认为道地药材。由于不同产地姜黄的形态相似, 很难确定它们的来源。因此, 对药材中的姜黄素进行定性和定量分析, 对于姜黄的质量控制具有重要意义。Jin等[32]基于LC-MS/MS技术对姜黄素类化合物进行了全面表征, 并整合姜黄素类化合物的MRM离子对和保留时间, 建立了基于LC-QTRAP-MS/MS技术的特征轮廓谱分析方法。随后, 以四川产姜黄为标准来分析10个产地姜黄的质量, 并采用热图分析了96种姜黄素类化合物的相对含量。结果显示, 其他产地姜黄中所含姜黄素类化合物的总含量与道地药材产地存在明显差别。此外, 许多微量的姜黄素类化合物在非道地药材区域的姜黄中未被检测到。通过对姜黄素类化合物进行相对定量分析, 能对姜黄的质量进行控制和评价。
盐泽泻与麸泽泻由两种不同的炮制方式得到, 其中盐泽泻具有较强的利尿活性, 而麸泽泻拥有较强的健脾功能。这可能是由于泽泻经过高温处理后出现脱水或者脱乙酰基, 从而导致泽泻三萜类成分发生改变。然而, 原料泽泻和泽泻炮制品的三萜类成分差异还未被系统报道。Li等[21]在UHPLC-QTOF-MS/MS分析基础上, 建立了基于MRM的特征轮廓谱分析方法, 对泽泻三萜类成分进行了全面表征, 对不同产地、炮制手段的泽泻样品中三萜成分差异进行了研究。基于QTRAP-MS/MS的MRM技术建立的特征轮廓谱能够将复杂的QTOF总离子流色谱图简化, 且泽泻三萜化合物的响应约为QTOF-MS/MS的3倍, 因此特别适合微量化合物的检测和定量分析。特征轮廓谱显示, 经炮制后的泽泻样品中三萜相对含量发生不同程度的变化。炮制过程中泽泻三萜类成分含量变化可能归因于发生在C-24和C-25的三元环开裂, C-11、C-23、C-24和C-25羟基的脱水及去乙酰基导致三萜类成分的同分异构体出现。另外, 四川、福建和江西产泽泻的MRM特征轮廓谱具有明显差异, 川泽泻和建泽泻三萜类成分种类相近, 仅含量有所差异。江西产泽泻样品在化学成分和三萜相对含量上与其他两个样品有较大差异, 共有23种三萜类成分未被检测出。不同产地的泽泻由于含量差异而具有不同的药理活性。本研究所建立的MRM特征轮廓谱分析方法对不同产地/炮制手段的泽泻药材质量控制具有潜在的应用价值。
现代药理学研究证明, 泽泻可通过降低血清总胆固醇、低密度脂蛋白胆固醇水平、动脉粥样硬化指数等有效降低血脂[33, 34]。Alisol B 23-acetate是泽泻中含量最高的三萜类化合物之一, 被作为中国药典中泽泻的质量标志物(Q-Marker)。但中药植化成分复杂, 仅采用单一泽泻三萜化合物难以反映泽泻的内在品质[35]。基于本研究团队之前对泽泻三萜类化合物的全面表征, Li等[21, 36]建立了基于MRM特征轮廓谱-支持向量机模型的方法, 来筛选泽泻中具有降脂活性的三萜类化合物。第一步, 建立了基于UHPLC-QTRAP-MS/MS的泽泻三萜MRM特征轮廓谱, 对30组泽泻样品中的87个泽泻三萜类化合物进行了相对定量分析; 第二步, 3T3-L1前脂肪细胞被用于检测30组泽泻样品的降脂效果; 第三步, 利用粒子群优化支持向量机在87个泽泻三萜类化合物中筛选出降脂活性成分; 第四步, 采用实验验证或者重新构建支持向量机模型, 对部分筛选出的降脂活性成分进行了验证。结果显示, 在87个泽泻三萜类化合物中共筛选出9个活性化合物, 其中部分化合物已被实验证实具有降脂活性, 为泽泻降血脂的药效物质基础提供了理论依据。
基于前期UHPLC-QTOF-MS/MS技术的紫草素类与紫草呋喃类化合物定性分析策略[10], Liao等[37]通过UHPLC-MS/MS和化学计量学方法研究了紫草中紫草素和紫草呋喃类化合物抗肿瘤活性的谱效关系。首先, 沿用前期的数据挖掘策略对混合紫草样品进行全面数据解析和结构鉴定; 其次, 整合UHPLC-QTOF-MS/MS和UHPLC-QTRAP-MS/MS, 应用TOF-Product Ion Scan、EMS-IDA-EPI、NL-IDA-EPI、PREC-IDA-EPI、MIM-IDA-EPI和MRM-IDA-EPI等靶向性和非靶向性扫描模式分析混合的紫草样品, 以识别尽可能多的新成分; 再次, 利用UHPLC-QTRAP-MS/MS (pMRM-IDA-EPI)对紫草素和紫草呋喃进行鉴定和初步表征, 该方法整合了所有已知和预测结构的MRM离子对、保留时间和EPI图谱; 最后, 利用UHPLC-QTRAP-MS/MS (MRM)建立特征轮廓谱。利用建立的特征轮廓谱方法分析紫草素和紫草呋喃类化合物的相对含量, 再结合正交偏最小回归分析(orthogonal projections to latent structures, OPLS)与抗肿瘤活性相关联, 揭示紫草潜在的药效物质基础。结果显示, 在混合紫草样品中共检测到73种紫草素类和紫草呋喃类化合物, 并筛选出27个活性成分。其中, 紫草素(shikonin)、乙酰紫草素(acetylshikonin)和β, β-二甲基丙烯酰紫草素(β, β-dimethylacrylshikonin)已在其他文献中被证实具有抑制HeLa的活性, 为紫草药材的质量控制和抗肿瘤活性的物质基础提供了科学依据。
4 结论与展望中药复杂的化学成分是其具有多种药理活性的物质基础。为了对中药化学成分进行全面表征, 研究者们需要采用分离能力和结构鉴定功能兼备的分析仪器。随着LC-MS/MS的发展, 该技术尤其适用于复杂体系及微量(痕量)成分的定性定量分析。但面对高通量的数据, 如何快速发现有效信息并进行数据处理成为亟需解决的问题。利用液质联用技术及质谱裂解规律开发相应的分析方法和策略对于中药化学成分的定性定量分析具有重要的意义。该研究为中药质量控制及药效物质基础研究提供了新的技术手段, 势必会促进中药现代化的发展。
| [1] |
Liu J, Xiao HB. Research progress on pharmacodynamic substances of Chinese medicine based on chromatographic techniques[J]. Acta Pharm Sin (药学学报), 2019, 54: 89-97. |
| [2] |
Yuan J, Xue Y, He H. Application of combined technique of liquid chromatography-mass spectrometry to pharmacodynamic material basis of traditional Chinese medicine[J]. Int J Tradit Chin Med (国际中医中药杂志), 2019, 41: 548-550. |
| [3] |
Li ZH, Guo XM, Cao ZL, et al. New MS network analysis pattern for the rapid identification of constituents from traditional Chinese medicine prescription Lishukang capsules in vitro and in vivo based on UHPLC/Q-TOF-MS[J]. Talanta, 2018, 189: 606-621. DOI:10.1016/j.talanta.2018.07.020 |
| [4] |
López-Ruiz R, Romero-González R, Garrido Frenich A. Ultrahigh-pressure liquid chromatography-mass spectrometry:an overview of the last decade[J]. TrAC Trends Anal Chem, 2019, 118: 170-181. DOI:10.1016/j.trac.2019.05.044 |
| [5] |
Shi ML, Song YL, Chen JF, et al. Identification of metabolites in rat plasma, bile, urine and feces after oral administration of Cinnamomi Cortex aqueous extract by UPLC-Qtrap-MS[J]. China J Chin Mater Med (中国中药杂志), 2019, 44: 4720-4727. |
| [6] |
Jin Y, Wu CS, Zhang JL, et al. A new strategy for the discovery of epimedium metabolites using high-performance liquid chromatography with high resolution mass spectrometry[J]. Anal Chim Acta, 2013, 768: 111-117. DOI:10.1016/j.aca.2013.01.012 |
| [7] |
Hou JJ, Zhang JQ, Yao CL, et al. Deeper chemical perceptions for better traditional Chinese medicine standards[J]. Engineering, 2019, 5: 83-97. DOI:10.1016/j.eng.2018.12.005 |
| [8] |
Cheng M, Tang J, Li SS. Recent advances in the research on pharmacological actions and quantitative analyses of naphthoquinones in Chinese medicinal herb "Zicao"[J]. Acta Pharm Sin (药学学报), 2018, 53: 89-102. |
| [9] |
Zhu MY, Yu RB, Zhou W, et al. Antitumor effect research progress of shikonin and its derivatives[J]. Acta Pharm Sin (药学学报), 2012, 47: 588-593. |
| [10] |
Liao M, Li AQ, Chen C, et al. Systematic identification of shikonins and shikonofurans in medicinal Zicao species using ultra-high performance liquid chromatography quadrupole time of flight tandem mass spectrometry combined with a data mining strategy[J]. J Chromatogr A, 2015, 1425: 158-172. DOI:10.1016/j.chroma.2015.11.028 |
| [11] |
Matsuura T, Kawai M, Nakashima R, et al. Structures of physalin A and physalin B, 13, 14-seco-16, 24-cyclo-steroids from Physalis alkekengi var. franchetii[J]. J Chem Soc Perkin 1, 1970, 5: 664-670. |
| [12] |
Huang C, Xu QM, Chen C, et al. The rapid discovery and identification of physalins in the calyx of Physalis alkekengi L.var. franchetii (Mast.) Makino using ultra-high performance liquid chromatography-quadrupole time of flight tandem mass spectrometry together with a novel three-step data mining strategy[J]. J Chromatogr A, 2014, 1361: 139-152. DOI:10.1016/j.chroma.2014.08.004 |
| [13] |
Ji YB, Xin GS, Qu ZY, et al. Research progress on chemical constituents and pharmacological effects of alkaloids from plants of Lycoris herb[J]. Chin Tradit Herb Drugs (中草药), 2016, 47: 157-164. |
| [14] |
Li AQ, Du ZF, Liao M, et al. Discovery and characterisation of lycorine-type alkaloids in Lycoris spp. (Amaryllidaceae) using UHPLC-QTOF-MS[J]. Phytochem Anal, 2019, 30: 268-277. DOI:10.1002/pca.2811 |
| [15] |
Sun Y, Peng ML. Recent advances in curcumin and its derivatives for treatment of liver diseases[J]. Acta Pharm Sin (药学学报), 2014, 49: 1483-1490. |
| [16] |
Jia SL, Du ZF, Song CW, et al. Identification and characterization of curcuminoids in turmeric using ultra-high performance liquid chromatography-quadrupole time of flight tandem mass spectrometry[J]. J Chromatogr A, 2017, 1521: 110-122. DOI:10.1016/j.chroma.2017.09.032 |
| [17] |
Jiang HL, Somogyi A, Jacobsen NE, et al. Analysis of curcuminoids by positive and negative electrospray ionization and tandem mass spectrometry[J]. Rapid Commun Mass Spectrom, 2006, 20: 1001-1012. DOI:10.1002/rcm.2401 |
| [18] |
Jiang HL, Timmermann BN, Gang DR. Use of liquid chromatography-electrospray ionization tandem mass spectrometry to identify diarylheptanoids in turmeric (Curcuma longa L.) rhizome[J]. J Chromatogr A, 2006, 1111: 21-31. DOI:10.1016/j.chroma.2006.01.103 |
| [19] |
Jin HG, Jin QL, Ryun Kim A, et al. A new triterpenoid from Alisma orientale and their antibacterial effect[J]. Arch Pharm Res, 2012, 35: 1919-1926. DOI:10.1007/s12272-012-1108-5 |
| [20] |
Zhu YL, Peng GP. Progress in the study on chemical constituents of Alisma orientalis[J]. Nat Prod Res Dev (天然产物研究与开发), 2006, 18: 348-351. |
| [21] |
Li S, Jin SN, Song CW, et al. The strategy for establishment of the multiple reaction monitoring based characteristic chemical profile of triterpenes in Alismatis rhizoma using two combined tandem mass spectrometers[J]. J Chromatogr A, 2017, 1524: 121-134. DOI:10.1016/j.chroma.2017.09.057 |
| [22] |
Li S. Elucidation of the Bioactive Ingredients of Alisma orientale for the Treatment of Hyperlipidemia Using UHPLC-MS/MS (基于UHPLC-MS/MS技术的中药泽泻治疗高脂血症的药效物质基础研究)[D]. Wuhan: Huazhong University of Science and Technology, 2016.
|
| [23] |
Jiang D, Lu Q, Xu FM, et al. Chemical constituents from the fruits of Akebiae quinata[J]. Chin Pharm J (中国药学杂志), 2015, 50: 1670-1672. |
| [24] |
Ma BL, Yang SL, Li JM, et al. A four-step filtering strategy based on ultra-high-performance liquid chromatography coupled to quadrupole-time-of-flight tandem mass spectrometry for comprehensive profiling the major chemical constituents of Akebiae Fructus[J]. Rapid Commun Mass Spectrom, 2019, 33: 1464-1474. DOI:10.1002/rcm.8480 |
| [25] |
Cao L, Yu D, Cui L, et al. Research progress on chemical composition, pharmacological effects and product development of Artemi[J]. Drug Eval Res (药物评价研究), 2018, 41: 918-923. |
| [26] |
Ren DB, Ran L, Yang C, et al. Integrated strategy for identifying minor components in complex samples combining mass defect, diagnostic ions and neutral loss information based on ultra-performance liquid chromatography-high resolution mass spectrometry platform:Folium Artemisiae Argyi as a case study[J]. J Chromatogr A, 2018, 1550: 35-44. DOI:10.1016/j.chroma.2018.03.044 |
| [27] |
Zhang QC, He JJ, Bai JF, et al. Rapid screening and quality evaluation for the harmful substance 5-hydroxymethyl furfural in commercially available tranditional Chinese medicine injection using LC-MS/MS method[J]. Acta Pharm Sin (药学学报), 2013, 48: 1705-1709. |
| [28] |
Chen GY, Song CW, Jin SN, et al. An integrated strategy for establishment of metabolite profile of endogenous lysoglycerophospholipids by two LC-MS/MS platforms[J]. Talanta, 2017, 162: 530-539. DOI:10.1016/j.talanta.2016.10.045 |
| [29] |
Yang X, Zhao YX, Zhu JM, et al. The juglone content of the green walnut husk in Jugians cathayensis Dode and the study of antifungal activity[J]. Appl Chem Ind (应用化工), 2019, 48: 242-245. |
| [30] |
Gan Y, Zhang Y, Li AQ, et al. A novel four-step approach for systematic identification of naphthoquinones in Juglans cathayensis Dode using various scan functions of liquid chromatography-tandem mass spectrometry along with data mining strategies[J]. Phytochem Anal, 2015, 26: 413-422. DOI:10.1002/pca.2575 |
| [31] |
Qiao X, Lin XH, Ji S, et al. Global profiling and novel structure discovery using multiple neutral loss/precursor ion scanning combined with substructure recognition and statistical analysis (MNPSS):characterization of terpene-conjugated curcuminoids in curcuma longa as a case study[J]. Anal Chem, 2016, 88: 703-710. DOI:10.1021/acs.analchem.5b02729 |
| [32] |
Jin SN, Song CW, Jia SN, et al. An integrated strategy for establishment of curcuminoid profile in turmeric using two LC-MS/MS platforms[J]. J Pharm Biomed Anal, 2017, 132: 93-102. DOI:10.1016/j.jpba.2016.09.039 |
| [33] |
Hua M, Li Z, Chen DQ, et al. Urinary biomarker and treatment mechanism of Rhizoma Alismatis on hyperlipidemia[J]. Biomed Chromatogr, 2017, 31: e3829. DOI:10.1002/bmc.3829 |
| [34] |
Zhang LL, Xu W, Xu YL, et al. Therapeutic potential of Rhizoma Alismatis:a review on ethnomedicinal application, phytochemistry, pharmacology, and toxicology[J]. Ann N Y Acad Sci, 2017, 1401: 90-101. DOI:10.1111/nyas.13381 |
| [35] |
Li Q, Qu HB. Study on the hypoglycemic activities and metabolism of alcohol extract of Alismatis Rhizoma[J]. Fitoterapia, 2012, 83: 1046-1053. DOI:10.1016/j.fitote.2012.05.009 |
| [36] |
Li S, Wang L, Du ZF, et al. Identification of the lipid-lowering component of triterpenes from Alismatis Rhizoma based on the MRM-based characteristic chemical profiles and support vector machine model[J]. Anal Bioanal Chem, 2019, 411: 3257-3268. DOI:10.1007/s00216-019-01818-x |
| [37] |
Liao M, Yan P, Liu XC, et al. Spectrum-effect relationship for anti-tumor activity of shikonins and shikonofurans in medicinal Zicao by UHPLC-MS/MS and chemometric approaches[J]. J Chromatogr B, 2020, 1136: 121924. DOI:10.1016/j.jchromb.2019.121924 |
 2020, Vol. 55
2020, Vol. 55


