2. 香港浸会大学中医药学院, 香港特别行政区;
3. 新疆维吾尔自治区药物研究所, 新疆 乌鲁木齐 830004;
4. 石河子大学药学院, 新疆特种植物药资源省部共建教育部重点实验室, 新疆 石河子 832000
2. School of Chinese Medicine, Hong Kong Baptist University, Hong Kong, China;
3. Xinjiang Institute of Materia Medica, Urumqi 830004, China;
4. Key Laboratory of Xinjiang Phytomedicine Resources of Ministry of Education, School of Pharmacy, Shihezi University, Shihezi 832000, China
雪莲是菊科风毛菊属的植物(Saussurea DC), 是一种极其名贵的药材。中药经典著作《月王药珍》和《木草纲目拾遗》均有对天山雪莲(SI)的记载。雪莲性温、味甘苦。中医认为该植物具有散寒除湿、活血通经、平衡阴阳的作用。该植物经研究发现有良好的消炎止痛、抗肿瘤、抗氧化、降血脂等作用, 因此具有良好的药物开发的潜力[1]。雪莲有天山雪莲(SI)、苞叶雪莲(SO)、绵头雪兔子(SL)、水母雪兔子(SM)、星状雪兔子(SS)和三指雪兔子(ST)等80个品种, 其中大约有92%的品种在我国分布, 大部分品种分布在青藏高原, 此外在俄罗斯、尼泊尔和印度等国家也有分布[2]。近年来, 有关雪莲的综述十分有限, 大多数的综述仅对雪莲中含有的化合物进行简述, 并未标注其化学结构。本文总结了近35年的研究成果, 在前人基础上对化合物的结构进行了绘制, 并总结了多种雪莲中的化学成分, 如黄酮类、木脂素类、酚醛类、苯丙素类和倍半萜类化合物等生物活性物质。同时更全面地总结了雪莲的药理作用及其相关分子机制, 对其研究现状进行了讨论与分析, 为进一步新药研发提供参考。
1 雪莲的鉴别雪莲根据形态方面的不同, 可以分为雪莲亚属和雪兔子亚属。雪莲亚属的植株有半透明的膜质苞叶, 并包围头状花序, 苞叶多呈黄白色, 如苞叶雪莲(SO)和天山雪莲(SI)的苞叶一般呈淡黄色。除此之外, 两种雪莲的根状茎粗且颈部均被稠密的褐色纤维状撕裂的叶柄残迹。但是, 两者的地域分布存在差异, 苞叶雪莲(SO)一般分布在甘肃、青海、四川、云南和西藏等地; 而天山雪莲(SI)一般只分布在新疆的乌鲁木齐、博克达山与和硕。雪兔子亚属的植株一般较矮小, 叶密, 具有茂密的雪白色的棉毛, 头状花序密集, 代表物种有绵头雪兔子(SL)、水母雪兔子(SM)、星状雪兔子(SS)和三指雪兔子(ST)。绵头雪兔子上端被白色或淡褐色的稠密棉毛, 基部有褐色的叶柄。叶极密, 呈披针形、挟匙形或倒椭圆形。另外3种雪兔子的叶片颜色存在一定的差异:水母雪兔子(SM)的叶片多呈灰绿色; 星状雪兔子(SS)的叶呈莲座状, 多呈紫红色; 而三指雪兔子(ST)的叶片呈白色或灰白色, 同时密被稠密的棉毛[2, 3]。
2 化学成分雪莲中主要含有黄酮类和木脂素类的化合物, 除此之外还含有香豆素类、倍半萜类、酚醛类、苯丙醇类、甾醇类、多糖类化合物和神经酰胺等具有生物活性的化合物。
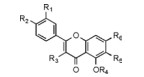
2.1 黄酮类化合物黄酮是雪莲中最主要的活性化合物, 上个世纪80年代, 贾忠建等[4]在天山雪莲(SI)中首先分离出了槲皮素、芦丁和高车前素等多种黄酮化合物。至今为止, 研究者们已经在天山雪莲(SI)、苞叶雪莲(SO)、绵头雪兔子(SL)、水母雪兔子(SM)、星状雪兔子(SS)和三指雪兔子(ST)中分离出了26种黄酮化合物(表 1、表 2)。雪莲中的黄酮类化合物与雪莲的抗肿瘤[5]、抗炎[6]、抗氧化[7]和促进脂质代谢[8]的药理作用有关。
| 表 1 Flavonoids in snow lotus |
| Table 2 Structures of flavonoids in snow lotus |
木脂素是雪莲中第二主要的化合物, 在2000年Takasaki等[18]发现水母雪兔子(SM)中的牛蒡子苷元(arctiin)和牛蒡子素(arctigenin)均具有抗肿瘤的活性。研究表明, 牛蒡子苷和牛蒡子素对由7, 12-dimethylbenz[α]anthracene (DMBA)和12-O-tetradecanoyl-13-acetate (TPA)诱导的皮肤乳头状癌变有抑制作用。此外, 在2004年Cho等[19]发现牛蒡子素能抑制肿瘤坏死因子α (tumor necrosis factor, TNF-α)的表达来发挥其抗炎的药理作用。迄今为止, 人们已经在水母雪兔子(SM)和星状雪兔子(SS)中分离出了18种木脂素类化合物(表 3)。

|
| Table 3 Lignans in snow lotus |
沈进等[9, 12, 15, 17]从绵头雪兔子(SM)和星状雪兔子(SS)等中分离出了11种酚醛类化合物, 分别是4-羟基-苯乙酮、云杉素、2-甲氧基-4-羟基苯甲醛、3-(3-甲氧基苯基)-丙烯醛、2-(4-羟基-3-甲氧基苯基)丙烷-1, 3-二醇、(2S)-3-(4-羟基-3-甲氧基苯基)丙烷-1, 2-二醇、香草酸、4-(羟基甲基)-2, 6-二甲氧基苯基-β-D-吡喃葡萄糖苷、原儿茶酸、4-(2-羟乙基)-2-甲氧基苯基-β-D-吡喃葡萄糖苷和2-(4-羟基-3-甲氧基苯基)乙基-β-D-吡喃葡萄糖苷(表 4)。

|
| 表 4 Phenolic compounds in snow lotus |
雪莲中也含有多种苯丙素类化合物, 其中有8种为香豆素类化合物, 分别是茵芋苷、异东莨菪醇、伞形酮、东莨菪内酯、伞形酮-7-O-β-D-葡萄糖苷、欧前胡素、东莨菪内酯-7-O-β-D-葡萄糖苷和黑麦草内酯[9-11, 20, 21]。它们分布在天山雪莲(SI)、绵头雪兔子(SL)、水母雪兔子(SM)和三指雪兔子(ST)中。有研究表明, 香豆素类化合物可能和抗炎作用有关[22]。除此之外, 陈绮蕾等[9]在绵头雪兔子(SL)、水母雪兔子(SM)和天山雪莲(SI)中还分离出了另外7种苯丙素类化合物, 分别为绿原酸、紫丁香苷、1, 5-二咖啡酰奎宁酸、3, 5-二咖啡酰奎宁酸、4, 5-二咖啡酰奎宁酸、1, 3-二咖啡酰奎宁酸和3, 4-二咖啡酰奎宁酸[9, 10, 13, 21] (表 5)。
| Table 5 Phenylpropanoids in snow lotus |
倍半萜也是雪莲中一种具有很高生物活性成分, 在雪莲中分离出了7种倍半萜[9, 16, 23-25], 分别是3α-羟基-11βH-11, 13-去氢木香内酯-8-O-β-D-葡萄糖苷、3α, 8α-二羟基, 11βH-11, 13-去氢木香内酯、葡聚糖内酯-β-D-葡萄糖苷、11β, 13-去氢木香内酯-8-O-β-D-葡萄糖苷、11β, 13-去氢木香内酯-8-O-[6-O-乙酰基-β-D-葡萄糖苷]、Lanicepomine A和6α-羟基己酸-6-β-D-吡喃葡萄糖苷(表 6)。有研究表明, Lanicepomine A能显著抑制小鼠T细胞的体外增殖, 由此推断该倍半萜类化合物可能具有治疗风湿性关节炎的作用[24]。

|

|
| Table 6 Sesquiterpenes in snow lotus |
除了以上总结的化学成分外, 雪莲中还含有其他种类化合物, 如各种甾醇[13, 14]、3β-hydroxy-5α, 6α-epoxy-7-megastigmen-9-one[20]、saussurostelloside A[17]、saussurostelloside B1[17]、saussurostelloside B2[17]、rel-(3R, 4S, 5S)-3-[(2R)-2-羟基壬二酰基~戊糖氨基]-4-羟基-5-[(4E)-庚烷-4-烯]-2, 3, 4, 5-四氢呋喃[16]、香草酸[12]、葡萄糖香草醇[12]和二十四烷酸[13]。其中神经酰胺rel-(3R, 4S, 5S)-3-[(2R)-2-羟基壬二酰基~戊糖氨基]-4-羟基-5-[(4E)-庚烷-4-烯]-2, 3, 4, 5-四氢呋喃具有抗肿瘤的作用[16]。研究显示, 该种化合物对急性粒细胞白血病细胞(HL-60)、人类黑色素瘤细胞(A375-S2)和人类宫颈癌细胞(HeLa)都具有细胞毒性作用, 其中该种神经酰胺类化合物对A375-S2细胞的抑制作用更强[16]。
由上可知, 几乎所有品种的雪莲都含有黄酮类化合物; 木脂素类化合物、苯丙素类化合物和倍半萜类化合物分别主要分布在水母雪兔子(SM)、绵头雪兔子(SL)和天山雪莲(SI)。研究人员可根据不同的雪莲含有不同种类的化合物, 或者不同含量的化合物的特征利用高相液相色谱对各个品种的雪莲进行质量控制。该方法此前已有先例[9]。虽然雪莲含有的多种活性化合物能为药物开发提供参考, 但由于过分的开采, 目前雪莲的产量已经极其稀少, 人们希望能利用植物组织培养技术增加雪莲的产量, 从而扩大雪莲的临床应用。Guo等[26]发现可以通过外植体组织培养的方法获得雪莲的幼苗, 此类幼苗与野生雪莲具有非常相似的化学成分。与此同时, Kuo等[27]发现通过植物组织培养的方法可以特异性地提高某些活性化合物的含量, 如芦丁和紫丁香苷。由此可见, 植物组织培养技术有望解决雪莲的稀缺问题。
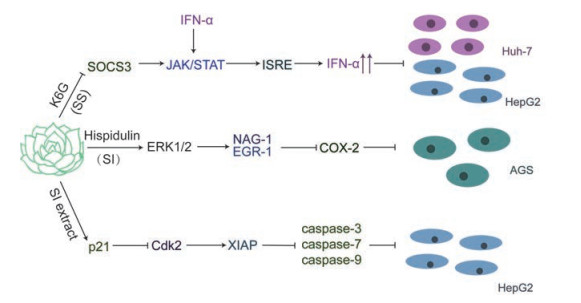
3 药理作用 3.1 抗肿瘤作用雪莲具有明显的抗肿瘤活性, 这与其含有的木脂素[18]、神经酰胺[16]、黄酮[5, 28]等活性化合物的抗癌活性密不可分, 其中对黄酮抗肿瘤的作用及机制研究的较多。雪莲中的黄酮[28]能抑制细胞因子信号转导抑制因子3 (suppressor of cytokine signaling 3, SOCS3)从而激活酪氨酸激酶/信号传导及转录激活蛋白(Janus kinase/Signal transducer and activator of transcription, JAK/STAT)信号通路, 促进干扰素的分泌, 进而抑制肿瘤生长; 也可能通过细胞外信号调节激酶1/2 (extracellular signal-regulated kinase, ERK1/2)信号通路激活非甾体类抗炎药激活基因-1 (NSAIDS activate gene-1, NAG-1)[5], 从而诱导肿瘤细胞凋亡; Byambaragchaa等[29]证明天山雪莲(SI)的萃取液具有阻断DNA合成从而抑制肿瘤细胞增殖和生长的作用。研究发现, 该种雪莲提取物的抗肿瘤活性高, 对正常细胞的毒副作用小。雪莲能为多种难治性肿瘤如肝癌、胃癌等的治疗提供新思路。
3.1.1 抑制SOCS3蛋白从而促进JAK/STAT信号通路的传导Ⅰ型干扰素(interferon α/β, IFN α/β)在一定程度上对肿瘤细胞[30, 31]和病毒[32-34]的生长过程具有抑制作用, 这有赖于JAK/STAT信号通路的调节。IFN-α通过JAK (JAK1和Tyk2)和STAT (STAT1和STAT2)激活IFN受体, 从而进行快速的信号传导, 并形成转录复合体[35]。该转录复合体可以进入细胞核, 特异性地与IFN-α刺激的反应元件(ISRE)结合, 并促进与IFN合成有关基因的转录。然而SOCS家族的蛋白质却可以抑制JAK/STAT信号通路, 从而抑制IFN的表达[36]。星状雪兔子(SS)中的化合物6-羟基-3-O-甲基-山柰酚-6-O-吡喃葡萄糖苷(K6G)能抑制SOCS家族中SOCS3的表达, 可由此增加IFN-α的分泌[28]。该实验表明K6G介导的IFN-α的增多可以抑制肝癌细胞Huh-7和HepG2的增殖。鉴于体外高剂量注射IFN会引起许多不良反应[37, 38], 通过药物在体内调控IFN含量的方法从而实现抗肿瘤的治疗目的不失为一种有效的治疗策略, 而K6G有望应用临床。
3.1.2 通过ERK1/2信号通路激活NAG-1, 诱导肿瘤凋亡研究人员还发现NAG-1基因的高表达可以抑制癌细胞的生长, 同时诱导细胞凋亡[39-41]。NAG-1的低表达可能在一定情况下促进肿瘤的生长。有研究表明, NAG-1的表达也伴随着EGR-1的表达。若需要激活以上两种基因, 离不开ERK1/2信号通路。ERK1/2信号通路的激活, 可以上调NAG-1和EGR-1基因表达, 从而起到诱导癌细胞凋亡的作用。Buskens等[42-45]发现大量的胃腺癌患者体内含有高表达的环氧酶2 (COX-2)。Houghton等[46]指出胃癌患者体内的肿瘤血管生成以及幽门螺旋杆菌的感染也与COX-2有莫大的关系。COX-2能诱导炎症的发生, 而慢性炎症在一定程度可以促进肿瘤的发生。高车前素[5]是天山雪莲(SI)中的一种黄酮类化合物。它可以激活ERK1/2信号通路, 上调NAG-1和EGR-1的表达, 同时还可以大大降低AGS胃癌细胞中COX-2的表达, 从而发挥其抗肿瘤作用[5]。高车前素的抗肿瘤作用很有可能与抑制慢性炎症有关, 这还需要进一步的药理实验去证实。高车前素抗癌作用的发现有望为高死亡率的胃癌提供治疗方案。
3.1.3 通过抑制DNA合成和阻滞细胞周期(G1), 抑制肿瘤生长肝癌是发病率较高的癌症[47], 虽然化疗对其有一定的抑制作用, 但其不良反应大, 且患者耐药性强, 因此研究者们希望能够找到不良反应小且作用效果显著的药物, 延长患者的生命, 改善他们的生活状态。天山雪莲(SI)的提取液被证实具有一定的细胞毒作用, 同时对肝细胞只产生适度的细胞毒性。研究表明该药理作用可能与阻断癌细胞的DNA合成有关[29]。
p21是一种抑制细胞生长的蛋白质, 其过量表达使细胞停滞在细胞分裂的G1期和G2期[48]。除此之外, p21可以结合并抑制多种周期蛋白/Cdk复合体, 尤其是Cdk2[49]。研究表明, 长期抑制Cdk2会引起X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein, XIAP)的下调[50]。XIAP会直接或间接抑制caspase-3、caspase-7和caspase-9的作用。而这些caspase家族的蛋白质可以清除凋亡细胞的蛋白质, 如DNA修复酶(poly ADP-ribose polymerase, PARP)[51], 该蛋白质极其不利于肿瘤的治疗。研究人员使用Western blot和实时荧光定量聚合酶链反应(quantitative real-time, PCR)的实验方法检测出雪莲提取液可以上调p21的表达, 提高PARP的降解率, 同时下调Cdk2和XIAP的表达量, 从而起到诱导肿瘤细胞凋亡和生长停止的作用[29] (图 1)。
|
Figure 1 The antineoplatic mechanisms of Saussurea involucrate (SI) and Saussurea stella (SS) |
炎症反应与多个炎症因子(TNF-α、IL-1α、IL-6和IL-17A等)和炎症介质(环氧合酶与脂氧合酶等)的分泌有关。由于非甾体抗炎药具有胃肠道出血和心血管意外等不良反应, 研究者们迫切需要研发一种不良反应小且药效好的新药对抗炎症。科学家们发现雪莲提取物对多种炎症皆具有很强的治疗作用[52-55], 同时不良反应较小, 能为研发新型的抗炎药提供思路。有研究表明多种雪莲都具有抗炎的作用, 通过比较绵头雪兔子(SL)、天山雪莲(SI)和水母雪兔子(SM)的抗炎活性发现, 绵头雪兔子(SL)的活性最好, 其次是天山雪莲(SI), 而水母雪兔子(SM)的抗炎活性相对较低[55]。雪莲的抗炎作用可能与该植物中的木脂素[19]、黄酮[6]等活性成分有关, 雪莲的提取物以及雪莲中的一些抗炎活性化合物可以通过调控炎性细胞因子的转录和翻译从而起到抗炎的作用。
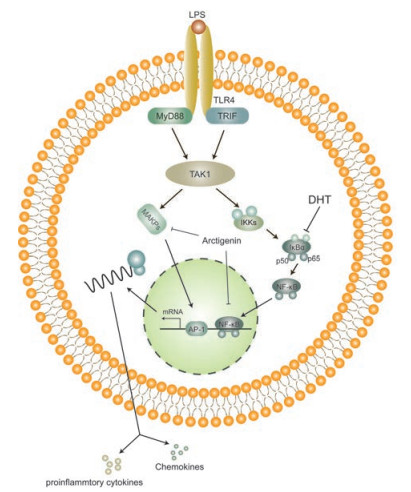
3.2.1 通过有效地抑制MKK和MAPK, 抑制AP-1活化以及TNF-α的转录研究表明, 丝裂原激活蛋白(mitogen activated protein, MAP)能将细胞外的信息传递到细胞内, 丝裂原激活蛋白激酶(mitogen activated protein kinase, MAPK)包括ERK1/2和p38激酶和JNK, 能对生长信号或环境压力的改变做出反应, 从而介导转录因子的磷酸化和基因表达的变化。MAPK与MAP激酶(MAP kinase kinase, MKK)都能活化激活蛋白-1 (AP-1)的表达。AP-1是一组由Jun、Fos和ATF家族蛋白组成的二聚体转录因子[56], 它能被病原体的脂多糖(LPS)激活。此外, 病毒和细菌的炎症反应会激活核因子κB (nuclear factor kappa B, NF-κB)[57], 该因子参与合成一氧化氮合酶(iNOS)和TNF-α[58, 59]。TNF-α是一种由巨噬细胞分泌的毒性细胞因子, 它能诱导多种炎症疾病。编码TNF-α的基因的启动子上有NF-κB和AP-1样反应元件的结合位点[60], 因此NF-κB和AP-1能够调控TNF-α的转录。水母雪兔子(SM)中的牛蒡子能抑制经LPS处理的Raw264.7细胞中MAP激酶ERK1/2、p38激酶的活性和JNK的磷酸化, 从而减少AP-1的活化[19]; 该实验还发现牛蒡子素还能影响MKK1的活性, 同时能通过下调iNOS基因的表达来抑制NF-κB的激活。总的来说, 牛蒡子素能从抑制NF-κB和AP-1的活性, 抑制TNF-α的转录, 从而起到抗炎作用(图 2)。
|
Figure 2 The anti-inflammatory mechanisms of 3, 4-dihydroxytoluene (DHT) and arctigenin |
前文中提到NF-κB能够调控炎性因子TNF-α的转录。在静止的巨噬细胞的细胞质中, NF-κB被其抑制蛋白IκB螯合为无活性的前体复合物。受到上游信号刺激后, IκB被IκB激酶磷酸化, 并通过蛋白酶体迅速降解, 随后释放带有p65亚单位的NF-κB, 带有p65亚单位的NF-κB就能进入细胞核与编码炎症因子序列的启动子结合从而调控炎症因子的转录[6]。
天山雪莲(SI)含有一种具有药理活性的黄酮类化合物—芦丁, 它具有抗氧化、抗肿瘤、保护心脏等药理作用[61-64]。它的代谢产物3, 4-二羟基甲苯(DHT)具有很强的抗炎作用[6]。该研究表明它能够减少细胞核内的NF-κB的含量, 从而使其滞留在细胞质中, 从而减少炎症因子的产生。芦丁对正常细胞的细胞毒性小, 因此该化合物将来有希望应用于各种炎症的治疗中。
3.3 抗氧化作用紫外线B (ultraviolet B, UVB)辐射通过生成活性氧(reactive oxygen species, ROS)伤害皮肤组织和细胞, 从而刺激皮肤的氧化应激反应, 导致细胞抗氧化剂的耗竭, 损伤细胞成分(如脂质膜、蛋白质和DNA), 产生光老化、炎症、免疫抑制和细胞凋亡等现象[65-70]。由过氧化氢酶(catalase, CAT)、超氧化物歧化酶(superoxide dismutase, SOD)和谷胱甘肽(glutathione, GSH)组成的酶促抗氧化剂防御系统通过减少光老化来修复皮肤, 丙二醛(malondialdehyde, MDA)通常是最常见的脂质过氧化的标志物。研究者们只需要通过检测被紫外线照射过的人角质形成细胞中的CAT、SOD、GSH和MDA就能大概分析出细胞的氧化的情况。研究人员发现三指雪兔子(ST)中的多糖和黄酮可以降低人角质形成细胞MDA含量[7], 提高CAT、SOD和GSH的含量, 从而缓解氧化应激反应。非但如此, 它们还能降低细胞内钙离子浓度, 提高线粒体的膜电位, 降低细胞通过线粒体途径凋亡的概率[7]。
细胞凋亡还可以从p38MAPK途径进行[7], 该途径能让肿瘤抑制基因p53失活, 通过形成促凋亡caspase-3复合物触发凋亡级联反应。但经过Western blot和免疫荧光法的实验结果, 经过来自三指雪兔子的黄酮和多糖处理过的人角质形成细胞, 上调了p53和p38的表达, 从而证实该植物中的黄酮和多糖阻止细胞凋亡的途径并非p38MAKP途径。但是它们可以上调Bcl-2的表达, 下调Bax和活性caspase-3的表达。Bcl-2可以阻止细胞凋亡而Bax能促进细胞凋亡。具体的机制还需要进一步的研究。
除了三指雪兔子, 别的品种的雪莲也具有抗氧化的活性, 比如, 绵头雪莲(SL)中的SLT-3和SLT-4[71]; 以及雪莲花(SI)中的多糖CSIP1-2和CSIP2-3都具有抗氧化的活性[72]。SLT-3和SLT-4的存在有效地阻止了ROS的生成, 抑制了MDA的形成, 并调节了CAT、谷胱甘肽过氧化物酶(glutathione peroxidase, GSH-Px)和SOD的活性[71]。而多糖CSIP1-2和CSIP2-3可以有效地清除超氧自由基、DDPH自由基和羟自由基[72]。因此雪莲中的多糖和黄酮类化合物都具有抗氧化的活性。
体内的氧化应激反应也会一定程度上引起疲劳[73]与衰老[74-76]。雪莲也具有一定的抗疲劳和抗衰老的作用。有研究发现肌肉运动会产生自由基, 而自由基会氧化多种蛋白质从而引起疲劳。研究表明天山雪莲(SI)中的芦丁可以降低实验小鼠细胞中MDA以及提高SOD和GSH-Px的含量。与此同时, 芦丁给药实验组的小鼠在负重游泳测试中表现更佳, 它们负重游泳的时间相较于控制组而言是更长的[77]。这就说明, 芦丁能够提高小鼠的运动耐力, 并从侧面验证了该化合物的抗疲劳作用。
除此之外, Yang等[78]发现天山雪莲(SI)中的芦丁还能够缓解D-半乳糖构建的脑损伤的小鼠模型的症状。通过进一步的研究发现, 芦丁可降低小鼠血浆中的MDA, 清除大脑中的自由基[78]。通过口服芦丁, 小鼠在避暗实验中的表现得到了改善, 由此可见, 雪莲中的芦丁可能具有抗衰老的作用。
3.4 促进脂质代谢, 减少脂质蓄积的作用肥胖是目前一种极其常见的亚健康的状态, 它与高血压、Ⅱ型糖尿病等多种慢性疾病有关[79-82]。有多种转录因子可以调控脂肪的生成, 如固醇调节元件结合蛋白1c (sterol-regulatory element binding proteins-1c, SREBP-1c)、CCAAT/增强子结合蛋白(CCAAT/enhancer-binding protein, C/EBP)、过氧化物酶体增殖物激活受体(peroxisome proliferators-activated receptor, PPAR)。这些转录因子能与编码脂肪酸与甘油三酸酯的基因的启动子结合, 从而调控他们的转录。如果在一定情况下调控这些转录因子的表达, 就能在很大程度上减少脂肪的生成以及减少脂质的蓄积。天山雪莲(SI)中的高车前素[8]和金合欢素[83]就能利用以上的途径起到这种药理作用。
PPAR与脂质代谢有密切的关系, 研究表明PPARα的激活与脂肪和肝组织的脂质代谢有关, 它能增加脂肪酸的β-氧化作用以促进脂质分解代谢[84]。高车前素就能激动PPARα, 从而调节下游的脂质代谢的蛋白的表达, 起到促进脂质代谢的作用[8]。
天山雪莲(SI)中的金合欢素的机制则较为复杂[83]。它能下调SREBP-1c和C/EBP的表达, 从而在一定程度上抑制以上的两种转录因子与FAS的启动子结合。FAS是有关脂质生成的多功能酶, 它能催化并合成长链的脂肪酸[85], 与此同时, 还能增加脂肪细胞激活蛋白-2 (activator protein-2, AP-2)和低密度脂蛋白(low-density lipoprotein, LDL)的表达。AP-2能调控脂质和葡萄糖的代谢[86], 而LDL能水解乳糜颗粒中的脂蛋白和极低密度脂蛋白, 从而在血清中产生更多的甘油酸酯, 而这些游离的甘油酸酯与心血管疾病的发展密切相关[87]。有研究表明, TNF-α能够诱导胰岛素抵抗的脂肪细胞分泌细胞因子-C-C基序配体5 (cytokine-C-C motif ligand 5, CCL-5)和单核细胞趋化蛋白-1 (monocyte chemotactic protein 1, MCP-1), 从而吸引巨噬细胞进入脂肪组织[88, 89], 该机制便能导致胰岛素抵抗。而金合欢素却能抑制CCL-5和MCP-1的表达, 从而改善胰岛素抵抗的症状。
综上所述, 金合欢素通过下调SREBP-1-c和C/EBP的表达, 从而减少FAS的转录, 进而下调AP-2和LDL的表达, 减少了脂肪的生成和蓄积。与此同时它还能抑制CCL-5和MCP-1的表达, 改善肥胖带来的胰岛素抵抗。若深入研究, 金合欢素有望进入临床, 改善肥胖的Ⅱ型糖尿病患者的生活质量。
除了以上的药理活性之外, 雪莲还具有抗高原反应、抗菌、抗病毒的活性[90-92]。例如, 苞叶雪莲(SO)中角鲨烯和α-亚麻酸甲酯对金葡菌、大肠杆菌、蜡状芽孢杆菌、枯草芽孢杆菌均有抑制作用[91]。绵头雪莲(SL)中的一种新型的果胶多糖SLP-4能够通过一定的相互作用抑制人乙型肝炎病毒表面抗原(hepatitis B surface antigen, HBsAg)和人乙型肝炎病毒e抗原(hepatitis B e antigen, HBeAg), 从而起到抗病毒的作用[92]。
4 小结与展望综上所述, 雪莲具有广泛而复杂的药理活性如抗肿瘤、抗炎、抗氧化、促进脂质代谢减少脂质蓄积和抗菌等, 这与雪莲中含有的黄酮、木脂素、多糖、倍半萜等多种生物活性成分密不可分, 尤其是黄酮类化合物, 该类化合物与抗肿瘤、抗炎、抗氧化[93]和促进脂质代谢等药理作用均有一定的关系。就目前的研究进展来看, 天山雪莲(SI)的药理作用较为全面, 这可能与其中含有大量具有生物活性的黄酮类化合物有关, 如芦丁、高车前素与金合欢素等[5, 6, 8, 77, 78, 83]。虽然其抗炎效果不及绵头雪兔子(SL)[55], 但仍具有巨大的药用开发前景。
由于过度的开采, 雪莲的数量十分有限, 这大大地限制了雪莲的临床应用。植物细胞培养和组织培养有望解决这一难题, 近年来已经有一定成效[26, 27, 94, 95]。尽管雪莲的活性成分众多, 但还有部分具有药理活性的化合物的作用机制亟待研究。此外, 雪莲品种众多, 仍有大量品种的雪莲等待着科研人员的探索。基于中药化学和中药药理的研究, 具有多种药理活性成分的雪莲, 在未来有望开发成新药, 造福人类。
| [1] |
Chik WI, Zhu L, Fan LL, et al. Saussurea involucrata: a review of the botany, phytochemistry and ethnopharmacology of a rare traditional herbal medicine[J]. J Ethnopharmacol, 2015, 172: 44-60. DOI:10.1016/j.jep.2015.06.033 |
| [2] |
Chen YS, Peng JS, Sun YL. Snow lotus blooms on snow plateau[J]. Forest Humankind (森林与人类), 2018, 4: 8-31. |
| [3] |
Editorial Board of Flora of China, Chinese Academy of Sciences. Flora of China (中国植物志)[M]. Beijing: Science Press, 1999: 5-35.
|
| [4] |
Jia ZJ, Li Y, Du M, et al. Studies on the constituents of Saussurea involucrata Kar. et Kin. (Ⅰ)[J]. Chem J Chin Univ (高等学校化学学报), 1983, 5: 581-584. |
| [5] |
Yu CY, Su KY, Lee PL, et al. Potential therapeutic role of hispidulin in gastric cancer through induction of apoptosis via NAG-1 signaling[J]. Evid Based Complement Alternat Med, 2013, 2013: 518301. |
| [6] |
Su KY, Yu CY, Chen YP, et al. 3, 4-Dihydroxytoluene, a metabolite of rutin, inhibits inflammatory responses in lipopolysaccharide-activated macrophages by reducing the activation of NF-κB signaling[J]. BMC Complement Altern Med, 2014, 14: 21. DOI:10.1186/1472-6882-14-21 |
| [7] |
Guo Y, Sun J, Ye J, et al. Saussurea tridactyla Sch. Bip.-derived polysaccharides and flavones reduce oxidative damage in ultraviolet B-irradiated HaCaT cells via a p38MAPK-independent mechanism[J]. Drug Des Devel Ther, 2016, 10: 389-403. |
| [8] |
Wu XC, Xu J. New role of hispidulin in lipid metabolism: PPARα activator[J]. Lipids, 2016, 51: 1249-1257. DOI:10.1007/s11745-016-4200-7 |
| [9] |
Chen QL, Zhu L, Tang Y, et al. Comparative evaluation of chemical profiles of three representative 'snow lotus' herbs by UPLC-DAD-QTOF-MS combined with principal component and hierarchical cluster analyses[J]. Drug Test Anal, 2017, 9: 1105-1115. DOI:10.1002/dta.2123 |
| [10] |
Dawa ZM, Bai Y, Zhou Y, et al. Chemical constituents of the whole plants of Saussurea medusa[J]. J Nat Med, 2009, 63: 327-330. DOI:10.1007/s11418-009-0320-1 |
| [11] |
Zhang XH, Yu MQ, Chen JM. Simultaneous determination of seven compounds in snow lotus herb using high-performance liquid chromatography[J]. J Chromatogr Sci, 2003, 41: 241-244. |
| [12] |
Fan CQ, Yue JM. Biologically active phenols from Saussurea medusa[J]. Bioorg Med Chem, 2003, 11: 703-708. DOI:10.1016/S0968-0896(02)00470-4 |
| [13] |
Chang LY, Xia XQ, Xin L, et al. Chemical constituents from Saussurea obvallata[J]. Chin Tradit Pat Med (中成药), 2019, 41: 1065-1069. |
| [14] |
Jia ZJ, Ju Y, Chu TT. Studies on the chemical constituents of Saussurea stella Maxim (Ⅰ)[J]. J Lanzhou Univ (兰州大学学报), 1989, 25: 64-67. |
| [15] |
Shen J, Liang J, Peng S, et al. Chemical constituents from Saussurea stella[J]. Nat Prod Res Dev (天然产物研究与开发), 2004, 5: 391-394. |
| [16] |
Wu W, Qu Y, Gao HY, et al. Novel ceramides from aerial parts of Saussurea involucrata Kar. et Kir[J]. Arch Pharmacal Res, 2009, 32: 1221-1225. DOI:10.1007/s12272-009-1906-6 |
| [17] |
Wang TM, Wang RF, Chen HB, et al. Alkyl and phenolic glycosides from Saussurea stella[J]. Fitoterapia, 2013, 88: 38-43. DOI:10.1016/j.fitote.2013.03.027 |
| [18] |
Takasaki M, Konoshima T, Komatsu K, et al. Anti-tumor-promoting activity of lignans from the aerial part of Saussurea medusa[J]. Cancer Lett, 2000, 158: 53-59. DOI:10.1016/S0304-3835(00)00499-7 |
| [19] |
Cho MK, Jang YP, Kim YC, et al. Arctigenin, a phenylpropanoid dibenzylbutyrolactone lignan, inhibits MAP kinases and AP-1 activation via potent MKK inhibition: the role in TNF-alpha inhibition[J]. Int Immunopharmacol, 2004, 4: 1419-1429. DOI:10.1016/j.intimp.2004.06.011 |
| [20] |
Duan HQ, Takaishi Y, Momota H, et al. Immunosuppressive constituents from Saussurea medusa[J]. Phytochemistry, 2002, 59: 85-90. DOI:10.1016/S0031-9422(01)00429-0 |
| [21] |
Yi T, Lo HW, Zhao ZA, et al. Comparison of the chemical composition and pharmacological effects of the aqueous and ethanolic extracts from a tibetan "snow lotus" (Saussurea laniceps) herb[J]. Molecules, 2012, 17: 7183-7194. DOI:10.3390/molecules17067183 |
| [22] |
Kim JS, Kim JC, Shim SH, et al. Chemical constituents of the root of dystaenia takeshimana and their anti-inflammatory activity[J]. Arch Pharmacal Res, 2006, 29: 617-623. DOI:10.1007/BF02968244 |
| [23] |
Li Y, Jia ZJ, Du M, et al. Study on the constituents of Saussurea involucrata Kar. et Kin. (Ⅱ)[J]. Chem J Chin Univ (高等学校化学学报), 1985, 5: 417-420. |
| [24] |
Wang HB, Zuo JP, Qin GW. One new sesquiterpene from Saussurea laniceps[J]. Fitoterapia, 2010, 81: 937-939. DOI:10.1016/j.fitote.2010.06.010 |
| [25] |
Li Y, Wang CL, Guo SX, et al. Three guaianolides from Saussurea involucrata and their contents determination by HPLC[J]. J Pharm Biomed Anal, 2007, 44: 288-292. DOI:10.1016/j.jpba.2007.02.017 |
| [26] |
Guo B, Gao M, Liu CZ. In vitro propagation of an endangered medicinal plant Saussurea involucrata Kar. et Kir[J]. Plant Cell Rep, 2007, 26: 261-265. DOI:10.1007/s00299-006-0230-6 |
| [27] |
Kuo CL, Agrawal DC, Chang HC, et al. In vitro culture and production of syringin and rutin in Saussurea involucrata (Kar. et Kir.) - an endangered medicinal plant[J]. Bot Studies, 2015, 56: 12. DOI:10.1186/s40529-015-0092-8 |
| [28] |
Wonganan O, He YJ, Shen XF, et al. 6-Hydroxy-3-O-methyl-kaempferol 6-O-glucopyranoside potentiates the anti-proliferative effect of interferon α/β by promoting activation of the JAK/STAT signaling by inhibiting SOCS3 in hepatocellular carcinoma cells[J]. Toxicol Appl Pharmacol, 2017, 336: 31-39. DOI:10.1016/j.taap.2017.10.004 |
| [29] |
Byambaragchaa M, Dela Cruz J, Kh A, et al. Anticancer potential of an ethanol extract of Saussurea involucrata against hepatic cancer cells in vitro[J]. Asian Pac J Cancer Prev, 2014, 15: 7527-7532. DOI:10.7314/APJCP.2014.15.18.7527 |
| [30] |
Salvagno C, Ciampricotti M, Tuit S, et al. Therapeutic targeting of macrophages enhances chemotherapy efficacy by unleashing type Ⅰ interferon response[J]. Nat Cell Biol, 2019, 21: 511-521. DOI:10.1038/s41556-019-0298-1 |
| [31] |
Sprooten J, Agostinis P, Garg AD. Type Ⅰ interferons and dendritic cells in cancer immunotherapy[J]. Int Rev Cell Mol Biol, 2019, 348: 217-262. DOI:10.1016/bs.ircmb.2019.06.001 |
| [32] |
Honda K, Yanai H, Negishi H, et al. IRF-7 is the master regulator of type-Ⅰ interferon-dependent immune responses[J]. Nature, 2005, 434: 772-777. DOI:10.1038/nature03464 |
| [33] |
Kato H, Takeuchi O, Sato S, et al. Differential roles of MDA5 and RIG-Ⅰ helicases in the recognition of RNA viruses[J]. Nature, 2006, 441: 101-105. DOI:10.1038/nature04734 |
| [34] |
Reinert LS, Harder L, Holm CK, et al. TLR3 deficiency renders astrocytes permissive to herpes simplex virus infection and facilitates establishment of CNS infection in mice[J]. J Clin Invest, 2012, 122: 1368-1376. DOI:10.1172/JCI60893 |
| [35] |
van Boxel-Dezaire AHH, Rani MRS, Stark GR. Complex modulation of cell type-specific signaling in response to type Ⅰ interferons[J]. Immunity, 2006, 25: 361-372. DOI:10.1016/j.immuni.2006.08.014 |
| [36] |
Liau NPD, Laktyushin A, Lucet IS, et al. The molecular basis of JAK/STAT inhibition by SOCS1[J]. Nat Commun, 2018, 9: 1558. DOI:10.1038/s41467-018-04013-1 |
| [37] |
Rice GI, Forte GMA, Szynkiewicz M, et al. Assessment of interferon-related biomarkers in aicardi-goutières syndrome associated with mutations in TREX1, RNASEH2A, RNASEH2B, RNASEH2C, SAMHD1, and ADAR: a case-control study[J]. Lancet Neurol, 2013, 12: 1159-1169. DOI:10.1016/S1474-4422(13)70258-8 |
| [38] |
Bennett L, Palucka AK, Arce E, et al. Interferon and granulopoiesis signatures in systemic lupus erythematosus blood[J]. J Exp Med, 2003, 197: 711-723. DOI:10.1084/jem.20021553 |
| [39] |
Baek SJ, Kim JS, Jackson FR, et al. Epicatechin gallate-induced expression of NAG-1 is associated with growth inhibition and apoptosis in colon cancer cells[J]. Carcinogenesis, 2004, 25: 2425-2432. DOI:10.1093/carcin/bgh255 |
| [40] |
Baek SJ, Kim JS, Moore SM, et al. Cyclooxygenase inhibitors induce the expression of the tumor suppressor gene EGR-1, which results in the up-regulation of NAG-1, an antitumorigenic protein[J]. Mol Pharmacol, 2005, 67: 356-364. DOI:10.1124/mol.104.005108 |
| [41] |
Eling TE, Baek SJ, Shim M, et al. NSAID activated gene (NAG-1), a modulator of tumorigenesis[J]. J Biochem Mol Biol, 2006, 39: 649-655. |
| [42] |
Buskens CJ, Van Rees BP, Sivula A, et al. Prognostic significance of elevated cyclooxygenase 2 expression in patients with adenocarcinoma of the esophagus[J]. Gastroenterology, 2002, 122: 1800-1807. DOI:10.1053/gast.2002.33580 |
| [43] |
Kim N, Kim CH, Ahn DW, et al. Anti-gastric cancer effects of celecoxib, a selective COX-2 inhibitor, through inhibition of Akt signaling[J]. J Gastroenterol Hepatol, 2009, 24: 480-487. DOI:10.1111/j.1440-1746.2008.05599.x |
| [44] |
Kishimoto Y, Yashima K, Morisawa T, et al. Effects of cyclooxygenase-2 inhibitor NS-398 on APC and c-myc expression in rat colon carcinogenesis induced by azoxymethane[J]. J Gastroenterol, 2002, 37: 186-193. DOI:10.1007/s005350200019 |
| [45] |
Lim HY, Joo HJ, Choi JH, et al. Increased expression of cyclooxygenase-2 protein in human gastric carcinoma[J]. Clin Cancer Res, 2000, 6: 519-525. |
| [46] |
Houghton J, Fox JG, Wang TC. Gastric cancer: laboratory bench to clinic[J]. J Gastroenterol Hepatol, 2002, 17: 495-502. DOI:10.1046/j.1440-1746.2002.02770.x |
| [47] |
Chan SL, Yeo W. Targeted therapy of hepatocellular carcinoma: present and future[J]. J Gastroenterol Hepatol, 2012, 27: 862-872. DOI:10.1111/j.1440-1746.2012.07096.x |
| [48] |
Masgras I, Carrera S, de Verdier PJ, et al. Reactive oxygen species and mitochondrial sensitivity to oxidative stress determine induction of cancer cell death by p21[J]. J Biol Chem, 2012, 287: 9845-9854. DOI:10.1074/jbc.M111.250357 |
| [49] |
Zhang H, Xiong Y, Beach D. Proliferating cell nuclear antigen and p21 are components of multiple cell cycle kinase complexes[J]. Mol Biol Cell, 1993, 4: 897-906. DOI:10.1091/mbc.4.9.897 |
| [50] |
Dong FQ, Guo W, Zhang LD, et al. Downregulation of XIAP and induction of apoptosis by the synthetic cyclin-dependent kinase inhibitor GW8510 in non-small cell lung cancer cells[J]. Cancer Biol Ther, 2006, 5: 165-170. DOI:10.4161/cbt.5.2.2316 |
| [51] |
Pommier Y, O'Connor MJ, de Bono J. Laying a trap to kill cancer cells: Parp inhibitors and their mechanisms of action[J]. Sci Transl Med, 2016, 8: 362ps17. DOI:10.1126/scitranslmed.aaf9246 |
| [52] |
Gong GW, Xie F, Zheng YZ, et al. The effect of methanol extract from Saussurea involucrata in the lipopolysaccharide-stimulated inflammation in cultured RAW 264.7 cells[J]. J Ethnopharmacol, 2019, 251: 112532. |
| [53] |
Wang XH, Chu L, Liu C, et al. Therapeutic effects of Saussurea involucrata injection against severe acute pancreatitis-induced brain injury in rats[J]. Biomed Pharmacother, 2018, 100: 564-574. DOI:10.1016/j.biopha.2018.02.044 |
| [54] |
Han XL, Su D, Xian XY, et al. Inhibitory effects of Saussurea involucrata (Kar. et Kir.) Sch. -Bip. on adjuvant arthritis in rats[J]. J Ethnopharmacol, 2016, 194: 228-235. DOI:10.1016/j.jep.2016.09.008 |
| [55] |
Yi T, Zhao ZZ, Yu ZL, et al. Comparison of the anti-inflammatory and anti-nociceptive effects of three medicinal plants known as "snow lotus" herb in traditional Uighur and Tibetan medicines[J]. J Ethnopharmacol, 2010, 128: 405-411. DOI:10.1016/j.jep.2010.01.037 |
| [56] |
Shaulian E, Karin M. AP-1 in cell proliferation and survival[J]. Oncogene, 2001, 20: 2390-2400. DOI:10.1038/sj.onc.1204383 |
| [57] |
Grilli M, Memo M. Nuclear factor-kappaB/Rel proteins: a point of convergence of signalling pathways relevant in neuronal function and dysfunction[J]. Biochem Pharmacol, 1999, 57: 1-7. DOI:10.1016/S0006-2952(98)00214-7 |
| [58] |
Cho MK, Park JW, Jang YP, et al. Potent inhibition of lipopolysaccharide-inducible nitric oxide synthase expression by dibenzylbutyrolactone lignans through inhibition of Ⅰ-kappaBalpha phosphorylation and of p65 nuclear translocation in macrophages[J]. Int Immunopharmacol, 2002, 2: 105-116. DOI:10.1016/S1567-5769(01)00153-9 |
| [59] |
Cho JY, Kim AR, Yoo ES, et al. Immunomodulatory effect of arctigenin, a lignan compound, on tumour necrosis factor-alpha and nitric oxide production, and lymphocyte proliferation[J]. J Pharm Pharmacol, 1999, 51: 1267-1273. DOI:10.1211/0022357991777001 |
| [60] |
Liu H, Sidiropoulos P, Song G, et al. TNF-alpha gene expression in macrophages: regulation by NF-kappa B is independent of c-Jun or C/EBP beta[J]. J Immunol, 2000, 164: 4277-4285. DOI:10.4049/jimmunol.164.8.4277 |
| [61] |
La Casa C, Villegas I, Alarcón de la Lastra C, et al. Evidence for protective and antioxidant properties of rutin, a natural flavone, against ethanol induced gastric lesions[J]. J Ethnopharmacol, 2000, 71: 45-53. DOI:10.1016/S0378-8741(99)00174-9 |
| [62] |
Janbaz KH, Saeed SA, Gilani AH. Protective effect of rutin on paracetamol- and CCl4-induced hepatotoxicity in rodents[J]. Fitoterapia, 2002, 73: 557-563. DOI:10.1016/S0367-326X(02)00217-4 |
| [63] |
Sheu JR, Hsiao G, Chou PH, et al. Mechanisms involved in the antiplatelet activity of rutin, a glycoside of the flavonol quercetin, in human platelets[J]. J Agric Food Chem, 2004, 52: 4414-4418. DOI:10.1021/jf040059f |
| [64] |
Trumbeckaite S, Bernatoniene J, Majiene D, et al. The effect of flavonoids on rat heart mitochondrial function[J]. Biomed Pharmacother, 2006, 60: 245-248. DOI:10.1016/j.biopha.2006.04.003 |
| [65] |
Saitoh Y, Miyanishi A, Mizuno H, et al. Super-highly hydroxylated fullerene derivative protects human keratinocytes from UV-induced cell injuries together with the decreases in intracellular ROS generation and DNA damages[J]. J Photochem Photobiol B, 2011, 102: 69-76. DOI:10.1016/j.jphotobiol.2010.09.006 |
| [66] |
Hyun YJ, Piao MJ, Ko MH, et al. Photoprotective effect of undaria crenata against ultraviolet B-induced damage to keratinocytes[J]. J Biosci Bioeng, 2013, 116: 256-264. DOI:10.1016/j.jbiosc.2013.02.003 |
| [67] |
Piao MJ, Lee NH, Chae S, et al. Eckol inhibits ultraviolet B-induced cell damage in human keratinocytes via a decrease in oxidative stress[J]. Biol Pharm Bull, 2012, 35: 873-880. DOI:10.1248/bpb.35.873 |
| [68] |
Filip A, Daicoviciu D, Clichici S, et al. Photoprotective effects of two natural products on ultraviolet B-induced oxidative stress and apoptosis in SKH-1 mouse skin[J]. J Med Food, 2011, 14: 761-766. DOI:10.1089/jmf.2010.0142 |
| [69] |
Park HM, Hwang E, Lee KG, et al. Royal jelly protects against ultraviolet B-induced photoaging in human skin fibroblasts via enhancing collagen production[J]. J Med Food, 2011, 14: 899-906. DOI:10.1089/jmf.2010.1363 |
| [70] |
Piao MJ, Kang KA, Kim KC, et al. Diphlorethohydroxycarmalol attenuated cell damage against UVB radiation via enhancing antioxidant effects and absorbing UVB ray in human HaCaT keratinocytes[J]. Environ Toxicol Pharmacol, 2013, 36: 680-688. DOI:10.1016/j.etap.2013.06.010 |
| [71] |
Chen WB, Ma JJ, Gong F, et al. Two novel polysaccharides from the torus of Saussurea laniceps protect against AAPH-induced oxidative damage in human erythrocytes[J]. Carbohydr Polym, 2018, 200: 446-455. DOI:10.1016/j.carbpol.2018.08.007 |
| [72] |
Yao LY, Zhao QS, Xiao J, et al. Composition and antioxidant activity of the polysaccharides from cultivated Saussurea involucrata[J]. Int J Biol Macromol, 2012, 50: 849-853. DOI:10.1016/j.ijbiomac.2011.11.012 |
| [73] |
Coombes JS, Rowell B, Dodd SL, et al. Effects of vitamin E deficiency on fatigue and muscle contractile properties[J]. Eur J Appl Physiol, 2002, 87: 272-277. DOI:10.1007/s00421-002-0631-3 |
| [74] |
Barnham KJ, Masters CL, Bush AI. Neurodegenerative diseases and oxidative stress[J]. Nat Rev Drug Discov, 2004, 3: 205-214. DOI:10.1038/nrd1330 |
| [75] |
Finkel T, Holbrook NJ. Oxidants, oxidative stress and the biology of ageing[J]. Nature, 2000, 408: 239-247. DOI:10.1038/35041687 |
| [76] |
Yin ST, Tang ML, Deng HM, et al. Epigallocatechin-3-gallate induced primary cultures of rat hippocampal neurons death linked to calcium overload and oxidative stress[J]. Naunyn-Schmiedeberg's Arch Pharmacol, 2009, 379: 551-564. DOI:10.1007/s00210-009-0401-4 |
| [77] |
Su KY, Yu CY, Chen YW, et al. Rutin, a flavonoid and principal component of Saussurea involucrata, attenuates physical fatigue in a forced swimming mouse model[J]. Int J Med Sci, 2014, 11: 528-537. DOI:10.7150/ijms.8220 |
| [78] |
Yang YC, Lin HY, Su KY, et al. Rutin, a flavonoid that is a main component of Saussurea involucrata, attenuates the senescence effect in D-galactose aging mouse model[J]. Evid Based Complement Alternat Med, 2012, 2012: 980276. |
| [79] |
Morrison MC, Kleemann R. Role of macrophage migration inhibitory factor in obesity, insulin resistance, type 2 diabetes, and associated hepatic co-morbidities: a comprehensive review of human and rodent studies[J]. Front Immunol, 2015, 6: 308. |
| [80] |
Singer K, Lumeng CN. The initiation of metabolic inflammation in childhood obesity[J]. J Clin Invest, 2017, 127: 65-73. DOI:10.1172/JCI88882 |
| [81] |
Geeraerts X, Bolli E, Fendt SM, et al. Macrophage metabolism as therapeutic target for cancer, atherosclerosis, and obesity[J]. Front Immunol, 2017, 8: 289. |
| [82] |
Wang K, Liu XF, Li PP. Advances in molecular mechanisms for enhanced hepatic lipogenesis in insulin resistance[J]. Acta Pharm Sin (药学学报), 2020, 55: 189-194. |
| [83] |
Liou CJ, Wu SJ, Chen LC, et al. Acacetin from traditionally used Saussurea involucrata Kar. et Kir. Suppressed adipogenesis in 3T3-L1 adipocytes and attenuated lipid accumulation in obese mice[J]. Front Pharmacol, 2017, 8: 589. DOI:10.3389/fphar.2017.00589 |
| [84] |
Barbosa-da-Silva S, Souza-Mello V, Magliano DAC, et al. Singular effects of PPAR agonists on nonalcoholic fatty liver disease of diet-induced obese mice[J]. Life Sci, 2015, 127: 73-81. DOI:10.1016/j.lfs.2015.02.003 |
| [85] |
Moseti D, Regassa A, Kim WK. Molecular regulation of adipogenesis and potential anti-adipogenic bioactive molecules[J]. Int J Mol Sci, 2016, 17: 124. DOI:10.3390/ijms17010124 |
| [86] |
Wang YH, Viscarra J, Kim SJ, et al. Transcriptional regulation of hepatic lipogenesis[J]. Nat Rev Mol Cell Biol, 2015, 16: 678-689. DOI:10.1038/nrm4074 |
| [87] |
Mota de Sá P, Richard AJ, Hang H, et al. Transcriptional regulation of adipogenesis[J]. Compr Physiol, 2017, 7: 635-674. |
| [88] |
Huang WC, Chang WT, Wu SJ, et al. Phloretin and phlorizin promote lipolysis and inhibit inflammation in mouse 3T3-L1 cells and in macrophage-adipocyte co-cultures[J]. Mol Nutr Food Res, 2013, 57: 1803-1813. DOI:10.1002/mnfr.201300001 |
| [89] |
Olefsky JM, Glass CK. Macrophages, inflammation, and insulin resistance[J]. Annu Rev Physiol, 2010, 72: 219-246. DOI:10.1146/annurev-physiol-021909-135846 |
| [90] |
Ma HP, Fan PC, Jing LL, et al. Anti-hypoxic activity at simulated high altitude was isolated in petroleum ether extract of Saussurea involucrata[J]. J Ethnopharmacol, 2011, 137: 1510-1515. DOI:10.1016/j.jep.2011.08.037 |
| [91] |
Mishra AP, Saklani S, Sharifi-Rad M, et al. Antibacterial potential of Saussurea obvallata petroleum ether extract: a spiritually revered medicinal plant[J]. Cell Mol Biol (Noisy-le-grand), 2018, 64: 65-70. |
| [92] |
Chen W, Zhu X, Ma J, et al. Structural elucidation of a novel pectin-polysaccharide from the petal of Saussurea laniceps and the mechanism of its anti-HBV activity[J]. Carbohydr Polym, 2019, 223: 115077. DOI:10.1016/j.carbpol.2019.115077 |
| [93] |
Li MR, Zhou YZ, Du GH, et al. Research progress about the anti-aging effect and mechanism of flavonoids from traditional Chinese medicine[J]. Acta Pharm Sin (药学学报), 2019, 54: 1382-1391. |
| [94] |
Jia JM, Wu CF, Liu W, et al. Antiinflammatory and analgesic activities of the tissue culture of Saussurea involucrata[J]. Biol Pharm Bull, 2005, 28: 1612-1614. DOI:10.1248/bpb.28.1612 |
| [95] |
Chen RD, Liu X, Zou JH, et al. Qualitative and quantitative analysis of phenylpropanoids in cell culture, regenerated plantlets and herbs of Saussurea involucrata[J]. J Pharm Biomed Anal, 2013, 74: 39-46. DOI:10.1016/j.jpba.2012.10.010 |
 2020, Vol. 55
2020, Vol. 55