作者贡献:张建业构思文章并修改文章, 周雯敏调查文献并起草撰写文章, 郭乔如绘制图片, 王会和吴增宝修改文章语言表达, 所有作者均批准了最终的出版版本。
利益冲突: 作者声明不存在任何利益冲突。
2. 广州医科大学附属广州市妇女儿童医疗中心, 广东 广州 510623;
3. 石河子大学药学院, 新疆植物药资源利用教育部重点实验室, 新疆石河子 832003;
4. 海南医学院热带转化医学教育部重点实验室, 海南 海口 571199
2. Guangzhou Institute of Pediatrics/Guangzhou Women and Children's Medical Center, Guangzhou Medical University, Guangzhou 510623, China;
3. Key Laboratory of Xinjiang Phytomedicine Resources of Ministry of Education, School of Pharmacy, Shihezi University, Shihezi 832003, China;
4. Key Laboratory of Tropical Translational Medicine of Ministry of Education, Hainan Medical University, Haikou 571199, China
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)简称慢阻肺, 是一种常见的以持续气流不完全可逆受限为特征的疾病[1], 气流受限主要呈进行性发展, 与气道和肺部对气体中有毒颗粒所引起的慢性炎性反应增强有关[2]。肺癌是一种常见的恶性肿瘤, 以细胞起源和表型分类可分为两大主要类型:小细胞肺癌(small cell lung cancer, SCLC)和非小细胞肺癌(non-small cell lung cancer, NSCLC)[3]。NSCLC是常见的肺癌类型, 约占所有病例的85%[4], 可进一步分为腺癌、鳞状细胞癌和大细胞癌。SCLC具有明显的神经内分泌分化和小细胞胞浆稀少的组织学特征, 约占肺癌的15%[5]。
COPD和肺癌是全世界范围内主要的肺部疾病, 对人类造成了巨大的社会和经济负担。COPD每年导致350万人死亡, 影响全球2亿多人[6]。世界卫生组织预测, 到2030年, COPD将成为全球第三大死亡原因[7]。肺癌是全球发病率和死亡率最高的恶性肿瘤, 估计每年全球有160多万人死于肺癌, 占全球癌症死亡人数的20%。据估计, 到2030年, 肺癌死亡人数将上升到每年1 000万人[8]。在临床实践中发现, 肺癌通常与COPD共存, COPD可能是发展为肺癌的潜在危险因素。Powell等[9]对COPD患者的肺癌风险进行回顾性分析, 发现在11 888例肺癌病例中有23%被诊断出罹患COPD。
从表面上看, COPD和肺癌是两种不同的疾病。COPD具有慢性肺损伤的特征, 主要有两种表现:气流受限与肺实质破坏。这些表现往往伴随着吸烟引起的细胞凋亡增加、细胞自噬和衰老[10]。相比之下, 肺癌的特征是DNA损伤和修复异常, 导致肿瘤血管生成、基因组不稳定、细胞增殖和细胞免疫逃逸等[11]。然而, 现在许多研究表明, 这两种疾病之间的发病机制具有一定的共同点, 最常见的诱因是吸入烟草烟雾。除此之外, 遗传因素和环境因素在其发展中起着至关重要的作用[12]。
越来越多的研究表明, 免疫功能障碍、肺部微生物群失调及炎症感染、氧化应激和DNA受损在COPD和肺癌发展中起到一定作用, 这些原因均可能是COPD转化为肺癌的潜在驱动因素[1]。此外, 涉及DNA甲基化和microRNA表达的表观遗传因素在转化过程中也有所体现[5]。COPD是肺癌发生的独立危险因素, 亦是肺癌患者治疗的负性预后因素, COPD的存在可能改变肺癌的治疗计划, 如放疗化疗、手术方法等[13]。
本综述将讨论导致COPD转化为肺癌的流行病学证据、常见转化途径及治疗预防手段。进一步了解这两种肺部疾病转化的信号通路和分子机制, 将为今后研究早期诊断和治疗策略的制定提供思路。
1 流行病学 1.1 烟草烟雾与空气污染接触烟草烟雾是COPD和肺癌最常见的危险因素, 受其影响的患者约占所有病例的90%[14]。吸烟(cigarette smoking, CS)产生的气体混合物含有约4 500种成分, 包括一氧化碳、烟碱、氧化剂和醛等, 其中至少60种被归类为致癌物[15]。肺上皮细胞长期暴露会使正常基因形成DNA加合物, 进而导致编码p53的基因发生致癌突变[16]。与不吸烟者相比, NSCLC中吸烟者的平均突变频率增加了10倍以上[17], 一些不吸烟者也可能因被动吸烟而患上癌症。
大部分COPD吸烟者具有气道上皮细胞异常增生的临床特征, 研究发现COPD中的肿瘤微环境可促进上皮-间充质转化(epithelial-mesenchymal transition, EMT)和抑制免疫应答[15], 通过促进慢性炎症和免疫逃避导致肺癌的发展。在COPD中, 大量气道巨噬细胞(airway macrophages, AMs)被香烟烟雾和其他刺激物激活释放细胞因子和蛋白酶。这些炎性介质反过来促进AMs释放趋化因子, 从而募集更多的白细胞触发慢性炎症, 最终导致气道阻塞和呼吸道症状[18]。
在吸烟者中, 多达50%~80%的轻度COPD患者发展为肺癌[19]。吸烟者罹患COPD和肺癌的风险因素存在重叠的部分, CS可通过核因子-κB (nuclear factor kappa B, NF-κB)的转录激活内皮细胞, 增加肿瘤坏死因子-α (tumor necrosis factor alpha, TNF-α)、白细胞介素-6 (interleukin-6, IL-6)和白细胞介素-1β (interleukin-1beta, IL-1β)等表达[20], 最终诱导肺上皮细胞死亡、细胞外基质沉积和免疫病理学发展。癌基因的激活、抑癌基因的失活及气道的慢性炎症等机制可能是转化的潜在因素, 且炎症持续时间越长, 致癌风险越高[14]。
据2016年国内统计, 室外PM 2.5 (颗粒物空气动力学直径 < 2.5 μm)暴露造成的肺癌死亡约占肺癌患者的1/4, 室外PM 2.5的元素碳成分主要来源于内燃机排放的烟尘, 而室内PM 2.5主要来源于吸烟和壁炉燃火[14]。Schraufnagel等[21]研究表明, PM 2.5与慢性肺部疾病密切相关, 且持续暖冬和城市空气质量恶化也是COPD高发的重要原因。
在一项流行病学研究中, 2 507例COPD患者中有215例诊断为肺癌, 每年COPD患者发展为肺癌的比例高达16.7/1 000人[22]。除烟草烟雾影响之外, Liu等[23]研究证实COPD和肺癌患病率随城市颗粒物增加而增加。在低收入国家, 空气污染是COPD发展为肺癌的潜在因素, 包括有毒颗粒物、多环芳烃和杂环芳香族化合物的增加, 以及木材和煤炭等生物质燃料燃烧的增加[24]。
1.2 遗传易感性尽管吸烟与肺癌之间存在着密切联系, 但越来越多的证据表明, 肺癌易感性存在着遗传因素, 可能性估计在15%~25%[5]。Bailey-Wilson等[25]对52个肺癌患者家庭进行连锁分析发现, 在染色体6q23-25区域有一个高外显率易感性位点与肺癌发展相关。此外, Couraud等[26]对93个高危家庭进一步分析证实, 这种罕见的遗传变异显著增加了肺癌风险。研究表明, SERPINA1基因突变约占COPD病例的1%, 导致α1抗胰蛋白酶(alpha1 antitrypsin, A1AT)缺乏, 使肺部受到破坏性蛋白酶的伤害[5]。另外, Cho等[27]确认CHRNA3、FAM13A、HHIP已知基因座及RIN3新的基因座与COPD风险增加相关。然而, 全基因组关联分析研究(genome wide association study, GWAS)表明, COPD患者支气管上皮中表达的4个候选基因(4q31、5q33、6p21和15q25)与肺癌遗传易感性存在重叠[19], 且上述共同表达的基因在COPD发展为肺癌中起着重要的作用。
1.3 表观遗传修饰表观遗传现象是指在不改变核苷酸序列的情况下影响基因表达的改变。表观遗传修饰主要包括DNA甲基化、组蛋白乙酰化和非编码RNA调控等。本文就DNA甲基化和非编码RNA调控在两种疾病的发病及其转化过程中发挥的作用进行讨论。
在哺乳动物细胞中, DNA甲基化主要在胞嘧啶-磷酸-鸟嘌呤(cytosine-phosphate-guanine, CpG)二核苷酸中的胞嘧啶残基5′位上添加一个甲基基团, 对DNA结构进行可逆的修饰, 修饰后的DNA会增加癌细胞的增殖[5]。GWAS确定了349个CpG位点的DNA甲基化与COPD严重程度和肺功能下降显著相关[28], 影响启动子的基因转录, 可能进一步导致肿瘤的增殖、迁移和侵袭。例如, SERPINA1基因低甲基化会导致A1AT突变, 进而诱导肿瘤抑制因子蛋白磷酸酶2A失活并诱发呼吸道炎症[29]。
microRNA (miRNA)是一种不直接参与蛋白质合成的小核酸分子, 是一类进化保守的长度为19~22 nt的非编码RNA[30]。miRNA作为主要的表观遗传介质, 参与关键的转录后调控过程, 通过抑制翻译或降解目标mRNA, 调控细胞代谢、凋亡和组织分化等生理过程, 并影响慢性炎症、DNA修复和肿瘤发生过程的启动和进展[31]。现在, 已知约有60%人类蛋白质编码基因受到miRNA的调控[32]。与健康者相比, 在吸烟的COPD患者中观察到70种miRNA的异常表达[33], 其中包括miR-223、miR-1274a、miR-101、miR-144、miR-145-5p、miR-15b和miR-210等表达水平上调, miR-452、miR-146a、miR-149-3p、miR-199a-5p和miR-1等表达水平下调。而在肺癌患者中可以观察到, 主要有miR-21、miR-155和miR-17-92上调, miR-34a、miR-193a-3p、miR-137、miR-451、miR-218和miR-216下调[33-36]。这些研究表明, miRNA在COPD和肺癌的发生和发展中发挥着重要的作用。
miRNA表达差异引起的分子机制与肺部的病理过程有关, 导致呼吸系统疾病的发展[34]。Mateu-Jimenez等[37]研究发现, 与非COPD患者相比, COPD患者的肺部肿瘤病变中miR-21、miR-200b、miR-210、miR-let7c和DNA甲基化的表达水平明显上调, 推测上述变化是COPD患者肺癌易感性增加的潜在原因。
2 转化机制研究表明, 与未患COPD的对照组相比, COPD组罹患癌症的风险增加了2.8倍[38]。COPD患者癌症风险增加的潜在机制尚不清楚, 但可能涉及DNA修复损伤异常、表观遗传调控异常、缺氧诱导的炎症因子表达、细胞因子失调、端粒长度缩短和线粒体功能障碍等[1]。COPD转化为肺癌的潜在机制见图 1。
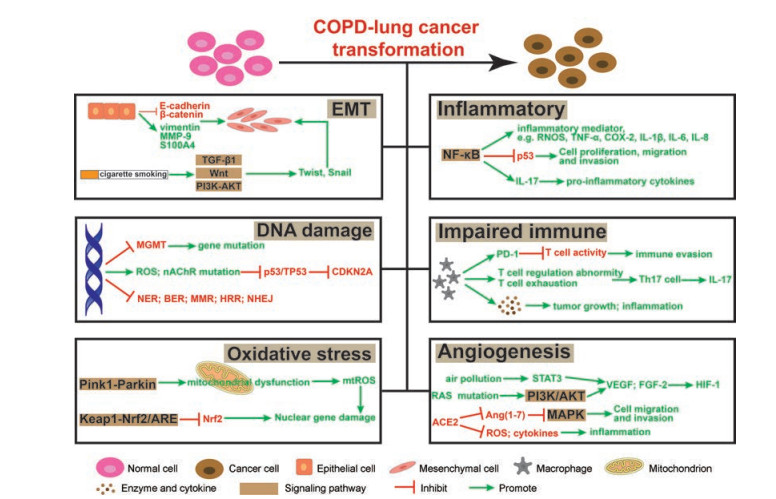
|
Figure 1 The mechanism of chronic obstructive pulmonary disease (COPD) transforming into lung cancer |
研究表明, 香烟烟雾通过调节COPD患者转化生长因子-β (transforming growth factor-beta, TGF-β)经典途径和环磷酸腺苷表达水平诱导EMT[15]。在此过程中, 上皮细胞逐渐丧失细胞极性和黏附性, 获得迁移能力并呈间充质表型[39], 进而促进肿瘤的发展。
TGF-β途径可诱导SMAD2/3表达, 同时抑制SMAD6/7表达[39], 调节COPD气道重塑。此外, 信号传导及转录激活蛋白3 (signal transducer and activator of transcription 3, STAT3)可以通过TGF-β途径增加癌细胞中Snail基因的表达来激活EMT与KRAS基因协同作用于肿瘤发展[40]。而Wnt和磷脂酰肌醇-3-激酶-蛋白激酶B (phosphoinositide 3 kinase-protein kinase B, PI3K-AKT)信号通路可以调节Snail和Twist家族转录因子表达参与EMT过程[15]。
在COPD患者中, 可以观察到波形蛋白表达升高, E-cadherin和β-catenin表达降低, 以及网状基底膜破裂导致的成纤维细胞蛋白质S100A4和基质金属蛋白酶-9 (matrix metalloproteinase-9, MMP-9)表达升高[5]。Mahmood等[41]在NSCLC患者手术切除的组织中发现, EMT生物标志物波形蛋白、N-cadherin和S100A4表达水平变化与COPD患者相似。此外, EMT参与了肺上皮细胞的肥大、化生、基因突变和修饰, 是促进COPD转化为癌症的潜在驱动因素[42]。
2.2 慢性炎症流行病学和临床研究表明, COPD是一种慢性炎症状态, 涉及到非常复杂的病理过程包括破坏肺部结构、改变肺部微环境甚至促进恶性肿瘤发展[43]。从病因上分析, 大约25%癌症与慢性炎症和感染有关[16]。慢性炎症与肿瘤发生的各个过程相关, 包括细胞转化、促进、存活、增殖、侵袭、血管生成和转移[44]。然而, 慢性炎症在COPD转化为肺癌的具体机制仍不完全清楚。
COPD的炎症特征主要是浸润迁移的白细胞产生细胞毒性介质, 如活性氮氧化物(RNOS)、干扰素(interferon, IFN)、环氧合酶2 (cyclooxygenase-2, COX-2)、MMP、TNF-α、IL-1、IL-6和IL-8等。在肿瘤微环境中, 异常的细胞因子信号传导可以驱动癌细胞增殖生长和分化。
在肺上皮细胞中可检测到高水平的NF-κB表达与肿瘤病变相关[16]。NF-κB和STAT3激活后可通过旁分泌信号促进释放炎症介质, 进而抑制细胞凋亡、诱导迁移和增殖并加速癌症的发展[45]。肿瘤抑制蛋白p53是炎症的抑制剂, 其基因TP53通常被香烟烟雾突变, 并被NF-κB介导的炎症所抑制[46]。
肺癌小鼠模型中的证据表明, IL-17是T细胞诱导的炎症反应早期启动因子, 可以通过促进释放前炎性细胞因子来放大炎症反应。例如, 促进中性粒细胞募集的IL-17C会增强肿瘤微环境中的炎症反应[47]。
炎症介质还可以诱导机体氧化应激反应, 例如肿瘤微环境中的RNOS使正常基因形成DNA加合物导致基因突变, 直接或间接影响细胞周期[16]。此外, COPD患者中COX-2表达水平升高导致前列腺素E2合成增加, 加重气流阻塞[45], 增加致癌风险。
2.3 DNA损伤修复异常抑癌基因突变及其DNA修复途径受损, 导致肿瘤的发生和发展。DNA修复途径包括核苷酸切除修复、碱基切除修复、DNA错配修复、同源重组修复和非同源末端连接途径。在COPD和肺癌患者中, 活性氧增加、单链断裂和碱基位点改变等因素会引起DNA损伤增加。相比之下, COPD患者的体细胞突变频率和微卫星不稳定性更高, 可发现更高水平的DNA损伤聚集[5]。
在吸烟的COPD患者中, 激活的烟碱型乙酰胆碱受体基因发生突变, 并下调TP53和p53相关信号通路的表达, 可能导致肺肿瘤发生[1]。此外, 突变的细胞周期蛋白依赖性激酶抑制蛋白2A (cyclin-dependent kinase inhibitor 2A, CDKN2A)可能通过失活的TP53导致细胞周期G1的异常调控, 影响肿瘤的生长[48]。
甲基鸟嘌呤DNA甲基转移酶(methylguanine DNA methyltransferase, MGMT)均存在于COPD和肺癌患者机体内, 然而在肺癌中通常是沉默表达的[49]。MGMT是细胞中的DNA损伤修复酶, 可激活DNA修复蛋白并减少基因突变和肿瘤发生。研究表明, 当单个DNA修复蛋白的敲除与突变结合时, 肺癌的风险会显著增加[12]。
内源性细胞代谢副产物和外源性致癌物如香烟烟雾会增加DNA损伤的数目, DNA损伤会导致修复过程的激活差异, 具体取决于其数量和类型[12]。此外, COPD导致的气流受限会使致癌物难以从气道清除, 诱发DNA修复错误、癌基因激活和抑癌基因受损, 增加呼吸道的致癌性[50]。
2.4 免疫系统受损研究表明, 在COPD患者中存在两种免疫反应改变: T细胞调节异常与T细胞衰竭[1], 这些变化会引起免疫系统的损伤。肿瘤细胞可以通过自身变异、改变抗原和阻断凋亡信号等途径逃避机体免疫监测, 引起宿主的免疫抑制[51]。此外, 程序性细胞死亡蛋白1 (programmed cell death protein, PD-1)在衰竭T细胞中的表达与COPD患者免疫功能的改变有关。在NSCLC患者中, PD-1与PD-L1结合抑制了T细胞的免疫活性, 使肿瘤细胞逃避免疫攻击, 进而诱导肿瘤发生[5]。
CD4+T细胞可分化为Th1、Th2、Th17和Treg细胞, 其中Th1细胞和Th2细胞具有促肿瘤与抗肿瘤的作用, 而Th17和Treg细胞具有促炎与抗炎的调节作用[5]。研究表明, COPD与肺癌的转化过程与Th1/Th2和Th17/Treg平衡影响的免疫调节有关[12]。此外, COPD中的气道巨噬细胞转化为M2型, 该状态有利于在肿瘤微环境内释放趋化因子诱导炎症反应[52]。
临床和临床前研究显示, Th17细胞分泌的IL-17通过促进募集白细胞, 释放人中性粒细胞弹性蛋白酶(human neutrophil elastase, HNE)和MMP-9等介质, 导致细胞外基质破坏和上皮细胞完整性丧失, 进而加重肺部炎症[51]。另外, IL-17A受体缺陷的小鼠免受香烟烟雾引起的肺气肿的侵袭也证实了这一点[53]。
COPD患者肺部长时间暴露于病原体下会影响先天免疫系统和适应性免疫系统。Toll样受体(Toll like receptor, TLR)主要参与识别并触发针对病原体攻击的先天性免疫反应[54]。TLR途径失调可导致炎症增加, 诱导肿瘤发生。此外, TLR4通过调节结构细胞中NADPH氧化酶3的表达来维持肺部氧化还原的平衡[55]。
2.5 氧化应激氧化应激可诱导产生致癌脂质过氧化物, 改变细胞外基质使防御机制失活[56]。氧化应激与细胞中的线粒体功能状态密切相关, 线粒体功能损害导致DNA损伤和慢性炎症增加, 从而增加致癌风险。在COPD中, Pink1-Parkin通路激活后, 泛素降解分子的转位受损, 导致线粒体功能异常[2]。
线粒体是RNOS的主要细胞来源, 活性氧会促进反应性羰基的形成, 既可引发DNA损伤, 也能改变宿主免疫力和肿瘤抑制功能[57]。线粒体损伤在细胞核周围累积, 产生大量的mtROS, 直接导致核基因损伤。
核因子-E2相关因子2 (nuclear factor-E2-related factor 2, Nrf2)由抗氧化剂响应元件(antioxidant response element, ARE)驱动, 主要调节细胞保护蛋白表达。激活Nrf2信号可以防止细胞和组织受到氧化应激诱导的损伤, 过度的氧化负担和肺细胞凋亡会引起Nrf2受损[58]。在NSCLC患者中, 由于体细胞突变和异常Nrf2激活, KELCH样ECH关联蛋白1 (Kelch like ECH associated protein 1, Keap1)功能障碍通常导致总体生存状况恶化。相反, 通过siRNA沉默Nrf2因子可抑制肿瘤生长并逆转化疗耐药性[59]。因此, 认为Keap1-Nrf2/ARE通路是一种有前景的抗氧化治疗候选靶点。
据研究报道[56], COPD可能通过诱导超氧化物歧化酶2 (superoxide dismutase 2, SOD2)增加氧化应激水平使肺癌风险增加。香烟烟雾激活白细胞产生超氧自由基, 在SOD2的影响下迅速转变为过氧化氢, 加速细胞衰老和DNA损伤[57]。
2.6 肿瘤血管生成肿瘤新生血管生成是肿瘤发展的特征之一。血管内皮生长因子(vascular endothelial growth factor, VEGF)和成纤维细胞生长因子2 (fibroblast growth factor-2, FGF-2)属于血管生成细胞因子, 可以刺激现有血管中的内皮细胞迁移和增殖, 生成新的血管。空气污染物、烟雾等有毒气体通过炎症级联反应和STAT3磷酸化激活肺组织结构中VEGF和FGF-2的过表达, 导致肺血管生成异常[60]。
Kranenburg等[61]发现, 在COPD的炎症组织中通常是缺氧的, 机体通过上调VEGF和FGF-2来促进缺氧诱导因子1 (hypoxia-inducible factor-1, HIF-1)表达进而诱导血管生成。RAS家族蛋白突变通过HIF-1转录元件激活PI3K/AKT通路, 从而增加VEGF的表达[46]。此外, HIF-1激活表皮生长因子(epidermal growth factor, EGF)导致VEGF过表达, EGFR基因的激活能够诱导新生血管生成。
血管紧张素转化酶2 (angiotensin converting enzyme 2, ACE2)是肾素-血管紧张素系统(renin-angiotensin system, RAS)中的重要活性肽, 其在血管内皮、肺泡上皮细胞、肺血管的平滑肌细胞和支气管上皮细胞中以膜结合蛋白的方式高度表达。血管紧张素Ⅱ (angiotensin Ⅱ, Ang Ⅱ)是RAS系统中的一种具有多功能生物活性的八肽, ACE2将Ang Ⅱ水解为血管扩张性七肽Ang (1-7), Ang (1-7)激活G蛋白偶联受体Mas发挥抗炎和抗重塑作用。ACE2/Ang (1-7)/Mas轴常起到反调节ACE/Ang Ⅱ/AT1轴的作用, 如调节炎症、细胞增殖和纤维化作用等[62]。研究表明, 在COPD大鼠模型中发现ACE2 mRNA表达降低、ROS升高和炎性细胞因子水平升高[63]。ACE2可能通过p38 MAPK和NF-κB途径调节炎症细胞募集和炎症细胞因子释放[64], 进而延迟肿瘤的生长和转移。
3 治疗手段许多吸烟者同时患有COPD和肺癌, 这使疾病发展变得复杂。肺癌预防措施的首要任务是戒烟, 一项针对吸烟者31年的随访研究表明, 戒烟者减少50%的吸烟量可以显著降低患肺癌的风险[65]。除此之外, 手术治疗、放射治疗及药物治疗在延长患者生命周期中起着至关重要的作用。
3.1 手术与放疗临床COPD治疗的目标是尽量保留残余的肺功能, 改善症状并防止病情加重。研究表明, 肺泡切除术和肺移植是目前显著改善肺功能和降低死亡率的重要干预措施[22]。对于合并严重COPD的NSCLC患者, 肺康复可以减少肺叶切除术后的肺部并发症。一项回顾性研究分析了116例COPD患者, 其中51例接受了肺康复治疗[66]。结果表明肺康复可提高肺叶切除术后早期肺功能恢复率, 降低肺癌风险。然而, 由于肺功能损害及其他并发症存在, 手术治疗并不适合于此类患者。
在NSCLC患者中, 放射治疗对小细胞癌最佳, 鳞癌次之, 腺癌最差。接受常规放疗的患者罹患肺炎风险增加, 且辐射范围大[67]。相比之下, 立体定向体放射治疗(stereotactic body radiation therapy, SBRT)预后效果较好且更为安全。SBRT是一种新型的放射治疗技术, 适于不可进行手术的重度COPD合并肺癌患者。在Palma等[68]研究中, 176例Ⅲ-Ⅳ期COPD和Ⅰ期NSCLC患者接受SBRT治疗。结果表明, 患者3年的总生存期相对延长, 且发病率和死亡率均降低, 表现出良好的治疗效果。
3.2 药物治疗临床上干预COPD转化为肺癌的药物治疗主要用于控制COPD症状及有利于病情好转, 常用药物包括支气管扩张剂、广谱抗炎药物和靶向药物等。
支气管扩张剂常用于哮喘和COPD等呼吸系统疾病的一线治疗, 主要分为β2受体激动剂和抗胆碱药。β2受体激动剂激动位于气管平滑肌(airway smooth muscle, ASM)细胞的β2肾上腺素受体、激活腺苷酸环化酶及cAMP依赖的蛋白酶, 并且抑制脂多糖诱导的TNF-α释放, 松弛ASM并改善患者呼吸困难[69]。抗胆碱药作用于细胞膜的胆碱能受体, 在小鼠模型中减少CS诱导的LTB4、IL-6、MCP-1、TNF-α等炎症介质的释放, 使支气管扩张[70]。短效β2受体激动剂沙丁胺醇和特布他林等及短效抗胆碱能药物异丙托溴铵等主要缓解患者急性症状, 而长效β2受体激动剂(long-acting β agonist, LABA)福莫特罗和沙美特罗等以及长效抗胆碱能药物(long-acting muscarinic antagonist, LAMA)噻托溴铵等作用时间可达12 h以上, 适用于急性加重高风险患者。
磷酸二酯酶4 (phosphodiesterase 4, PDE4)抑制剂和吸入皮质类固醇(inhaled corticosteroid, ICS)是临床上针对改善COPD患者炎症反应的主要药物。PDE4抑制剂罗氟司特和西洛司特可以降低中性粒细胞、巨噬细胞和CD8+细胞的数量, 明显抑制TNF-α的合成和释放, 旨在减少COPD患者的气道炎症和支气管收缩[71]。研究表明, ICS可显著改善患者1秒用力呼气量(forced expiratory volume in 1 s, FEV1), 减少COPD患者慢性炎症的发生, 降低致癌风险[72]。如氟替卡松丙酸酯对气道具有免疫调节作用, 还可有效降低S100A4和波形蛋白的表达[73]。此外, 使用三联疗法(LABA + LAMA + ICS)可以使中度或重度COPD患者加重率降低, 改善肺功能, 降低患癌几率[74]。然而, Sørli等[75]随机对照试验结果表明, ICS并未有效降低肺癌的发病率。这可能是诊断程序、调查方法、剂量和标准等不同导致的, COPD的致癌作用也不能仅通过慢性炎症的改变来解释。
应用于COPD的大部分药物主要是改善COPD患者的症状, 缺乏治本措施, 因此迫切需要针对COPD转化为肺癌的机制的药物研发。IKB激酶(IK kinase, IKK)抑制剂通过抑制NF-κB信号通路抑制TNF-α、IL-8等炎症因子释放。Li等[76]合成了一种IKK抑制剂IMD0354, 在低浓度时可抑制促炎细胞因子的产生, 可能有助于治疗慢性炎症或预防癌症。另外, HNE是降解基质的关键蛋白酶, HNE抑制剂BAY 85-8501目前正处于治疗肺部疾病的Ⅱ期临床试验中, 有望成为治疗COPD的潜在靶点[77]。尽管靶向药物大多处于初始研究阶段, 但其干预COPD转化为肺癌的治疗前景应该受到重视。
部分NSCLC患者无法手术治疗的主要原因是合并COPD, 此类患者预后较差, 临床上主要应用免疫检查点抑制剂(immune checkpoint inhibitors, ICIs)和酪氨酸激酶抑制剂(tyrosine kinase inhibitors, TKIs)等药物, 延长患者生命周期, 降低疾病死亡率。NSCLC合并COPD患者对ICIs的敏感性高于单纯NSCLC患者, 其中包括PD-1/PD-L1抑制剂阿特珠单抗和哌姆单抗[78]。阻断PD-1/PD-L1信号传导可增强肿瘤特异性T细胞免疫, 提高抗肿瘤疗效。EGFR基因突变和间变性淋巴瘤激酶(anaplastic lymphoma kinase, ALK)基因重排突变导致肺癌的发生, 靶向药物治疗可以显著降低NSCLC死亡率[79]。6个上市的EGFR-TKIs药物吉非替尼、厄洛替尼、埃克替尼、阿法替尼、达克替尼和奥斯替尼, 以及5个ALK-TKIs药物克唑替尼、塞瑞替尼、阿来替尼、布加替尼和劳拉替尼的治疗效果明显优于传统化疗组, 但其耐药性限制了此类药物在临床上的使用。寻找新的靶点药物和克服耐药性是治疗NSCLC患者以及NSCLC合并COPD患者的主要研究方向。
此外, 新型药物传递系统和个性化治疗是当前肿瘤治疗的热点。研究表明, 纳米粒、脂质体和树枝状大分子等可以逃避黏膜纤毛清除并可以准确到达治疗部位发挥作用[80], 这些载体改善了药物的溶解度, 并且提高用药安全性。
4 总结与展望COPD与肺癌具有共同的危险因素, 包括香烟烟雾和表观遗传变化等, 但这些因素是否一定使COPD转化为肺癌还待进一步的研究。其中, 慢性炎症和氧化应激的增加最可能驱动COPD转化为肺癌。COPD是一种极其复杂的肺部疾病, 转化为肺癌的分子机制并不是孤立地起作用, 而是相互交织在一起。例如, 慢性炎症可导致慢性有丝分裂, 并增加内源性DNA损伤和基因突变; 氧化剂和抗氧化剂失衡会导致自由基破坏DNA[81]。然而, 目前尚不清楚COPD患者肺癌发病率增加的确切机制, 但这两种疾病在分子水平上密切相关。
通过认识与COPD和肺癌有关的常见信号通路, 希望针对COPD潜在疾病提出有效的治疗策略, 并且可以降低COPD转化为肺癌的风险。尽管已经确定了这两种疾病之间存在一定的联系, 但是用于预防COPD患者发展为肺癌的治疗方法仍然有限, 而且药物的多中心临床研究证据相对缺乏。进一步研究阐明COPD转化为肺癌的过程及确定分子靶标迫在眉睫, 研究者需要挖掘COPD与肺癌之间的分子联系, 针对分子靶标研究开发出靶点药物, 为COPD转化为肺癌的干预提供预防、筛查和药物治疗等方面的有力支持。
| [1] |
Zeneyedpour L, Dekker LJM, van Sten-van T Hoff JJM, et al. Neoantigens in chronic obstructive pulmonary disease and lung cancer: a point of view[J]. Proteomics Clin Appl, 2019, 13: e1800093. DOI:10.1002/prca.201800093 |
| [2] |
Fang TT, Wang MN, Xiao HY, et al. Mitochondrial dysfunction and chronic lung disease[J]. Cell Biol Toxicol, 2019, 35: 493-502. DOI:10.1007/s10565-019-09473-9 |
| [3] |
Vliegen G, Raju TK, Adriaensen D, et al. The expression of proline-specific enzymes in the human lung[J]. Ann Transl Med, 2017, 5: 130. DOI:10.21037/atm.2017.03.36 |
| [4] |
Jiang WX, Cai GQ, Hu PC, et al. Personalized medicine in non-small cell lung cancer: a review from a pharmacogenomics perspective[J]. Acta Pharm Sin B, 2018, 8: 530-538. DOI:10.1016/j.apsb.2018.04.005 |
| [5] |
Parris BA, O'Farrell HE, Fong KM, et al. Chronic obstructive pulmonary disease (COPD) and lung cancer: common pathways for pathogenesis[J]. J Thorac Dis, 2019, 11: S2155-S2172. DOI:10.21037/jtd.2019.10.54 |
| [6] |
Quaderi SA, Hurst JR. The unmet global burden of COPD[J]. Glob Health Epidemiol Genom, 2018, 3: e4. DOI:10.1017/gheg.2018.1 |
| [7] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67: 7-30. DOI:10.3322/caac.21387 |
| [8] |
Wong MCS, Lao XQ, Ho KF, et al. Incidence and mortality of lung cancer: global trends and association with socioeconomic status[J]. Sci Rep, 2017, 7: 14300. DOI:10.1038/s41598-017-14513-7 |
| [9] |
Powell HA, Iyen-Omofoman B, Baldwin DR, et al. Chronic obstructive pulmonary disease and risk of lung cancer: the importance of smoking and timing of diagnosis[J]. J Thorac Oncol, 2013, 8: 6-11. DOI:10.1097/JTO.0b013e318274a7dc |
| [10] |
Aoshiba K, Zhou F, Tsuji T, et al. DNA damage as a molecular link in the pathogenesis of COPD in smokers[J]. Eur Respir J, 2012, 39: 1368. DOI:10.1183/09031936.00050211 |
| [11] |
Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation[J]. Cell, 2011, 144: 646-674. DOI:10.1016/j.cell.2011.02.013 |
| [12] |
Sears CR. DNA repair as an emerging target for COPD-lung cancer overlap[J]. Respir Invest, 2019, 57: 111-121. DOI:10.1016/j.resinv.2018.11.005 |
| [13] |
Wang C, Chen SZ. Advances in the mechanisms of acquired resistance to EGFR-tyrosine kinase inhibitors in non-small cell lung cancer[J]. Acta Pharm Sin (药学学报), 2019, 54: 1364-1371. |
| [14] |
Ni YM, Shi GC, Qu JM. Indoor PM 2.5, tobacco smoking and chronic lung diseases: a narrative review[J]. Environ Res, 2020, 181: 108910. DOI:10.1016/j.envres.2019.108910 |
| [15] |
Hou W, Hu SY, Li CY, et al. Cigarette smoke induced lung barrier dysfunction, EMT, and tissue remodeling: a possible link between COPD and lung cancer[J]. Biomed Res Int, 2019, 2019: 2025636. |
| [16] |
Hamilton G, Rath B. Smoking, inflammation and small cell lung cancer: recent developments[J]. Wien Med Wochenschr, 2015, 165: 379-386. DOI:10.1007/s10354-015-0381-6 |
| [17] |
Govindan R, Ding L, Griffith M, et al. Genomic landscape of non-small cell lung cancer in smokers and never-smokers[J]. Cell, 2012, 150: 1121-1134. DOI:10.1016/j.cell.2012.08.024 |
| [18] |
Rovina N, Koutsoukou A, Koulouris NG. Inflammation and immune response in COPD: where do we stand?[J]. Med Inflamm, 2013, 2013: 413735. |
| [19] |
Young RP, Hopkins RJ. How the genetics of lung cancer may overlap with COPD[J]. Respirology, 2011, 16: 1047-1055. DOI:10.1111/j.1440-1843.2011.02019.x |
| [20] |
Orosz Z, Csiszar A, Labinskyy N, et al. Cigarette smoke-induced proinflammatory alterations in the endothelial phenotype: role of NAD(P)H oxidase activation[J]. Am J Physiol Heart Circul Physiol, 2007, 292: H130-H139. DOI:10.1152/ajpheart.00599.2006 |
| [21] |
Schraufnagel DE, Balmes JR, Cowl CT, et al. Air pollution and noncommunicable diseases: a review by the Forum of International Respiratory Societies' Environmental Committee, part 2: air pollution and organ systems[J]. Chest, 2019, 155: 417-426. DOI:10.1016/j.chest.2018.10.041 |
| [22] |
de Torres JP, Marín JM, Casanova C, et al. Lung cancer in patients with chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 2011, 184: 913-919. DOI:10.1164/rccm.201103-0430OC |
| [23] |
Liu S, Zhou YM, Liu SX, et al. Association between exposure to ambient particulate matter and chronic obstructive pulmonary disease: results from a cross-sectional study in China[J]. Thorax, 2017, 72: 788. DOI:10.1136/thoraxjnl-2016-208910 |
| [24] |
Zhang JF, Smith KR. Household air pollution from coal and biomass fuels in China: measurements, health impacts, and interventions[J]. Environ Health Perspect, 2007, 115: 848-855. DOI:10.1289/ehp.9479 |
| [25] |
Bailey-Wilson JE, Amos CI, Pinney SM, et al. A major lung cancer susceptibility locus maps to chromosome 6q23-25[J]. Am J Hum Genet, 2004, 75: 460-474. DOI:10.1086/423857 |
| [26] |
Couraud S, Zalcman G, Milleron B, et al. Lung cancer in never smokers - a review[J]. Eur J Cancer, 2012, 48: 1299-1311. DOI:10.1016/j.ejca.2012.03.007 |
| [27] |
Cho MH, McDonald ML, Zhou X, et al. Risk loci for chronic obstructive pulmonary disease: a genome-wide association study and meta-analysis[J]. Lancet Respir Med, 2014, 2: 214-225. DOI:10.1016/S2213-2600(14)70002-5 |
| [28] |
Qiu W, Baccarelli A, Carey VJ, et al. Variable DNA methylation is associated with chronic obstructive pulmonary disease and lung function[J]. Am J Respir Crit Care Med, 2012, 185: 373-381. DOI:10.1164/rccm.201108-1382OC |
| [29] |
Nader CP, Cidem A, Verrills NM, et al. Protein phosphatase 2A (PP2A): a key phosphatase in the progression of chronic obstructive pulmonary disease (COPD) to lung cancer[J]. Respir Res, 2019, 20: 222. DOI:10.1186/s12931-019-1192-x |
| [30] |
Guo QR, Liu Y, Su CY, et al. Non-coding RNA and tumor immune regulation[J]. Acta Pharm Sin (药学学报), 2019, 54: 1783-1791. |
| [31] |
Li Y, Yin ZR, Fan JS, et al. The roles of exosomal miRNAs and lncRNAs in lung diseases[J]. Signal Transduct Target Ther, 2019, 4: 47. DOI:10.1038/s41392-019-0080-7 |
| [32] |
Catalanotto C, Cogoni C, Zardo G. microRNA in control of gene expression: an overview of nuclear functions[J]. Int J Mol Sci, 2016, 17: 1712. DOI:10.3390/ijms17101712 |
| [33] |
Alipoor SD, Adcock IM, Garssen J, et al. The roles of miRNAs as potential biomarkers in lung diseases[J]. Eur J Pharmacol, 2016, 791: 395-404. DOI:10.1016/j.ejphar.2016.09.015 |
| [34] |
Dutta RK, Chinnapaiyan S, Unwalla H. Aberrant micro RNAomics in pulmonary complications: implications in lung health and diseases[J]. Mol Ther Nucl Acids, 2019, 18: 413-431. DOI:10.1016/j.omtn.2019.09.007 |
| [35] |
Ebrahimi A, Sadroddiny E. microRNAs in lung diseases: recent findings and their pathophysiological implications[J]. Pulm Pharmacol Ther, 2015, 34: 55-63. DOI:10.1016/j.pupt.2015.08.007 |
| [36] |
Gon Y, Shimizu T, Mizumura K, et al. Molecular techniques for respiratory diseases: microRNA and extracellular vesicles[J]. Respirology, 2020, 25: 149-160. |
| [37] |
Mateu-Jimenez M, Curull V, Rodríguez-Fuster A, et al. Profile of epigenetic mechanisms in lung tumors of patients with underlying chronic respiratory conditions[J]. Clin Epigenetics, 2018, 10: 7. DOI:10.1186/s13148-017-0437-0 |
| [38] |
Keller A, Fehlmann T, Ludwig N, et al. Genome-wide microRNA expression profiles in COPD: early predictors for cancer development[J]. Genom Proteom Bioinf, 2018, 16: 162-171. |
| [39] |
Eapen MS, Sharma P, Gaikwad AV, et al. Epithelial-mesenchymal transition is driven by transcriptional and post transcriptional modulations in COPD: implications for disease progression and new therapeutics[J]. Int J Chron Obstruct Pulmon Dis, 2019, 14: 1603-1610. DOI:10.2147/COPD.S208428 |
| [40] |
Lim J, Shin KM, Lee K, et al. Relationship between emphysema severity and the location of lung cancer in patients with chronic obstructive lung disease[J]. Am J Roentgenol, 2015, 205: 540-545. DOI:10.2214/AJR.14.13992 |
| [41] |
Mahmood MQ, Ward C, Muller HK, et al. Epithelial mesenchymal transition (EMT) and non-small cell lung cancer (NSCLC): a mutual association with airway disease[J]. Med Oncol, 2017, 34: 45. DOI:10.1007/s12032-017-0900-y |
| [42] |
Milara J, Peiró T, Serrano A, et al. Epithelial to mesenchymal transition is increased in patients with COPD and induced by cigarette smoke[J]. Thorax, 2013, 68: 410. DOI:10.1136/thoraxjnl-2012-201761 |
| [43] |
Samadi AK, Bilsland A, Georgakilas AG, et al. A multi-targeted approach to suppress tumor-promoting inflammation[J]. Semin Cancer Biol, 2015, 35: S151-S184. DOI:10.1016/j.semcancer.2015.03.006 |
| [44] |
Singh N, Baby D, Rajguru JP, et al. Inflammation and cancer[J]. Ann Afr Med, 2019, 18: 121-126. DOI:10.4103/aam.aam_56_18 |
| [45] |
Sekine Y, Katsura H, Koh E, et al. Early detection of COPD is important for lung cancer surveillance[J]. Eur Respir J, 2012, 39: 1230. DOI:10.1183/09031936.00126011 |
| [46] |
Laddha AP, Kulkarni YA. VEGF and FGF-2: promising targets for the treatment of respiratory disorders[J]. Respir Med, 2019, 156: 33-46. DOI:10.1016/j.rmed.2019.08.003 |
| [47] |
Durham AL, Adcock IM. The relationship between COPD and lung cancer[J]. Lung Cancer, 2015, 90: 121-127. DOI:10.1016/j.lungcan.2015.08.017 |
| [48] |
Wang DC, Shi L, Zhu ZH, et al. Genomic mechanisms of transformation from chronic obstructive pulmonary disease to lung cancer[J]. Semin Cancer Biol, 2017, 42: 52-59. DOI:10.1016/j.semcancer.2016.11.001 |
| [49] |
Leng S, Wu G, Collins LB, et al. Implication of a chromosome 15q15.2 locus in regulating UBR1 and predisposing smokers to MGMT methylation in lung[J]. Cancer Res, 2015, 75: 3108. DOI:10.1158/0008-5472.CAN-15-0243 |
| [50] |
Takiguchi Y, Sekine I, Iwasawa S, et al. Chronic obstructive pulmonary disease as a risk factor for lung cancer[J]. World J Clin Oncol, 2014, 5: 660-666. DOI:10.5306/wjco.v5.i4.660 |
| [51] |
Desrichard A, Snyder A, Chan TA. Cancer neoantigens and applications for immunotherapy[J]. Clin Cancer Res, 2016, 22: 807. DOI:10.1158/1078-0432.CCR-14-3175 |
| [52] |
Liu JY, Ren LW, Li S, et al. Research progress of tumor immune and tumor metabolic drug targets[J]. Acta Pharm Sin (药学学报), 2019, 54: 1718-1727. |
| [53] |
Chen K, Pociask DA, McAleer JP, et al. IL-17RA is required for CCL2 expression, macrophage recruitment, and emphysema in response to cigarette smoke[J]. PLoS One, 2011, 6: e20333. DOI:10.1371/journal.pone.0020333 |
| [54] |
Arora S, Ahmad S, Irshad R, et al. TLRS in pulmonary diseases[J]. Life Sci, 2019, 233: 116671. DOI:10.1016/j.lfs.2019.116671 |
| [55] |
Schleimer RP. Innate immune responses and chronic obstructive pulmonary disease: "terminator" or "terminator 2"?[J]. Proc Am Thorac Soc, 2005, 2: 342-372. DOI:10.1513/pats.200504-030SR |
| [56] |
Houghton AM. Common mechanisms linking chronic obstructive pulmonary disease and lung cancer[J]. Ann Am Thorac Soc, 2018, 15: S273-S277. DOI:10.1513/AnnalsATS.201808-537MG |
| [57] |
Bozinovski S, Vlahos R, Anthony D, et al. COPD and squamous cell lung cancer: aberrant inflammation and immunity is the common link[J]. Br J Pharmacol, 2016, 173: 635-648. DOI:10.1111/bph.13198 |
| [58] |
Malhotra D, Thimmulappa R, Navas-Acien A, et al. Decline in Nrf2-regulated antioxidants in chronic obstructive pulmonary disease lungs due to loss of its positive regulator, DJ-1[J]. Am J Respir Crit Care Med, 2008, 178: 592-604. DOI:10.1164/rccm.200803-380OC |
| [59] |
Mizumura K, Maruoka S, Shimizu T, et al. Role of Nrf2 in the pathogenesis of respiratory diseases[J]. Respir Invest, 2020, 58: 28-35. DOI:10.1016/j.resinv.2019.10.003 |
| [60] |
Landskron G, De la Fuente M, Thuwajit P, et al. Chronic inflammation and cytokines in the tumor microenvironment[J]. J Immunol Res, 2014, 2014: 149185. |
| [61] |
Kranenburg AR, de Boer WI, Alagappan VKT, et al. Enhanced bronchial expression of vascular endothelial growth factor and receptors (Flk-1 and Flt-1) in patients with chronic obstructive pulmonary disease[J]. Thorax, 2005, 60: 106-113. DOI:10.1136/thx.2004.023986 |
| [62] |
Tan WSD, Liao W, Zhou S, et al. Targeting the renin-angiotensin system as novel therapeutic strategy for pulmonary diseases[J]. Curr Opin Pharmacol, 2018, 40: 9-17. DOI:10.1016/j.coph.2017.12.002 |
| [63] |
Tian X, Nie W, Zhou X, et al. Angiotensin-converting enzyme-2 overexpression attenuates inflammation in rat model of chronic obstructive pulmonary disease[J]. Inhal Toxicol, 2014, 26: 14-22. DOI:10.3109/08958378.2013.850563 |
| [64] |
Zhang H, Li Y, Zeng Y, et al. Endothelin-1 downregulates angiotensin-converting enzyme-2 expression in human bronchial epithelial cells[J]. Pharmacology, 2013, 91: 297-304. DOI:10.1159/000350395 |
| [65] |
Godtfredsen NS, Prescott E, Osler M. Effect of smoking reduction on lung cancer risk[J]. JAMA, 2005, 294: 1505-1510. DOI:10.1001/jama.294.12.1505 |
| [66] |
Saito H, Hatakeyama K, Konno H, et al. Impact of pulmonary rehabilitation on postoperative complications in patients with lung cancer and chronic obstructive pulmonary disease[J]. Thorac Cancer, 2017, 8: 451-460. DOI:10.1111/1759-7714.12466 |
| [67] |
Donovan EK, Swaminath A. Stereotactic body radiation therapy (SBRT) in the management of non-small-cell lung cancer: clinical impact and patient perspectives[J]. Lung Cancer, 2018, 9: 13-23. |
| [68] |
Palma D, Lagerwaard F, Rodrigues G, et al. Curative treatment of stage I non-small-cell lung cancer in patients with severe COPD: stereotactic radiotherapy outcomes and systematic review[J]. Int J Radiat Oncol Biol Phys, 2012, 82: 1149-1156. DOI:10.1016/j.ijrobp.2011.03.005 |
| [69] |
Billington CK, Penn RB, Hall IP. β(2) Agonists[J]. Handb Exp Pharmacol, 2017, 237: 23-40. |
| [70] |
Wollin L, Pieper MP. Tiotropium bromide exerts anti-inflammatory activity in a cigarette smoke mouse model of COPD[J]. Pulm Pharmacol Ther, 2010, 23: 345-354. DOI:10.1016/j.pupt.2010.03.008 |
| [71] |
Chong J, Leung B, Poole P. Phosphodiesterase 4 inhibitors for chronic obstructive pulmonary disease[J]. Cochrane Database Syst Rev, 2017, 9: CD002309. |
| [72] |
Sandelin M, Mindus S, Thuresson M, et al. Factors associated with lung cancer in COPD patients[J]. Int J Chron Obstruct Pulmon Dis, 2018, 13: 1833-1839. DOI:10.2147/COPD.S162484 |
| [73] |
Lee YM, Kim SJ, Lee JH, et al. Inhaled corticosteroids in COPD and the risk of lung cancer[J]. Int J Cancer, 2018, 143: 2311-2318. DOI:10.1002/ijc.31632 |
| [74] |
Zheng Y, Zhu J, Liu Y, et al. Triple therapy in the management of chronic obstructive pulmonary disease: systematic review and meta-analysis[J]. BMJ, 2018, 363: k4388. |
| [75] |
Sørli K, Thorvaldsen SM, Hatlen P. Use of inhaled corticosteroids and the risk of lung cancer, the hunt study[J]. Lung, 2018, 196: 179-184. DOI:10.1007/s00408-018-0092-z |
| [76] |
Li YR, Lin CC, Huang CY, et al. Study of the inhibitory effects on TNF-α-induced NF-κB activation of IMD0354 analogs[J]. Chem Biol Drug Des, 2017, 90: 1307-1311. |
| [77] |
von Nussbaum F, Li VMJ, Allerheiligen S, et al. Freezing the bioactive conformation to boost potency: the identification of BAY 85-8501, a selective and potent inhibitor of human neutrophil elastase for pulmonary diseases[J]. ChemMedChem, 2015, 10: 1163-1173. DOI:10.1002/cmdc.201500131 |
| [78] |
Shin SH, Park HY, Im Y, et al. Improved treatment outcome of pembrolizumab in patients with nonsmall cell lung cancer and chronic obstructive pulmonary disease[J]. Int J Cancer, 2019, 145: 2433-2439. DOI:10.1002/ijc.32235 |
| [79] |
Tadokoro H, Aguiar PN, Liu DJJ, et al. EGFR and EML4-ALK updated therapies in non-small cell lung cancer[J]. Recent Pat Anticancer Drug Discov, 2016, 11: 393-400. DOI:10.2174/1574892811666160803090944 |
| [80] |
Wang XS, Chen HY, Zeng XW, et al. Efficient lung cancer-targeted drug delivery via a nanoparticle/MSC system[J]. Acta Pharm Sin B, 2019, 9: 167-176. DOI:10.1016/j.apsb.2018.08.006 |
| [81] |
Sekine Y, Hata A, Koh E, et al. Lung carcinogenesis from chronic obstructive pulmonary disease: characteristics of lung cancer from COPD and contribution of signal transducers and lung stem cells in the inflammatory microenvironment[J]. Gen Thorac Cardiovasc Surg, 2014, 62: 415-421. DOI:10.1007/s11748-014-0386-x |
 2020, Vol. 55
2020, Vol. 55


