作者贡献: 该文章由司绒、程明涵收集整理了文献资料并进行撰写, 高建提供了文章的总体思路, 并为文章的修改提供了重要的指导和意见。
利益冲突:作者声明没有任何利益冲突。
半乳糖凝集素-3 (galectin-3, Gal-3)是一种多功能蛋白质, 在调节人体的多种生理和病理生理过程中发挥重要的作用[1]。Gal-3的过表达和分泌与多种疾病的发生发展进程有关, 尤其是在心力衰竭、癌症、脏器纤维化和糖尿病等疾病中。在过去的十多年, 人们对Gal-3开展了广泛的研究, 很多研究认为Gal-3可作为心衰和心血管疾病的一个生物标志物[2]。Gal-3在肺部高表达, 且Gal-3的多种抑制剂正在被开发作为治疗癌症和纤维化等多种疾病的药物, 同时, 越来越多的证据表明Gal-3与多种呼吸系统疾病有关, 因此本文围绕Gal-3与呼吸系统多种疾病的研究进展作总结分析, 以期评估Gal-3是否可以作为呼吸系统疾病的一个新兴的生物标志物, 从而为其临床治疗提供一个潜在的药物靶点。
1 Gal-3的介绍 1.1 Gal-3的结构凝集素是在植物和动物中均被发现的一种碳水化合物结合蛋白, 最初被定义为“具有凝集细胞和沉淀糖结合物能力的非免疫来源的糖结合蛋白”[3]。半乳糖凝集素属于动物凝集素家族, 是一组进化保守的水溶性的非糖基化的球状蛋白质, 能够以非共价键结合的方式与碳水化合物相互作用。Gal-3属于半乳糖凝集素家族的一员, 迄今为止, 已经在哺乳动物中鉴定了15种半乳糖凝集素, 它们都具有共同的碳水化合物识别结构域(carbohydrate recognition domain, CRD)[4]。CRD区域可结合不同的糖蛋白和糖脂分子等, 参与多种生物功能包括细胞的生长、增殖和分化等。根据结构将半乳糖凝集素分为3种类型(图 1), 包括半乳糖凝集素原型:仅含有CRD结构, 一般形成2个相同CRD的二聚体形式(见于Gal-1、2、5、7、10、11、13、14和15中); 串联重复型:通过一段重复的胶原样序列连接2个不同CRD的串联形式(见于Gal-4、6、8、9和12中); 嵌合体类型:具有1个COOH末端、一个NH2末端以及中间的重复胶原样序列(仅见于Gal-3)[5]。当通过多价相互作用连接细胞表面的碳水化合物时, Gal-3可以通过CRD-CRD连接或者NH2-NH2连接自我寡聚为五聚体或其他形式, 形成黏附网络[1, 6]。

|
Figure 1 The 15 galectins are divided into three types according to their structure: proto-, chimera-, and tandem-repeat types |
Gal-3结构中的每一个部分都与至少一个特定功能相关: NH2末端包含1个丝氨酸磷酸化位点, 这对调节其入核定位很重要; 富含脯氨酸的胶原样序列可被基质金属蛋白酶(MMPs)切割, 并且该切割作用可作为组织中MMP-2和MMP-9活性的替代诊断标记物; COOH末端含有单个CRD、NWGR抗死亡基序和调节出核的信号位点(图 2)[7]。

|
Figure 2 Structure and post-translational modifications of galectin-3 |
在成年人体中, Gal-3广泛分布于造血组织、胸腺、淋巴结、皮肤、呼吸道、消化道、生殖道和泌尿道中, 并且Gal-3的表达取决于组织类型和组织成熟度。有文献报道, 通过Western blot实验方法检测小鼠不同组织的Gal-3表达, 结果发现Gal-3在肺、脾脏、胃、结肠、子宫和卵巢中表达最高, 在肝、肾和肾上腺表达中等, 而在心脏、胰腺和回肠的表达最低[8]。尽管Gal-3的表达在不同组织中是不同的, 但其表达是可诱导的。例如, 健康的心脏组织的基线Gal-3表达非常低, 但是在心脏损伤期间会迅速增加其表达, 这在组织修复的初始阶段起着至关重要的作用, 然而, 持续的过度表达会导致心脏纤维化[9]。损伤后在其他组织中也可诱导Gal-3的表达增加, 这与器官纤维化显著相关。除了组织特异性, Gal-3的表达也具有细胞特异性, 目前发现Gal-3主要在肿瘤细胞、巨噬细胞、上皮细胞、成纤维细胞及活化的T细胞中表达。即使在相同的组织中, 不同的细胞类型表达Gal-3也有所不同, 例如在造血组织中, Gal-3在单核细胞中有所表达, 但在巨噬细胞中表达量更高[10]。
Gal-3在1982年首次被鉴定为“巨噬细胞亚群特异性标记物(Mac-2抗原)”, 其分布在细胞质、细胞外培养基以及细胞膜中[11]。实际上, Gal-3在细胞质中合成, 在细胞核和细胞质中起作用, 还可以分泌到细胞膜和细胞外基质中, 并存在于循环系统中。Gal-3缺乏经典的分泌信号序列, 故其不通过“内质网-高尔基体”途径而是通过非经典机制分泌到细胞外, 例如通过囊泡释放、作为外泌体的成分释放或通过机械转导机制分泌到细胞外。已知许多因素会影响Gal-3的分泌, 例如热休克蛋白、钙离子载体、酰化和磷酸化, 但是确切的机制尚待阐明。除了可以分泌到细胞外, 胞质中的Gal-3还可以转移到细胞核或者细胞器中。据报道, Gal-3的磷酸化对于其核输出到细胞质中很重要[12], 并且Gal-3可通过核孔复合物进行被动扩散或者主动传输易位到核中[6]。Synexin (annexin Ⅶ)是一种Ca2+和磷脂结合蛋白, 可介导Gal-3向核周线粒体膜转运[13]。
1.3 Gal-3的基因与转录后修饰LGALS3是人类基因组中编码Gal-3的单一基因, 位于第14号染色体q21~22位, 由6个外显子和5个内含子组成, 跨度约1.7万个碱基[1]。LGALS3的启动子甲基化状态、位于启动子内的CRE基序、核因子κB (NF-κB)样位点和GC盒等元素调节Gal-3的表达[14]。Gal-3的转录可以被诸如Krüppel样因子3 (KLF-3)之类的蛋白抑制, 该蛋白属于锌指转录因子家族, 也可以被其他转录因子如runt相关转录因子2 (RUNX2)等因素上调。
切割和磷酸化是影响Gal-3活性的两种重要的转录后修饰形式, 可通过改变Gal-3的多价态、定位和凝集素结合活性影响Gal-3的功能。MMPs、前列腺特异性抗原(PSA)和一种来自寄生虫的蛋白酶可切割Gal-3并产生完整的CRD和长度可变的NH2末端多肽, 这些多肽保留了Gal-3的结合活性, 但失去了多价性。Gal-3的丝氨酸和酪氨酸可被c-Abl (一种非受体酪氨酸激酶)、酪蛋白激酶Ⅰ (casein kinase Ⅰ, CKⅠ)和糖原合酶激酶-3β (glycogen synthase kinase-3β, GSK-3β)磷酸化, 从而调节其定位和相关的信号转导(图 2)[15]。
1.4 Gal-3的功能Gal-3在细胞内外均存在, 是一种穿梭蛋白, 通过与不同的配体结合从而具有多种生理或者病理生理的功能(表 1和图 3)。
| Table 1 The ligand of galectin-3 in respiratory disease. TLR4: Toll-like receptor-4; EGFR: Epidermal growth factor receptor; TGF-βR: Transforming growth factor-β receptor; IL-8: Interleukin-8; EGR-1: Early growth response-1; VE-cad: Vascular endothelial-cadherin |
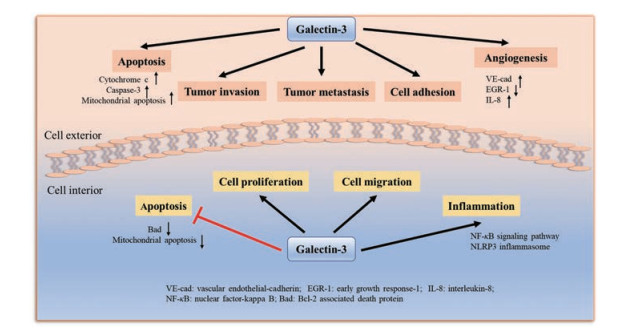
|
Figure 3 The partial function of galectin-3 inside and outside of cell |
细胞内的Gal-3与各种配体的结合通常利用NH2末端或CRD的蛋白质-蛋白质结合而发生, 并不涉及糖部分, 也就是没有发生蛋白质与糖的结合。细胞内的Gal-3具有与生长和发育相关的几种生物学功能, 例如胚胎植入和肾形态发生, 并且在发育过程中, 在脊索、软骨和骨骼中也发现了Gal-3表达的增加[16]。在细胞内, 许多胞质分子已被鉴定为Gal-3的配体, 包括几个参与凋亡途径的分子: Bcl-2、Bax、nucling和Alix/A1P1等。有研究发现, 在暴露于抗癌药物诱导的凋亡刺激后, 过表达Gal-3可下调Bad (Bcl-2相关死亡蛋白)的表达, 并且从核转移到细胞质后, Gal-3还抑制线粒体的去极化和损伤, 从而抑制了细胞色素c的释放和半胱氨酸蛋白酶-3 (caspase-3)的活化, 表明Gal-3可通过调节Bad蛋白和抑制线粒体凋亡途径而抑制凋亡, 因此靶向Gal-3可提高抗前列腺癌药物的化疗疗效[17]。此外, 过表达Gal-3可促进人肺动脉平滑肌细胞的迁移及增殖能力, 而在Gal-3敲除的小鼠中, 肝祖细胞的增殖明显减少[18, 19]。上调的Gal-3可通过NF-κB和NLRP3炎症小体依赖性途径促进炎症反应的发生, 而敲除Gal-3可以抑制炎症的发生从而改善疾病症状[20]。
Gal-3由于其凝集素活性以及对细胞表面和细胞外基质聚糖的识别而发挥细胞外功能。细胞外Gal-3的配体主要是β-半乳糖苷衍生物, 例如乳糖和N-乙酰氨基乳糖, 通过非共价键与Gal-3结构中的CRD结合。Gal-3结合糖时具有不同的亲和力, 具体取决于糖的糖序列、键类型、线性或分支结构以及碳水化合物的大小[8]。尽管半乳糖的存在对于所有半乳糖凝集素的结合必不可少, 但Gal-3对单糖配体的亲和力很弱, 如果半乳糖附着于其他糖, 例如N-乙酰氨基葡糖形成N-乙酰氨基乳糖, 则Gal-3的结合亲和力增加[21]。细胞外的Gal-3在胚胎发生、生长和发育以及维持体内平衡中起着重要作用。例如, CD98重链是在发育中的人类滋养细胞中表达的糖基化跨膜蛋白, 在体外条件下, Gal-3与CD98重链结合, 可能通过凝集素-聚糖相互作用而促进胎盘细胞融合[22]。当Gal-3被释放到细胞外基质中, 由于它具有结合糖基化蛋白的能力, 它可以与众多分子结合, 例如表皮生长因子受体、整联蛋白、纤连蛋白和层黏连蛋白。据报道, 细胞外Gal-3可诱导T细胞凋亡, 并且在患有Hermansky–Pudlak肺病综合征小鼠中可诱导肺泡的原代上皮细胞凋亡[23-25]。在多种肿瘤中, 可观察到Gal-3的表达增强肿瘤的转移和/或侵袭, 例如乳腺癌、肺癌和胃癌等。此外, Gal-3与MUC1 (癌症相关跨膜黏蛋白)的相互作用可增强肿瘤与内皮细胞之间的异型黏附[26]。细胞外的Gal-3还可以诱导血管生成, 例如当Gal-3的NH2末端被切割, 随后在肿瘤微环境中释放, 这部分导致了乳腺癌的血管生成和进展, 并且其还可以诱导人脐静脉内皮细胞形态发生及血管生成[27]。
2 Gal-3在呼吸系统疾病中的研究进展 2.1 特发性肺纤维化特发性肺纤维化(idiopathic pulmonary fibrosis, IPF)被定义为在成人中发生的病因不明的慢性纤维化间质性肺病, 其特征是普通间质性肺炎的组织病理学特征[28]。IPF是特发性间质性肺炎中最常见的, 在各种形式的间质性肺疾病中, 因其预后差且对传统疗法无效而备受关注。IPF的形成是一个复杂的病理过程, 其发病机制涉及多种生理病理环节, 有研究表明Gal-3也参与其中。最早的一篇报道是在1996年, 该研究在大鼠体内利用辐射诱导肺损伤, 结果发现Gal-3的合成和分泌增加[29]。首次针对IPF患者的研究是在2007年的一篇报道中, 发现IPF患者的支气管肺泡灌洗液中Gal-3的含量呈现特异性增高, 并且IPF患者的肺泡巨噬细胞表达了更多的Gal-3。体外实验发现, 在单核细胞系U937中, 肿瘤坏死因子-α和干扰素-γ诱导了Gal-3的表达, 而Gal-3还可以刺激NIH-3T3成纤维细胞的迁移和胶原合成[30]。与非特异性间质性肺炎相比, 稳定IPF患者的支气管肺泡灌洗液和血清中Gal-3的表达增加, 并且在急性加重期急剧上升, 这表明Gal-3可能是IPF中活动性纤维化的标志物, 阻断Gal-3的策略可能有效地治疗IPF的急性纤维化进程的恶化。在该研究中首次报道了Gal-3的新型抑制剂TD139可在体内外阻断TGF-β1诱导的β-catenin活化, 并减轻博来霉素诱导的肺纤维化的晚期进程, 并且Gal-3还可以通过调节上皮间质转化或者诱导成纤维细胞的活化而参与到IPF的发病机制中[31]。目前被批准使用的抗特发性肺纤维化的药物有吡非尼酮和尼达尼布, 它们可能是通过抑制Wnt/β-catenin信号通路产生抗炎作用而减轻肺纤维化[32], 但是其疗效并未取得完全满意的效果, 故迫切需要开发新的治疗药物。有文献报道针对Gal-3的新型抑制剂具有抗纤维化的作用, 例如合成的一种3, 3′-双-(4-芳基-三唑-1-酰基)-硫代二乳糖苷可作为Gal-3的拮抗剂, 经气管内给药可减轻博莱霉素诱导的小鼠肺纤维化, 其剂量-反应曲线与吡非尼酮相比具有优势[33-36]。Gal-3的小分子抑制剂TD139可以在小鼠模型中减轻肺纤维化, 目前正在开展一项针对IPF患者的随机、双盲、安慰剂对照的Ⅱb期临床试验, 旨在研究TD139的疗效和安全性(临床试验编号: NCT03832946)。上述研究证明了Gal-3可作为IPF治疗靶点的重要意义和巨大潜力, 为IPF的临床治疗提供了新的方向。
2.2 肺癌肺癌是世界上最常见的恶性肿瘤之一, 2018年全球统计数据显示, 男性肺癌的死亡率和发病率均占恶性肿瘤的第一位[37]。肺癌根据解剖部位或者病理类型和临床分期可分为多种不同的类型, 其中非小细胞肺癌(non-small cell lung cancer, NSCLC)占肺癌发病率的80%左右[38]。肺癌的发病机制复杂多样, 有很多研究结果显示, Gal-3在其中扮演着重要的角色。早在1993年就有人发现Gal-3的血清水平在肺癌患者中显著升高[39], 在体外实验中也发现了Gal-3的表达增强了人非小细胞肺癌细胞系(DLKP)的黏附力、运动性和侵袭性。Gal-3在NSCLC中高表达, 但在小细胞癌中不表达或者表达很低, 因此, Gal-3可能是排除小细胞肺癌的表型标记, 并且可能代表非小细胞肺癌治疗中的新型靶分子[40]。除了证明Gal-3在肺癌的组织学类型之间的差异表达, 大量研究还发现Gal-3是肺癌的不利预后因素, 其核表达可作为重要的预后指标[41]。由于其在B细胞受体、ERK/MAPK和PPAR信号通路中的调节作用, 降低Gal-3的表达可能会减弱肺癌的发生[42]。此外, Gal-3与肿瘤的转移有关, 研究显示高水平的Gal-3与NSCLC的发生和转移密切相关, 表明Gal-3可能是评估NSCLC隐匿性转移的指标[43]。Gal-3和CD82/KAI1的联合检测在预测NSCLC的进展和预后中具有重要作用, 并且与其他肺癌标志物联合使用可能会提高诊断率[44]。此外, Gal-3还可以通过激活lncRNA-NEAT1的表达来激活TLR4/NF-κB的信号传导, 从而促进肺腺癌细胞的增殖[45]。同时, Gal-3在肿瘤细胞中的表达可以作为复发的预测因素, 但是血清中的Gal-3水平对于预测NSCLC的复发没有帮助[46]。有研究显示Gal-3是一个有趣的肿瘤反应性的预测指标, 至少在非小细胞肺癌中, Gal-3的标记有望筛选出适合免疫治疗的患者, 从而减少不必要的治疗暴露和社会成本, 目前正在进行一项大型的多中心研究以验证这一发现[47]。大量研究已证明, Gal-3参与到NSCLC的发生发展过程中, 因此Gal-3抑制剂的开发也正在进行中, 例如, 合成的一种Gal-3抑制剂(乳果糖基-L-亮氨酸)增加了转移性癌细胞对紫杉醇诱导的细胞凋亡的体内外敏感性[48]。化学修饰的非抗凝肝素衍生物是有效的Gal-3结合抑制剂, 可抑制黑色素瘤的肺转移[49]。口服的新型小分子Gal-3抑制剂GB1107可以减少人和小鼠肺腺癌的生长, 并在同基因模型中阻止转移[50]。此外, 研究证明了氨基嘧啶-半乳糖杂化物是高度选择性的Gal-3抑制剂, 并且雷帕霉素衍生物也是潜在的Gal-3抑制剂。以上研究证明了Gal-3是肺癌, 尤其是NSCLC的一个很有开发前景的药物治疗靶点, 值得进一步研究。
2.3 肺动脉高压肺动脉高压(pulmonary arterial hypertension, PAH)是一种由于肺动脉狭窄引起的进行性疾病, 导致肺动脉血压升高, 最终引起右心室衰竭, 是一种致残率和病死率很高的疾病, 被称为心血管系统的癌症[51]。PAH的主要特征是肺动脉过度的内向重塑, 包括增殖、炎症和纤维化程度的增加[52]。关于Gal-3在PAH中的研究在近年才开始进行, 但是已研究得较为深入。研究发现, Gal-3水平与肺动脉高压的右心室功能和形态变化有关, 表明Gal-3可能是PAH中右心室重构和相关细胞外基质转换的新型生物标志物[53]。血小板源性生长因子(platelet-derived growth factor, PDGF)可诱导肺动脉平滑肌细胞(PASMC)中Gal-3的表达, 并且Gal-3可介导PDGF对PASMC增殖、凋亡和迁移的影响, 从而促进PAH的发病[54]。此外, 有多个研究指出Gal-3/醛固酮是潜在的生物标志物, 可用于显示PAH的疾病病理生物学和临床状况, 并且随着Gal-3表达水平的提高, 死亡率显著增加, 显示Gal-3是PAH死亡率的有力预测指标, 同时也是强而独立的预后标志物[55, 56]。Gal-3通过调节多种细胞的功能而参与到PAH的发病机制中, 例如, Gal-3通过调节肺外膜成纤维细胞的增殖、分化和细胞外基质沉积合成, 在PAH的发病机制中起着至关重要的调节作用。在PAH的大鼠模型中, 观察到了Gal-3表达的增加, 从而刺激了PASMC的迁移和对凋亡的抵抗。Gal-3介导的肺动脉内皮细胞转分化可导致低氧性肺血管重构, 并且低氧介导的Gal-3增加通过抑制TRPC1/4途径并激活蛋白激酶B/GSK-3β/哺乳动物雷帕霉素靶蛋白, 来促进肺血管内皮细胞的凋亡并抑制自噬[57]。在多个研究中, 采取Gal-3基因敲除的动物模型或者体外实验采用小干扰RNA降低Gal-3的表达, 结果均可以减轻PAH的程度, 表明Gal-3的抑制剂可能代表PAH治疗的新型靶点。
2.4 支气管哮喘支气管哮喘是一种慢性炎症性呼吸系统疾病, 其特征在于气道炎症、气道高反应性和可逆性气道阻塞[58], 病理生理学涉及分子和细胞相互作用的复杂网络。研究表明, Gal-3参与到了支气管哮喘的病理机制中, 而有趣的是, Gal-3在其中发挥的作用似乎是矛盾的。最先的研究发现, 给予大鼠体内注射编码Gal-3基因的质粒, 结果显示对IL-5 mRNA有强烈的抑制作用, 且大鼠显示出肺功能参数的恢复, 如肺压和呼气流量, 同时Gal-3在嗜酸性粒细胞气道积聚、气道高反应性和重塑方面几乎完全阻断抗原反应, 表明质粒编码的Gal-3可作为小鼠慢性哮喘的一种新型治疗方法[59]。但也有文献表明, 在卵白蛋白(OVA)诱发的哮喘小鼠模型中, Gal-3的表达在支气管周炎性细胞及支气管肺泡灌洗液中明显更高, 并且Gal-3可以调节Th1/Th2反应, 表明Gal-3可能在哮喘的发病机制中起重要作用, 其抑制剂可能用于治疗该疾病[60]。此后更多的研究集中在Gal-3对于炎症、巨噬细胞的活化以及气道重塑上, Gal-3可通过炎症细胞(特别是嗜酸性粒细胞)的气道募集、Th2表型的发展以及促纤维化和血管生成介质的表达增加来促进气道重塑[61]。支气管活检的蛋白质组学和其他一些研究表明, Gal-3在奥马珠单抗治疗的严重哮喘患者中可作为气道重塑调节的预测生物标志物[62], 并且Gal-3可能是有用的标志物, 用于识别对抗IgE治疗有反应的患者, 其中主要涉及平滑肌蛋白和胶原/纤连蛋白沉积的调节性支气管重塑[63]。目前, 关于人类哮喘或慢性阻塞性肺疾病的Gal-3水平和功能的可用数据有限, 因此针对Gal-3的研究可能会阐明哮喘的分子机制, 代表了一种有效的开发哮喘治疗药物的治疗策略。
3 总结与展望呼吸系统疾病是一个广泛的概念, 包含多种疾病, 其中很多都没有有效的治疗方法, 使其成为一种世界范围内的医学难题。本文通过总结并分析Gal-3在特发性肺纤维化、肺癌、肺动脉高压和支气管哮喘中的研究进展, 试图为临床治疗这些疾病提供新的思路。Gal-3在IPF中高表达, 通过多种病理机制如上皮间质转化、成纤维细胞活化等促进纤维化的发生, 明确了Gal-3作为IPF治疗靶点的重要意义。在肺癌中, Gal-3主要与NSCLC有关, 其可以单独或者与其他肿瘤标志物一起作为NSCLC的预后、转移、对抗癌药物的反应性及预测复发的生物指标。在肺动脉高压中, Gal-3可用于告知PAH的疾病病理生物学和临床状况, 并且是PAH死亡率的有力预测指标, 同时也是强而独立的预后标志物。在支气管哮喘中, Gal-3可作为气道重塑调节的预测生物标志物, 并且可用于识别对抗IgE治疗有反应的患者。综上可知, Gal-3在这几种呼吸系统疾病中可以作为一种多功能的标志物, 显示了其独特的作用。Gal-3是进化保守的半乳糖凝集素家族中的一员, 与年龄、体重指数或性别无关[64, 65], 也不会出现昼夜节律变化, 即使在运动后略有增加, 在1~3 h后也可以恢复正常水平[66]。因此, Gal-3可作为上述几种呼吸系统疾病的稳定的生物标志物, 在判断疾病的发生程度、预后、复发及对药物治疗的反应性等方面具有重要的价值。因此, 研究者需要开发灵敏、准确、通用的Gal-3的检测方法, 并建立正常的参考范围, 为其临床实用性提供支持。
针对Gal-3的特异性抑制剂在这几种疾病中均取得了较好的效果, 提示Gal-3抑制剂用于治疗疾病的良好前景, 可作为呼吸系统疾病的一个潜在治疗靶点。但是, 目前并没有可用于临床的Gal-3抑制剂, 最有希望开发为药物的Gal-3小分子抑制剂TD139目前仅处于Ⅱ期临床试验阶段。由于半乳糖凝集素的大部分活性与其糖结合特性有关, 因此拮抗剂(或抑制剂)与天然配体竞争抑制CRD似乎是一种可行的选择, 不仅可以揭示其确切功能, 而且可以开发用于治疗干预的分子。开发Gal-3抑制剂的一个主要的难点在于特异性, 因为理想的抑制剂必须将Gal-3与其他半乳糖凝集素成员区分开, 但是由于CRD结构高度的相似性, 使得开发Gal-3的选择性抑制剂成为一个艰巨的任务。此外, Gal-3可分泌到细胞外, 其在细胞内外可结合不同的分子从而具有不同的功能, 开发高亲和力的抑制剂以特异性靶向细胞外或细胞内Gal-3, 甚至选择性地标记其细胞位置是必不可少的, 这也增加了开发Gal-3抑制剂的难度。
除了上述几种呼吸系统疾病, 有大量研究报道Gal-3参与了其他多种疾病的发病机制中, 例如心衰、糖尿病、乳腺癌和肝脏纤维化等, 有研究表明改良的柑橘果胶(Gal-3的一种抑制剂)能够抑制醛固酮诱导的心脏和肾脏纤维化, 并改善心肾功能不全[67]。Gal-3还能够调节自噬过程[68-70], 可以预见其参与更多疾病发生发展过程的可能性, 因此在未来针对Gal-3开展更多的研究, 开发可作为Gal-3选择性抑制剂的候选药物, 这将为临床治疗多种疾病尤其是呼吸系统疾病提供新的方向。
| [1] |
Suthahar N, Meijers WC, Silljé HHW, et al. Galectin-3 activation and inhibition in heart failure and cardiovascular disease: an update[J]. Theranostics, 2018, 8: 593-609. DOI:10.7150/thno.22196 |
| [2] |
Besler C, Lang D, Urban D, et al. Plasma and cardiac galectin-3 in patients with heart failure reflects both inflammation and fibrosis: implications for its use as a biomarker[J]. Circ Heart Fail, 2017, 10: e003804. |
| [3] |
Suseelan KN, Bhatia AR, Mitra R. Purification and characterization of two major lectins from Vigna mungo (blackgram)[J]. J Biosci, 1997, 22: 439-455. DOI:10.1007/BF02703190 |
| [4] |
Barondes SH, Castronovo V, Cooper DNW, et al. Galectins: a family of animal β-galactoside-binding lectins[J]. Cell, 1994, 76: 597-598. DOI:10.1016/0092-8674(94)90498-7 |
| [5] |
Gilson RC, Gunasinghe SD, Johannes L, et al. Galectin-3 modulation of T-cell activation: mechanisms of membrane remodeling[J]. Prog Lipid Res, 2019, 76: 101010. DOI:10.1016/j.plipres.2019.101010 |
| [6] |
Lepur A, Salomonsson E, Nilsson UJ, et al. Ligand induced galectin-3 protein self-association[J]. J Biol Chem, 2012, 287: 21751-21756. DOI:10.1074/jbc.C112.358002 |
| [7] |
Funasaka T, Raz A, Nangia-Makker P. Nuclear transport of galectin-3 and its therapeutic implications[J]. Semin Cancer Biol, 2014, 27: 30-38. DOI:10.1016/j.semcancer.2014.03.004 |
| [8] |
Kim H, Lee J, Hyun JW, et al. Expression and immunohistochemical localization of galectin-3 in various mouse tissues[J]. Cell Biol Int, 2007, 31: 655-662. DOI:10.1016/j.cellbi.2006.11.036 |
| [9] |
Yu L, Ruifrok WPT, Meissner M, et al. Genetic and pharmacological inhibition of galectin-3 prevents cardiac remodeling by interfering with myocardial fibrogenesis[J]. Circ Heart Fail, 2013, 6: 107-117. DOI:10.1161/CIRCHEARTFAILURE.112.971168 |
| [10] |
Kim K, Mayer EP, Nachtigal M. Galectin-3 expression in macrophages is signaled by Ras/MAP kinase pathway and up-regulated by modified lipoproteins[J]. Biochim Biophys Acta, 2003, 1641: 13-23. DOI:10.1016/S0167-4889(03)00045-4 |
| [11] |
Ho MK, Springer TA. Mac-2, a novel 32 000 Mr mouse macrophage subpopulation-specific antigen defined by monoclonal antibodies[J]. J Immunol, 1982, 128: 1221-1228. |
| [12] |
Takenaka Y, Fukumori T, Yoshii T, et al. Nuclear export of phosphorylated galectin-3 regulates its antiapoptotic activity in response to chemotherapeutic drugs[J]. Mol Cell Biol, 2004, 24: 4395-4406. DOI:10.1128/MCB.24.10.4395-4406.2004 |
| [13] |
Yu F, Finley RL, Raz A, et al. Galectin-3 translocates to the perinuclear membranes and inhibits cytochrome c release from the mitochondria. A role for synexin in galectin-3 translocation[J]. J Biol Chem, 2002, 277: 15819-15827. DOI:10.1074/jbc.M200154200 |
| [14] |
Dumic J, Dabelic S, Flögel M. Galectin-3: an open-ended story[J]. Biochim Biophys Acta, 2006, 1760: 616-635. DOI:10.1016/j.bbagen.2005.12.020 |
| [15] |
Gao XG, Liu JJ, Liu XG, et al. Cleavage and phosphorylation: important post-translational modifications of galectin-3[J]. Cancer Metastasis Rev, 2017, 36: 367-374. DOI:10.1007/s10555-017-9666-0 |
| [16] |
Fowlis D, Colnot C, Ripoche MA, et al. Galectin-3 is expressed in the notochord, developing bones, and skin of the postimplantation mouse embryo[J]. Dev Dyn, 1995, 203: 241-251. DOI:10.1002/aja.1002030211 |
| [17] |
Fukumori T, Oka N, Takenaka Y, et al. Galectin-3 regulates mitochondrial stability and antiapoptotic function in response to anticancer drug in prostate cancer[J]. Cancer Res, 2006, 66: 3114-3119. DOI:10.1158/0008-5472.CAN-05-3750 |
| [18] |
Barman SA, Li X, Haigh S, et al. Galectin-3 is expressed in vascular smooth muscle cells and promotes pulmonary hypertension through changes in proliferation, apoptosis, and fibrosis[J]. Am J Physiol Lung Cell Mol Physiol, 2019, 316: L784-L797. DOI:10.1152/ajplung.00186.2018 |
| [19] |
Hsieh WC, Mackinnon AC, Lu WY, et al. Galectin-3 regulates hepatic progenitor cell expansion during liver injury[J]. Gut, 2015, 64: 312-321. DOI:10.1136/gutjnl-2013-306290 |
| [20] |
Siew JJ, Chen HM, Chen HY, et al. Galectin-3 is required for the microglia-mediated brain inflammation in a model of Huntington's disease[J]. Nat Commun, 2019, 10: 3473. DOI:10.1038/s41467-019-11441-0 |
| [21] |
Hirabayashi J, Hashidate T, Arata Y, et al. Oligosaccharide specificity of galectins: a search by frontal affinity chromatography[J]. Biochim Biophys Acta, 2002, 1572: 232-254. DOI:10.1016/S0304-4165(02)00311-2 |
| [22] |
Dalton P, Christian HC, Redman CWG, et al. Membrane trafficking of CD98 and its ligand galectin 3 in BeWo cells--implication for placental cell fusion[J]. FEBS J, 2007, 274: 2715-2727. DOI:10.1111/j.1742-4658.2007.05806.x |
| [23] |
Fukumori T, Takenaka Y, Yoshii T, et al. CD29 and CD7 mediate galectin-3-induced type Ⅱ T-cell apoptosis[J]. Cancer Res, 2003, 63: 8302-8311. |
| [24] |
Hsu DK, Chen HY, Liu FT. Galectin-3 regulates T-cell functions[J]. Immunol Rev, 2009, 230: 114-127. DOI:10.1111/j.1600-065X.2009.00798.x |
| [25] |
Zhou Y, He CH, Yang DS, et al. Galectin-3 interacts with the CHI3L1 axis and contributes to Hermansky-Pudlak syndrome lung disease[J]. J Immunol, 2018, 200: 2140-2153. DOI:10.4049/jimmunol.1701442 |
| [26] |
Glinsky V, Glinsky G, Rittenhouse-Olson K, et al. The role of Thomsen-Friedenreich antigen in adhesion of human breast and prostate cancer cells to the endothelium[J]. Cancer Res, 2001, 61: 4851-4857. |
| [27] |
Nangia-Makker P, Honjo Y, Sarvis R, et al. Galectin-3 induces endothelial cell morphogenesis and angiogenesis[J]. Am J Pathol, 2000, 156: 899-909. DOI:10.1016/S0002-9440(10)64959-0 |
| [28] |
Raghu G, Collard HR, Egan JJ, et al. An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management[J]. Am J Respir Crit Care Med, 2011, 183: 788-824. DOI:10.1164/rccm.2009-040GL |
| [29] |
Kasper M, Hughes RC. Immunocytochemical evidence for a modulation of galectin 3 (Mac-2), a carbohydrate binding protein, in pulmonary fibrosis[J]. J Pathol, 1996, 179: 309-316. DOI:10.1002/(SICI)1096-9896(199607)179:3<309::AID-PATH572>3.0.CO;2-D |
| [30] |
Nishi Y, Sano H, Kawashima T, et al. Role of galectin-3 in human pulmonary fibrosis[J]. Allergol Int, 2007, 56: 57-65. DOI:10.2332/allergolint.O-06-449 |
| [31] |
Mackinnon AC, Gibbons MA, Farnworth SL, et al. Regulation of transforming growth factor-β1-driven lung fibrosis by galectin-3[J]. Am J Respir Crit Care Med, 2012, 185: 537-546. DOI:10.1164/rccm.201106-0965OC |
| [32] |
Li YX, Lv XX, Liu C, et al. Pirfenidone and nintedanib inhibit the lung alveolar regeneration in chronic pulmonary fibrosis mouse[J]. Acta Pharm Sin (药学学报), 2020, 55: 861-867. |
| [33] |
Abdelkarim Maki MA, Kumar PV, Elumalai M, et al. In silico-based approach to investigate the ability of PEGylated rapamycin to inhibit galectin-3[J]. Curr Drug Discov Technol, 2020. DOI:10.2174/1570163817666200122162042 |
| [34] |
Dahlqvist A, Zetterberg FR, Leffler H, et al. Aminopyrimidine-galactose hybrids are highly selective galectin-3 inhibitors[J]. MedChemComm, 2019, 10: 913-925. DOI:10.1039/C9MD00183B |
| [35] |
Rajput VK, MacKinnon A, Mandal S, et al. A selective galactose-coumarin-derived galectin-3 inhibitor demonstrates involvement of galectin-3-glycan interactions in a pulmonary fibrosis model[J]. J Med Chem, 2016, 59: 8141-8147. |
| [36] |
Delaine T, Collins P, MacKinnon A, et al. Galectin-3-binding glycomimetics that strongly reduce bleomycin-induced lung fibrosis and modulate intracellular glycan recognition[J]. Chembiochem, 2016, 17: 1759-1770. DOI:10.1002/cbic.201600285 |
| [37] |
Mattiuzzi C, Lippi G. Current cancer epidemiology[J]. J Epidemiol Glob Health, 2019, 9: 217-222. DOI:10.2991/jegh.k.191008.001 |
| [38] |
Wang C, Chen SZ. Advances in the mechanisms of acquired resistance to EGFR-tyrosine kinase inhibitors in non-small cell lung cancer[J]. Acta Pharm Sin (药学学报), 2019, 54: 1364-1371. |
| [39] |
Iurisci I, Tinari N, Natoli C, et al. Concentrations of galectin-3 in the sera of normal controls and cancer patients[J]. Clin Cancer Res, 2000, 6: 1389-1393. |
| [40] |
Yoshimura A, Gemma A, Hosoya Y, et al. Increased expression of the LGALS3 (galectin 3) gene in human non-small-cell lung cancer[J]. Genes Chromosomes Cancer, 2003, 37: 159-164. DOI:10.1002/gcc.10205 |
| [41] |
Mathieu A, Saal I, Vuckovic A, et al. Nuclear galectin-3 expression is an independent predictive factor of recurrence for adenocarcinoma and squamous cell carcinoma of the lung[J]. Mod Pathol, 2005, 18: 1264-1271. DOI:10.1038/modpathol.3800416 |
| [42] |
Abdel-Aziz HO, Murai Y, Takasaki I, et al. Targeted disruption of the galectin-3 gene results in decreased susceptibility to NNK-induced lung tumorigenesis: an oligonucleotide microarray study[J]. J Cancer Res Clin Oncol, 2008, 134: 777-788. DOI:10.1007/s00432-007-0345-3 |
| [43] |
Liang Y, Li H, Hou SC, et al. The expression of galectin-3 andosteopontin in occult metastasis of non-small cell lung cancer[J]. Chin J Surg (中华外科杂志), 2009, 47: 1061-1063. |
| [44] |
Liu MY, Du B, Li CH, et al. Expression and related factors of galectin-3 in non-small cell lung cancer[J]. Chin J Lung Cancer (中国肺癌杂志), 2013, 16: 417-421. |
| [45] |
Zhou W, Chen X, Hu QH, et al. Galectin-3 activates TLR4/NF-κB signaling to promote lung adenocarcinoma cell proliferation through activating lncRNA-NEAT1 expression[J]. BMC Cancer, 2018, 18: 580. DOI:10.1186/s12885-018-4461-z |
| [46] |
Kataoka Y, Igarashi T, Ohshio Y, et al. Predictive importance of galectin-3 for recurrence of non-small cell lung cancer[J]. Gen Thorac Cardiovasc Surg, 2019, 67: 704-711. DOI:10.1007/s11748-019-01074-x |
| [47] |
Capalbo C, Scafetta G, Filetti M, et al. Predictive biomarkers for checkpoint inhibitor-based immunotherapy: the galectin-3 signature in NSCLCs[J]. Int J Mol Sci, 2019, 20: 1607. DOI:10.3390/ijms20071607 |
| [48] |
Glinsky VV, Kiriakova G, Glinskii OV, et al. Synthetic galectin-3 inhibitor increases metastatic cancer cell sensitivity to taxol-induced apoptosis in vitro and in vivo[J]. Neoplasia, 2009, 11: 901-909. DOI:10.1593/neo.09594 |
| [49] |
Duckworth CA, Guimond SE, Sindrewicz P, et al. Chemically modified, non-anticoagulant heparin derivatives are potent galectin-3 binding inhibitors and inhibit circulating galectin-3-promoted metastasis[J]. Oncotarget, 2015, 6: 23671-23687. DOI:10.18632/oncotarget.4409 |
| [50] |
Vuong L, Kouverianou E, Rooney CM, et al. An orally active galectin-3 antagonist inhibits lung adenocarcinoma growth and augments response to PD-L1 blockade[J]. Cancer Res, 2019, 79: 1480-1492. DOI:10.1158/0008-5472.CAN-18-2244 |
| [51] |
Guo ZR. Drugs for pulmonary arterial hypertension: the pioneering bosentan and the following macitentan[J]. Acta Pharm Sin (药学学报), 2019, 54: 1524-1530. |
| [52] |
Fulton DJR, Li X, Bordan Z, et al. Galectin-3: a harbinger of reactive oxygen species, fibrosis, and inflammation in pulmonary arterial hypertension[J]. Antioxid Redox Signal, 2019, 31: 1053-1069. DOI:10.1089/ars.2019.7753 |
| [53] |
Fenster BE, Lasalvia L, Schroeder JD, et al. Galectin-3 levels are associated with right ventricular functional and morphologic changes in pulmonary arterial hypertension[J]. Heart Vessels, 2016, 31: 939-946. DOI:10.1007/s00380-015-0691-z |
| [54] |
Guo S, Feng Z. Galectin-3 mediates the effect of PDGF on pulmonary arterial hypertension[J]. Int J Clin Exp Med, 2015, 8: 15302-15307. |
| [55] |
Maron BA. The quest for biomarker discovery in pulmonary arterial hypertension: the right takes lessons from the left[J]. Heart, 2016, 102: 335-336. DOI:10.1136/heartjnl-2015-309070 |
| [56] |
Mazurek JA, Horne BD, Saeed W, et al. Galectin-3 levels are elevated and predictive of mortality in pulmonary hypertension[J]. Heart Lung Circ, 2017, 26: 1208-1215. DOI:10.1016/j.hlc.2016.12.012 |
| [57] |
Li YM, Chen XH, Zeng XX, et al. Galectin-3 mediates pulmonary vascular endothelial cell dynamics via TRPC1/4 under acute hypoxia[J]. J Biochem Mol Toxicol, 2020, 34: e22463. |
| [58] |
Mammen MJ, Sands MF, Abou-Jaoude E, et al. Role of galectin-3 in the pathophysiology underlying allergic lung inflammation in a tissue inhibitor of metalloproteinases 1 knockout model of murine asthma[J]. Immunology, 2018, 153: 387-396. DOI:10.1111/imm.12848 |
| [59] |
López E, del Pozo V, Miguel T, et al. Inhibition of chronic airway inflammation and remodeling by galectin-3 gene therapy in a murine model[J]. J Immunol, 2006, 176: 1943-1950. DOI:10.4049/jimmunol.176.3.1943 |
| [60] |
Zuberi RI, Hsu DK, Kalayci O, et al. Critical role for galectin-3 in airway inflammation and bronchial hyperresponsiveness in a murine model of asthma[J]. Am J Pathol, 2004, 165: 2045-2053. DOI:10.1016/S0002-9440(10)63255-5 |
| [61] |
Ge XN, Bahaie NS, Kang BN, et al. Allergen-induced airway remodeling is impaired in galectin-3-deficient mice[J]. J Immunol, 2010, 185: 1205-1214. DOI:10.4049/jimmunol.1000039 |
| [62] |
Mauri P, Riccio AM, Rossi R, et al. Proteomics of bronchial biopsies: galectin-3 as a predictive biomarker of airway remodelling modulation in omalizumab-treated severe asthma patients[J]. Immunol Lett, 2014, 162: 2-10. DOI:10.1016/j.imlet.2014.08.010 |
| [63] |
Moretta L, Pistoia V. Anti-IgE treatment in asthma: galectin-3 as a predictive marker[J]. Immunol Lett, 2014, 162: 1. |
| [64] |
Meeusen JW, Johnson JN, Gray A, et al. Soluble ST2 and galectin-3 in pediatric patients without heart failure[J]. Clin Biochem, 2015, 48: 1337-1340. DOI:10.1016/j.clinbiochem.2015.08.007 |
| [65] |
Schindler EI, Szymanski JJ, Hock KG, et al. Short- and long-term biologic variability of galectin-3 and other cardiac biomarkers in patients with stable heart failure and healthy adults[J]. Clin Chem, 2016, 62: 360-366. DOI:10.1373/clinchem.2015.246553 |
| [66] |
Issa SF, Christensen AF, Lottenburger T, et al. Within-day variation and influence of physical exercise on circulating galectin-3 in patients with rheumatoid arthritis and healthy individuals[J]. Scand J Immunol, 2015, 82: 70-75. DOI:10.1111/sji.12301 |
| [67] |
Calvier L, Martinez-Martinez E, Miana M, et al. The impact of galectin-3 inhibition on aldosterone-induced cardiac and renal injuries[J]. JACC Heart Fail, 2015, 3: 59-67. DOI:10.1016/j.jchf.2014.08.002 |
| [68] |
Pei CZ, Wang XY, Lin YJ, et al. Inhibition of galectin-3 alleviates cigarette smoke extract-induced autophagy and dysfunction in endothelial progenitor cells[J]. Oxid Med Cell Longev, 2019, 2019: 7252943. |
| [69] |
Weng IC, Chen HL, Lo TH, et al. Cytosolic galectin-3 and -8 regulate antibacterial autophagy through differential recognition of host glycans on damaged phagosomes[J]. Glycobiology, 2018, 28: 392-405. DOI:10.1093/glycob/cwy017 |
| [70] |
Chauhan S, Kumar S, Jain A, et al. TRIMs and galectins globally cooperate and TRIM16 and galectin-3 co-direct autophagy in endomembrane damage homeostasis[J]. Dev Cell, 2016, 39: 13-27. DOI:10.1016/j.devcel.2016.08.003 |
 2020, Vol. 55
2020, Vol. 55


